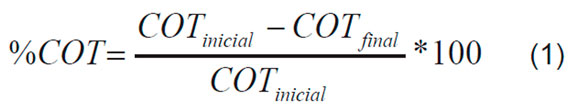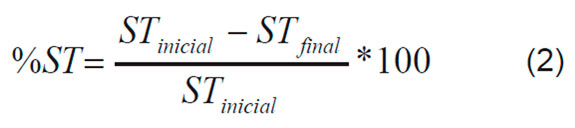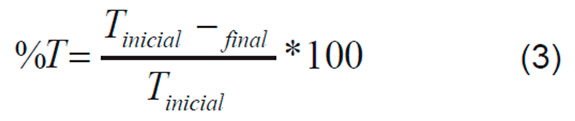Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista ION
Print version ISSN 0120-100X
Rev. ion vol.24 no.1 Bucaramanga Jan./June 2011
MEDIANTE FOTOCATÁLISIS SOLAR CON DIÓXIDO DE
TITANIO EN UN REACTOR DE PELÍCULA DESCENDENTE
LINA MARÍA GIRATÁ SASTOQUE; JORGE EDUARDO GUEVARA RODRÍGUEZ;
FIDERMAN MACHUCA MARTÍNEZ*
Escuela de Ingeniería Química, Universidad del Valle, Santiago de Cali,
A.A. 25360, Colombia.
*fiderman.machuca@correounivalle.edu.co
Fecha Recepción: 30 de julio de 2010
Fecha Aceptación: 4 de abril de 2011
La fotocatálisis con dióxido de titanio y radiación solar aparece como una aplicación potencial para el tratamiento de la vinaza, dado que muchos de sus componentes podrían ser totalmente mineralizados u oxidados en compuestos de menor carga orgánica. En este artículo se estudia el comportamiento del tratamiento para diferentes condiciones de operación tales como concentración inicial de catalizador, el pH inicial y el factor de dilución de vinaza, en un reactor solar de película descendente a escala piloto. La degradación por fotocatálisis heterogénea en el tratamiento de vinaza se cuantificó con el seguimiento del carbono orgánico total, los sólidos totales y la turbidez. En promedio se obtuvo una reducción en el carbono orgánico total de 12,33%, pero se obtuvo un aumento de sólidos totales y turbidez de 12,93% y 16,50%, respectivamente. Estos resultados se obtuvieron a pH ácido, a concentración inicial de dióxido de titanio de 0,8 g/L y concentración de vinaza del 10% v. Por otra parte, cuando el proceso se llevo a un pH básico se presenta el fenómeno de floculación debido a la formación de hidróxidos metálicos que actúan como floculantes convencionales.
Palabras clave: alcohol carburante, fotocatálisis heterogénea, plantas piloto, aguas residuales industriales
BY SOLAR PHOTOCATALYSIS WITH TITANIUM
DIOXIDE IN A FALLING FILM REACTOR
Photocatalysis with titanium dioxide and solar radiation becomes as a potential application for vinasse degradation, because its many components could be completely mineralized in low organic load compounds. This paper shows the behavior of treatment for different operating conditions such as initial concentration of catalyst, the initial pH and the dilution factor of vinasse in a solar reactor pilot-scale falling film. The degradation of the vinasse by heterogeneous photocatalysis was quantified monitoring total organic carbon, total solids and turbidity. By heterogeneous photocatalysis average were obtained the highest total organic carbon reduction of 12,33%, but there are a increase of total solids and turbidity of 12,93% and 16,50%, respectively. These results were obtained at acid pH, initial concentration of titanium dioxide of 0,8 g/L and concentration of vinasse of 10% v/v. Moreover, when the process was running in a basic pH, this shows the flocculation process due to the formation of metal hydroxides that act as conventional flocculants.
Keywords: alcohol fuel, heterogeneous photocatalysis, pilot plants, industrial wastewater
Las políticas de control de la contaminación ambiental han cambiado sustancialmente hacia nuevas tendencias preventivas, como el uso de etanol como aditivo en las gasolinas y reducir la contaminación. La utilización del 10% en volumen de alcohol carburante mezclado con la gasolina permitiría en Colombia, obtener una reducción neta de la emisión de 6 millones de toneladas/año de CO2 atmosférico, lo cual tiene una incidencia muy positiva en la problemática del cambio climático [1].
La caña de azúcar se convirtió en el principal cultivo para la producción de alcohol carburante. La industria azucarero alcoholera puede producir residuos con alta presencia de materia orgánica como la vinaza que constituye un subproducto de la producción del alcohol. La elevada carga orgánica (COT >70.000 ppm), el carácter ácido y la complejidad química como presencia de compuestos fenólicos no biodegradables [2], hacen de la vinaza un efluente potencialmente contaminante o un subproducto valioso para la generación de productos de valor agregado.
Los métodos tradicionales para el tratamiento de la vinaza se clasifican en tres grandes grupos, los de uso directo, como el compostaje y la fertirrigación; los de concentración, para fabricar alimento para animales, fertilizantes y proteína celular; y los de fermentación tanto aeróbica como anaeróbica. El objetivo de dichos métodos no es específicamente reducir la carga contaminante de la vinaza sino darle un uso alternativo [3].
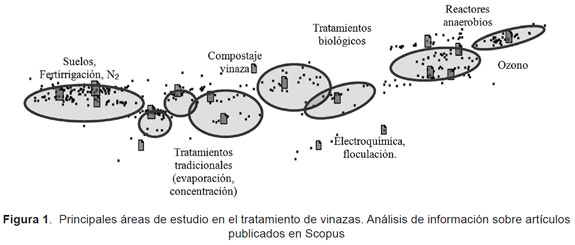
En consecuencia, se encuentra en la literatura (véase Figura 1) diversos estudios para el tratamiento de la vinaza, entre los cuales se destaca la aplicación de los métodos de oxidación química, cuyo objetivo es reducir los compuestos contaminantes en especies de menor complejidad química y menor carga orgánica y así poder mejorar los tiempos de tratamiento de sistemas convencionales. La Figura 1 presenta un esquema basado en el análisis de información (scopus) tipo galaxia y los principales aspectos en estudio.
En este artículo se presenta los principales resultados del efecto de variables tales como, concentración inicial de dióxido de titanio, el pH inicial y la dilución de vinaza, en la reducción del carbono orgánico total, los sólidos totales y la turbidez. El trabajo fue realizado en un reactor solar sin concentración tipo placa plana a escala piloto.
Pruebas experimentales
El reactor solar de placa plana que se utilizó en el desarrollo experimental de este proyecto está ubicado en la plataforma solar de la Escuela de Ingeniería Química de la Universidad del Valle y está compuesto por una placa de vidrio comercial de 1,28 m de largo por 0,98 m de ancho y 0,5 m de espesor. El área total expuesta a la radiación es de 1,25 m2. La base del reactor es de hierro y la inclinación es de 3,5° correspondiente a la latitud de Santiago de Cali, con una altura de 1,30 m en la parte más baja de la placa, el sistema cuenta con un sistema de recirculación que permite obtener un Re mínimo de 66000 y un espesor de película de 0,002 m. Para cada experimento se trataron 20 L de vinaza, manteniendo un flujo volumétrico promedio de 15 gpm en régimen turbulento. Los experimentos se llevaron a cabo en temporada seca del año 2010 (enero-febrero).
En cada uno de los experimentos se hizo seguimiento a las energías UV instantánea y acumulada. Además se garantizó la saturación de oxígeno con la instalación de un sistema de aireadores.
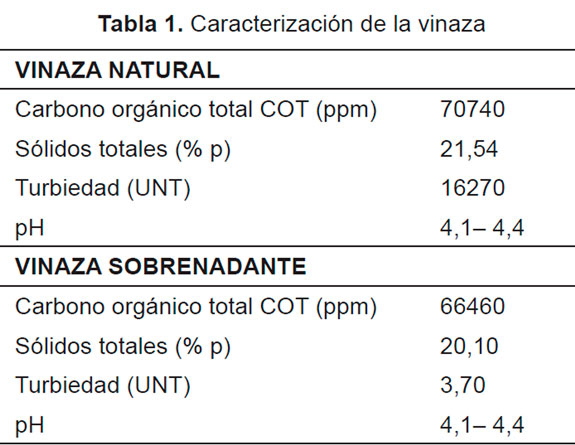
La vinaza a tratar se deja en reposo durante aproximadamente 15 días (en refrigeración) para luego utilizar el líquido sobrenadante (vinaza sobrenadante). En los experimentos se usó agua de acueducto para diluir la vinaza sobrenadante y se utilizó como modificador de pH soluciones 2M de NaOH y H2SO4. Como catalizador se utilizó TiO2 AEROXIDE® P-25.
Diseño experimental
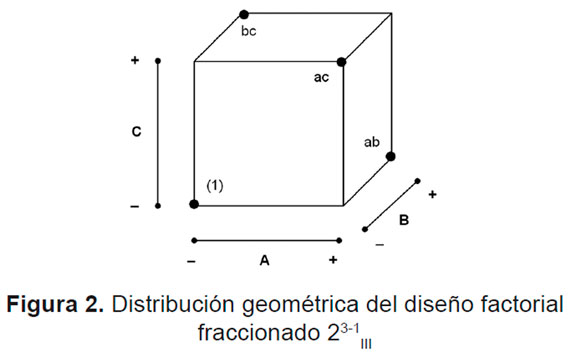
Para las pruebas experimentales se utilizó un diseño factorial fraccionado 23-1 III . El diseño factorial fraccionado permite minimizar el número de ensayos mientras mantiene el balance de apareamiento entre los niveles de cada factor. La limitación de este tipo de diseños es que no permiten establecer la significancia estadística de las interacciones entre los factores, debido al enmascaramiento de los efectos principales con sus interacciones [4]. En la Figura 2 se muestra la distribución geométrica del diseño factorial fraccionado 23-1 III, donde los puntos indican las pruebas experimentales que se realizaron, cada prueba con una réplica.
Variables de entrada
Las variables en estudio son: energía UV acumulada/ tiempo, cada uno de los experimentos se realizó hasta alcanzar un valor de energía UV acumulada de 35 W-h/m2 en aproximadamente 4 horas. pH inicial de la mezcla, esta variable se analizó en dos niveles, ácido (pH = 4) y básico (pH = 9). Concentración inicial de catalizador, se evaluaron dos niveles, 0,4 y 0,8 g/L. Dilución, los niveles de dilución se fijaron en relaciones 1:10 y 1:5 que corresponden a soluciones del 10% y 20% v de vinaza sobrenadante, respectivamente.
Variables de respuesta
Las Ecuaciones 1, 2 y 3 describen las variables de respuesta escogidas, el porcentaje de reducción del carbono orgánico total (%COT), y los porcentajes de aumento de los sólidos totales (%ST) y de la turbidez (%T).
Las características de la vinaza utilizada se presentan en la Tabla 1. Como se observa al dejar decantar la vinaza original se obtiene una ligera variación en la cantidad de sólidos totales y una apreciable reducción de la turbidez, esto debido a precipitación de los sólidos sedimentables de la vinaza. Se observa una ligera disminución del carbono orgánico total.
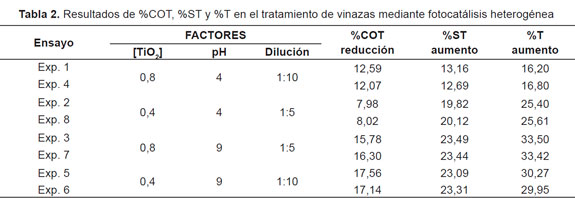
Los resultados obtenidos experimentalmente del tratamiento fotocatalítico de la vinaza, se presentan en la Tabla 2, en términos de la reducción del carbono orgánico total (%COT), porcentaje de los sólidos totales (%ST) y el porcentaje de turbidez (%T).
A pH ácido, la mayor reducción del carbono orgánico total se obtuvo con una concentración inicial de TiO2 de 0,8 g/L y con la mayor dilución de la vinaza. Este resultado es consecuente con lo reportado en la literatura, donde la degradación del contaminante es proporcional a la concentración de catalizador [5]. Por su parte, la mayor dilución puede garantizar un mejor aprovechamiento de la energía solar por parte de la vinaza y por tanto menor efecto de apantallamiento para el catalizador. De esta forma se permitió una mayor activación del TiO2, produciendo el par electrón-hueco para la formación del radical OH• responsable de la degradación de la materia orgánica.
La mayor reducción de carbono orgánico total que se obtuvo a pH ácido fue en promedio de 12,33%. Esta reducción relativamente baja pudo deberse a un fenómeno de limitación difusional en las reacciones de degradación ó una inhibición tanto de la adsorción del sustrato como de la formación de las especies reactivas. La limitación difusional se puede presentar cuando el radical hidroxilo OH• debe alcanzar sitios reactivos presentes en el centro de grandes moléculas, donde muchos de los sitios se encuentran bloqueados debido al tamaño de las mismas [6]; la inhibición de la adsorción del sustrato y la formación de las especies reactivas y la complejidad de las muestras a tratar [7]. Por otra parte, en estudios posteriores realizados por el grupo de investigación, con catalizadores homogéneos (fotofenton) se encontró porcentajes alrededor del 15% para condiciones solares similares.
En cuanto a los sólidos totales y la turbidez, el menor aumento también se obtuvo con una concentración inicial de TiO2 de 0,8 g/L y dilución 1:10. Es importante aclarar que el aumento obtenido en los sólidos totales y la turbidez no fue contribución del dióxido de titanio, ya que tanto la medición inicial como la final se tomaron cuando el catalizador estaba mezclado en la solución. Este aspecto es importante pues normalmente no se espera este tipo de comportamiento en el tratamiento de aguas.
Los resultados de los sólidos totales y la turbidez están directamente relacionados, es probable que la turbidez de una muestra se vea afectada por la metodología utilizada, las muestras se agitaron previamente a la determinación de la turbidez, por lo que la medición pudo estar afectada tanto por los sólidos suspendidos como por los sólidos sedimentables. Con la contribución de ambos tipos de sólidos, la turbidez se convierte en una variable equivalente a la de los sólidos totales.
En términos generales, el aumento de los sólidos totales y la turbidez podría explicarse bajo la consideración de que los componentes presentes en la vinaza, por medio de las reacciones fotocatalíticas o por medio de reacciones paralelas no controladas (por ejemplo, reacciones con el oxígeno), puedan generar productos de reacción intermediarios en fase sólida. Esta explicación tiene su razón en la naturaleza química de la vinaza, y a las múltiples reacciones que pudieron ocurrir durante el proceso de fotocatálisis. Por lo anterior es necesario mas estudios sobre el sistema y tratar de establecer una ruta de degradación multicomponente para la misma.
La vinaza contiene una mezcla de compuestos orgánicos que complican la cuantificación e identificación de sus estructuras características es una limitación en el entendimiento de su reactividad. Además debe tenerse presente que la velocidad de las reacciones fotocatalíticas no sólo se afecta por el sustrato y los radicales formados a través del proceso reactivo, sino también por las interacciones electrostáticas en la superficie del semiconductor [7].
Específicamente, el aumento de los sólidos totales y la turbidez en medio ácido pudo deberse a la precipitación de las melanoidinas [8]; estos compuestos, responsables de la coloración oscura de la vinaza, son polímeros de bajo y alto peso molecular formados como uno de los productos finales de la reacción de Maillard, la cual es una reacción no enzimática resultado de la reducción de azúcares y compuestos amino [9].
A pH básico la reducción del carbono orgánico total es independiente de la concentración de catalizador y de la dilución. La diferencia de %COT para ambos valores de concentración inicial de TiO2 y de dilución, es tan sólo de 1,31% lo que no permite establecer cuál de los dos factores presentó mayor incidencia sobre la disminución de la carga orgánica.
La reducción del carbono orgánico total es mayor en medio básico que en ácido, dado que a valores altos de pH los iones hidroxilo OH- absorbidos en la superficie del catalizador son eficientemente atrapados por los huecos fotogenerados para la formación de los radicales hidroxilos OH• [10]. Con un pH básico se garantiza una cantidad suficiente de iones OH- que producirán los radicales OH• responsables de la diminución de la carga orgánica.
En medio básico, el aumento de los sólidos totales también es independiente tanto de la concentración inicial de catalizador como de la dilución. Se presenta una diferencia de %ST de 0,26% para ambos valores de concentración inicial de TiO2 y dilución, lo que no permite establecer cuál de los factores es más influyente en el comportamiento de esta variable. El menor aumento de la turbidez se obtuvo en un pH básico, con 0,4 g/L de TiO2 y dilución 1:10. Sin embargo, la diferencia en el porcentaje de turbidez para ambos valores de concentración inicial de catalizador y dilución fue de 3,35%.
De forma general para el medio básico, el aumento de los sólidos totales y la turbidez podría explicarse con base en las reacciones paralelas de los iones metálicos disueltos (como Na+, K+, Ca+2, Mg+2, Fe+2 entre otros); el medio alcalino favorece la adsorción de este tipo de iones, dado que la superficie del dióxido de titanio se carga negativamente [10]. Como punto de referencia se encontró que la vinaza puede contener diferentes cantidades de iones, como ejemplo de ello, Kannan et al (2006) reportan en promedio 571 ppm de sodio, 823 ppm de potasio, 507 ppm de calcio, 387 ppm de magnesio y 17 ppm de hierro [11].
La presencia de iones metálicos disueltos pudo afectar la velocidad y eficiencia de las reacciones fotocatalíticas [12]. Por un lado, los iones metálicos de reaccionar con los electrones promovidos a la banda de valencia, lo que evita la recombinación electrón-hueco y a su vez incrementa la formación de los radicales hidroxilo.
En términos específicos, se observó experimentalmente el efecto de los iones de hierro sobre el aumento tanto de los sólidos totales como de la turbidez. A pH básico, el ion ferroso puede reaccionar con los iones OH- produciendo Fe(OH)2 comúnmente denominado herrumbre verde, compuesto que se apreció visualmente durante la experimentación por su coloración verde oscuro. Con pH superiores a 7,75, el Fe(OH)2 precipita y su concentración no varía con el pH [13].
A su vez, en presencia de radicales hidroxilo, el herrumbre verde puede formar hidróxido férrico Fe(OH)3, el cual se caracteriza por su color rojizo y por precipitar a condiciones básicas [14]. Por otra parte, el Fe(OH)3 también se puede formar mediante la oxidación del hidróxido ferroso, por acción del oxígeno disuelto en el medio. El hidróxido férrico puede actuar como floculante facilitando la separación de los materiales en suspensión del efluente. Además, este tratamiento puede reducir los compuestos fenólicos disueltos por adsorción en el gel férrico Fe(OH)3 [14].
La presencia de este tipo de compuestos, que actúan como floculantes dentro del proceso, podría indicar que en medio básico además de la fotocatálisis, se presente una separación por floculación, donde una parte de la materia orgánica suspendida se precipitó y no se mineralizó. Esta consideración permitiría explicar el comportamiento obtenido para el %COT en medio básico, donde la concentración inicial de TiO2 no tiene efecto sobre el tratamiento. Si la reducción del carbono orgánico total hubiera sido por fotocatálisis heterogénea, la mayor degradación se habría alcanzado con la mayor concentración inicial de catalizador, como ocurrió en medio ácido.
La floculación que probablemente se presentó en medio básico pudo inactivar el dióxido de titanio suspendido debido a la gran cantidad de compuestos precipitados que se adhirieron a su superficie, evitando así la generación del par electrón-hueco para la formación del radical hidroxilo y la posterior degradación de la materia orgánica. Aunque en la floculación no hay degradación de materia orgánica, la aparente reducción obtenida en medio básico pudo deberse al método utilizado para la medición del carbono orgánico total; dado que en este método es necesario retirar los sólidos de la muestra, no es posible medir el carbono presente en los compuestos orgánicos que pudieron precipitar por floculación.
Finalmente, se realizaron cuatro experimentos de fotólisis y se realizó el seguimiento al carbono orgánico total. La reducción del carbono orgánico total obtenida por medio de fotólisis en medio ácido, que en promedio fue de 0,58%, indica que la radiación solar por sí sola no es suficiente para la degradación de la materia orgánica.
En medio básico la reducción del carbono orgánico total fue en promedio de 16,7%, lo que implica que pudo ocurrir un proceso de floculación debido a la formación de lodos. De acuerdo a los resultados experimentales, se podría suponer que la adición de dióxido de titanio junto con la formación del floculante hace que se presente una mayor precipitación de la materia orgánica.
La degradación de la vinaza por medio de fotocatálisis heterogénea, en las condiciones de estudio, ocurrió a pH ácido, concentración alta de catalizador y alto factor de dilución, obteniendo la mayor reducción promedio de carbono orgánico total de 12,33%, se presentó un aumento promedio de sólidos totales y turbidez de 12,93 y 16,50%, respectivamente.
En medio básico a pH de 9, probablemente se presentó bajo porcentaje de oxidación de la materia orgánica por medio de fotocatálisis heterogénea puesto que aparentemente hubo una separación por floculación, debido a la posible formación de hidróxidos metálicos que precipitan en medio básico y actúan como floculantes.
Los autores agradecen a la Universidad del Valle (Colombia) por el apoyo financiero para el desarrollo del presente trabajo.
[1] Quintero, R.; Cadena, S. y Briceño, C.O. "Proyectos de investigación sobre uso y manejo de vinazas (marzo 2010)". Disponible en Internet: http://www.cengicana.org/Portal/SubOtrasAreas/Etanol/Presentaciones/ProyectosInvestigacionSobreUsoManejoVinaza.pdF. [ Links ]
[2] Martin, M. A.; Raposo, F.; Borja, R. and Martin, A. "Kinetic study of the anaerobic digestion of vinasse pretreated with ozone, ozone plus ultraviolet light, and ozone plus ultraviolet light in the presence of titanium dioxide". Process Biochermistry, 37, 2002, 699-706. [ Links ]
[3] Dávila, Javier A. "Tratamientos aplicados a vinazas de la producción de alcohol". Monografía. Escuela de Ingeniería Química. Universidad del Valle. Colombia, 2007, 126. [ Links ]
[4] Montgomery, D. C. Diseño y Análisis de Experimentos. 3 ed. México: Grupo Editorial Iberoamérica, 1991, 300-303. [ Links ]
[5] Herrmann, Jean-Marie. "Heterogeneous photocatalysis: fundamentals and applications to the removal of various types of aqueous pollutants". Catal. Today, 53, 1999, 115-129. [ Links ]
[6] Westerhoff, Paul; Aiken, George; Amy, Gary and Debroux, Jean. "Relationships between the structure of the natural organic matter and its reactivity towards molecular ozone and hydroxyl radicals". Water Research, 33 (10), 1999, 2265-2276. [ Links ]
[7] O'Shea, Kevin E. and Cardona, Claudia. "The reactivity of phenol in irradiated aqueous suspensions of TiO2. Mechanistic changes as a function of solution pH". Journal of Photochemistry and Photobiology A: Chemistry, 91, 1995, 67-72. [ Links ]
[8] Hatano, Ken-ichi; Kikuchi, Satoshi; Miyakawa, Takuya; Tanokura, Masaru and Kubota, Kenji. "Separation and characterization of the colored material from sugarcane molasses". Chemosphere, 71, 2008, 1730-1737. [ Links ]
[9] Satyawali, Y. and BalakrishnaN, M. "Wastewater treatment in molasses-based alcohol distilleries for COD and color removal: A review". J of Environmental Management, 86, 2008, 481-497. [ Links ]
[10] Prieto, O.; Fermoso, J.; Nuñez, Y.; del Valle, J. L. and Irusta, R. "Decolouration of textile dyes in wastewaters by photocatalysis with TiO2". Solar Energy, 79, 2005, 376-383. [ Links ]
[11] Kannan, N.; Karthikeyan, G. and Tamilselvan N. "Comparison of treatment potential of electrocoagulation of distillery effluent with and without activated Areca catechu nut carbon". J of Hazardous Materials, 137, 2006, 1803- 1809. [ Links ]
[12] Litter, Marta I. "Heterogeneous photocatalysis Transition metal ions in photocatalytic systems". Appl. Catal. B: Env, 23, 1999, 89-114. [ Links ]
[13] Morgan, Barak and Lahav, Ori. "The effect of pH on the kinetics of spontaneous Fe(II) oxidation by O2 in aqueous solution - basic principles and a sample heuristic description". Chemosphere, 68, 2007, 2080-2084. [ Links ]
[14] Beltran de Heredia, Jesús; Dominguez, J. R. and PARTIDO E. "Physico-chemical treatment for the depuration of wine distillery wastewater (vinasses)". Water Science and Technology, 51 (1), 2005, 159-166. [ Links ]
[15] Santana-Casiano, J. M.; González-Dávila, M.; Rodríguez, M. J. and Millero, F. "The effect of organic compounds in the oxidation kinetics of Fe(II)". Marine Chemistry, 70, 2000, 211-222. [ Links ]