Introducción
La depreciación del valor comercial de la glicerina y la complejidad para desarrollar procesos energéticamente viables que permitan el aprovechamiento de esta sustancia química como recurso renovable hace atractivo el estudio de la transformación de glicerol 1.
Con el fin de aprovechar esta fuente residual se han propuesto alternativas, encontrándose que el uso de catalizadores heterogéneos, metálicos y soportados de Pt, Ru, Pd o Rh, resultan muy convenientes para procesos de conversión de glicerol a otras sustancias de alta aplicabilidad en diferentes áreas industriales 1.
La hidrogenólisis del glicerol a 1,2-propanodiol por procesos catalíticos promete incrementar el valor ofertado de la glicerina como materia prima debido a la alta demanda de este producto en la industria. Además, hay que señalar que en comparación con los procesos industriales clásicos para la obtención de 1,2-propanodiol, los procesos catalíticos son más económicos y medioambientalmente amigables 2.
La transformación catalítica del glicerol a 1,2-propanodiol no es fácil, pues se han logrado reacciones con buenas conversiones pero con baja selectividad hacia el producto deseado, dejando además, trazas de otros productos como 1,2-propanodiol, mono alcoholes volátiles o dioles más pesados como el etilenglicol o el butanodiol o para el caso de reacciones con buena selectividad hacia el 1,2-propanodiol no se logran porcentajes de transformación del glicerol elevados. Es por esta razón y con el propósito de mejorar la eficiencia de la reacción que se han sintetizado, estudiado y aplicado diversos catalizadores heterogéneos 3. La hidrogenólisis se efectúa sobre un catalizador de (CuCr2O4) a 473K y menos de 10atm, seguido de una destilación reactiva 4. Los autores sugieren que la hidrogenólisis de glicerol a 1,2PDO procede según el sistema de catalizador y la fase de reacción, pero por lo general se requiere un sistema de catalizador que se involucre tanto en la deshidratación como en la hidrogenación 5.
En las reacciones de fase líquida, en general se acepta que los sitios ácidos catalizan la deshidratación del glicerol en acetol, que se hidrogena adicionalmente en 1,2-PDO sobre metales de transición, tales como Pt, Ru, y Cu 5. Se propone que el grupo OH terminal del glicerol interactúa más probable con un sitio ácido de Lewis y posteriormente se efectúa la transferencia del grupo OH terminal al sitio ácido de Lewis y la migración del H+ del átomo de carbono interno para el átomo en puente del O del óxido dando 2,3-dihidroxipropeno, que se tautomeriza para producir acetol.
De otro lado, también se proponen sitios ácido de Brønsted puedan catalizar la deshidratación de glicerol en acetol y la posterior tautomerización cetoenólica. La deshidrogenación de glicerol puede proceder igualmente a través de sitios del metal con la asistencia del soporte básico para formar gliceraldehído, que se deshidrata a 2-hidroxi-2-propenal sobre los sitios básicos, y, finalmente el 1,2-PDO se produce a partir de 2-hidroxi-2-propenal 6.
Entre los metales que más se han trabajado para la preparación de los catalizadores se encuentra el Cu por su abundancia y bajo costo comparado con otros metales como el Ru o el Rh, aunque estos estudios aun no arrojan resultados óptimos en cuanto a conversión, selectividad y condiciones de reacción 3,4,7,8,9,10,11,12,13,14.
El Cu metálico interviene en la hidrogenólisis de glicerol, de tal manera que contribuye en la hidrogenación del intermediario hidroxiacetona (acetol) formado en la primera etapa de deshidratación del glicerol (4.
Catalizadores de Cu soportado en óxidos básicos como: MgO, CaO, CeO 7,8,9, anfóteros como: ZnO 1,2,3,4,7,8,9,10 y ácidos como: SiO2, MCM41, ZrO2, TiO2, Al2O33,11,12, demuestran que un buen equilibrio entre la fase metálica de Cu y la fase del soporte, mejoran la conversión y favorecen el rompimiento de enlaces C-O contribuyendo a la selectividad hacía el 1,2-propanodiol 13. Dentro de los productos encontrados aplicando estos catalizadores heterogéneos, se tiene principalmente: acetol y propilenglicol, por otra parte se encuentran productos secundarios como metanol, etanol y propanol, demostrando que la aplicación de los catalizadores heterogéneos conlleva a rompimientos entre enlaces C-C (13, 14).
Estos estudios demuestran que la aplicación de un catalizador preparado mediante impregnación por humedad incipiente y bajo condiciones drásticas de hasta 523K y 32bar de presión en un tiempo de 12 a 13h favorece tanto a la conversión del glicerol como a la selectividad hacia 1,2-propanodiol 14.
Hasta el momento no se reporta en la literatura la transformación de glicerol hacia el 1,2-propanodiol con buenas conversiones y con buenas selectividades mediante la reacción catalítica de hidrogenólisis a temperaturas y presiones por debajo de 473K y 20bar, respectivamente. Por este motivo, este estudio trata de encontrar nuevos sistemas catalíticos de Cu/MgO, Cu/SiO2, Cu/Al2O3 y Cu/ZnO, preparados por el método de impregnación en humedad incipiente que sean activos y selectivos en la hidrogenólisis de glicerol.
Procedimiento experimental
Materiales y reactivos
Cu(NO3)2.3H2O, ZnO, Al2O3, SiO2, MgO y glicerol al 99% marca Panreac, H2 al 99,9% Cryogas.
Síntesis de los catalizadores
Con el propósito de evaluar la actividad y selectividad catalítica en relación con el contenido en cobre, los catalizadores se prepararon con un 10% y 20% de Cu mediante la técnica impregnación por humedad incipiente 14. Para esto, se prepararon disoluciones 1M de nitrato de cobre (II) que se adiciona sobre cada uno de los soportes de ZnO, Al2O3, SiO2 y MgO. Luego, se evaporó el agua a una temperatura de 333K durante 4h. Después se procedió a secar completamente el sólido a 383K durante 11h en un horno, y finalmente cada uno de los sólidos fue calcinado a 673K durante 4h en un horno tubular.
Caracterización de los catalizadores
Con el fin de determinar la composición de los catalizadores se empleó la técnica FTIR, empleando un equipo SHIMADZU FT-IR 8400 que cubre la región entre los 300cm-1 y 4000cm-1 a una resolución de 2cm-1, mediante el método de pastilla de KBr. Para determinar las fases cristalinas presentes en la superficie del catalizador, la composición porcentual de las mismas y el tamaño de los cristalitos para cada una de ellas, se utilizó la técnica de difracción de rayos X (DRX) en un equipo X’PERT PRO PAN Analytical, empleando un barrido de 2θ entre 10° y 90° con paso de 0,02º, velocidad de barrido de 5º/min, voltaje de aceleración de 40kV y corriente de 50mA. La caracterización microestructural de los catalizadores se realizó mediante la técnica de microscopía electrónica de transmisión, empleando un equipo Philips CM120 con filamento LaB6 con previo tratamiento de la muestra diluyendo una cantidad muy pequeña de muestra en acetona buscando la máxima dispersión sumergiendo la solución en un baño de ultrasonidos y depositando una gota sobre una rejilla filmada con carbono para ser observada directamente después de secada.
Reacción de hidrogenólisis del glicerol
Se tomaron 10mL de glicerina grado técnico que equivalen a 15,50g de glicerol aproximadamente, se adicionaron 0,63g de cada catalizador lo que corresponde a un porcentaje del 5%p en un vaso de 50mL previamente pesado. La reacción se llevó a cabo en un reactor tipo Parr con una capacidad de 500mL. El reactor fue purgado con hidrógeno grado 5.0, para posteriormente realizar el suministro de hidrógeno a 10 y 20bar con el fin de evaluar el efecto de la presión. Se emplearon dos temperaturas de reacción 473K y 523K con una agitación constante de 80 rpm por un tiempo de 13h. El catalizador fue previamente activado con hidrógeno, a 573K y 623K, en un flujo de 0,1L/min durante 3h.
Análisis cromatográfico por GC y GC-Masas
La muestra a analizar fue derivatizada empleando Hexametildisilosano (HMDS) y Clorotrimetilsilano (TMCS), como disolvente se empleó piridina. El cromatógrafo de gases empleado fue un CG Hewlett Packard 6890 y las condiciones de trabajo fueron: para el Inyector en Modo Splitless, temperatura 563K, el detector FID (Flame Ionization Detector) a una temperatura de 573K.
Para el análisis por espectrofotometría de masas se utilizó un equipo marca SHIMADZU GCMSQp2010 con impacto electrónico cuadrupolar con un detector chaneltron, un rango de trabajo de 2-100 masa-carga, una velocidad de escaneo de 166 scan/s, haciendo uso de una columna Inowax para análisis de alcoholes y una perfil de temperatura programada que inicia en 323K durante 4 minutos, luego se usa la primer rampa con pendiente de 303K/min hasta alcanzar una temperatura de 383K donde reposara 4 minutos para posteriormente llevar a la segunda rampa de pendiente 313K/min hasta alcanzar los 503K donde se deja durante 4 minutos para finalizar el análisis.
Resultados y Discusión
Los resultados tras la caracterización de los catalizadores de este estudio se presentan a continuación:
Espectroscopia FT-IR. La Figura 1 se observan las bandas características en el infrarrojo para los catalizadores Cu/ZnO, Cu/Al2O3, Cu/SiO2 y Cu/MgO con porcentajes de cobre al 20%.

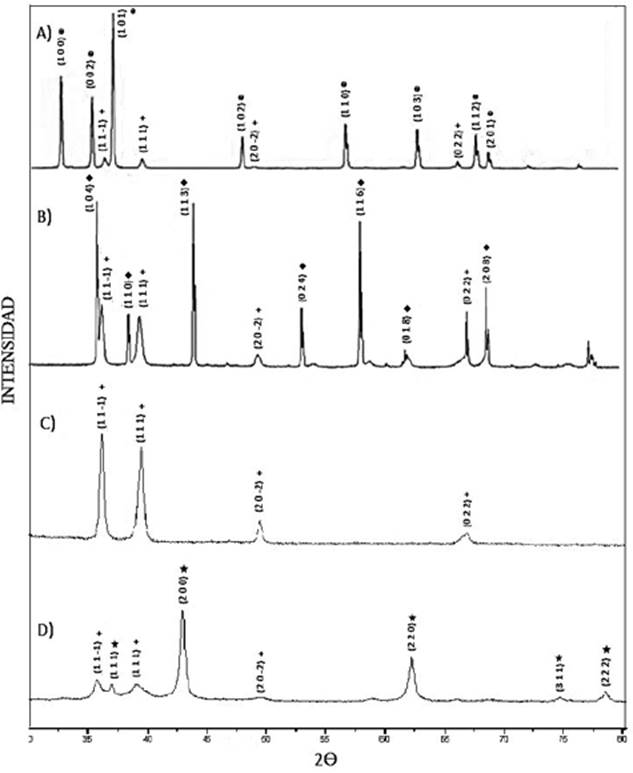
Figura 1 Espectro FT-IR para los catalizadores A) Cu20%/ZnO, B) Cu20%/Al2O3, C) Cu20%/SiO2, D) Cu20%/MgO.
En todos los infrarrojos se observa una banda a 3400cm-1, la cual se pueden atribuir a la vibración del enlace O-H de los grupos hidroxilos. Adicionalmente para el óxido de zinc (Figura 1a), el scissoring del grupo O-H se observa a 669cm-1. La absorción a 874cm-1 es debida a la formación de una coordinación tetraédrica del Zn. El pico a 604cm-1 indica el estiramiento del enlace Zn-O. En lo que respecta al Al2O3 (Figura 1b), aparecen las bandas asociadas al enlace Al-O del Al2O3 las cuales se encuentran alrededor de 554cm-1 y 456 cm-1. Para el caso del SiO2 (Figura 1c), se aprecia la banda de absorción cercana a 1105cm-1 que corresponde a la vibración del enlace Si-O, la banda a 468cm-1, se puede atribuir a las deformaciones del enlace Si-O-Si pertenecientes al SiO2. Para el caso del óxido de magnesio, a 422cm-1 se aprecia la banda característica del enlace Mg=O.
Adicionalmente, se observan que todos los catalizadores de este estudio presentan las bandas a 874cm-1, 1383cm-1 y 1632cm-1, correspondientes a los modos de vibración simétricos y asimétricos característicos de los nitratos 15, lo anterior muestra que la temperatura de calcinación a la que fueron sometidos los cuatro catalizadores no fue suficiente para la eliminación de los nitratos.
Difracción de rayos X. Los patrones de difracción de rayos X de los catalizadores con un contenido de Cu20%, calcinados a 573K y sin ser reducidos se muestran en la Figura 2. Se aprecia principalmente las fases cristalinas de los soportes, óxido de zinc (zincita), óxido de aluminio, sílice y magnesio (periclasa), además de la fase tenorita que corresponde al CuO presente en la superficie de los catalizadores, tras la impregnación del Cu(NO3).3H2O y los diámetros paralelos y perpendiculares mediante el uso del software GSAS a partir de cada uno de los difractográmas.
La aparición de los picos de difracción a un 2Ө = 35,6º y 38,7º, confirma la presencia de Cu2+ y demuestra la mayor disponibilidad de los planos (1 1 -1) y (1 1 1) respectivamente.
Es importante mencionar que la intensidad de los picos de difracción del Cu2+ representa la cuenta de cada uno de los planos presentes en proporción a la cantidad de cristal puro formado y en el Cu20%/ ZnO, (Figura 2A), se observa que la intensidad disminuye posiblemente por un alto contenido de especies interferentes correspondiente a los nitratos (NO3 -), restándole disponibilidad a los dos planos (1 1 -1) y (1 1 1) del CuO, mientras que en el Cu20%/Al2O3, la intensidad de los picos de difracción del Cu2+ es mayor debido a la menor presencia de nitratos, que permiten una mayor disponibilidad de los planos anteriormente mencionados.
En el difractograma correspondiente al catalizador Cu/SiO2, Figura 2C, se aprecia mayoritariamente los picos de difracción de la fase CuO debido a que el SiO2 es un sólido amorfo que presenta solo un máximo con como patrón de difracción. En el sólido Cu/MgO se observa que los picos de difracción del CuO presentan poca intensidad aunque si se compara la relación entre la intensidad de los picos de las fases CuO y la de los correspondientes soportes, se puede deducir que los planos (1 1 -1) y (1 1 1) del CuO están más disponibles en el Cu/ MgO que en el Cu/ZnO.
Por otra parte, la composición de la tenorita CuO, así como el diámetro perpendicular y paralelo de los cristalitos de las especies caracterizadas se reportan en la Tabla 1.
Tabla 1 Análisis de tamaño de cristalitos y composición porcentual superficial para el Cu/ZnO mediante el tratamiento de los difractográmas con el software GSAS.
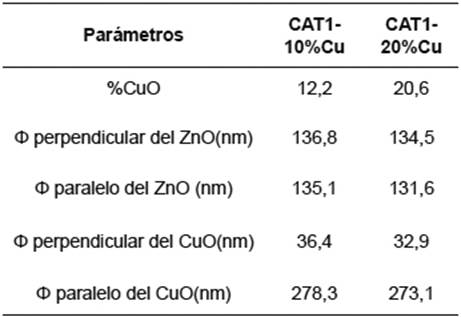
Como se puede ver en la Tabla 1, el aumento en la carga de cobre incrementa el porcentaje de CuO presente en la superficie del catalizador. Además, el diámetro paralelo de los cristalitos de CuO aumentó considerablemente, debido a la mayor cantidad de este óxido disponible habrá una mayor cantidad de núcleos que posibilitan la formación y crecimiento mayoritario de aglomerados 16.
Microscopía Electrónica de Barrido ( SEM ).
La microscopía electrónica de barrido (SEM) (Figura 3) indica que los soportes empleados presentan agregados de cobre con una gran cantidad de nanoestructuras cristalinas de diferentes tamaños con longitudes que varían desde los 20nm hasta los 600nm aproximadamente. En los sistemas Cu/SiO2 y Cu/MgO, las partículas formadas presentan cristalitos unidos constituyendo particulados cercanos a los 600 y 900nm respectivamente. Los nanocristales de óxido de cobre en forma de tenorita, no se distribuyen de manera uniforme en toda la superficie, disminuyendo asi la capacidad de interacción entre los sitios activos del soporte y el sustrato que en este caso es el glicerol. Desde un punto de vista general, se podría creer que, con el fin de lograr una buena dispersión de la fase metálica, se deberían crear sobre la superficie del soporte grupos funcionales, para producir una activación del mismo y de esta forma lograr que las partículas del metal puedan interactuar con los diferentes grupos funcionales presentes en el soporte y se depositen. Adicionalmente, se debe considerar que la superficie del soporte cambia su polarización dependiendo del valor de pH de la solución y del punto isoeléctrico (pI) del soporte. Así, a pH<pI la superficie se encuentra cargada positivamente y está rodeada por aniones por un efecto electrostático, por lo que la superficie adsorberá aniones. Para el caso de que pH>pI la superficie está cargada negativamente y rodeada por cationes, los que adsorberá de la solución. Si se evalúa la posibilidad de modificar o de generar sitios nuevos de anclaje, se pueden hacer diferentes tratamientos que pueden también modificar el comportamiento frente a la impregnación, tanto en hidrofilicidad como en reducibilidad de precursor sobre el soporte. Cabe destacar que la presencia de grupos oxigenados puede inhibir la fácil reducción del metal debido a la formación de especies estables sobre el soporte.
De otro lado, el estudio de la morfología y tamaño de partícula sugiere que para todos los catalizadores se presentan regiones oscuras las cuales se asocian a la presencia del CuO cristalino, y de nitrato de cobre presentes en el catalizador. La Figura 3a, muestra que el catalizador Cu/ZnO posee cristales de formas variadas entre aciculares y esféricas con tamaños de aglomerados entre los 200 y los 1000nm, y que la distribución de los cristalitos no es homogénea.
La Figura 3b, muestra el catalizador Cu/SiO 2 se encuentra como un polvo fino con tamaño de aglomerados menor a 100nm. Su morfología también varía en cada parte del catalizador y no presenta una distribución uniforme en el tamaño de cristalitos.
Por otra parte, en la Figura 3c, se encontró que el catalizador Cu/MgO presenta aglomerados con forma de rectángulos, de aguja y cristales aciculares en red, con tamaño de cristalitos superiores a los 40nm. Lo anterior puede ser debido al método de impregnación en humedad incipiente de donde se parte de una solución de nitrato de cobre (II), con Cita: González Vera OF, Mutiz JJ, Urresta Aragón J. Synthesis and characterization of Cu type catalysts supported on MgO, SiO2, ZnO, and Al2O3 applied to the hydrogenolysis of glycerol. rev.ion. 2017;30(2):31-41.
Reacción de hidrogenólisis del glicerol
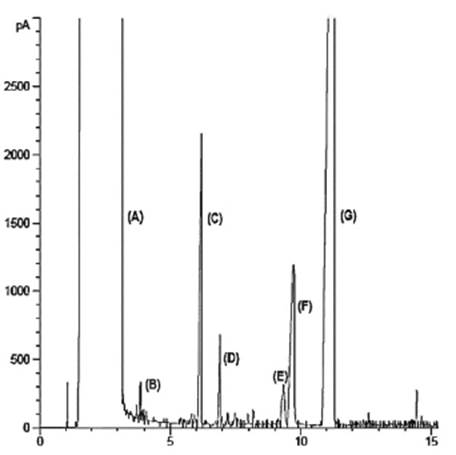
Productos de Reacción. En la evaluación de los catalizadores de Cu/ZnO, Cu/SiO2, Cu/Al2O3 y Cu/MgO se encontró no solo una deshidratación seguida de una hidrogenación de la glicerina, sino también la ruptura de la cadena carbonada, resultado que evidenciado por los productos obtenidos por cromatografía de gases acoplado a espectrofotometría de masas, Figura 4, donde se aprecia la presencia de compuestos orgánicos más pesados, por lo que se puede sugerir la posible participación de intermediarios como lactatos 17 y que posteriormente pueden conllevar a procesos de dimerización indicando que la transformación de glicerol se ha dirigido por otra ruta catalítica no deseada.
Por otra parte se refleja la formación de butanodiol en intervalos que oscilan entre el 1% y el 20%, producto que quizá se genere por el rompimiento entre enlaces C-C, que pueden ocurrir por un rearreglo debido al soporte catalítico, en el que posiblemente tras la primera deshidratación del glicerol, el intermediario acetol fortalece el enlace entre el hidroxilo terminal y el soporte debilitando de esta forma el enlace C-C con posible ruptura que reacciona con otra especie similar formando el butanodiol como se observa en el cromatograma generado por cromatografía acoplada a masas en la Figura 4.
Efecto de la presión de hidrógeno sobre la reacción catalítica de hidrogenólisis.
En la Tabla 3 se presenta la conversión del glicerol y la selectividad hacia los productos de reacción a presiones de 10 y 20bar, a 473K de reacción y activados a 573K.
En ella se observa que para el sistema MgO (sólido básico) o para el ZnO (anfótero) incrementar la presión de 10 a 20 bar conlleva a un aumento en la conversión del glicerol. Por otro lado, para los sistemas ácidos Al2O3 y SiO2, se evidencia un detrimento en la conversión de glicerol. Como han descrito varios autores 4,5,6, el trabajar con sólidos ácidos o básicos implica que haya un mecanismo diferente, sea por medio de sitios ácidos de Lewis, transformando el glicerol en 2,3-dihidroxipropeno para tautomerizarse y producir acetol, o por medio de sitios ácido de Brønsted o básicos que puedan catalizar la deshidratación de glicerol en acetol y la posterior tautomerización cetoenólica.
De la misma forma, se observa que incrementar el porcentaje metálico de cobre de 10 al 20%, aumenta la conversión del sistema catalítico. Sin embargo para los sistemas ácidos, al incrementarse el porcentaje de cobre, se pierde en selectividad hacia el 1,2 propanodiol y se favorece más bien es la obtención de productos de ruptura de enlace C-C y de dimerización, pues es conocido que un soporte básico favorece la reacción de deshidratación del glicerol hacia el 1,2-propanodiol, por lo que en el caso de emplear un sistema ácido debe favorecer la formación de un carbocatión y posterior ruptura de un enlace C-C y lo anterior puede conducir a la dimerización de los productos obtenidos. Los argumentos para decir esto desde el punto de vista de la caracterización se pueden fundamentar en el carácter ácido del soporte SiO2 u otro soporte ácido. En contraste, el sólido Cu/MgO que contiene 10% de Cu presentó el menor porcentaje de conversión (28%), por lo que la presión de hidrógeno y la temperatura de reacción no son apropiadas para favorecer la reacción. Incrementar la presión de hidrógeno a 20 bar favorece la conversión pasando de 28 a 84% y selectividad hacia el 1,2-propanodiol de 52% por lo que se puede decir que es muy probable que un incremento en la presión favorece la interacción del glicerol y el intermediario acetol con la superficie catalítica de cobre soportado en óxido de magnesio. El sistema Cu/ZnO por su parte presenta una selectividad hacia otros productos y no es selectivo hacia el 1,2-propanodiol, en este estudio se sugiere que este comportamiento se puede deber al carácter anfótero del ZnO y a la débil interacción entre el metal y el soporte (SMSI) por sus siglas en inglés.
Según estos resultados se puede decir que el Cu20%/MgO es el catalizador más efectivo para la hidrogenólisis de glicerol mostrando el mayor porcentaje de conversión (84%) con una alta selectividad hacia el 1,2-propanodiol (52%).
Tabla 2 Respuesta cuantitativa de la reacción de hidrogenólisis de glicerol a 473K usando los catalizadores de cobre soportado en óxidos de Zn, Al, Si y Mg activados a 573K.

Efecto de la temperatura de reducción de los catalizadores sobre la reacción catalítica de hidrogenólisis. Al evaluar la influencia de la temperatura de activación pasando de 573K a 673K, se observa en la Tabla 3 que la conversión aumenta para todos los catalizadores. Incrementar la temperatura brinda a los reactivos la energía suficiente para interactuar más fuertemente con la superficie del catalizador, venciendo el impedimento que generan las especies e interactuando con el óxido soporte y con las especies hidrogenantes
Tabla 3 Respuesta cuantitativa de la reacción de hidrogenólisis de glicerol a 473K usando los catalizadores de cobre soportado en óxidos de Zn, Al, Si y Mg activados a 623K.

En este caso el mayor porcentaje de conversión (80%) se logró con el Cu/MgO con 10% en Cu, sin embargo a 20bar de presión se logra la mejor selectividad con 63%, aunque en general se favorece para todos los sólidos la formación de otros productos.
Mientras que cuando se incrementó la temperatura de reacción a 523K, manteniendo la temperatura de activación a 623K, como se observa en la Tabla 4, muestra un incremento en la conversión, pero una baja selectividad para el 1,2-propanodiol, y más bien se favorece la formación de otros productos, en todos los sólidos estudiados.
Conclusiones
La síntesis de los sistemas catalíticos por el método de impregnación en humedad incipiente, permitió la cristalización de cobre en su fase tenorita con cantidades muy cercanas a 10 y 20% de Cu tal y como se esperaba sobre MgO, ZnO, SiO2 y Al2O3.
La caracterización de los sistemas condujo a observar la existencia de la especie tenorita (CuO) que es responsable de la transformación del glicerol, y de especies Cu-O-M que a su vez son responsables de la selectividad hacia el 1,2-propanodiol.
El estudio de microscopía electrónica mostró que la cantidad de cobre empleado para la preparación de los catalizadores influye en la aglomeración y por tanto en el tamaño de los cristalitos de cada uno de los sistemas catalíticos de este estudio.
El catalizador más eficiente para la reacción de hidrogenólisis de glicerina fue el Cu20%/MgO que a condiciones de reacción de 20bar de presión de hidrógeno, 473K en la temperatura de reacción y 573K en la temperatura de reducción del Cu, se encuentra una transformación de glicerol del 84% y una selectividad hacia el 1,2-propanodiol 52%, por otra parte, este mismo catalizador favorece la hidrogenólisis de glicerol cuando se activa este mismo catalizador a 623K a las mismas condiciones de reacción, incrementando la selectividad hasta 63% con una disminución en la conversión a 65%.