Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.3 Bogotá Sept./Dec. 2008
Leonardo Castellanos1, Carmenza Duque1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. lcastellanosh@unal.edu.co
Recibido: 04/11/08 – Aceptado: 17/12/08
RESUMEN
Del extracto orgánico de la esponja marina Cliona tenuis, recolectada en las Islas del Rosario (Colombia, mar Caribe), fue obtenida la fracción lipídica, la cual presentó propiedades antifouling en pruebas en campo. Esta fracción fue separada por CC sobre gel de sílice hasta obtener fracciones de ésteres metílicos, glicéridos, glicolípidos, fosfolípidos y ácidos grasos libres, las cuales fueron identificadas por CCD y técnicas de de-replicación (RMN 1H y 13C). Posteriormente, las fracciones de glicéridos, glicolípidos y fosfolípidos fueron hidrolizadas, y los ácidos obtenidos, junto con los provenientes de la fracción de ácidos grasos libres, fueron transformados en ésteres metílicos, y todos se analizaron por CGAR-EM. Para ubicar las insaturaciones y ramificaciones, los ésteres metílicos se transformaron luego en sus correspondientes pirrolididas, las cuales también se analizaron por CGAR-EM. El estudio cromatográfico (valores de ECL) y de los espectros de masas de los ésteres metílicos y de sus derivados pirrolididas permitió identificar 81 ácidos grasos diferentes, de los cuales no habían sido previamente reportados: los ácidos 4,8-hexadecadienoico, 11-metil- 4,10-octadecadienoico, 6,9,12,14- icosatetraenoico, y 6,9,12,14,17-icosapentanoico.
Palabras Clave: Cliona tenuis, lípidos, ácidos grasos, antifouling.
ABSTRACT
The lipid fraction obtained from the marine sponge Cliona tenuis, collected at the Islas del Rosario (Colombia, Caribbean Sea), showed antifouling activity using field bioassays. This fraction was separated by CC on silica gel obtaining a mixture of methyl esters, and enriched fractions of glycerides, glycolipids, phospholipids and free fatty acids. All of them were identified by TLC and dereplication techniques (NMR). The glyceride, glycolipid, and phospholipid fractions were hydrolyzed and the fatty acids obtained, together with the initial fatty acids fraction, were converted into their methyl esters and analyzed by HRGC-MS. To locate unsaturations and alkyl branches in fatty acids, their methyl esters derivates were transformed to pyrrolidides and subsequently analyzed by HRGC-MS. The identity of the fatty acids was carried out using their ECL value as methyl esters, and particularly the study of their pirrolidide spectra was used to locate unsaturations and alkyl branch positions. This study allowed us to identify 81 fatty acids, four of them never reported before: 4,8-hexadecadienoic acid, 11-methy l-4, 10-octadecadienoic acid, 6,9,12,14-icosatetraenoic acid, and 6,9,12,14,17-icosapentanoic acid.
Key Words: Cliona tenuis, lipids, fatty acids, antifouling.
RESUMO
A partir do extrato orgânico da esponja marinha Cliona tenuis, coletada nas ilhas do Rosario (Colombia, Mar Caribe), foi obtido uma fração lipídica, que apresentou propriedades antifouling in situ. Esta fração foi separada através de CC em gel de sílica para obter as frações de ésteres metílicos, glicerídeos, glicolipídeos, folfolipídeos e ácidos libres, as quais foram identificadas por CCD e técnicas espectroscópicas de RMN 1H e 13C. Posteriormente, as frações contendo glicerídeos, glicolipídeos e folfolipídeos foram hidrolizadas e os ácidos obtidos, juntamente com os ácidos obtidos das frações que continham ácidos livres foram transformadas em ésteres metílicos e analisados por CGAR-EM. Para identificar as insaturações e ramificações, os ésteres metílicos foram transformados em derivados pirrolidínicos para serem analisadas por CG-EM. Através da análise cromatográfica (valores de ECL) e dos espectros de massas dos ésteres metílicos e seus derivados pirrolidínicos foi possível identificar 81 ácidos graxos diferentes, sendo que quatro são compostos ainda não relatados: os ácidos 4,8-hexadecadienóico, 11-metil-4,10-octadecadienóico, 6,9, 12, 14- icosatetraenóico, e 6,9,12,14,17-icosapentanóico.
Palavras-Chave: Cliona tenuis, lipídeos, ácidos graxos, antifouling.
INTRODUCCION
Las esponjas son organismosmulticelulares que han logrado colonizar la mayoría de los hábitat acuáticos. El proceso de adaptación a estos ambientes pudo traer como consecuencia cambios en las membranas celulares, en especial en los fosfolípidos y los esteroles que las constituyen, lo cual les permitió adaptarse a su entorno. A partir de los estudios químicos practicados sobre esponjas marinas, se ha logrado aislar una gran cantidad de metabolitos novedosos, incluidos lípidos y muchos otros compuestos con actividad farmacológica (1). Los estudios en esponjas marinas sobre la composición de ácidos grasos ligados a distintas clases de lípidos, como por ejemplo fosfolípidos, glicolípidos, glicéridos, esteroles o en forma libre, muestran la presencia de ácidos demospóngicos (longitudes de cadena superiores a C24 y generalmente con un patrón de insaturación cisC-5 y cisC-9); ácidos grasos con sustituyentes hidroxilo, ciclopropilo, acetoxi, metoxilo, bromo; ácidos con cadena impar y ácidos con un patrón de insaturación C-6 y C-11, muy poco difundido en la naturaleza, además de la presencia de ácidos poliinsaturados y ramificados (2). Algunos de estos ácidos grasos y sus derivados han mostrado actividad antimicrobiana (3), citotóxica (4) y antifouling (5), por lo cual recientemente se han venido desarrollado esfuerzos sintéticos para obtener este tipo de compuestos (6).
El presente estudio fue llevado a cabo con el objeto de ampliar el conocimiento de los lípidos de las esponjas del género Cliona. Las esponjas de este género resultan interesantes puesto que han sido consideradas unos de los organismos bioerodadores más abundantes de los arrecifes del mar Caribe, siendo también uno de los organismos más eficientes en la competencia por espacio; por ejemplo Cliona tenuis y Cliona aprica son capaces de crecer lateralmente sobre y dentro del sustrato coralino a una tasa de varios centímetros por año (7), pudiendo llegar a matar al coral que están invadiendo, y en algunos casos hasta monopolizar el sustrato arrecifal con las consecuentes pérdidas en la biodiversidad. De lo anterior resulta claro que estos organismos han tenido efecto notorio sobre la morfología y ecología de los arrecifes coralinos. De otro lado, las esponjas de este género han sido estudiadas químicamente, en particular por el interés que ha despertado la presencia de péptidos lineales enamínicos en ellas (8); no obstante también se ha estudiado su composición lipídica, particularmente de las esponjas caribeñas Cliona aprica (9) y Cliona caribbaea (10), además de las esponjas Cliona celata, Cliona viridis y Cliona chilensis. Hasta la fecha no se ha reportado la composición lipídica de Cliona tenuis, objeto de estudio en este trabajo, aunque en 2006, dentro de nuestro grupo de investigación, se reportó el aislamiento de un imino derivado de un aminoácido (11) que presenta propiedades aleopáticas (12) contra corales, constituyéndose en el primer ejemplo de un compuesto involucrado en la competencia por espacio contra corales, aislado de una esponja.
Por las razones antes mencionadas, este trabajo pretendió identificar la fracción responsable de la actividad antifouling observada en el extracto total de Cliona tenuis, y caracterizarla químicamente. El fouling puede ser descrito como la acumulación de material particulado, microorganismos, plantas y animales sobre superficies (animadas o inanimadas) sumergidas en un medio acuoso. Este proceso obedece a la necesidad que tienen muchos organismos marinos de asentarse sobre una superficie para su desarrollo, y hace parte de la competencia natural de los individuos por colonizar y luego defender el espacio adquirido en el bentos, atendiendo lo anterior al hecho de que este recurso es muy limitado en el mar. Existen múltiples estrategias por las cuales los organismos marinos evitan el fouling; entre ellas se destacan los compuestos químicos que producidos por un organismo pueden disuadir el asentamiento de otros sobre él (13).
PARTE EXPERIMENTAL
Para la cromatografía en columna (CC) se utilizó sílica gelMerck (230-400 mesh), y para la CCD se emplearon cromatoplacas Merck de sílica gel HF254. Los espectros de RMN fueron registrados en un equipo Brucker-400 empleando CDCl3 y CD3OD como solventes. Los análisis por cromatografía de gases se realizaron en un cromatógrafo Shimadzu GC-17A acoplado a un espectrómetro de masas QP5050A, empleando una columna DB-1 de sílica fundida (25 m x 0,25 mm d.i., 1mm) y usando He (1 mL/min) como gas de arrastre. Las temperaturas del detector e inyector se mantuvieron a 300 °C. La fuente de ionización se usó a 70 eV.
Material de Estudio
Ejemplares de la esponja Cliona tenuis fueron recolectados, mediante buceo autónomo, en las Islas del Rosario (Colombia) en agosto de 2003 a una profundidad de 3 a 6 metros. Las muestras se lavaron, se limpiaron cuidadosamente y se congelaron a -30 ºC. La especie fue identificada por el doctor Sven Zea, y un espécimen fue depositado en el Instituto de Ciencias Naturales de Colombia con el código ICN-MHN(Po) 189.
EXTRACCION Y SEPARACION
La esponja (2,1 kg) fue cortada en pequeños trozos, limpiada del carbonato y extraída con diclorometano y metanol. Los extractos se combinaron en uno solo (36,3 g, extracto crudo total, ECT), y fueron sometidos a partición entre CH2Cl2 y H2O. La fracción acuosa fue sometida a partición entre butanol y agua, obteniéndose la subfracción butanólica (WB) y la subfracción acuosa (WW), respectivamente. Los lípidos totales fueron obtenidos en la fracción de CH2Cl2 (NP). Finalmente, la fracción NP fue sometida a partición entre metanol (al 90%) y n-hexano, obteniendo la subfracción metanólica (FM) y la subfracción hexánica (FH), respectivamente.
La subfracción FH se separó por CC sobre sílica gel empleando mezclas de hexano y acetato de etilo para su elución. Así, se obtuvieron las fracciones de ésteres metílicos (11% de FH), de acilglicéridos (47% de FH) y de ácidos libres (3,5% de FH). Estas fracciones fueron identificadas por CCD comparativa usando patrones de este tipo de compuestos, y caracterizadas preliminarmente por RMN 1H y 13C.
Para obtener las subfracciones de fosfolípidos y glicolípidos, la fracción lipídica total NP se separó por cromatografía al vacío sobre sílica gel previamente tratada con hidróxido de amonio y secada a 120 ºC, tal y como lo indica la metodología desarrollada originalmente por Privett et ál. en 1973 (14, 15). En la fracción eluida con acetona se detectó la presencia de glicolípidos (10% de NP) por el color rojo de revelado frente a una solución de a-naftol, y por el análisis de su espectro de RMN 1H y 13C. En la fracción eluida con metanol (7% de NP) se detectó la presencia de fosfolípidos por comparación en CCD con patrones, y por el color azul de revelado frente a una solución de azul de molibdeno, así como por el análisis de su espectro de RMN 1H y 13C.
Obteción de los ésteres metílicos y N-acilpirrolididas de ácidos grasos
Las fracciones de ácidos grasos libres, acilglicéridos, glicolípidos y fosfolípidos fueron convertidos en sus ésteres metílicos (EMAG) por reacción con KOH metanólico (10%), y luego con BF3-MeOH (14%). Los derivados N-pirrolidínicos fueron preparados por reacción de los EMAG (1 mg aprox.) con pirrolidina recién destilada (0,1 ml) en presencia de ácido acético (0,01 ml), y calentamiento a 110 ºC por 2 h. Los EMAG obtenidos fueron analizados por CG-EM usando la columna antes descrita, y un programa de temperatura desde 130 ºC hasta 305 ºC calentando a 4 ºC/min. Las mezclas de pirrolididas fueron analizadas empleando un programa de temperatura desde 200 ºC hasta 300 ºC calentando a 4 ºC/min.
Los índices de retención ECL (longitud equivalente de cadena, por sus siglas en inglés) y los datos del espectro de masas (EM, 70 eV) de los ácidos grasos nuevos (Figura 1) se presentan a continuación.
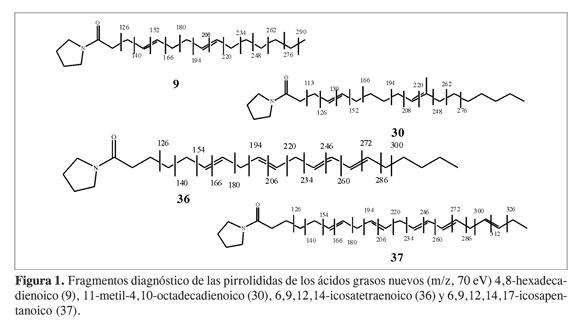
4,8-Hexadecadienoato de metilo(9):
ECL 15,66; EM m/z: 266 (M+, 2%), 234 (2%), 192 (2%), 150 (3%), 135 (10%), 121 (10%), 95 (40%), 81 (70%), 67 (100%).
Pilorridida del ácido 4,8-hexadeca-dienoico:
EM m/z 305 (M+, 20%), 290 (1%), 276 (2%), 262 (3%), 248 (8%), 234 (10%), 220 (9%), 206 (3%), 194 (20%), 180 (10%), 166 (3%), 152 (5%), 140 (8%), 126 (100%), 113 (90%), 98 (60%).
11-Metil-4,10-octadecadienoato de metilo (30):
ECL 18,74; EM m/z 308 (M+, 2%), 293 (2%), 265 (5%), 209 (20%), 140 (100%), 121 (10%), 95 (50%), 81 (100%), 70 (60%).
Pirrolidida del ácido 11-metil-4,10-octadecadieinoico:
EM m/z 347 (M+, 1%), 332 (1%), 318 (1%), 304 (1%), 290 (1%), 276 (2%), 262 (5%), 248 (5%), 220 (5%), 208 (5%), 194 (10%), 180 (10%), 166 (25%), 152 (12%), 140 (2%), 126 (20%), 113 (100%), 98 (50%).
6,9,12,14-Icosatetraenoato de metilo (36).
(10%), 180 (10%), 166 (25%), 152 (12%), 140 (2%), 126 (20%), 113 (100%), 98 (50%).
Perrolidida del ácido 6,9,12,14-icosa-tetrainoico:
EM m/z 357 (M+, 2%), 328 (1%), 314 (1%), 300 (2%), 286 (2%), 272 (2%), 260 (2%), 246 (2%), 234 (1%), 220 (2%), 206 (3%), 194 (1%), 180 (3%), 166 (3%), 154 (1%), 140 (3%), 126 (20%), 113 (100%), 98 (20%).
6,9,12,14,17-Icosapentanoato de metilo (37):
ECL 19,38; EM m/z 316 (M+, 1%), 301 (1%), 247 (1%), 233 (2%), 215, (2%), 201 (3%), 95 (50%), 91 (70%), 79 (100%), 67 (80%).
Perrolidida del ácido 6,9,12,14,17-Icosapentanoico:
EMm/z 355 (M+, 2%), 326 (1%), 312 (1%), 300 (2%), 286 (2%), 272 (2%), 260 (2%), 246 (2%), 234 (1%), 220 (2%), 206 (3%), 194 (1%), 180 (3%), 166 (3%), 154 (2%), 140 (3%), 126 (20%), 113 (100%), 98 (20%).
Ensayo de actividad antifouling
Para este ensayo se utilizaron geles de PhytagelTM, que tienen la características de liberar lentamente los compuestos en él retenidos (16). Los geles con las fracciones de prueba (ECT, WW, WB y NP), a una concentración volumétrica natural, fueron dispuestos en cajas de petri (90 mm de diámetro x 10mmde altura). Los geles control se prepararon mezclando la misma cantidad de Phytagel y agua, y agregando la cantidad equivalente de metanol o diclorometano empleados en el proceso de dispersión de las fracciones. Posteriormente, las cajas fueron amarradas boca abajo (con los geles en dirección al sustrato) en dos andamios de tubos de PVC, y se sumergieron a 8 m de profundidad en Punta de Betín (SantaMarta). Los experimentos se realizaron enmarzo de 2005, y durante marzo y abril de 2006, dejando los geles sumergidos en el agua por un período de 30 días. Luego las cajas de petri se sacaron del mar teniendo cuidado de mantenerlas siempre sumergidas en aguamarina, y se llevaron a los laboratorios de Invemar donde se colocaron en acuarios con flujo continuo de agua marina filtrada. Bajo el estereoscopio se evaluaron la abundancia y el porcentaje de cobertura de organismos sésiles. Se realizaron comparaciones de estas variables entre extractos crudos, fracciones y el control por medio de las pruebas estadísticas Kruskal- Wallis y Dunn y ANOVA (17).
RESULTADOS Y DISCUSION
Propiedades antifouling del extracto lipídico de Cliona tenuis
La esponja Cliona tenuis contiene una gran cantidad de zooxantella asociada, pero no está colonizada por macroorganismos pese a que ocupa espacios grandes en el fondo marino, lo cual podría indicar que contiene compuestos capaces de inhibir la colonización de su superficie. Por lo anterior se procedió a determinar si el extracto total (ECT) de C. tenuis mostraba propiedades antifouling según el ensayo antes descrito, y se encontró que ECT presenta un efecto antifouling estadísticamente significativo respecto al control (Tabla 1), pues tanto la abundancia como la cobertura de organismos disminuyó notablemente al usar el extracto en comparación con los controles.

El paso siguiente fue determinar en cuál o cuáles de las fracciones se centraba esta actividad, para lo cual se ensayaron las fracciones acuosa (WW), butanólica (WB) y no polar (NP), encontrando que la fracción no polar (NP) presenta un efecto antifouling estadísticamente significativo respecto al control, mientras que las fracciones WW y WB no tuvieron un efecto antifouling significativo respecto al control (Abundancia: Kruskal Wallis, p > 0,05; Cobertura: ANOVA, p = 0,05). Así, se pudo establecer que en la fracción lipídica (NP) de esta esponja se concentró la actividad antifouling exhibida por el extracto total. Las propiedades antifouling son muy importantes para la supervivencia de la esponja, puesto que le permite mantener su superficie libre de epibiontes dejando el espacio libre para su supervivencia. Una revisión de la bibliografía ha mostrado que compuestos tales como los glicolípidos, glicerilglicolípidos, ácidos grasos de cadena larga como el araquidónico o palmitoléico y los esfingolípidos han mostrado actividad antifouling (5). Por lo anterior resultó importante caracterizar químicamente esta fracción lipídica (NP).
Composición de la fracción lipídica
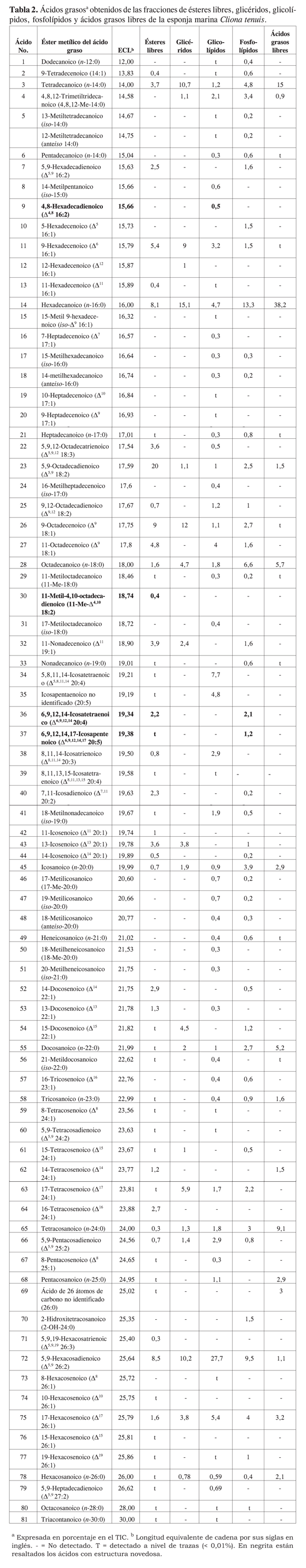
La fracción lipídica total (NP) fue separada por cromatografía en columna en mezclas de ésteres metílicos, glicéridos, glicolípidos, fosfolípidos y ácidos libres, tal y como se describió en la parte experimental. Cada una de las fracciones fue identificada por su movilidad en CCD con respecto a patrones de cada una de las clases de compuestos, así como por sus espectros de RMN tanto protónica como de carbono. Posteriormente, los ácidos grasos que componían las fracciones fueron transformados en sus ésteres metílicos y pirrolididas, tal y como se describe en la parte experimental. La asignación estructural de los ácidos grasos se hizo mediante el estudio de los espectros de masas de los ésteres metílicos, la comparación del parámetro cromatográfico ECL (longitud equivalente de cadena, por sus siglas en inglés) con los valores reportados en la literatura, y los obtenidos por nosotros para muestras verdaderas. La asignación de la posición de las insaturaciones y de las ramificaciones se hizo mediante el estudio detallado del espectro de masas de las pirrolididas obtenidas (18). La cuantificación se realizó por el método de normalización de áreas tanto en el TIC como en el cromatograma. En la Tabla 2 se presentan los ésteres metílicos de los ácidos grasos identificados en las fracciones de ésteres metílicos libres, glicéridos, glicolípidos, fosfolípidos y ácidos libres, indicando en cada caso su abundancia relativa. Adicionalmente, se presenta el valor de ECL para cada uno de estos ésteres metílicos de ácido graso.
En la Tabla 2 se destacan en negrita los ácidos cuya estructura no había sido reportada previamente en la bibliografía. En la Figura 1 se presentan los iones diagnóstico de los derivados pirrolidínicos que permitieron localizar los dobles enlaces y las ramificaciones de los ácidos no reportados: 4,8-hexadecadienoico, 11- metil- 4,10-octadecadienoico, 6,9,12, 14- icosatetraenoico, y 6,9,12,14,17-icosapentanoico. Cabe resaltar que los valores de ECL encontrados para estos ácidos no corresponden a ningún ácido reportado en la literatura. A continuación, y a manera de ejemplo, se presenta el análisis de los espectros de masas de dos de ellos. El éster metílico del ácido 4,8-hexadecadienoico presentó un ion en m/z 266 que corresponde con una fórmula molecular C17H30O2, indicando la presencia de dos dobles enlaces en la cadena hidrocarbonada; además mostró los iones en m/z 234 correspondiente a la pérdida de metanol (M+-CH3OH), y en m/z 150 correspondiente a un rompimiento alílico desde el fragmento anterior (M+-CH3 OH-C6H13), sugiriendo un doble enlace en la posición 8. El espectro del derivado pirrolidínico mostró un fragmento en m/z 305 (M+), que confirma que se trata de un ácido de 16 carbonos diinsaturado; la posición de las insaturaciones se asignó en las posiciones 4 y 8 por los fragmentos en m/z 234, 220, 206, 194, 180, 166, 152, 140 y 126, tal y como se indica en la Figura 1. El valor ECL de 15,66 para este compuesto tampoco se encontró reportado en la literatura para un compuesto de las características antes mencionadas.
El éster metílico del ácido 11-metil-4,10-octadecadienoico presentó un ion en m/z 308 que corresponde con una fórmula molecular C20H36O2, indicando la presencia de dos dobles enlaces en la cadena; además presentó un ion en m/z 209, correspondiente a la fragmentación vinílica de una cadena C7H15. El espectro del derivado pirrolidínico mostró un fragmento en m/z 347 (M+, 1%) que corresponde al derivado pirrolidínico de un ácido de 19 carbonos diinsaturado; la posición de las insaturaciones se asignó en las posiciones 4 y 10 por la presencia de los fragmentos en m/z 276, 262, 248, 220, 208, 194, 166, 152, 140, 126 y 113; la presencia del metilo en C-11 se identificó por la presencia del fragmento en m/z 248, y la ausencia de un ion en m/z 234, tal y como se muestra en la Figura 1.
En cuanto a la composición lipídica de C. tenuis, en la fracción de ésteres metílicos libres se encontró que el 5,9-octadecadienoato de metilo (20%) es el más abundante, seguido del 9-octadecenoato de metilo (9,0%), 5,9-hexacosadienoato de metilo (8,5%) y hexadecanoato de metilo (8,1%). Entre los ácidos grasos obtenidos de la fracción de glicéridos se encontró al ácido hexadecanoico (15,1%) como el más abundante, seguido por los ácidos 9-octadecenoico (12%), tetradecanoico (10,7%), 5,9-hexacosadienoico (10,2%) y 9-hexadecenoico (9%). En la fracción de glicolípidos se encontró al ácido 5,9-hexacosadienoico (27,7%) como el mayoritario, seguido por el ácido tetrainsaturado 5,8,11,14-icosatetraenoico (7,7%); los ácidos restantes tienen abundancias inferiores al 5,5%. Entre los ácidos grasos obtenidos a partir de la fracción de fosfolípidos se encontró que el hexadecanoico (13,3%) es el mayoritario, seguido por los ácidos 5,9-hexacosadienoico (9,5%), el octadecanoico (6,6%) y el tetradecanoico (4,8%). Entre los ácidos grasos identificados en la fracción de ácidos libres se encontró que el hexadecanoico (38,2%) es el mayoritario, seguido de los ácidos tetradecanoico (15%), tetracosanoico (9,1%), y octadecanoico (5,7%); también se pudo evidenciar que los ácidos grasos más abundantes en este tipo de lípidos son los de cadena lineal saturada (cadena normal).
Los ácidos grasos de cadena par (Figura 2a) y no ramificada (Figura 2b) son predominantes en todas las clases de lípidos; no obstante, entre los glicolípidos los ácidos grasos de cadena impar y ramificada presentan abundancias cercanas al 10%. En la Figura 2c se observa que los ácidos de cadena larga (superior a 24 átomos de carbono, conocidos como ácidos demospóngicos) son minoritarios con respecto a los de cadena corta; sin embargo, su abundancia relativa es superior al 10% en todos los casos, llegando a ser casi la mitad los glicolípidos.
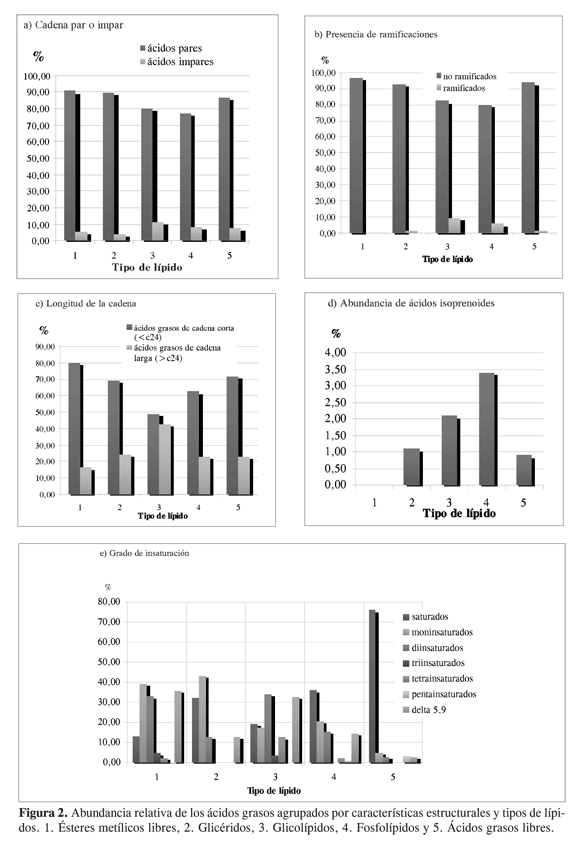
Los ácidos grasos tipo isoprenoide (Figura 2d), en todos los lípidos aquí estudiados, son minoritarios o están ausentes, como en el caso de la fracción de ésteres metílicos libres. Este resultado contrasta con lo encontrado en la bibliografía para otras especies de esponjas del género Cliona, en las que la abundancia de este tipo de ácidos es alta (9). Los ácidos grasos tipo terpenoide: 15, 18, 21, 24-triacontatetraenoico y 4, 8, 12-trimetiltridecanoico (TMTD) han sido propuestos como quimiotrazadores para las familias Spirastrellidae y Clionidae (9) sin que este hecho se haya podido observar en el presente estudio. Otra interpretación posible sobre la presencia de ácidos grasos con cadena ramificada es que su origen sea bacteriano (19, 20), y en el caso específico del ácido TMTD se ha propuesto que proviene de la transformación del fitol, que a su vez se produce por la transformación de la clorofila en las cianobacterias (19).
Los ácidos grasos insaturados (Figura 2e) son abundantes en todas las clases de lípidos estudiados, mostrando una distribución heterogénea.No obstante, entre los ácidos identificados en la fracción de ácidos grasos libres éstos son minoritarios, siendo su abundancia inferior al 10%. Entre los otros tipos de lípidos se observa una preponderancia de los ácidos grasos mono- y diinsaturados. En la Figura 2e también se puede observar que los ácidos grasos con cadena D5,9 tienen abundancias superiores al 10%en todos los lípidos, salvo en los ácidos grasos libres donde su abundancia es inferior al 3%.
La presencia del ácido araquidónico (No. 34), en elevadas concentraciones en la fracción de glicolípidos, y del ácido palmitoleico (No. 26), en elevadas concentraciones en todas las clases de lípidos salvo en los ácidos libres, podría ser la responsable de las propiedades alelopáticas observadas en la fracción lipídica de Cliona tenuis, pues estos compuestos presentan probadas propiedades antifouling (5).
La presencia del ácido araquidónico (No. 34), en elevadas concentraciones en la fracción de glicolípidos, y del ácido palmitoleico (No. 26), en elevadas concentraciones en todas las clases de lípidos salvo en los ácidos libres, podría ser la responsable de las propiedades alelopáticas observadas en la fracción lipídica de Cliona tenuis, pues estos compuestos presentan probadas propiedades antifouling (5).
el sentido de que los ácidos demospóngicos tienen abundancias del orden del 40% y la elevada abundancia del ácido 5,9-hexacosadienoico en la fracción de fosfolípidos. Con las otras especies estudiadas en la literatura no se observaron correlaciones en el contenido de lípidos.
En conclusión se identificó, por medio de un ensayo ecológico en campo, la fracción lípidica del extracto de C. tenuis como la responsable de la actividad antifouling. Esta fracción está constituida por ésteres metílicos, glicéridos, glicolípidos, fosfolípidos y ácidos grasos libres. Cada una de las fracciones anteriores fue caracterizada en cuanto a su contenido de ácidos grasos, lográndose identificar 81 ácidos conocidos y 4 no reportados previamente en la literatura. Este es el primer trabajo acerca del contenido lipídico de la esponja marina excavadora C. tenuis.
AGRADECIMIENTOS
Agradecemos a Colciencias, Fundación para la promoción de la investigación y la tecnología (Banco de la República), y a la Universidad Nacional de Colombia (DIB), por la financiación del presente estudio. Leonardo Castellanos agradece a la Universidad Nacional de Colombia por la comisión de estudios de doctorado.
REFERENCIAS BIBLIOGRAFICAS
1. Blunt, J. W.; Copp, B. R.; Hu, W-P.; Munro, M. H. G.; Northcote, P. T.; Prinsep, M. R. Marine natural products. Nat. Prod. Rep. 2008. (1): 35-94, y revisiones anteriores que aparecen anualmente con el mismo título en esta revista. [ Links ]
2. Djerassi, C.; Lam, W. W. Sponge phospholipids. Acc. Chem. Res. 1991. (3): 69-75. [ Links ]
3. Carballeira, N. M. New advances in fatty acids as antimalarial antimycobacterial and antifungal agents. Progress in Lipid Research. 2008. 47 (1): 50-61. [ Links ]
4. Zhao, O.; Mansoor, T. A.; Chong- O., J. O.; Kwang Sik Im, L.; Lee, D. S.; Jung, J. H. New Lysophosphatidylcholines and Monoglycerides from the Marine Sponge Stelletta sp. J. Nat. Prod. 2003. (5): 725-728. [ Links ]
5. Omae, I. General Aspects of Tin- Free Antifouling Paints. Chem. Rev. 2003. (9): 3431-3448. [ Links ]
6. Carballeira, N.M.; ONeill, R.; Parang, K. Synthesis and antifungal properties of alpha-methoxy and alpha- hydroxyl substituted 4-thiatetradecanoic acids. Chem Phys Lipids. 2007. (1): 82-88. [ Links ]
7. López, M.; Zea, S.; Weil, E. Competition for space between encrusting excavating Caribbean sponges and other coral reef organisms. Mar. Ecol. Prog. Ser. 2006. : 113-121. [ Links ]
8. Palermo, J. A.; Rodríguez, M. F.; Cabezas, E.; Balzaretti, V.; Seldes, A. M. Celenamide E, a tripeptide alkaloid from the patagonian sponge Cliona chilensis. J. Nat. Prod. 1998. (4): 488-490. [ Links ]
9. Carballeira, N. M.; Maldonado, M. E.; Rivera, E.; Porras, B. The fatty acid 4, 8, 12-trimethyltridecanoic as a common constituent of the phospholipids of the sponge families Spi-rastrellidae and Clionidae. Biochem. Syst. Ecol. 1989. (4): 311-314. [ Links ]
10. Bergmann, W.; McTigue, F. H.; Low, E. M.; Stokes,W. M.; Feeney, R. J. Marine products. XXVI. Sterols from sponges of the family Suberitidae. J. Org. Chem. 1949. (1): 96. [ Links ]
11. Castellanos, L.; Duque, C.; Zea, S.; Espada, A.; Rodríguez, J.; Jiménez, C. Isolation and Synthesis of (-)- (5S)-2-imino-1-methylpyrrolidine- 5-carboxylic acid from Cliona tenuis. Revision structure of pyrostatin B.Org. Lett. 2006. (21): 4967-4970. [ Links ]
12. Chaves-Fonnegra, A.; Castellanos, L.;Zea, S.;Duque,C.;Rodríguez, J.; Jiménez, C. Clionapirrolidine A, a metabolite fromthe encrusting and excavating spongeCliona tenuis that kills coral tissue upon contact. J. Chem. Ecol. 2008. (12): 1565-1574. [ Links ]
13. Fusetani, N.; Clare, A. S. Antifouling compounds. Berlin: Springer. 2006. pp. 225. [ Links ]
14. Privett, O. S.; Dougherty, W. L.; Erdahl,W. L.; Stolyhwo, A. Studies on the lipid composition of developing soybeans. J. Amer. Oil Chem. Soc. 1973. (12): 516-518. [ Links ]
15. Genin, E.; Wielgosz-Collin, G.; Njinkoué, J. M.; Velosaotsy, N. E.; Kornprobst, J. M.; Gouygou, J. P.; Vacelet, J.; Barnathan, G. New trends in phospholipid class composition of marine sponges. Comp. Biochem, Physiol. B: Biochem. Mol. Biol. 2008. (4): 427-431. [ Links ]
16. Henrikson, A. A; Pawlik, J. R. A new antifouling assay method: results from field experiments using extracts of four marine organisms. J. Exp. Mar. Biol. Ecol. 1995. (2): 157-165. [ Links ]
17. Siegel, S.; Castellan, N. J. Nonparametric statistics for the behavioral sciences. New York: McGraw-Hill, Inc. 1988. pp. 399. [ Links ]
18. Christie, W. W. The Lipid Library. Disponible en: http://www. lipidlibrary. co.uk [ Links ]
19. Barnathan, G.; Genin, E.; Velosaostsy, N. E.; Kornprobst, J. M.; Al-Lihaibi, S.; Al-Sofyani, A.; Nongonierma, R. Phospholipid fatty acids and sterols of two Cinachyrella sponges from the Saudi Arabian Red Sea: comparation with Cinachyrella species from other origins. Comp. Biochem. Physiol. B: Biochem. Mol. Biol. 2003. (2) 297-308. [ Links ]
20. Gillan, F. T.; Stoilov, I. L.; Thompson, J. E.; Hogg, R.W.;Wilkinson, C. R.; Djerassi, C. Fatty acids as biological markers for bacterial symbionts in sponges. Lipids. 1988. (12): 1139-1145. [ Links ]
21. Litchfiel, C.; Greenberg, A. J.; Noto, G.;Morales, R.W.Unusually high levels of C24 - C30 fatty acids in sponges of the class Demospongiae. Lipids. 1976. (7): 567-573. [ Links ]
22. Litchfield, C.; Tyszkiewicz, J.; Marcantonio, E. E.; Noto, G. 15, 18, 21, 24-triacontetranoic and 15, 18, 21, 24, 27-triacontapentaenoic acids: a new C30 fatty acids from the marine sponge Cliona celata. Lipids. 1979. (7): 619-622. [ Links ]














