Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.60 no.4 Palmira Oct./Dec. 2011
1Universidad Nacional de Colombia, Bogotá, Cundinamarca, Colombia.
2Corporación Centro de Investigaciones en Palma de Aceite - CENIPALMA, Colombia.
3Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, A.A. 237, Palmira, Valle del Cauca, Colombia.
4Grupo de Investigación en Orquídeas y Ecología Vegetal, Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, A.A. 237, Palmira, Valle del Cauca, Colombia.
5Miembro fundador y Director Técnico, Fundación Nativa para la Conservación de la Biodiversidad, Colombia.
*Autor para correspondencia: donaldriascos@hotmail.com; †fitopatologia@hotmail.com
El chontaduro o pejibaye (Bactris gasipaes H.B.K) es el principal cultivo de los agroecosistemas de la selva húmeda tropical de la costa pacífica colombiana. Esta región no aparece referenciada en la literatura científica a pesar de su alta biodiversidad e importancia agroecológica. El objetivo de este estudio fue aislar y caracterizar morfológicamente hasta género, hongos presentes en la rizósfera de B. gasipaes en dos sistemas de producción diferentes, localizados en Citronela y Sabaletas, Valle del Cauca, Colombia. Durante seis meses se tomaron muestras de raíces y suelo rizosférico en tres épocas con distinta precipitación pluvial. Se planteó como hipótesis que el tamaño y diversidad de la población de hongos son influenciados negativamente por la precipitación, ya que esta es la variable climática preponderante en la región del estudio. Los resultados mostraron que en la localidad de Citronela las poblaciones de hongos permanecieron estables durante los dos primeros muestreos, independiente de los cambios ocurridos en el régimen de lluvias entre épocas. En Sabaletas, durante estos mismos periodos, los registros de lluvias fueron más altos, lo que pudo generar condiciones anaerobias en la rizósfera y limitar la expresión poblacional fúngica. Para el tercer muestreo, en ambas localidades aumentó la población y diversidad de géneros de hongos, lo que coincide con la época de alta precipitación pluvial y llenado de frutos en las palmas, condiciones que aparentemente favorecen la liberación de exudados en las raíces y consecuentemente el desarrollo de las poblaciones microbianas benéficas de la rizósfera. Los géneros de hongos aislados en este estudio fueron: Trichoderma en ambas localidades, Fusarium y Rhizopus sólo en Citronela, Penicillium y Thielaviopsis sólo en Sabaletas. Estos microorganismos fungosos podrían presentar potencial benéfico para ser utilizados en programas de manejo integrado dentro del sistema de producción del chontaduro en la región Pacífico de Colombia.
Palabra clave: Buenaventura, Fusarium, hongos del suelo, pejibaye, Penicillium, Rhizopus, Thielaviopsis, Trichoderma, trópicos húmedos.
The peach palm or chontaduro (Bactris gasipaes H.B.K.) is the principal crop of the rainforest agroecosytems of the Colombian Pacific coast. This region is poorly referenced in the scientific literature despite its high biodiversity and agroecological importance. The aim of this study was to isolate and identify up to the level of genus, fungi from the rhizosphere of B. gasipaes in two areas with different crop management, Citronela and Sabanetas, both in Valle del Cauca state. Roots and rhizospherical soil were sampled at three times of varying rainfall from 2006 to 2007. It is hypothesized that the size and diversity of the population of fungi are negatively influenced by rainfall, as this is the dominant climatic variable in the study region. Results showed that in Citronela populations of fungi were stable during the first two sampling, independent of rainfall between the sampling dates. In Sabaletas rainfall was higher than in Citronela, which was associated with anaerobic conditions in the rhizosphere that limited fungal growth. The third sampling had higher fungal populations and diversity of fungal genera at both sites, coinciding with the period of high rainfall and palm fruit production, conditions which favor the liberation of exudates from the roots. These factors could have favored secretion of root exudates which in turn could favor the growth of beneficial microorganisms in the rhizosphere. The genera of fungi isolated were: Trichoderma in both sites, Fusarium and Rhizopus in Citronela only, and Penicillium y Thielaviopsis in Sabaletas only. These fungi could be beneficial and useful in programs of integrated pest management for palm peach production. The results could thus serve as a base for future studies in the Pacific region.
Key words: Buenaventura, Fusarium, humid tropics, pejibaye, Penicillium, Rhizopus, soil fungi, Thielaviopsis, Trichoderma.
El chontaduro (Bactris gasipaes H.B.K.) es uno de los cultivos de mayor importancia económica en la región del litoral pacífico colombiano. Esta especie es cultivada en las vegas aluviales y colinas del bosque cálido húmedo, en asocio con otros cultivos como las musáceas y el borojó (Borojoa patinoi Cuatrec.) para autoconsumo y comercialización local, principalmente (Escobar et ál., 1996).
La palma de chontaduro es afectada por una amplia gama de microorganismos patógenos, que en condiciones de alta humedad en el suelo y en el ambiente pueden ocasionar graves problemas fitosanitarios, los cuales provocarían pérdidas económicamente importantes. Dentro de las enfermedades asociadas con protistas, hongos y bacterias se encuentran la pudrición del cogollo o de la flecha relacionado con Phytophthora palmivora o Erwinia chrysanthemi, la mancha negra de las hojas causada por Colletotrichum spp., la mancha foliar por Pestalotia spp., la mancha parda por Mycosphaerella spp., la mancha de anillo por Drechslera setariae, la hoja deshilachada por Lasiodiplodia theobromae y la pudrición del tallo y quema de hojas por Erwinia spp. (Orduz y Rangel, 2002; Arroyo et ál., 2004).
El manejo tradicional de este cultivo no permite la identificación temprana de enfermedades, sus síntomas y agentes causales (Mora et ál., 1997; Arroyo et ál., 2004), lo que conlleva la utilización indiscriminada de fungicidas por parte de los agricultores, quienes desconocen que dichos productos de amplio espectro tienen efectos detrimentales sobre la biota natural del suelo, incluyendo poblaciones microbianas benéficas (Alabouvette et ál., 2004). Para los agricultores el empleo indiscriminado de productos químicos representa un costo substancial tanto económico como de salud, sin desconocer el deterioro ambiental (Baker y Dickman, 1995; Whipps, 2001).
A lo anterior se agrega el hecho que algunos pesticidas han reducido su efecto sobre el control de formas biológicas nocivas, debido principalmente a mecanismos de resistencia y a la presión de selección, por lo cual se deben superar los límites de dosificación lo que resulta peligroso para el hombre, los animales, las plantas y el ambiente (Pramauro, 1990). En la actualidad, debido a la necesidad de encontrar alternativas compatibles con el ambiente, ha aumentado el interés por el control biológico y la generación del manejo integrado de enfermedades en cultivos de importancia económica (Whipps, 2001).
Se define como biocontrol la reducción del inóculo del patógeno a través de la acción de uno o más organismos diferentes al hombre (Baker y Dickman, 1995). El éxito de este sistema es posible en la medida que a partir de diferentes hábitats se aíslen microorganismos antagónicos para enfrentarlos al agente causal de una enfermedad determinada. El mayor éxito con dichas prácticas se ha observado en el ecosistema suelo (Olalde y Aguilera, 1998).
Barea et ál. ( 2005) consideran q ue l a interacción entre la raíz de la planta y las comunidades microbianas promueve el desarrollo de un ambiente dinámico, conocido como rizósfera, que se define como la porción de suelo que está adyacente al sistema de raíces de una planta y que a su vez está influenciada por los exudados de dichas raíces (Cooke, 1979; Manoharachary et ál., 2006). Tanto los exudados como el material orgánico del suelo depositado por la misma biota, proveen la fuerza necesaria para el desarrollo de la población microbiana activa alrededor de las raíces, lo que se conoce como efecto rizosférico (Whipps, 2001; Manoharachary et ál., 2006). La comunidad de la rizósfera está compuesta principalmente por microorganismos no-patogénicos (Alexander, 1994). En esta zona, se pueden encontrar por gramo de suelo aproximadamente 106 hongos, 107 actinobacterias, 109 bacterias y 103 protozoarios (Dix y Webster, 1995), los cuales pueden afectar de forma positiva el crecimiento y desarrollo de la planta, la nutrición, la defensa contra enfermedades, la tolerancia a metales pesados, y la resistencia a la degradación de xenobióticos ocasionada por productos químicos de origen natural o sintético presentes en el ambiente (Barea et ál., 2005).
Es común la presencia del género Trichoderma a nivel de la rizósfera de distintas especies vegetales donde cumple actividades como antagonista, micoparásito, competidor por nutrientes y espacio con microorganismos patógenos y/o inductor de resistencia en plantas (Yedidia y Chet, 1999; Baker y Dickman, 1995; Barea et ál., 2005; Harman, 2006). Según Whipps (2001) algunas de las especies de Trichoderma dominan el grupo de hongos que exhiben propiedades antagónicas. Por su parte, Penicillium es un agente primario activo muy importante en la descomposición de materia orgánica, que se caracteriza por ser uno de los microorganismos que más contribuye en los procesos de regulación de poblaciones patógenas a través de la inducción de resistencia en plantas (De Cal et ál., 1997) y la producción de sustancias antibióticas como penicilina y extrolitos fungitóxicos como griseofulvina, diclorogriseofulvina y ácido curvulinico (Raper y Thom, 1930; Nicoletti et ál., 2007).
Algunas especies de Fusarium nopatogénicas compiten con otras especies patogénicas de este mismo género y lo hacen principalmente por carbono, hierro y nitrógeno (Whipps, 2001; Alabouvette et ál., 2004); adicionalmente a este género se le atribuye actividad saprofítica (Barnett y Hunter, 1972). Esta misma función la cumple el género Rhizopus, asociado con la descomposición de compuestos solubles de la materia orgánica del suelo entre ellos aminoácidos libres, ácidos orgánicos y azúcares (Agrios, 2005; Luo y Zhou, 2006). En Colombia, Buriticá (1999) cita a Thielaviopsis como patógeno de plátano y banano; no obstante, Mora et ál. (1997) lo consideran saprófito al encontrarlo creciendo sobre frutos de chontaduro en descomposición.
Para entender el funcionamiento de los agroecosistemas desde el componente microbiológico, es necesario interpretar valores de biomasa y actividad microbiana tendientes a desarrollar estrategias de manejo en los sistemas de producción (Smith et ál., 1993) y de esta forma contribuir al mejoramiento de las prácticas agrícolas y los métodos de conservación de la biodiversidad (Morgan et ál., 2005). El desarrollo de trabajos de investigación para reconocer poblaciones de microorganismos benéficos presentes en la rizósfera de plantas de chontaduro establecidas en agroecosistemas de trópico húmedo, contribuye a garantizar elementos de bioprospección dentro del componente biológico en programas de manejo integrado del cultivo, lo cual ayudaría a reducir la demanda de insumos de síntesis química por parte de los agricultores que aún desarrollan prácticas tradicionales de agricultura.
El objetivo general de este trabajo fue reconocer la población de algunos hongos con posible acción benéfica presentes en la rizósfera de palmas de chontaduro, establecidas en agroecosistemas y huertos de los corregimientos de Citronela y Sabaletas, Buenaventura, Valle del Cauca, Colombia. Como objetivos específicos se consideraron: (1) El aislamiento y la cuantificación de la población de hongos cultivables presentes en la rizósfera de chontaduro con posible potencial benéfico (antagonistas, entomopatógenos y saprófitos); (2) la caracterización a nivel de género de la población fungosa aislada con el fin de determinar su diversidad; (3) preservar los aislamientos obtenidos de hongos, con el propósito de crear un cepario para su posterior uso en estudios de biocontrol y programas de manejo integrado de problemas fitosanitarios asociadas con este cultivo en los sistemas agroforestales del trópico húmedo de la región Pacífico del Valle del Cauca.
Fase de campo
El trabajo se realizó entre noviembre de 2006 y abril de 2007, en las localidades Citronela y Sabaletas, zona rural del municipio de Buenaventura (3° 52' 46" N, 77° 04' 12" O) departamento Valle del Cauca (Colombia), donde el cultivo principal era palma de chontaduro bajo sistemas de producción contrastantes en su manejo. La localidad de Citronela presenta una temperatura, promedio anual, de 25.8 °C y 6.408 mm de precipitación. Se encuentra fisiográficamente ubicada en un paisaje de colinas en la cuenca baja del río Dagua. Los suelos tienen pH de 4.7, textura arcillosa (Ar), con densidad aparente de 0.60 g/cm3 y porcentaje de humedad gravimétrica de 75.68% (Eslava, 1994). Asociados con el cultivo de chontaduro se encontraron arbustos de borojó (Borojoa patinoi Cuatrec.) y chirimoya (Annona cherimola Mill.). Sabaletas, por su parte, presenta un promedio de temperatura de 26.5 °C y una precipitación anual de 6500 mm. Esta localidad, al igual que la anterior, se encuentra a 7 m.s.n.m. en una zona de vega aluvial en la cuenca baja del río Anchicayá. Los suelos tienen pH de 5.21, son franco arcillo limosos (FArL), con densidad aparente de 0.89 g/cm3 y porcentaje de humedad gravimétrica de 63.97% (Eslava, 1994). Como cultivos asociados, además de chontaduro, se encontraron borojó y arrayán o guayaba agria (Psidium araca Raddi).
El manejo del cultivo de chontaduro fue diferente entre localidades. En Citronela se aplicó fertilizantes al suelo y fue fumigado con insumos de síntesis química. Las arvenses asociadas al cultivo se cortaron y dejaron sobre el suelo para su posterior descomposición. Por el contrario, en Sabaletas el cultivo fue manejado en forma tradicional sin aplicación de fertilizantes ni eliminación de arvenses, las cuales permanecieron asociadas al cultivo. Las series históricas de precipitación muestran un régimen bimodal para la región del Pacífico colombiano, con dos picos de menor precipitación en enero y julio y un número igual de picos con mayor precipitación en abril y octubre (Eslava, 1994). Con base en esta característica de clima en la zona, se realizaron dos muestreos u observaciones en épocas de picos altos de lluvias (noviembre 2006 y abril 2007) y uno en un pico bajo de lluvias (enero 2007).
En las dos finca de estudio y en las tres épocas de muestreo, se recolectaron al azar en recorridos en forma de zig-zag muestras compuestas de suelo rizosférico y raíces de aproximadamente 500 g cada una, constituidas por submuestras tomadas de la rizósfera de quince palmas productivas. La profundidad de muestreo se definió de acuerdo con el desarrollo del sistema radical de la planta, considerando la forma fasciculada de la raíz de chontaduro y sus raíces cuaternarias como las responsables de la toma de nutrientes (Trujillo, 1981).
Fase de laboratorio
Los aislamientos se obtuvieron siguiendo el protocolo estandarizado por Mosquera- Espinosa (2001). Para tal efecto se realizaron diluciones en serie base 10, tomando 10 g de las muestras de suelo rizosférico para suspenderlos en 90 ml de agua destilada estéril. Dicha suspensión se agitó en el 'vortex' por 10 minutos y a partir de ésta se realizaron diluciones seriadas hasta 10-6. Para la obtención de los hongos se sembraron individualmente 50 µl de todas las diluciones en cajas de Petri con medio de papa - dextrosa - agar acidulado (PDAA) con ácido láctico al 25% (pH 6.5). Para cada dilución se hicieron siembras en dos cajas de Petri consideradas como repeticiones, que se incubaron en las condiciones ambientales de Buenaventura por 48 h a 26 °C y humedad relativa de 85%. Las diluciones 10-2 y 10-3 se seleccionaron para cuantificar las unidades formadoras de colonias por gramo de suelo húmedo (ufc/g suelo húmedo).
Los valores de cuantificación de colonias para cada dilución fueron promediados y posteriormente transformados con logaritmo base 10, para expresar el nivel poblacional de los hongos en ufc/g suelo húmedo (Benson, 2001). Posteriormente, los hongos fueron purificados en PDAA e incubados nuevamente a temperatura y humedad ambiental.
La caracterización de los aislamientos fungosos se hizo con base en las características macroscópicas (descripción de colonias) y microscópicas (conidias, conidíoforos, hifas, clamidosporas) entre otras estructuras, para llegar a clasificarlos hasta género. De acuerdo con lo anterior, se realizaron microcultivos siguiendo la metodología de Benson (2001), para tener una mejor formación y visualización de las estructuras fungosas y realizar una correcta descripción. Los montajes fueron incubados a temperatura ambiente y las observaciones al microscopio de luz, así como la descripción macroscópica de las colonias, se realizaron 96 h después de la inoculación. La identificación se hizo utilizando claves taxonómicas de hongos (Agrios, 2005; Paulin-Mahady et ál., 2002; Benson, 2001; Barnett y Hunter, 1972).
Los hongos aislados se preservaron siguiendo las técnicas: (1) PDAA + crecimiento fungoso durante cinco días de desarrollo, en agua destilada estéril; (2) almacenamiento a 4 °C en cajas de Petri con medio PDAA + crecimiento fungoso durante cinco días de desarrollo (Smith y Onions, 1983); y (3) preservación a -20 °C en papel filtro de crecimiento fungoso (Aricapa y Correa, 1994).
Nivel poblacional de hongos presentes en la rizósfera
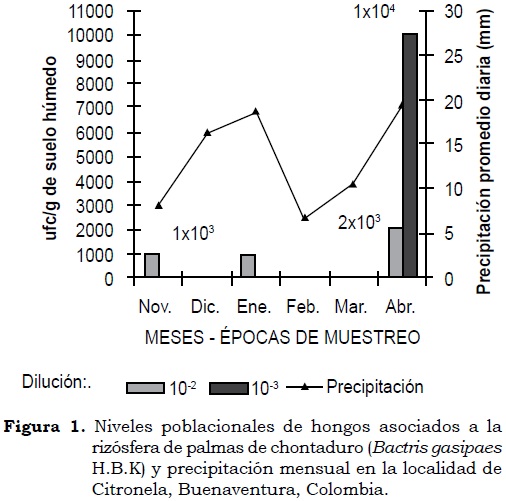
En la localidad de Citronela durante el primero y segundo muestreos (menor precipitación) la población de hongos registrada permaneció estable con valor de 1.0 x 103 ufc/g en suelo húmedo. Para el tercer muestreo (mayor precipitación) la expresión poblacional aumentó tanto en la dilución 10-2 como en 10-3, con valores de 2.0 x 103 y 1.0 x 104 ufc/g en suelo húmedo, respectivamente. Para este último muestreo, el incremento poblacional se confirmó con la presencia de colonias en la dilución 10-3 (Figura 1). Durante las épocas de muestreo los valores de precipitación pluvial, promedio diario, fueron: 8.23 mm, 18.79 mm y 19.39 mm, respectivamente.
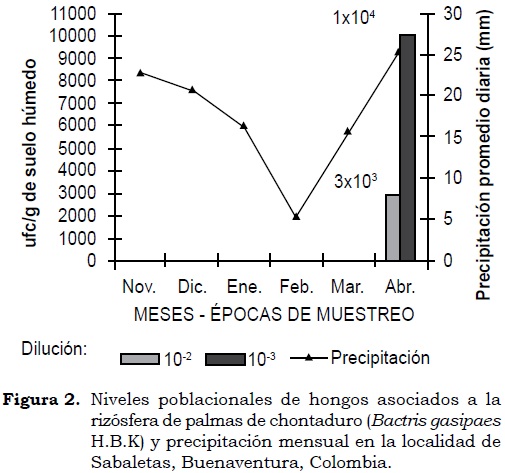
En Sabaletas, durante los dos primeros muestreos no se observó expresión poblacional de hongos en las diluciones evaluadas; pero en el tercero se registró población en ambas diluciones, con valores de 3.0 x 103 ufc/g en suelo húmedo en 10-2 y de 1.0 x 104 ufc/g en suelo húmedo en 10-3 (Figura 2). El promedio diario de precipitación en las tres épocas de muestreo para esta localidad fue de 22.73 mm, 16.43 mm y 26.6 mm, respectivamente.
Según Dix y Webster (1995) la composición de la micoflora de la rizósfera depende de factores como el ambiente físico, las características del suelo, las especies vegetales presentes en el ecosistema y las condiciones fisiológicas de las plantas. No obstante, en este estudio los resultados de expresión poblacional de los hongos se relacionaron principalmente con la precipitación pluvial por ser la variable ambiental prevalente en las zonas del estudio (Cuadro 1). De acuerdo con lo anterior, en la localidad Citronela durante los dos primeros muestreos los niveles poblacionales permanecieron por debajo de los valores (106 hongos/g de suelo rizosférico) considerados por estos mismos autores.
En Sabaletas en estos mismos periodos de muestreo no se registró población de hongos, coincidiendo con altos valores de precipitación. En este caso es probable que la humedad excesiva en el suelo favoreciera un ambiente anaeróbico adverso para el desarrollo de hongos (Smith et ál., 1993).
En ambas localidades los niveles de las poblaciones de hongos aumentaron durante el tercer muestreo, lo cual pudo estar relacionado con cambios favorables en los factores ambientales como temperatura, humedad y aireación del suelo, que ocurrieron en los meses anteriores a febrero, cuando los niveles de precipitación disminuyeron (Wieland et ál., 2001; Smith et ál., 1993). Este muestreo coincidió con la época de llenado de frutos en ambas localidades, condición fisiológica que posiblemente favorece la liberación de exudados de la raíz, lo que junto con la materia orgánica presente a nivel de rizósfera, estimula el desarrollo de poblaciones microbianas activas (Whipps, 2001; Manoharachary et ál., 2006) y consecuentemente induce el establecimiento efectivo de poblaciones de hongos.
Diversidad de géneros de hongos con potencial benéfico presentes en la rizósfera
Trichoderma fue el género de hongo que predominó en las rizósfera de plantas de chontaduro en este estudio, del cual fue posible obtener y preservar quince aislamientos. En la localidad de Citronela el hongo se presentó en tres aislamientos durante cada una de las tres épocas de muestreo; mientras que en Sabaleta sólo se observaron seis aislamientos durante el tercer muestreo, siendo ésta la única época en que se observó expresión poblacional de hongos en esta localidad. Durante el tercer muestreo, en la localidad de Citronela se observaron, además, Fusarium y Rhizopus, cada uno con un aislamiento; en Sabaletas se encontraron Penicillium y Thielaviopsis con 3 y 1 aislamiento, respectivamente (Figura 3 y Figura 4).
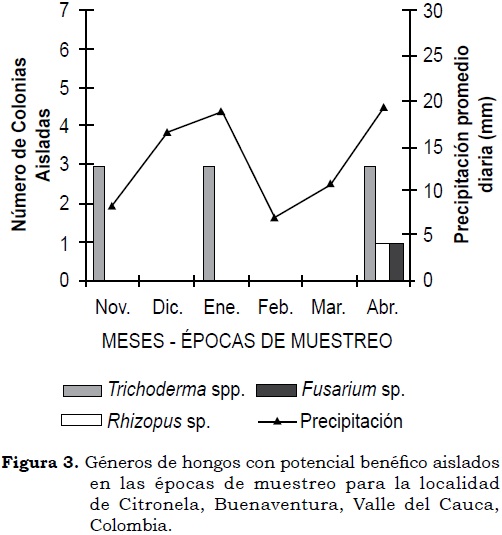
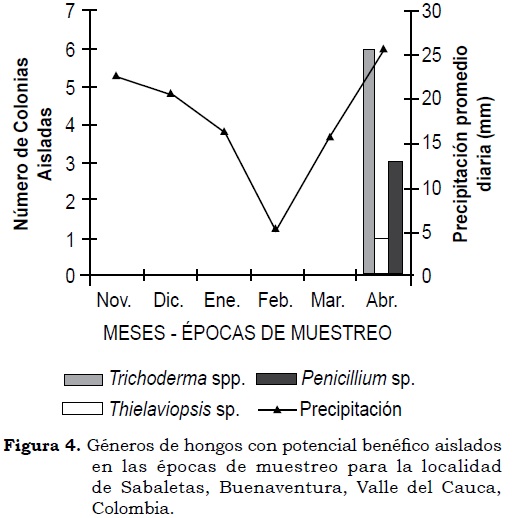
El predominio de Trichoderma en la rizósfera de chontaduro en la localidad de Citronela, aun bajo condiciones contrastantes de precipitación en los periodos de muestreo, sugiere la existencia de una relación sinergística hongo-hospedero. Lo anterior es producto de la interacción entre las raíces de la planta, sus exudados y el estímulo de las comunidades microbianas, lo cual favorece un ambiente dinámico a nivel de rizósfera (Barea et ál., 2005). Estos resultados sugieren que la rizósfera de algunas plantas está dominada por especies de hongos no-patógenos, tal como lo sugiere Alexander (1994), siendo Trichoderma uno de los géneros principales (Whipps, 2001; Manoharachary et ál., 2006).
Durante la época del tercer muestreo, cuando en ambas localidades se presentó la mayor diversidad de géneros de hongos, es posible que los cambios fisiológicos debidos al llenado de frutos hayan afectado en forma positiva la calidad y la cantidad de los exudados liberados a nivel de raíces (Souza-Mota et ál., 2003; Drigo et ál., 2009). Según Bardgett (2005) y Manoharachary et ál. (2006) estos compuestos tienen efecto selectivo sobre los microorganismos presentes en la zona de rizósfera, lo cual favorece el establecimiento y la actividad de los géneros de hongos encontrados. De la misma forma, esta condición puede estimular la presencia de otras poblaciones microbianas, principalmente hongos formadores de micorrizas arbusculares, los cuales se han encontrado asociados con palmas de chontaduro en estos sistemas de producción bajo los mismos agroecosistemas del estudio en la zona Pacífica de Colombia (Molineros- Hurtado, 2007).
Los géneros de hongos identificados en este estudio han sido encontrados asociados a la rizósfera de otras especies vegetales de interés agrícola, alimentario y ecológico (Souza-Mota et ál., 2003; Tariq et ál., 2008). Es posible que en los sistemas de producción de chontaduro estudiados, estos hongos desempeñan una actividad benéfica ya que no se observaron síntomas de enfermedades, por el contrario, su acción benéfica se traduce en el aporte al crecimiento, desarrollo y protección de las plantas ante problemas fitosanitarios (Orduz y Rangel, 2002; Barea et ál., 2005; Yedidia y Chet, 1999; Baker y Dickman, 1995).
Es posible que la población de Penicillium contribuya de una manera similar a la de Trichoderma, teniendo en cuenta su capacidad de producción de antibióticos útiles para el control de patógenos en el suelo (Baker y Dickman, 1995). Para el caso de Fusarium no todas las especies son patogénicas, ya que existen registros de su actividad antagónica o saprofita a nivel de rizósfera (Barnett y Hunter, 1972; Whipps, 2001). Igualmente se estima que Rhizopus (Agrios, 2005) y Thielaviopsis (Mora et ál., 1997) presentan actividades similares a esta última, sin descartar la posibilidad de una mayor participación en los procesos de ciclaje de nutrientes (Alexander, 1994) en el agroecosistema del cultivo de chontaduro.
Preservación de los hongos aislados
En su totalidad los microorganismos aislados fueron conservados por las tres técnicas mencionadas en la metodología, lo que permitió crear un cepario base (banco) para ser ampliado y utilizado en estudios posteriores de diversidad microbiana y bioprospección, con énfasis en componentes biológicos para integrarlos en propuestas de manejo fitosanitario de enfermedades y plagas asociadas con el cultivo de chontaduro en agroecosistemas del Pacífico colombiano.
- Los niveles poblacionales de los géneros de hongos identificados fueron variables según la intensidad de la precipitación en los sitios del estudio. Las condiciones anaerobias que ocurren por el exceso de humedad en la rizósfera, aparentemente afectaron las poblaciones de hongos benéficos por debajo de los niveles mencionados en la literatura.
- El llenado de fruto de las plantas de chontaduro coincidió con una mayor población de hongos con potencial benéfico en la rizósfera de las plantas de chontaduro.
- Aunque en ambas localidades de estudio las prácticas de manejo fueron contrastantes, el género Trichoderma fue el predominante. En Citronela fueron aislados los géneros Fusarium y Rhizopus, y en Sabaletas Penicillium y Thielaviopsis, los cuales presentan una actividad benéfica que coincidió con la buena sanidad observada en las palmas de chontaduro evaluadas.
Al Instituto Colombiano Agropecuario (ICA) – Palmira, laboratorio de diagnóstico vegetal por permitir el procesamiento de las muestras, así como la identificación y preservación de los hongos encontrados asociados a la rizósfera. A la Universidad del Pacífico, sede Buenaventura, por su aporte complementario al desarrollo del trabajo base para posteriores estudios en el área de protección vegetal.
Agrios, G. 2005. Fitopatología. México D.F. Limusa Noriega Editores. p. 332 - 335. [ Links ]
Alabouvette, C.; Backhouse, D.; Steinberg, C.; Donovan, N.; Edel, V.; y Burgess, L. 2004. Microbial diversity in Soil. Effects on crop health. En: Nosberger, J.; Geiger, H. y Struik, P. (eds.). Crop Science. Progress and Prospects. CABI Publishing, Reino Unido. p. 121 - 138. [ Links ]
Alexander, M. 1994. Introducción a la microbiología del suelo. Segunda edición, AGT Editor, S.A. 491 p. [ Links ]
Aricapa, M. y Correa, F. 1994. Almacenamiento de hongos en papel filtro. Ascolfi Informa 20(3):29 - 30. [ Links ]
Arroyo, C.; Arauz, L.; y Mora, J. 2004. Enfermedades en pejibaye (Bactris gasipaes H.B.K.) para palmito. Agron. Mesoamericana 15(1):61 - 68. [ Links ]
Baker, R. y Dickman, M. 1995. Biological control with fungi. En: Metting, B. (ed.). Soil microbial ecology. Applications in agricultural and environmental management. Nueva York, EE.UU. p. 275 - 305. [ Links ]
Bardgett, R. 2005. The biology of soil. A community and ecosystem approach. Nueva York, EE.UU. Oxford University. p. 86 - 118. [ Links ]
Barea, J.; Pozo, M.; Azcon, R.; y Azcon, C. 2005. Microbial co-operation in the rhizosphere. J. Exp. Bot. 56(417):1761 - 1778. [ Links ]
Barnett, H. y Hunter, B. 1972. Illustrated genera of imperfect fungi. EE. UU. Burgess Publ. Co. 241 p. [ Links ]
Benson, H. 2001. Microbiological applications. Laboratory manual in general microbiology. The McGraw - Hill Co. p. 93 - 98. [ Links ]
Buriticá, P. 1999. Patógenos y enfermedades de las plantas de importancia económica en Colombia. Universidad Nacional de Colombia. Instituto Colombiano Agropecuario (ICA). p. 59 - 60. [ Links ]
Cooke, R. 1979. Antagonism and biological control: concluding remarks. En: Soilborne plant pathogens. Schippers, B. y Gams, W. (eds.). Nueva York. Academic. p. 653 - 657. [ Links ]
De Cal, A.; Pascual, S.; y Melgarejo, P. 1997. Involvement of resistance induction by Penicillium oxalicum in the biocontrol of tomato wilt. Plant Pathol. 46:72 - 79. [ Links ]
Dix, N. y Webster, J. 1995. Fungal ecology. Londres. Published by Chapman y Hall. p. 172 - 202. [ Links ]
Drigo, B.; Van Veen, J.; y Kowalkchuh, G. 2009. Specific rhizosphere bacterial and fungal groups respond differently to elevated atmospheric CO2. Intern. Soc. Microb. Ecol. 3:1204 - 1217. [ Links ]
Escobar, J.; Zuluaga, J.; y Martinez, A. 1996. El cultivo del chontaduro (Bactris gasipaes H.B.K). Florencia, Caquetá. Corporación Colombiana de Investigación Agropecuaria (Corpoica) - Fondo Amazónico. 12 p. [ Links ]
Eslava, J. 1994. Climatología del Pacifico colombiano. Bogotá. Academia Colombiana de Ciencias Geofísicas. 79 p. [ Links ]
Harman, G. 2006. Overview of mechanisms and uses of Trichoderma spp. Phytopathology 96:190 - 194. [ Links ]
Luo, Y. y Zhou, X. 2006. Processes of CO2 production in soil. En: Soil respitation and the environment. Academic Press. p. 35 - 60. [ Links ]
Manoharachary, C.; Mukerji, K.; y Singh, J. 2006. Microbial activity in the rhizosphere - Soil biology. Germany. Springer . p. 1 - 15. [ Links ]
Molineros-Hurtado, F. H. 2007. Reconocimiento de hongos Micorrízicos Arbusculares (HMA) nativos en palmas de chontaduro Bactris gasipaes H.B.K. presentes en agroecosistemas localizados en los corregimientos de Citronella y Zabaleta, Buenaventura, Valle del Cauca. Buenaventura. Universidad del Pacifico, Agronomía del Trópico Húmedo. 79 p. [ Links ]
Mora, J.; Weber, J.; y Clement, C. 1997. Peach palm Bactris gasipaes H.B.K. Promoting the conservation and use of underutilized and neglected crops. Roma, Italia. Institute of Plant Genetics and Crop Plant Research/International Plant Genetic Resources Institute. p. 54 - 57. [ Links ]
Morgan, J.; Bending, G.; y White, P. 2005. Biological cost and benefits to plant - microbe interactions in the rhizosphere. J. Exp. Bot. 56(417)1729 - 1739. [ Links ]
Mosquera-Espinosa, A. T. 2001. Identificación de población microbiana asociada a la rizósfera de plantas recuperadoras de suelos erosionados en Puerto Rico. Tesis de Maestría. Universidad de Puerto Rico, Recinto Universitario de Mayagüez. 240 p. [ Links ]
Nicoletti, R.; Lopez-Gresa, M.; Manzo, E.; Carella, A.; y Ciavatta, M. 2007. Production and fungitoxic activity of Sch642305, a secondary metabolite of Penicillium canescens. Mycopathologia 163:295 - 301. [ Links ]
Olalde, V. y Aguilera, L. 1998. Microorganismos y biodiversidad. Irapuato, México. Terra 3(16):289 - 292. [ Links ]
Orduz, J y Rangel, J. 2002. Frutales tropicales potenciales para el piedemonte llanero. Corporación Colombiana de Investigación Agropecuaria (Coppoica) Regional 8, Programa Nacional de Transferencia de Tecnología Agropecuaria (Pronatta). 133 p. [ Links ]
Paulin-Mahady, A. E.; Harrington, T. C.; y McNew, D. 2002. Phylogenetic and taxonomic evaluation of Chalara, Chalaropsis, and Thielaviopsis anamorphs associated with Ceratocystis. Mycologia 94(1):62 - 72. [ Links ]
Pramauro, E. 1990. Los pesticidas en el medio ambiente. Valencia, España. Universidad de Valencia. p. 57 - 103. [ Links ]
Raper, A. y Thom, C. 1930. The penicillia-1930. Baltimore (ed.). The Williams and Wilkins Co. 643 p. [ Links ]
Smith, D. y Onions, A. 1983. The preservation and maintenance of living fungi. IMI Technical Handbooks No. 2. CAB International. 93 p. [ Links ]
Smith, J.; Papendick, R.; Bezdicek, D.; y Lynch, J. 1993. Soil organic matter dynamics and crop residue management. En: Metting, B. (ed.). Soil microbial ecology. Applications in agricultural and environmental management. Nueva York. p. 65 - 94. [ Links ]
Souza-Motta, C.; Cavalcanti, M.; Fernandes, M.; Lima, D.; Coimbra, J.; y Laranjeira, D. 2003. Identification and characterization of filamentous fungi isolated from the sunflower (Helianthus annus L.) rhizosphere according to their capacity to hydrolyse inulina. Brazilian J. Microbiol. 34:273 - 280. [ Links ]
Tariq, M.; Dawar, S.; y Mehdi, F. 2008. Studies on the rhizosphere mycoflora of mangroves. Turk J. Bot. 32:97 - 101. [ Links ]
Trujillo, F. 1981. Anatomía y morfología de la raíz del chontaduro Bactris gassipaes H.B.K. Tesis de grado. Universidad Nacional de Colombia, sede Palmira. Palmira, Valle. Colombia. 54 p. [ Links ]
Whipps, J. 2001. Microbial interactions and biocontrol in the rhizosphere. Plant Pathology Microbiology Department, Horticulture Research Intern. J. Exp. Bot. 52:487 - 511. [ Links ]
Wieland, G.; Neumann, R.; y Backhaus, H. 2001. Variation of microbial communities in soil, rhizosphere, and rhizoplano in response to crop species, soil type, and crop development. Appl. Environ. Microbiol. 67 (12):5849 - 5854. [ Links ]
Yedidia, I. y Chet, I. 1999. Indution of defense responses in cucumber plants (Cucumis sativus L.) by the biocontrol agent Trichoderma harzianum. Appl. Environ. Microbiol. 65 (3):1061 - 1070. [ Links ]













