Introducción
La contaminación por metales pesados, en especial por cadmio ha generado preocupación a nivel mundial por presentar un riesgo para el ambiente y para la salud humana. En los suelos agrícolas, el Cd puede alcanzar un nivel alto debido a la aplicación de fertilizantes, abonos y lodos de depuradoras, riego con aguas residuales industriales y deposición atmosféricas por actividades industriales y urbanas (Liu et al., 2007). Sin embargo, la acumulación de Cd en los suelos agrícolas se ha atribuido principalmente a la fertilización por períodos prolongados con fertilizantes fosfatados, mismos que pueden contener altas concentraciones de Cd, dependiendo del origen de la roca fosfática utilizada para su fabricación (Kuo et al., 2007; Ramírez et al., 2016).
Una vez que el Cd llega al suelo, presenta una alta movilidad y es absorbido por las plantas, donde se distribuye rápidamente a través del sistema vascular ocasionando efectos negativos (Sanità di Toppi y Gabbrielli, 1999; Zhang et al., 2009). A nivel de las semillas, uno de los principales síntomas que presentan ante condiciones ambientales adversas como la contaminación por metales es la inhibición de la germinación (Bautista et al., 2013).
Otros efectos del cadmio en las plantas son: la inhibición del crecimiento de las raíces, reducción de la biomasa, inhibición de la síntesis de clorofila e incluso la muerte de la planta; además, se ha descrito que el cadmio genera síntomas de toxicidad tales como atrofia y clorosis, los cuales son producto de la interacción directa o indirecta del Cd con el hierro, zinc, fósforo y manganeso (Sanità di Toppi y Gabbrielli, 1999; Pernía et al., 2008).
En este sentido, Li et al. (2017) mencionaron que en las plantas de arroz el cadmio es fitotóxico y puede afectar tanto el crecimiento del cultivo como la absorción de nutrientes a través de la interacción con la fotosíntesis, la respiración y la asimilación de nitrógeno en las plantas; además, afirman que el Cd podría alterar la eficiencia en la toma de nutrientes en el sistema suelo-arroz, y en última instancia reducir la producción de arroz.
El arroz (O. sativa L.) es uno de los cultivos más importantes en todo el mundo, y no deja de serlo para Ecuador, donde forma parte de la mayoría de los platos típicos del país. Ecuador es uno de los países productores de arroz más importantes de América Latina y donde el mejoramiento genético ha sido ampliamente promovido (Marin et al., 2018).
Esto ha conllevado a que, varias instituciones han desarrollado nuevas variedades de arroz tolerantes a plagas, con mayor rendimiento y calidad de grano; sin embargo, no se han realizado estudios de su tolerancia al cadmio.
Considerando: 1) que se ha descrito contaminación por cadmio en suelos agrícolas de Ecuador con concentraciones que van de 0.22-5.25 mg.kg-1 en cultivos de cacao (Chávez et al., 2015) y de 0.26-2.86 mg.kg-1 Cd en suelos de producción de arroz (Pozo et al., 2011); y 2) Según Zhang et al. (2009) la toxicidad del Cd para las plantas y el riesgo para la salud humana podría reducirse considerablemente plantando cultivares de arroz tolerantes a Cd en los campos contaminados con este metal.
El objetivo de la presente investigación fue evaluar los efectos del cadmio sobre la germinación y crecimiento inicial de cinco variedades de O. sativa L. que se cultivan en Ecuador.
Materiales y métodos
Material vegetal
Se obtuvieron semillas certificadas de cinco variedades de arroz que se cultivan en Ecuador por donación del Instituto Nacional de Investigaciones Agropecuarias (INIAP). Las variedades seleccionadas fueron: ‘INIAP-11’, ‘INIAP-14’, ‘INIAP-FL-Arenillas’, ‘INIAP-FL Cristalino’ y la variedad ‘SFL-011’ que fue donada por el Biólogo Nelson Villavicencio. Una vez obtenidas las semillas se trasladaron al Instituto de Investigaciones de Recursos Naturales de la Universidad de Guayaquil donde fueron seleccionadas 280 semillas de cada variedad, con pesos y longitudes similares para los bioensayos. Posteriormente, las semillas se esterilizaron con hipoclorito de sodio al 2.5 % por 30 minutos y se lavaron seis veces con agua destilada, según el protocolo de Vadillo et al. (2004).
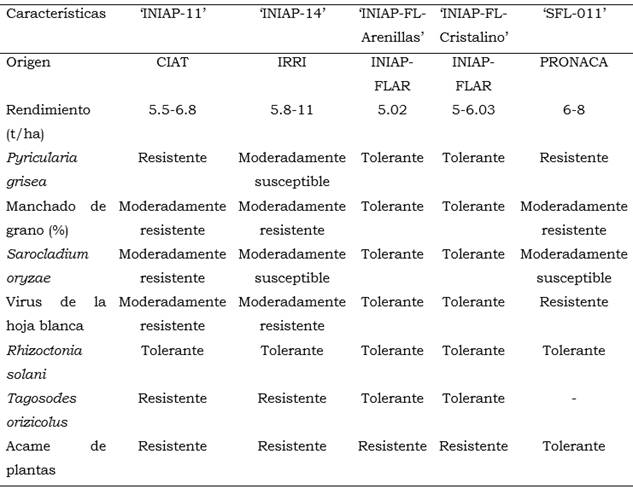
La Tabla 1 muestra las dimensiones del largo y ancho de las semillas para cada variedad. En la Tabla 2 se resumen las propiedades de cada variedad de arroz en cuanto a su origen, rendimiento, y tolerancia a diversas plagas en Ecuador.
Tabla 1 Medidas de las semillas del arroz y sus variedades.
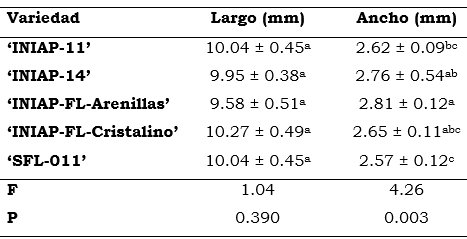
Letras iguales indican que no existen diferencias significativas según ANOVA de una vía y test a posteriori de Tukey (P > 0.05)
Bioensayo
Una vez esterilizadas, las semillas fueron embebidas por 24 horas en distintas soluciones de cadmio. Se prepararon soluciones de CdNO3 (Accustandard) a las siguientes concentraciones: 0.25, 0.50, 1, 2, 4 y 8 mg.L-1 Cd y se utilizó agua destilada como testigo. Se realizó un diseño experimental completamente aleatorizado con cuatro repeticiones para cada concentración y 40 semillas por tratamiento. Una vez embebidas las semillas por cuadriplicado se colocaron 10 semillas en envases de plástico de 10 cm de diámetro y 10 cm de altura con tapa a la que se le realizaron 10 perforaciones para permitir el intercambio gaseoso. A los envases se les colocó dos capas de papel filtro Whatman n.o1, al cual se le añadió 5 mL de la concentración respectiva de CdNO3.
Los envases con las semillas se colocaron en una cámara de germinación a 24 ± 1°C, humedad (60-80 %), 2000 lux y un fotoperíodo de 12 horas por ocho días.
La longitud de las radículas e hipocótilos fue medida con un vernier calibrado (VWR) a interdiario durante ocho días. Simultáneamente se llevó un control de la humedad y de la temperatura con un termo-higrómetro (ELC) y la luminosidad con un luxómetro (Kyoritsu).
Variables de germinación
El porcentaje de germinación, el tiempo medio de germinación (TMG), la velocidad media de germinación (VMG), el índice de tolerancia (IT) y el índice integral de fitotoxicidad se calcularon utilizando las fórmulas que se muestran en la Tabla 3.
Tabla 3 Fórmulas utilizadas en el cálculo de las variables de estudio.
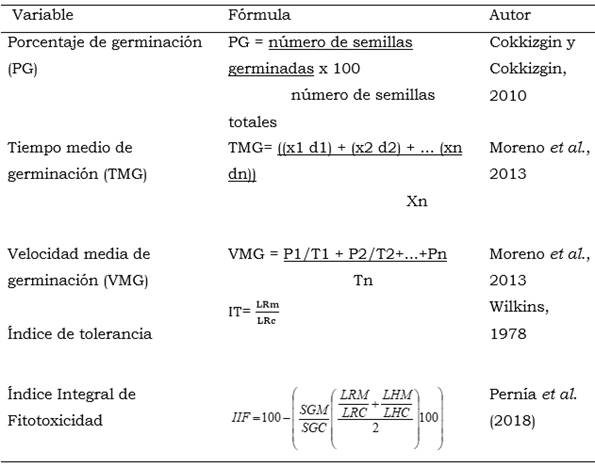
x1, x2, xn = semillas germinadas día 1, 2,…n; d1, d2,... dn = días incubación, Xi = semillas germinadas por día de revisión y Xn = número total de semillas germinadas el último día de control, P = número de semillas germinadas, T = tiempo germinación; Tn = último día del ensayo. LRm = es la longitud radical de las plántulas que crecieron en presencia del Cd. LRc = es la longitud radical de las plántulas en ausencia del Cd. SGM = número de semillas germinadas de la muestra, es el promedio del número de semillas germinadas en las cuatro réplicas para cada tratamiento (n = 4). SGC = número de semillas germinadas del control, es el promedio del número de semillas germinadas en las cuatro réplicas del testigo (n = 4). LRM = Longitud de la radícula de la muestra, es el promedio de la medición en centímetros de las radículas de 10 plántulas por réplica de cada tratamiento (n = 40). LRC = Longitud de la radícula del control, es el promedio de la medición en centímetros de las radículas de 10 plántulas por réplica del testigo (n = 40). LHM = Longitud del hipocótílo de la muestra, es el promedio de la medición en centímetros de los hipocótilos de 10 plántulas por réplica de cada tratamiento (n = 40). LHC = Longitud del hipocótílo del control, es el promedio de la medición en centímetros de los hipocótilos de 10 plántulas por réplica del testigo (n = 40).
Concentración inhibitoria media (CI50)
Las concentraciones inhibitorias medias (CI50) para los bioensayos se calcularon utilizando el Programa Probit de la Agencia de Protección Ambiental de los Estados Unidos (USEPA), empleando el método de interpolación lineal, calculando la concentración de inhibición media de la longitud de la radícula (Environmental Protection Agency [EPA], 1993).
Análisis estadístico
Los resultados se muestran como medias ± desviación estándar. Se analizó la normalidad de los datos utilizando la prueba de Anderson-Darling y la igualdad de varianza con el test de Levene. Para determinar si existían diferencias significativas en el porcentaje de germinación, mortalidad, TMG, VG, longitud de las radículas e hipocótilos de las plántulas expuestas a las diferentes concentraciones de Cd se aplicó una prueba no paramétrica de Kruskall-Wallis (P < 0.05). A fin de comparar las diferencias entre los tratamientos individuales y el control se utilizó una prueba de U de Mann Whitney. Para comparar el largo y ancho de las semillas, la longitud de las radículas e hipocótilos y el IIF de las plántulas expuestas a las diferentes concentraciones de Cd se aplicó una prueba de ANOVA de una vía y test a posteriori de Dunnet o Tukey (P ≤ 0.05). Para identificar correlación entre la concentración de Cd y la longitud de las radículas e hipocótilos de las variedades de arroz, se aplicó una prueba de correlación de Spearman. Todos los análisis se realizaron con el programa MINITAB versión 19.
Resultados
Efectos del cadmio sobre la germinación de las variedades de arroz
El cadmio no afectó significativamente la germinación, el tiempo medio de germinación (TMG) ni la velocidad media de germinación (VMG) de las variedades de arroz estudiadas. La Tabla 3 muestra altos porcentajes de germinación que variaron de 90.00 %-100.00 %. Se observó una tendencia a disminuir el porcentaje de germinación a 8 mg.L-1 de Cd, sin diferencias estadísticas significativas. De igual forma, el tiempo medio de germinación varió de 4.05 a 4.50 días sin observarse diferencias significativas entre tratamientos ni entre variedades y por ende, tampoco varió la velocidad media de germinación, que estuvo en el rango de 0.60-0.67 semillas.día-1. El Cd no afectó el porcentaje de mortalidad siendo este muy bajo de 0-2.5 % (Tabla 4).
Tabla 4 Variedades de arroz expuestas a diferentes concentraciones de Cd.
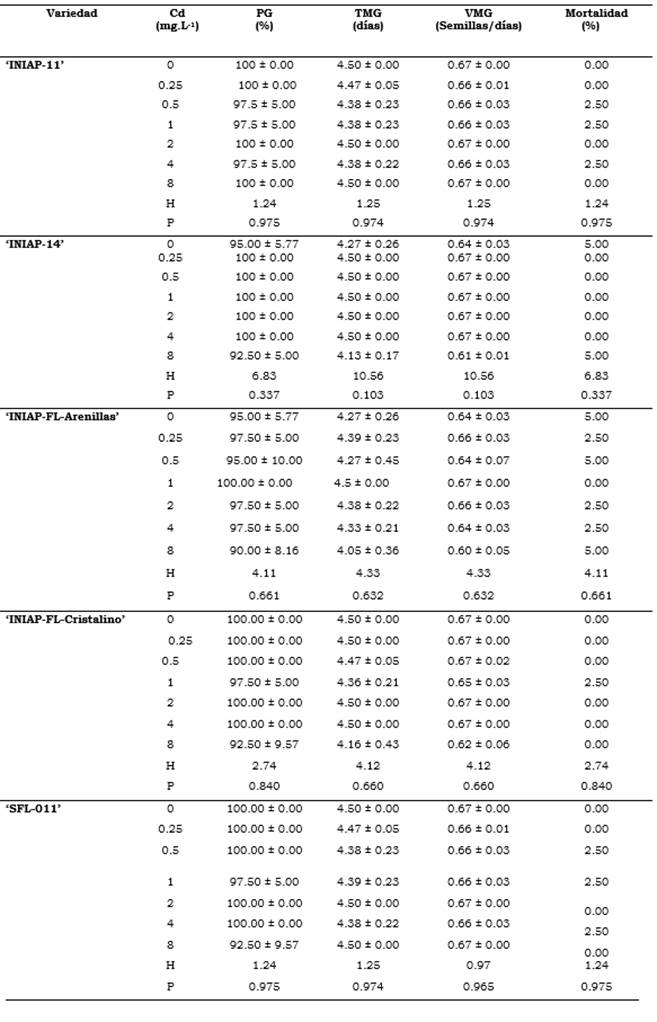
PG: porcentaje de germinación; TMG: tiempo medio de germinación; VMG: velocidad media de germinación y porcentaje de mortalidad de las variedades de arroz expuestas a diferentes concentraciones de Cd (0, 0.25, 0.5, 1, 2, 4 y 8 mg.L-1 Cd) durante ocho días (media ± desviación estándar).
Efectos del cadmio sobre el crecimiento inicial de las radículas e hipocótilos de las variedades de arroz
Con respecto al crecimiento inicial de las plántulas el parámetro más afectado fue la longitud de las radículas donde se observó una fuerte correlación inversamente proporcional entre la concentración de Cd y la longitud de las radículas en las variedades ‘INIAP-11’ (rs= -0.924; P = 0.000), ‘INIAP-14’ (rs= -0.945; P = 0.000), ‘INIAP FL-Arenillas’ (rs= -0.845; P =0.000) e ‘INIAP FL-Cristalino’ (rs= -0.884; P = 0.000). La única variedad donde se apreció una baja correlación entre el crecimiento y la concentración de Cd fue en ‘SFL-011’ que demostró ser la variedad más tolerante a este metal (rs= -0.362; P =0.000) (Figura 1).
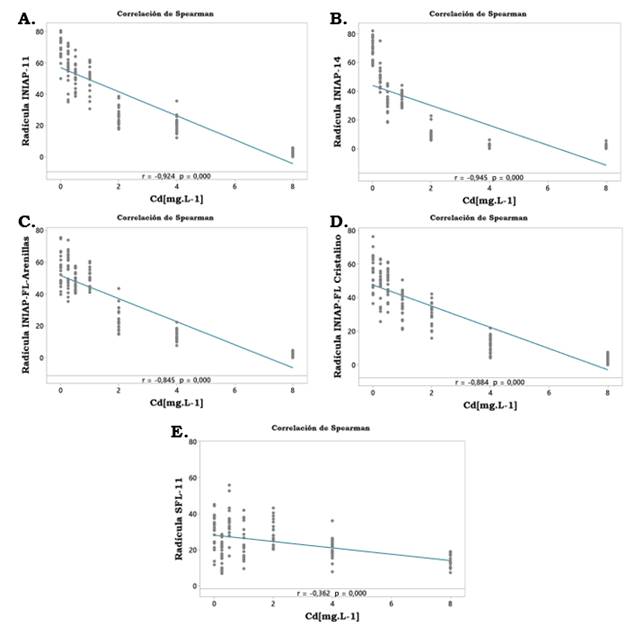
Figura 1 Correlación de Spearman según las radículas y el Cd. Concentración de Cd: 0, 0.25, 0.50, 1, 2, 4 y 8 mg.L-1; longitud de las radículas en cm. A) I‘NIAP-11’; B) ‘INIAP-14’; C) ‘INIAP-FL-Arenillas’; D) ‘INIAP-FL-Cristalino’ y E) ‘SFL-011’.
En la Figura 2A se observa la reducción en la longitud de las radículas a partir de 0.25 mg.L-1 Cd en la variedad ‘INIAP-11’ y una reducción proporcional a la concentración de Cd, hasta inhibirse en un 96 % a 8 mg.L-1 Cd donde la longitud de las radículas disminuyó de 69.58 ± 7.22 mm en el control a 2.47 ± 1.77 mm (H, P = 0.000). De igual manera, la variedad ‘INIAP-14’ presentó una inhibición en el crecimiento inicial de las radículas proporcional a la concentración de Cd de 69.43 ± 7.56 mm en el control a 1.38 ± 1.00 mm a 8 mg.L-1 (H, P = 0.000) (Figura 2B). A diferencia de las otras variedades ‘INIAP-FL-Arenillas’ se vio afectada a partir de los 0.5 mg.L-1 Cd con una máxima reducción a los 8 mg.L-1 Cd de 55.32 ± 10.30 mm en el testigo a 1.65 ± 1.66 mm (P = 0.000) (Figura 2C).
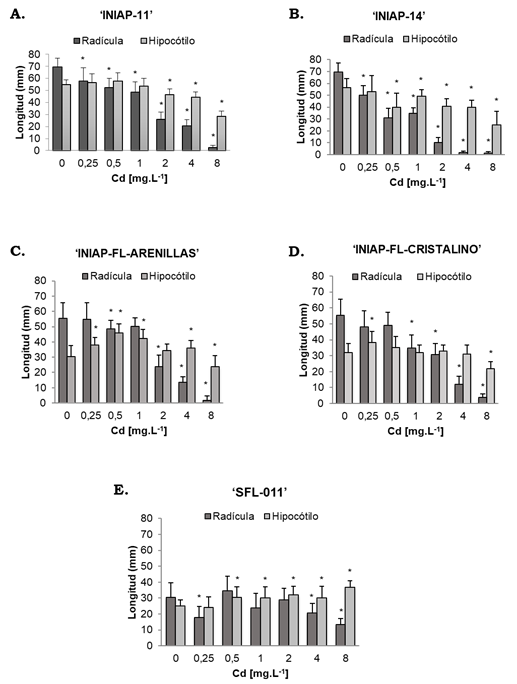
Figura 2 Longitud de las radículas e hipocótilos de las variedades de arroz. Las variedades fueron expuestas a 0, 0.25, 0.50, 1, 2, 4 y 8 mg.L-1 de Cd a los 8 días. A) I‘NIAP-11’; B) ‘INIAP-14’; C) ‘INIAP-FL-Arenillas’; D) ‘INIAP-FL-Cristalino’ y E) ‘SFL-011’. *Indica que existen diferencias estadísticamente significativas con respecto al control 0 mg.L-1 Cd (P < 0.05). Las barras en las columnas indican ± desviación estándar.
Por otro lado, la variedad ‘INIAP-FL-Cristalino’ presentó una disminución de la longitud de las radículas a partir de 1 mg.L-1 Cd (Figura 2D). A la mayor concentración del metal pesado la longitud de la radícula fue de 3.81 ± 2.2 mm, significativamente menor a su control 55.36 ± 10.22 mm (P = 0.000).
La variedad de arroz menos afectada por el Cd fue ‘SFL-11’ donde se observó la menor inhibición en el crecimiento inicial de las radículas a 0.25, 4 y 8 mg.L-1 Cd (Figura 2E). Al igual que las otras variedades de INIAP se presentó la máxima inhibición a 8 mg.L-1 Cd con una reducción de la longitud de 30.33 ± 9.33 mm en el control a 13.51 ± 6.68 mm (H, P = 0.000).
En general el porcentaje de inhibición del crecimiento de las radículas a 8 mg.L-1 se dio en el orden ‘INIAP-14’ (98 %) > ‘INIAP-FL-Arenillas’ (97 %) > ‘INIAP-11’ (96 %) > ‘INIAP-FL-Cristalino’ (93 %) > ‘SFL-011’ (55 %). A 4 mg.L-1 de Cd reportado en suelos agrícolas en Ecuador la inhibición se dio en el orden ‘INIAP-14’ (97 %) > ‘INIAP-FL-Cristalino’ (78 %) > ‘INIAP-FL-Arenillas’ (75 %) > ‘INIAP-11’ (70 %) > ‘SFL-011’ (32 %).
Contrario a lo observado en las radículas, los hipocótilos no se vieron tan afectados por la toxicidad del Cd e incluso se observó estímulo de crecimiento a bajas concentraciones del metal pesado en algunas variedades. La reducción en el crecimiento inicial se apreció a partir de las concentraciones de Cd: 1 mg.L-1 en ‘INIAP-14’, 2 mg.L-1 en ‘INIAP-11’, 8 mg.L-1 en ‘INIAP-FL-Arenillas’ e ‘INIAP-FL-Cristalino’ y en ‘SFL-011’ no se observó inhibición del crecimiento de los hipocótilos. Comparativamente, a la mayor concentración de Cd la inhibición se dio en el orden: ‘INIAP-14’ (56 %)>‘INIAP-11’ (48 %) > ‘INIAP-FL-Cristalino’ (32 %) > ‘INIAP-FL-Arenillas’ (22 %) y en ‘SFL-11’ no hubo reducción de los hipocótilos sino un incremento del 47 %, apreciándose una longitud de 36.92 ± 3.97 mm mayor al control 25.00 ± 3.72 mm (P = 0.000).
Por otro lado, el estímulo en el crecimiento inicial de los hipocótilos se apreció en las variedades ‘INIAP-FL-Arenillas’, ‘INIAP-FL-Cristalino’ y en ‘SFL-011’. En la variedad ‘INIAP-FL-Arenillas’ se observó un aumento significativo en la longitud de los hipocótilos a las concentraciones de Cd: 0.25 mg.L-1 (37.82 mm), 0.5 mg.L-1 (46.00 mm) y a 1 mg.L-1 (42.30 mm) en comparación al control (30.33 mm) (F = 30.72, P = 0.000). De igual manera, ‘INIAP-FL-Cristalino’ incrementó la longitud de sus hipocótilos en presencia de 0.25 mg.L-1 Cd aumentando de 32.04 ± 5.61 mm en el control a 38.15 ± 7.13 mm (F, P = 0.000) y ‘SFL-011’ presentó estímulo de crecimiento a partir de los 0.5 mg.L-1 de Cd hasta los 8 mg.L-1 con un incremento del 20 % al 47 %, respectivamente.
Tolerancia de las variedades de arroz al cadmio
En general la tolerancia al cadmio representada por el índice de tolerancia de los hipocótilos (ITH) se presentó en el orden ‘SFL-011’ > ‘INIAP-FL-Arenilla’ > ‘INIAP-FL-Cristalino’ > ‘INIAP-11’ > ‘INIAP-14’. El ITH mostró un estímulo de crecimiento inicial reflejado en valores mayores a uno en la variedad ‘SFL-011’ a las concentraciones de Cd: 0.5(1.13), 1(1.2), 2(1.28), 4(1.21) y 8(1.47) mg.L-1, lo que refleja una alta tolerancia al Cd en esta variedad. De igual manera, la variedad ‘INIAP-FL-Arenillas’ mostró una alta tolerancia en los hipocótilos de 0.25-4 mg.L-1 de Cd y se redujo a 8 mg.L-1 (0.77) y la variedad menos tolerante fue ‘INIAP-14’ cuyos valores se redujeron al incrementar la concentración de Cd desde 0.93 a 0.25 mg.L-1 Cd hasta 0.43 a 8 mg.L-1 de Cd.
Se evidenció que los hipocótilos son más tolerantes al cadmio que las radículas donde se apreció una reducción significativa del índice de tolerancia proporcional a la concentración de Cd (Figura 3A y 3B). ‘SFL-011’ disminuyó su tolerancia a 0.
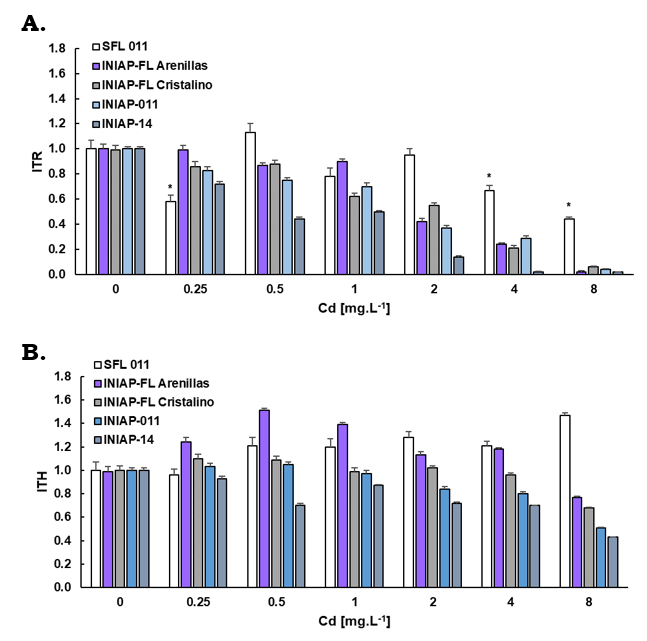
Figura 3 Índice de tolerancia de las variedades de arroz. Las varieadades fueron expuestas a 0, 0.25, 0.50, 1, 2, 4 y 8 mg.L-1 de Cd durante ocho días (media ± error estándar). A) Índice de tolerancia de las radículas (ITR) y B) Índice de tolerancia de los hipocótilos (ITH).
Con respecto al índice integral de fitotoxicidad las variedades más tolerantes fueron ‘SFL-011’ e ‘INIAP-FL-Arenillas’ (Figura 4). La variedad ‘SFL-11’ mostró un estímulo de crecimiento inicial reflejado por su valor negativo a las concentraciones 0.5(-17.44), 2(-14.38) y 8(-3.33) mg.L-1 lo que refleja la tolerancia de esta variedad al Cd. De igual manera, ‘INIAP-FL-Arenilla’ presentó un estímulo de crecimiento a 0.25(-15.41), 0.5(-19.69) y 1(-21.2) mg.L-1 de Cd.
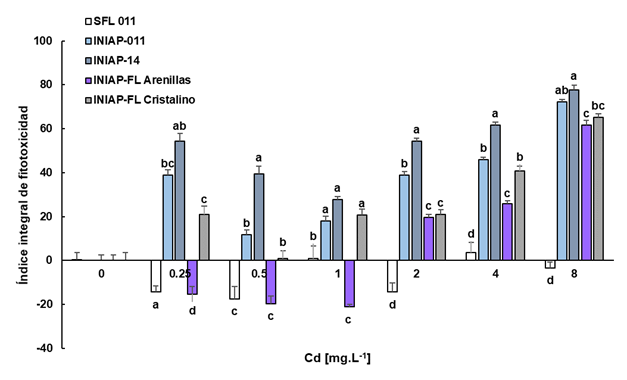
Figura 4 Índice integral de fitotoxicidad de las variedades de arroz. Las variedades fueron expuestas a 0, 0.25, 0.50, 1, 2, 4 y 8 mg.L-1 de Cd durante ocho días. Las letras iguales indican que no existen diferencias significativas según ANOVA de una vía y test a posteriori de Tukey entre los índices con respecto a otras variedades para una misma concentración de Cd (P > 0.05).
Como se observa en la Figura 3, a la mayor concentración de Cd (8 mg.L-1) el orden de toxicidad fue el siguiente: ‘INIAP-14’ (77.52) = ‘INIAP-11’ (72.31) > ‘INIAP-FL- Cristalino’ (65.14) > ‘INIAP-FL-Arenillas’ (61.67) > ‘SFL-11’ (-3.33) con diferencias significativas entre las variedades (F, P = 0.000).
La variedad menos tolerante fue ‘INIAP-14’ donde se observó un alto índice de fitotoxicidad desde la concentración más baja de cadmio con promedios de 54.36-77.52 y la variedad más tolerante fue la ‘SFL-011’ donde el índice más alto fue de 3.54 a 4 mg.L-1 de Cd y presentó estímulo de crecimiento incluso a 8 mg.L-1 del metal pesado.
Finalmente, se calculó la concentración inhibitoria media, utilizando como referencia la longitud de la radícula por ser las más afectada por el Cd. Las variedades con mayores CI50 fueron ‘INIAP-11’ (4.56 mg.L-1Cd) y ‘SFL-011’ (4.02 mg.L-1 Cd), seguidas por ‘INIAP FL Cristalino’ (2.93 mg.L-1Cd), ‘INIAP FL Arenillas’ (1.94 mg.L-1 Cd) y la variedad menos tolerante fue ‘INIAP-14’ con 0.72 mg.L-1.
Discusión
En la presente investigación el cadmio no afectó el porcentaje, el tiempo medio, ni la velocidad media de germinación de las semillas de O. sativa expuestas al metal por ocho días, lo que demuestra tolerancia al cadmio en las diferentes variedades de arroz del Ecuador. Es probable que las semillas de arroz sean más resistentes al cadmio, debido a que están cubiertas además de su testa por un pericarpio duro que podría ejercer la función de filtro e impedir el ingreso del metal pesado hasta el embrión. Al igual que en la presente investigación He et al. (2008) analizaron el efecto del cadmio sobre la germinación de dos variedades de arroz en China (‘Xiushui 110’ y ‘Xiushui 111’) y solo se inhibió la germinación a altas concentraciones de Cd (200 µM), superiores a las concentraciones utilizadas en este trabajo.
Aunque la germinación puede ser utilizada como un indicador de fitotoxicidad de metales (Escalante-Campos et al., 2012), en el caso del arroz este no es un buen indicador de toxicidad. Por el contrario, en las variedades ‘INIAP-14’ e ‘INIAP-Arenillas’ se observó una tendencia a incrementar el porcentaje de germinación en comparación con el control a 0.25 mg.L-1 de Cd, aumentando de 95 % en el control a 100 % y 97 %, respectivamente. En este sentido, se ha descrito que el estímulo en germinación puede deberse a un exceso en la producción de especies reactivas de oxígeno y especies reactivas de nitrógeno a bajas concentraciones de cadmio, lo cual estimula la germinación (Escalante-Campos et al., 2012).
A diferencia de la germinación, el crecimiento inicial se vio afectado por el Cd. Con respecto a la longitud de las radículas, estas se afectaron a altas concentraciones de Cd en todas las variedades y en cuatro de cinco variedades presentaron una correlación inversamente proporcional entre la concentración de cadmio y la longitud de las radículas. De igual manera, el índice de tolerancia en cuatro de las cinco variedades disminuyó al aumentar las concentraciones del metal. Según Rodríguez-Serrano et al. (2008), la raíz actúa como una barrera de defensa de la planta en presencia del cadmio a través de la inmovilización de este metal por las pectinas de la pared celular, es decir, la radícula o raíz embrionaria de la planta, posee la capacidad de atrapar el cadmio tratando de evitar su distribución al resto de la planta, por esta razón la radícula se ve mayormente afectada por este contaminante.
Esta inhibición del crecimiento de las radículas se debe a la modificación de la homeostasis de auxina en plantas de arroz por parte del Cd, afectando su expresión genética lo que resulta en una diferenciación celular alterada y la inhibición del crecimiento de las raíces (Ronzan et al., 2018). También inhibe la formación de raíces laterales y provoca alteraciones en la raíz principal, haciendo que esta pueda enrollarse, volverse rígida y tomar una coloración marrón, generando reducción del crecimiento e incluso la muerte de la planta (Espanany et al., 2015). En la presente investigación a altas concentraciones se observaron raíces con los ápices marrones y algunas enrolladas. De igual forma, se observó un fototropismo positivo en algunas raíces, creciendo hacia arriba aprovechando el agua condensada en el ambiente como respuesta a la toxicidad generada por el Cd.
Estudios similares demuestran la afectación producida por el cadmio en la longitud de la radícula de semillas de rábano y zanahoria, chocho (Lupinus mutabilis), arveja, lechuga, acelga, espinaca, lenteja y frijol (Bautista et al., 2013; Gouia et al., 2003; Prieto et al., 2009).
Con respecto a los hipocótilos las variedades ‘INIAP-11’ e ‘INIAP-14’ presentaron inhibición del crecimiento inicial incluso a bajas concentraciones de Cd. Por el contrario, ‘SFL-011’ e ‘INIAP-FL-Arenillas’, presentaron alta tolerancia las plántulas expuestas a 0.25, 0.5 y 1 mg.L-1 de Cd donde se apreció un estímulo de crecimiento. En este sentido, ciertas plantas poseen la capacidad de tolerar el cadmio a bajas concentraciones sin mostrar ningún síntoma de toxicidad (Chávez et al., 2015). Este podría ser el caso de las variedades ‘SFL-011’ e ‘INIAP-FL-Arenillas’ que expuestas a bajas concentraciones de Cd no mostraron diferencias en su germinación y crecimiento inicial, incluso, se observó estímulo de crecimiento. Pramanik et al. (2018) encontró un comportamiento similar, y mencionaron que la absorción de bajas concentraciones de cadmio es tolerada por las plantas de arroz y estimula el crecimiento de las plántulas; este comportamiento de estas variedades frente al cadmio puede describirse como fenómeno de hormesis, lo cual se puede interpretar como un estímulo de crecimiento en las plántulas expuestas a bajas concentraciones del metal y una inhibición para aquellas plántulas expuestas a mayores concentraciones.
Por otro lado, los mayores índices de tolerancia lo presentaron las variedades ‘SFL-011’ e ‘INIAP-Arenillas’. De igual manera, el índice integral de fitotoxicidad demostró menor o nula toxicidad en estas variedades. En especial se destacó la tolerancia al cadmio de la variedad ‘SFL-011’ al no afectar su germinación, generar estímulo de crecimiento en los hipocótilos que se reflejó como un índice de fitotoxicidad negativo y un alto IC50 de 4.02 mg.L-1 Cd. Además, esta variedad presenta tolerancia a patógenos tales como Pyricularia grisea Cooke ex Sacc. 1880 (Pezizomycotina, Ascomycota, Fungi), Rhizoctonia solani Kühn 1858 (Agaricomycotina, Basidiomycota, Fungi) y al acame de plantas. De igual manera, la variedad ‘INIAP-Arenillas’ además de ser tolerante al cadmio tiene la ventaja de tolerar un mayor número de patógenos: virus de la hoja blanca, Sarocladium oryzae, Rhizoctonia solani, Pyricularia grisea y al manchado del grano lo que permite recomendar el cultivo de estas variedades en Ecuador.
De los resultados se concluye que las variedades ‘SFL-011’ e ‘INIAP-FL-Arenillas’ son las variedades más tolerantes al Cd y las variedades ‘INIAP-11’ e ‘INIAP-14’ son las más sensibles y por ende no se recomienda su cultivo en suelos contaminados con este metal pesado. Además, en la Tabla 2 se muestran algunas características de las variedades de arroz donde se observa que ‘SFL-011’ e ‘INIAP-FL-Arenillas’, además de ser tolerantes al cadmio son tolerantes al virus de la hoja blanca (RHBV), pudrición de la vaina (Sarocladium oryzae), tizón del tallo (Rhizoctonia solani), quemazón (Pyricularia grisea) y al manchado del grano (complejo hongo-bacteria), de allí que estas variedades son óptimas para su cultivo en suelos agrícolas de Ecuador.
Por el contrario, los menores índices las de tolerancia los presentaron las variedades ‘INIAP-11’ e ‘INIAP14’, hecho que se confirmó con un alto índice integral de fitotoxicidad. Esta diferencia entre las tolerancias de las variedades podría deberse a variaciones en sus mecanismos de detoxificación de Cd. Wang et al. (2013) señalaron que diferentes cultivares de arroz adoptan variadas estrategias bioquímicas para hacer frente al estrés de Cd tales como el aumento en la concentración de fitosideróforos, incremento de la actividad de las enzimas antioxidantes y la síntesis de fitoquelatinas.
Si bien es cierto que las concentraciones de Cd evaluadas en el presente trabajo son las reportadas en suelos agrícolas de Ecuador y afectaron el crecimiento de las radículas de variedades de arroz, el cadmio se encontraba totalmente biodisponible al encontrarse en agua, por el contrario, el suelo tiene una capacidad amortiguadora que reduce en gran medida la disponibilidad de este elemento, de allí que estos resultados corresponderían a concentraciones biodisponibles del metal pesado en el suelo. La siguiente parte del presente trabajo será analizar los niveles de Cd que acumulan las variedades más tolerantes de arroz a fin de precautelar la inocuidad alimentaria de los ecuatorianos.
Además, se debe tener en cuenta la acumulación de Cd en la biomasa vegetal, que luego de ser cosechada se incorpora al suelo nuevamente y, en el caso de suelos contaminados se recomienda que se extraigan las plantas como una medida de fitorremediación para que el metal pesado no se recicle. También es importante realizar una investigación donde se midan los niveles de metales pesados en los granos de arroz comercializados a nivel nacional.
Para finalizar, a nivel mundial las variedades de arroz se mantienen en una constante renovación donde se busca generar híbridos con mejores rendimientos, mayor resistencia a plagas y enfermedades, mejor calidad del grano y una mayor producción (Franquet et al., 2004; Pérez et al., 2019). Sin embargo, se recomienda que además de las características mencionadas se considere la capacidad de tolerar y acumular metales pesados, para así asegurar la seguridad y la inocuidad alimentaria.
Conclusiones
El porcentaje de germinación no es un buen indicador de contaminación por cadmio en las variedades de arroz. El mejor indicador fue la longitud de las radículas que disminuyó al incrementar la concentración de Cd y hubo correlación entre ambas variables.
Las variedades más tolerantes al metal pesado fueron ‘SFL-011’ e ‘INIAP-Arenillas’ y las menos tolerantes ‘INIAP-11’ e ‘INIAP-14’.