Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.38 no.2 Bogotá Apr./June 2010
Artículos de Reflexión
Anestesia total intravenosa: de la farmacéutica a la farmacocinética*
Luis Alberto Tafur**, Eduardo Lema***
* Conferencia presentada en el XXVIII Congreso Colombiano de Anestesiología y Reanimación “Camino a la excelencia”, Bogotá, D.C., 2009.
** Médico anestesiólogo, Hospital Universitario del Valle, Universidad del Valle; Clínica Visual y Auditiva, Instituto para Niños Ciegos y Sordos del Valle del Cauca, Cali, Colombia: tafur05@hotmail.com
*** Médico anestesiólogo, Hospital Universitario del Valle, Universidad del Valle; Clínica Visual y Auditiva, Instituto para Niños Ciegos y Sordos del Valle del Cauca; docente, Departamento de Anestesiología, Universidad del Valle, Cali, Colombia.
Recibido: noviembre 4 de 2009. Enviado para modificaciones: enero 26 de 2010. Aceptado: marzo 15 de 2010.
RESUMEN
Introducción. En la actualidad, la disponibilidad de medicamentos como el remifentanilo y el propofol, ha creado la necesidad en los anestesiólogos de tener conceptos básicos sobre la anestesia total intravenosa. Más allá de conocer cómo se construye un modelo farmacocinético, es fundamental entender la diferencia entre administrar un medicamento de forma farmacéutica, farmacocinética o farmacodinámica.
Objetivo. Reflexionar sobre los conceptos básicos que le permitan al anestesiólogo moderno la administración de los medicamentos utilizados en la anestesia intravenosa de una forma farmacocinética.
Metodología. Se realizó una búsqueda en la literatura indexada para obtener artículos didácticos e ilustrativos en los conceptos de anestesia total intravenosa y farmacocinética. Se seleccionaron aquellos que se consideraron más relevantes y se complementaron con textos guía en anestesia en lo concerniente a farmacocinética y anestesia total intravenosa.
Resultados. Se obtuvieron 51 artículos y 5 capítulos de texto guía en anestesia. Independientemente de cuál de estos instrumentos utilicemos o qué tan exactos sean, lo realmente importante es saber que contamos con herramientas que nos permiten adecuar, con base en la estimación de los niveles plasmáticos, la anestesia en los diferentes momentos de la cirugía y, en el caso del remifentanilo, a condiciones particulares como la edad.
Se trata de la evolución del anestesiólogo a la par con la de los fármacos cada vez más predecibles con los que contamos en la actualidad y de la posibilidad de obtener una anestesia más segura, más predecible, más costo-eficiente y con mayor control por parte del profesional.
Palabras clave: Anestesia intravenosa, remifentanilo, propofol, bomba de infusión, nomogramas (Fuente: DeCS, BIREME)
INTRODUCCIÓN
La anestesia total intravenosa (total intravenous anesthesia, TIVA) es una técnica de anestesia general en la cual se administra por vía intravenosa, exclusivamente, una combinación de medicamentos en ausencia de cualquier agente anestésico inhalado, incluido el óxido nitroso (1). Los principios de la anestesia total intravenosa datan de 1628, cuando William Harvey describió la circulación sanguínea: “yo he contado como descubrí la verdadera función del músculo cardiaco, órgano motor de la circulación de la sangre” (2). Era el inicio de una etapa en la que se podrían modificar las condiciones fisiológicas y anatómicas del individuo con un trauma mínimo. Doscientos años después Alexander Wood, con el invento de la aguja y la jeringa, administró morfina intravenosa para aliviar el dolor de su esposa, quien padecía un cáncer incurable. Y, en 1874, Pirre Cyprien Ore administró por primera vez hidrato de cloral intravenoso para facilitar los procedimientos quirúrgicos. Con el surgimiento del tiopental sódico, en 1934, la anestesia intravenosa se popularizó. Halford (3), en 1943, describió cómo, en la segunda guerra mundial, el uso del pentotal con la morfina fue una técnica anestésica que, por el desconocimiento de su farmacocinética, marcó con tragedias este avance en la anestesia.
A partir de 1957 se impulsó el desarrollo de medicamentos con inicio y fin de acción rápidos; es así como surgieron, en 1980, el propofol (4) y, en 1993, el remifentanilo (5).
Con estos medicamentos en el escenario anestésico, se inició la transición entre una forma de administración farmacéutica a una de administración farmacocinética. Schwilden (6) en 1981 fue el primero que usó las infusiones controladas por computador, sistemas TCI (target controlled infusion), que evolucionaron hasta convertirse en lo que hoy conocemos como “diprinfusor”. Con la creación de herramientas como los potenciales evocados en 1989 y el BIS (Bispectral Index) en 1990, comenzó el concepto de la administración de medicamentos, no sólo basado en sus principios farmacocinéticos, sino también en sus principios farmacodinámicos (7), conceptos que hacen de la anestesia total intravenosa una técnica costo-eficiente y segura.
Fase farmaceútica y farmacocinética
El desarrollo de la anestesia total intravenosa está ligado estrechamente al de los sistemas de infusión; estos hacen que la anestesia total intravenosa goce de varias ventajas que la hacen fundamental tanto en la anestesia ambulatoria como en los procedimientos de alta complejidad. Algunas de estas ventajas son: gran estabilidad hemodinámica, profundidad anestésica más equilibrada, recuperación rápida y predecible, menor cantidad de medicamento administrado, menor contaminación y menor toxicidad, no sólo para el paciente, sino también para el equipo quirúrgico (8).
Cuando administramos un medicamento intravenoso para obtener una acción específica, lo podemos hacer siguiendo las diferentes fases de administración: farmacéutica, farmacocinética o farmacodinámica (9).
Fase farmacéutica: en esta, se tiene en cuenta el principio químico del medicamento y su manera de formulación. Manejamos unas dosis preesta blecidas para alcanzar un umbral terapéutico, siendo la manera más común de administrar los fármacos. Por ejemplo, empleamos 2,5 mg/ kg de propofol para la colocación de la máscara laríngea (10). Sabemos que con esta dosis alcanzaremos el objetivo, pero desconocemos su nivel plasmático y, por consiguiente, la duración del efecto, situación que se complica más cuando administramos múltiples dosis, lo que convierte a esta fase en un sistema de poca precisión.
Fase farmacocinética: en esta, se contemplan los cambios que sufren los medicamentos dentro del organismo mediante los procesos de absorción, distribución, metabolismo y eliminación. El objetivo es mantener una concentración constante, precisa y predecible dentro de una ventana terapéutica que garantice el efecto deseado. Para lograrlo se tienen en cuenta la cantidad de medicamento infundida y los cambios que este sufre dentro del organismo.
La administración de un medicamento en su fase farmacocinética requiere la ayuda de aparatos de infusión programados con modelos farmacocinéticos previamente estudiados y avalados por su precisión. El ejemplo clásico es la infusión de medicamentos por medio de los sistemas de TCI, en los que no sólo se evitan fluctuaciones plasmáticas, sino que disminuyen las necesidades del fármaco hasta en un 30 % (11,12).
Modelo de tres compartimentos
En la fase farmacocinética, los modelos farmacocinéticos son la piedra angular para la administración del medicamento (13). Existen tres tipos de modelos farmacocinéticos (1): los modelos de compartimentos, los fisiológicos y los híbridos.
Modelos de compartimentos: en estos, el cuerpo está representando matemáticamente en uno o varios compartimentos (14), no ubicados como cavidades reales dentro del organismo, en el que el paso del medicamento de uno a otro está representado por la distribución del fármaco que se hace por medio del flujo sanguíneo.
Estos modelos pueden ser de uno o múltiples compartimentos. El primero es el modelo farmacocinético más simple; el cuerpo está representado como un compartimento único con un volumen de distribución definido y se asume que la concentración plasmática disminuye después de la administración del fármaco de una manera exponencial como resultado de una única eliminación del medicamento (1).
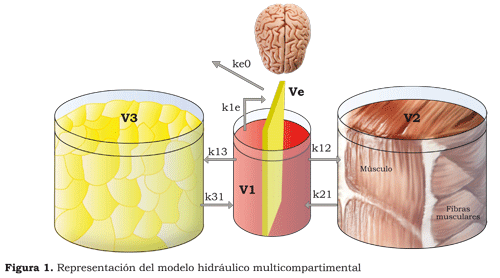
En los modelos de múltiples compartimentos (figura 1) se asume que existen dos o más compartimentos. La mayor parte de los medicamentos en anestesia presentan un modelo de tres compartimentos, el cual puede estar representado por tres recipientes, tres volúmenes de distribución, tres eliminaciones y cinco constantes de paso (15).
Aguilera (16) describe el modelo de tres compartimentos de la siguiente forma: la distribución inicial del fármaco se hace a un compartimento central (V1) compuesto por el plasma y los órganos ricamente irrigados: corazón, cerebro, riñón, hígado y pulmones. Este compartimento recibe el 75 % del gasto cardiaco y representa el 10 % de toda la masa corporal; posteriormente, el fármaco se distribuye a otros compartimentos.
El compartimento periférico rápido (V2) es aquel donde el fármaco se difunde con rapidez desde el central. Está constituido por territorios relativamente menos irrigados, como la masa muscular.
El compartimento periférico lento (V3) está constituido por los tejidos pobremente perfundidos (piel o grasa); es el compartimento donde el fármaco se difunde con mayor lentitud desde el central. Este volumen tiene gran importancia ya que puede “captar” a los fármacos muy liposolubles, como el sufentanilo, incluso después de suspender su infusión, y puede actuar como “reservorio” y ser el responsable de los episodios de “despertar” prolongado y depresión respiratoria en la fase de recuperación.
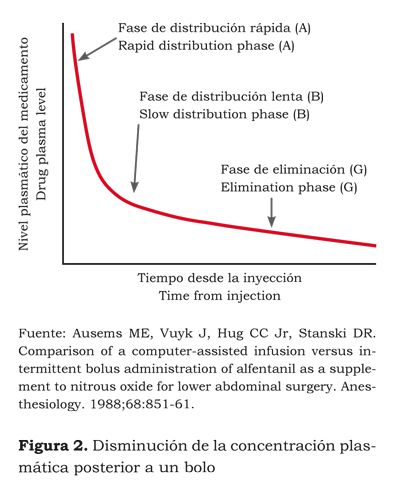
La suma de los tres compartimentos, o volúmenes, es lo que se conoce como el “volumen en el estado estacionario o de equilibrio”. No obstante, para el cálculo de estos volúmenes, excepto para el central, es necesaria la aplicación de modelos farmacocinéticos que, mediante complicadas ecuaciones, permiten además predecir la evolución de la concentración plasmática relacionada en el tiempo. Mediante un gráfico se puede representar la evolución de la concentración plasmática (ordenadas) con relación al tiempo (abscisas), y se obtienen tres fases (12):
1) Después de la administración en el compartimento central (V1) comienza la fase de distribución rápida (A) hacia los tejidos pobremente irrigados (V2).
2) La fase de distribución lenta (B) se caracteriza por el paso del fármaco desde el V1 hacia el territorio englobado en V3 y, también, por el retorno del V2 hacia V1.
3) La fase de eliminación o terminal (G) es aquella en la cual se produce el retorno desde V3 y V2 hacia V1. Es precisamente en esta fase cuando pueden aparecer fenómenos de efecto prolongado y se desarrolla la mayor parte de la verdadera depuración metabólica o eliminación (figura 1).
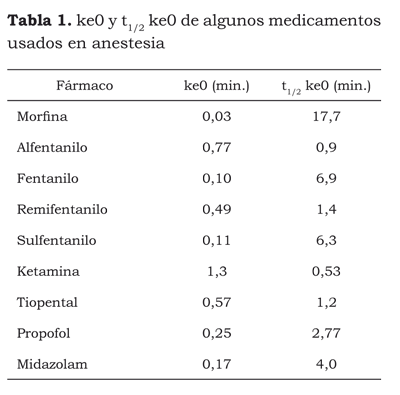
El curso de la concentración de un fármaco en un modelo de tres compartimentos se puede describir matemáticamente como (figura 2):
• ecuación de tres exponentes (17):
Cp = Ae-ατ + Be-βτ + G-γτ,
• tres volúmenes de distribución,
• tres aclaramientos o depuraciones y
• cinco constantes de paso del fármaco.
Esta ecuación es muy útil como modelo básico para la aplicación de la regresión no lineal que nos sirve para estimar parámetros farmacocinéticos; también, para controlar la infusión continua intravenosa de fármacos mediante un computador, realizar simulaciones o estimar pautas de dosificación (12).
Constantes de velocidad
Las constantes de velocidad k12, k21, k13, k31, k10, k1e y ke0 representan el ritmo equilibrado entre los diferentes compartimentos. Así, k12 representa la constante de velocidad entre el v1 y el V2, k21 entre el V2 y V1, k13 entre V1 y V3, k31 entre V3 y V1, k10 la constante de eliminación renal (figura 1).
El concepto de ke0 nació con Galeazzi (18) en los años ochenta con los estudios de la concentración de la procainamida en la saliva. Este concepto se basa en que al colocar un medicamento intravenoso, hay un tiempo de retraso llamado histéresis, el cual comprende entre la concentración plasmática alcanzada y la respuesta clínica observada. La explicación de este retraso es que el sitio de acción del medicamento no se encuentra en el plasma (V1), entonces, el medicamento debe pasar del plasma (V1) al sitio de efecto (Ve), un volumen virtual muy pequeño que está representado como un compartimento que se encuentra dentro del compartimento central V1. El tiempo que tarda el medicamento en alcanzar un ritmo de equilibrio entre el V1 y el sitio de efecto estaría representado por la constate de velocidad k1e y la constante de equilibrio entre Ve y V1 sería la ke1; al ser Ve un volumen virtual muy pequeño, la k1e y la ke1 no representan valores significativos, por lo que se decide eliminarlas y en su lugar se tiene en cuenta sólo lo que sale de Ve hacia el exterior. Esta constante de equilibrio está representada como keO o ke0, que significa que no va hacia otro compartimento.
El t1/2 ke0 es el tiempo en que la concentración en el sitio del efecto alcanza el 50 % de la concentración plasmática cuando ésta se mantiene constante (tabla 1).
Se calcula así:
t1/2 ke0 = log2 / ke0,
donde
ke0 = Lg2 t1/2 ke0 = 0,693/ t1/2 ke0.
La ke0 es el enlace entre la fase farmacocinética y la fase farmacodinámica y su importancia clínica radica en que una ke0 pequeña = gran t1/2 ke0 = gran histéresis. El concepto de histéresis se puede entender como el tiempo de latencia, el cual sería el tiempo comprendido entre la administración y el inicio de efecto farmacológico.
El concepto de ke0 se puede ver claramente con los diferentes opioides, alfentanilo y remifentanilo, que tienen una gran ke0 y una histéresis pequeña y, por consiguiente, un inicio de efecto rápido, lo cual permite ajustar la concentración plasmática dentro de rangos terapéuticos relativamente estrechos dando flexibilidad a la estrategia del tratamiento. El fentanilo y el sufentanilo tienen una ke0 intermedia por lo que su inicio de efecto es lento (de 4 a 6 minutos). La morfina, que tiene una ke0 mucho menor, tiene un mayor retardo en el inicio de su acción (19,20).
Como se mencionó anteriormente, el Ve está dentro del V1. Por lo tanto, al hacerse pequeño el V1 disminuye el Ve y, por consiguiente, se hace más pequeña la ke0. Este punto es muy importante para entender por qué el inicio de acción de los medicamentos a medida que envejecemos se hace mayor, ya que el V1 se hace cada vez menor y, por lo tanto, el t1/2 ke0 mayor (21).
En 2003, Minto et al. (22) incorporaron el concepto del pico de t (t-peak) para predecir un mejor enlace entre la farmacocinética y la farmacodinámica.
El t-peak se refiere al tiempo de la máxima concentración en el sitio de efecto después de un bolo intravenoso cuando no existe fármaco inicialmente en el sistema (17,23). Así, por ejemplo, los opioides administrados a dosis altas en procedimientos anestésicos son una opción que permite ofrecer analgesia adecuada, disminuyendo la concentración alveolar mínima de agentes inhalados o concentraciones plasmáticas de agentes hipnóticos intravenosos, ya que permite llevar a cabo adecuada interacción sinérgica que ofrece potencia analgésica y una predictibilidad de la respuesta clínica al conocerse de manera precisa el inicio o el cese del efecto clínico deseado (15).
Modelos farmacocinéticos de Minto-Schinder y Marsh
Los modelos farmacocinéticos para la administración de medicamentos intravenosos, como el propofol (24), utilizan programas computadorizados de infusión que permiten de una forma rápida y fácil intentar predecir las concentraciones deseadas en sangre. Uno de esos programas es el Diprinfusor, con un error promedio de desempeño de 5,7 % (25). Estos programas utilizados para la administración intravenosa de propofol se basan, principalmente, en dos modelos farmacocinéticos: el de Marsh (26) y el de Schnider (27,28).
La tasa de infusión para el mantenimiento de una concentración plasmática determinada puede ser calculada con la siguiente ecuación (29):
Mantenimiento = Cp (mg/ml) x Cl (mg/kg/min). Como la Cp (concentración plasmática) depende del V1 y el Cl (aclaramiento, depuración o eliminación) de la k10, tenemos:
Mantenimiento = (V1 x k10).
La diferencia entre los modelos de Marsh y de Schnider radica, principalmente, en el cálculo del V1. Para Marsh, V1 depende del peso del paciente. Así, cuanto más peso se tenga, mayor será el V1. Para Schnider, V1 depende de la edad y, como se dijo anteriormente, a medida que envejecemos el V1 se hace más pequeño. Estas diferencias se pueden ver en el cálculo del ke0 y, por consiguiente, en la tasa de infusión; además de la edad, Schnider tiene en cuenta otras variables como el peso y la talla del paciente.
Se han adelantado estudios para analizar la correlación de los dos modelos con el estado de sedación del paciente (30), pero dichos estudios no tienen en cuenta las variables que emplean los diferentes simuladores (31). Hasta el momento se ha visto un consumo menor del medicamento hipnótico cuando se utiliza el modelo de Schnider (32).
Para la administración del remifentanilo se cuenta con el modelo de Minto (16,33), el cual tiene presente variables como la edad, el peso y la talla del paciente. Los modelos disponibles para el fentanilo no dependen de ninguna de estas variables (34) y cuentan con errores promedio de desempeño del 30 %. Shibutani et al. (35) corrigieron estos modelos a dosis ajustadas por peso que le dan mayor exactitud al momento de predecir un blanco con fentanilo. Aunque, según el contexto, el remifentanilo es el opioide ideal por su vida media, no hay que desconocer la utilidad de los otros opioides, cuya farmacocinética, si se conoce, permite emplearlos con mucha seguridad (36).
Interacciones farmacodinámicas
La administración simultánea de los medicamentos anestésicos produce diferentes interacciones que pueden sumarse, potenciarse o inhibirse.
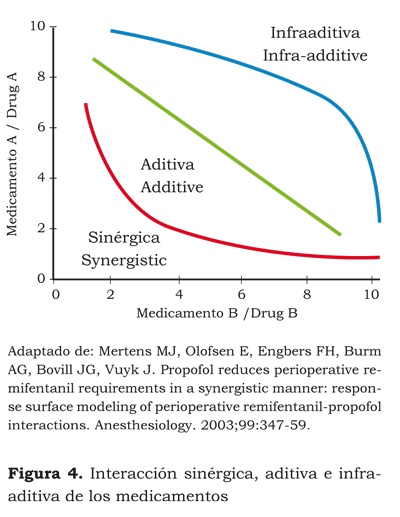
Las interacciones aditivas se presentan cuando los efectos de una dosis del medicamento A son iguales a los de una dosis del medicamento B, y a su vez, son iguales a la suma de la mitad de la dosis de A más B; por ejemplo, la falta de respuesta a la incisión se puede lograr con un blanco propuesto de propofol de 11 μg/ml en el sitio de efecto o con un CAM de 1,8 de sevofluorano, o con un blanco propuesto de propofol de 5,5 en el sitio de efecto más un CAM de 0,9 de sevofluorano (37).
Las interacciones sinérgicas se presentan cuando los efectos de una dosis del medicamento A o del B son menores que los que se obtendrían con la suma de la dosis de A y la de B. Por ejemplo, la probabilidad de no obtener respuesta durante la intubación se lograría con un blanco de propofol de 10 μg/ml o con un blanco de remifentanilo de 10 ng/ml; cuando administramos ambos medicamentos simultáneamente, podríamos deducir que se necesitaría un blanco de propofol de 5 μg/ ml más un blanco de remifentanilo de 5 ng/ml (interacción aditiva), pero lo que se observa es que se requiere un blanco de propofol de 2 μg/ml más un blanco de remifentanilo de 4 ng/ml para que no haya respuesta. Esto es lo que se conoce como interacción sinérgica o “supraaditiva” (38).
La interacción antagónica se presenta cuando los efectos de una dosis del medicamento A o del B son mayores que los que se obtendrían con la suma de las dosis de A y de B. Por ejemplo, la dosis efectiva 50 DE50 para la inhibición del dolor postoperatorio se consigue con 5,8 mg de morfina o con 85 mg de tramadol. Cuando damos juntos estos medicamentos, podríamos pensar que necesitaríamos 2,9 mg de morfina más 42,5 mg de tramadol (interacción aditiva), pero lo que vemos es que se siguen necesitando 5,5 mg de morfina y 80 mg de tramadol para la inhibición del dolor. Esto es una interacción infraaditiva (39).
Modelo de superficie
Cuando graficamos una interacción sinérgica, en el eje de la ordenadas el medicamento A y en el eje de abscisas, el medicamento B, obtenemos una curva (figura 3) que representa el efecto deseado en el 50 % de la población.
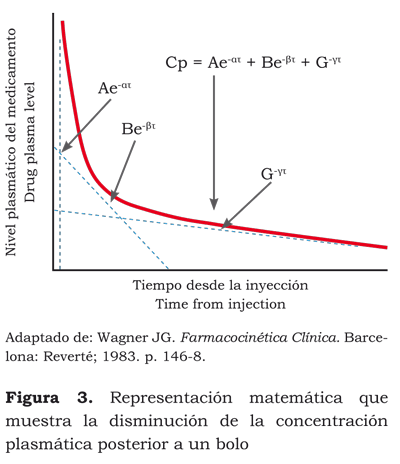
Cada punto de esa curva representa la posible combinación entre la dosis del medicamento A y la dosis del medicamento B para obtener el mismo efecto.
Por ejemplo, el efecto deseado en el 50 % de la población se obtiene con una dosis A1 más B1 o una dosis de A2 más B2 o una dosis de A3 más B3.
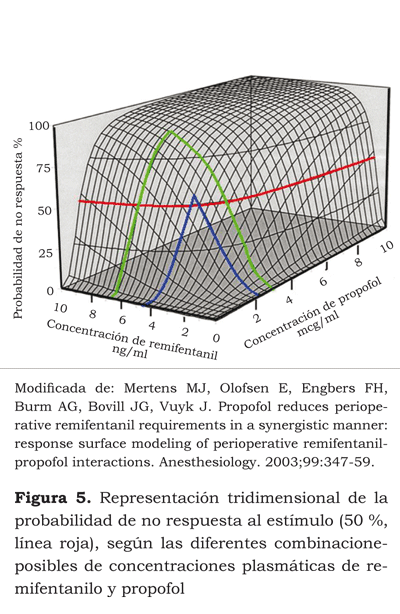
Si colocamos en un plano cartesiano la curva del efecto en el 50 % de la población, la curva del efecto en 25 % y 75 %, obtenemos una gráfica tridimensional, donde cada fármaco está representado en uno de los ejes del plano horizontal y el nivel de efecto es la tercera dimensión, lo que da origen a lo que se conoce como modelo de superficie, en el cual se observa la interacción a diferentes niveles de efecto y, por tanto de concentraciones, de cada uno de los fármacos (figura 4) (28).
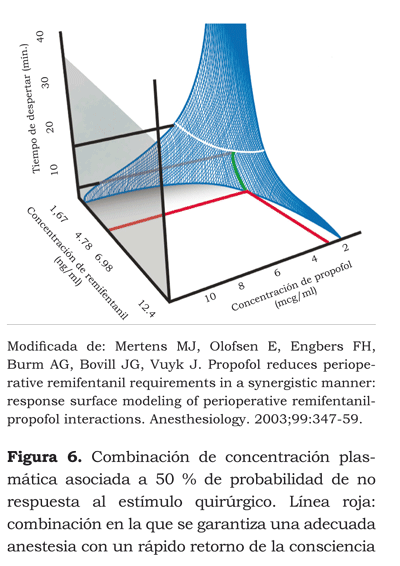
Si con este modelo podemos inferir las concentraciones de cada fármaco que necesitamos para obtener un efecto deseado y, además, ver cómo, con diferentes concentraciones, obtenemos el mismo efecto, ¿cuál sería la concentración ideal de cada fármaco para obtener una adecuada anestesia intraoperatoria y permitir al paciente una recuperación rápida? Vuyk et al. (40) diseñaron un estudio cuyo objetivo fue identificar la concentración efectiva 50 y 95 CE50 y CE95 en el sitio de efecto del propofol y los diferentes opioides, con la cual se aseguraría una adecuada anestesia y se permitiría al paciente recobrar más rápido la conciencia (figuras 5 y 6).
Las CE50 en el sitio de efecto del remifentanilo y el propofol después de una hora de infusión, fueron de 4,78 ng/ml y 2,51 μg/ml, respectivamente. Con ellas se logró el menor tiempo de despertar, que fue de 6,1 minutos. Las CE95 fueron de 7,71 ng/ml y 2,70 μg/ml, con un tiempo de despertar de 9,4 minutos.
En la CE50 se puede notar que la relación de concentración entre el remifentanilo y el propofol es de 2:1. Con el modelo de superficie que se obtuvo, el efecto en el 50 % también se podría obtener con concentraciones de remifentanilo de 6,98 ng/ml y de propofol de 2 μg/ml. Esto representa una relación de 3,5:1, con la cual se consiguen tiempos de despertar cercanos a 7 minutos. El despertar de un paciente a los 6 o a los 7 minutos, aunque tenga significancia estadística, no tiene mayor significado clínico.
El conocimiento de estos modelos es muy importante por las repercusiones económicas y la disponibilidad de recursos de cada institución, pues podemos obtener una adecuada anestesia con tiempos de despertar entre 6 y 8 minutos recargando más la concentración hacia el remifentanilo, logrando así la economía del propofol, medicamento que el más aumenta los costos en la anestesia intravenosa.
Esquemas de infusión manual
Tradicionalmente, antes del uso del sistema TCI, se utilizaban esquemas manuales para la administración de los anestésicos intravenosos. Uno muy conocido fue el de Roberts et al. (41), en el cual disminuían progresivamente las dosis del propofol con intervalos de 30 minutos.
A pesar de que el TCI y los esquemas de infusión manual proveen una adecuada anestesia (42), el primero es preferido sobre el segundo por permitir un control más adecuado de la profundidad anestésica y brindar una mejor estabilidad cardiovascular y respiratoria (43-45).
O’Hare et al. (46), al comparar la infusión manual con el TCI, encontraron un adecuado nivel de anestesia en ambos, pero el consumo de propofol por el segundo fue mayor. Un estudio similar fue realizado por Breslin, en el 2004, quien encontró que no había diferencia en la profundidad anestésica ni en el tiempo de despertar; sin embargo, el consumo del propofol por el sistema TCI fue mayor (47).
Uno de los grandes problemas que afrontan nuestras instituciones de salud es la disponibilidad de alta tecnología, debido en gran parte a que los recursos están dirigidos a solucionar problemas derivados de la violencia en que vivimos, y que parece no tener fin, razón por la cual sólo pocos centros de la ciudad disponen de un TCI para administrar anestesia total intravenosa.
En nuestro hospital logramos incorporar los modelos farmacocinéticos del TCI en nomogramas, los cuales nos permiten administrar infusiones de propofol, remifentanilo y fentanilo (48), por medio de bombas de infusión para alcanzar o buscar una concentración determinada. Este sistema de infusión manual práctico, accesible y fácil de manejar, en estudios previos ha logrado concordancias cercanas al 90 % cuando se compara con el Rugloop (47,49).
Otro de los inconvenientes en nuestras instituciones públicas es la disponibilidad de bombas de infusión, ya que, en el mejor de los casos, generalmente se dispone de una por sala. Una alternativa práctica que se ha estado utilizando en varios centros de la ciudad es la mezcla de remifentanilo con propofol para infusión única (50).
Las concentraciones plasmáticas de remifentanilo y propofol dependen del tipo de cirugía (tabla 2). En general, después de una dosis de midazolam de 30 μg/kg, 5 minutos antes de la inducción, se requiere una concentración plasmática de 7 a 8 ng/ml de remifentanilo y de 2 a 2,5 μg/ ml de propofol, para realizar la intubación (51). Una concentración plasmática de propofol mayor de 1,8 μg/ml y una menor de 2,5 μg/ml son suficientes para mantener la hipnosis durante la anestesia (52,53).
Una concentración plasmática de propofol inferior a 1,8 μg/ml con una de remifentanilo entre 3 y 3,5 ng/ml suficientes para extubar un paciente despierto (54,55), tranquilo y con una baja incidencia de tos.
CONCLUSIÓN
La administración de la anestesia total intravenosa es como pilotear un avión: se deben conocer las infusiones necesarias para alcanzar concentraciones de intubación (despegue), de mantenimiento (vuelo) y de despertar (aterrizaje). No tener una aproximación a las concentraciones plasmáticas que estamos manejando es como pilotear un avión con el simple concepto de encenderlo, despegar y apagar los motores a la hora de aterrizar (56).
REFERENCIAS
1. Campbell L, Engbers FH, Kenny GNC. Total intravenous anesthesia. Anesthesia. 2001;3(3):109-19. [ Links ]
2. Kerdel F. El diario de William Harvey. 2008 Jul 12 citado 2009 Nov 3. En: Bitácora médica blog Internet. Kerdel F. Disponible en: http://bitacoramedica.com/weblog/?p=427. [ Links ]
3. Halford FJ. A critique of intravenous anesthesia in war surgery. Anesthesiology. 1943;4(1):67-9. [ Links ]
4. Kay B, Stephenson DK. ICI 35868 (Diprivan): a new intravenous anesthetic. A comparison with Althesin. Anaesthesia. 1980;35(12):1182-7. [ Links ]
5. Glass PS, Hardman D, Kamiyama Y, Quill TJ, Marton G, Donn KH, et al. Preliminary pharmacokinetics and pharmacodynamics of an ultra-short-acting opioid: remifentanil (GI87084B). Anesth Analg. 1993;77(5):1031-40. [ Links ]
6. Schwilden H. A general method for calculating the dosage scheme in linear pharmacokinetics. Eur J Clin Pharmacol. 1981;20(5):379-86. [ Links ]
7. Voss LJ, Ludbrook G, Grant C, Upton R, Sleigh JW. A comparison of pharmacokinetic/pharmacodynamic versus mass-balance measurement of brain concentrations of intravenous anesthetics in sheep. Anesth Analg. 2007;104(6):1440-6. [ Links ]
8. Eyres R. Update on TIVA. Paediatr Anaesth. 2004;14(5):374-9. [ Links ]
9. Grahame-Smith DG. How will knowledge of the human genome affect drug therapy? Br J Clin Pharmacol. 1999;47(1):7-10. [ Links ]
10. Pennant J, White P. The laryngeal mask airway. Its uses in anesthesiology. Anesthesiology. 1993;79(1):144-63. [ Links ]
11. White PF. Use of continuous infusion versus intermittent bolus administration of fentanyl or ketamine during outpatient anesthesia. Anesthesiology. 1983;59(4):294-300. [ Links ]
12. Ausems ME, Vuyk J, Hug CC Jr, Stanski DR. Comparison of a computer-assisted infusion versus intermittent bolus administration of alfentanil as a supplement to nitrous oxide for lower abdominal surgery. Anesthesiology. 1988;68(6):851-61. [ Links ]
13. Pang KS, Weiss M, Macheras P. Advanced pharmacokinetic models based on organ clearance, circulatory, and fractal concepts. AAPS J. 2007;9(2):E268- 83. [ Links ]
14. Upton RN. The two-compartment recirculatory pharmacokinetic model an--introduction to recirculatory pharmacokinetic concepts. Br J Anaesth. 2004;92(4):475-84. [ Links ]
15. Carrasco MS. Aspectos farmacológicos de la anestesia intravenosa. Rev Venez Anestesiol. 2002;7(2):90- 7. [ Links ]
16. Aguilera L. Conceptos básicos de farmacocinética farmacodinámia en TIVA Internet. Grupo de Anestesia Total Intravenosa; 2008. 2008 Jun 1 citado 2009 Nov 3; Disponible en: http://www.tivabcn.org/ponencias.html. [ Links ]
17. Wagner Jon G. Farmacocinética clínica. Barcelona: Reverté; 1983. p. 146-8. [ Links ]
18. Galeazzi RL, Benet LZ, Sheiner LB. Relationship between the pharmacokinetics and pharmacodynamics of procainamide. Clin Pharmacol Ther. 1976;20(3):278-89. [ Links ]
19. Muñoz JH. Anestesia basada en analgesia. Rev Mex Anest. 2007;30(Suppl 1):S180-4. [ Links ]
20. Gupta D, Henthorn T. Pharmacologic principles. In: Barash PG, Cullen BF, Stoelting RK, Cahalan M, Stock MC (editors). Clinical anesthesia. 6th Ed. Philadelphia: Lippincott; 2009. p. 137-64. [ Links ]
21. Minto CF, Schnider TW, Shafer SL. Pharmacokinetics and pharmacodynamics of remifentanyl. II. Model application. Anesthesiology. 1997;86(1):24-33. [ Links ]
22. Minto CF, Schnider TW, Gregg KM, Henthorn TK, Shafer SL. Using the time of maximum effect site concentration to combine pharmacokinetics and pharmacodynamics. Anesthesiology. 2003;99(2):324-33. [ Links ]
23. Sepúlveda P. Actualizaciones en modelación, drogas y tecnologías complementarias. La anestesia intravenosa II. Santiago de Chile: Sociedad de Anestesiología de Chile, Clínica Alemana de Santiago, Universidad del Desarrollo; 2006. p. 209-15. [ Links ]
24. Coetzee JF, Glen JB, Wium CA, Boshoff L. Pharmacokinetic model selection for target controlled infusions of propofol. Assessment of three parameter sets. Anesthesiology. 1995;82(6):1328-45. [ Links ]
25. Glen JB. The development of 'Diprifusor': a TCI system for propofol. Anesthesia. 1998;53 Suppl 1:13-21. [ Links ]
26. Marsh B, White M, Morton N, Kenny GN. Pharmacokinetic model driven infusion of propofol in children. Br J Anaesth. 1991;67(1):41-8. [ Links ]
27. Schnider TW, Minto CF, Shafer SL, Gambus PL, Andresen C, Goodale DB, et al. The influence of age on propofol pharmacodynamics. Anesthesiology. 1999;90(6):1502-16. [ Links ]
28. Schnider TW, Minto CF, Gambus PL, Andresen C, Goodale DB, Shafer SL, et al. The influence of method of administration and covariates on the pharmacokinetics of propofol in adult volunteers. Anesthesiology. 1998;88(5):1170-82. [ Links ]
29. White P, Eng M. Intravenous anesthetics. In: Barash PG, Cullen BF, Stoelting RK, Cahalan M, Stock MC (editors). Clinical anesthesia. 6th Ed. Philadelphia: Lippincott; 2009: 444-64. [ Links ]
30. Barakat AR, Sutcliffe N, Schwab M. Effect site concentration during propofol TCI sedation: a comparison of sedation score with two pharmacokinetic models. Anaesthesia. 2007;62(7):661-6. [ Links ]
31. Schnider T, Minto C. Pharmacokinetic models of propofol for TCI. Anesthesia. 2008;63(2):206. [ Links ]
32. Absalom AR, Mani V, De Smet T, Struys MM. Pharmacokinetic models for propofol--defining and illuminating the devil in the detail. Br J Anaesth. 2009;103(1):26-37. [ Links ]
33. Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics of remifentanil. I. Model development. Anesthesiology. 1997;86(1):10-23. [ Links ]
34. Shafer SL, Varvel JR, Aziz N, Scott JC. Pharmacokinetics of fentanyl administered by computer-controlled infusion pump. Anesthesiology. 1990;73(6):1091- 102. [ Links ]
35. Shibutani K, Inchiosa MA, Sawada K, Bairamian M. Accuracy of pharmacokinetic models for predicting plasma fentanyl concentrations in lean and obese surgical patients: derivation of dosing weight ("pharmacokinetics mass"). Anesthesiology. 2004;101(3):603- 13. [ Links ]
36. Shafer SL, Varvel JR. Pharmacokinetics, pharmacodynamics, and rational opioid selection. Anesthesiology. 1991;74(1):53-63. [ Links ]
37. Harris RS, Lazar O, Johansen JW, Sebel PS. Interaction of propofol and sevoflurane on loss of consciousness and movement to skin incision during general anesthesia. Anesthesiology. 2006;104(6):1170-5. [ Links ]
38. Mertens MJ, Olofsen E, Engbers FH, Burm AG, Bovill JG, Vuyk J. Propofol reduces perioperative remifentanil requirements in a synergistic manner: response surface modeling of perioperative remifentanil-propofol interactions. Anesthesiology. 2003;99(2):347-59. [ Links ]
39. Marcou TA, Marque S, Mazoit JX, Benhamou D. The median effective dose of tramadol and morphine for postoperative patients: a study of interactions. Anesth Analg. 2005;100(2):469-74. [ Links ]
40. Vuyk J, Mertens MJ, Olofsen E, Burm AG, Bovill JG. Propofol anesthesia and rational opioid selection: determination of optimal EC50-EC95 propofol-opioid concentrations that assure adequate anesthesia and a rapid return of consciousness. Anesthesiology. 1997;87(6):1549-62. [ Links ]
41. Roberts FL, Dixon J, Lewis GTR, Tackley RM, Prys- Roberts C. Induction and maintenance of propofol anaesthesia. A manual infusion scheme. Anesthesia. 1988;43 Suppl:14-7. [ Links ]
42. Servin FS. TCI compared with manually controlled infusion of propofol: a multicentre study. Anaesthesia. 1998;53(Suppl 1):82-6. [ Links ]
43. Russell D, Wilkes MP, Hunter SC, Glen JB, Hutton P, Kenny GN. Manual compared with target-controlled infusion of propofol. Br J Anesth. 1995;75(5):562-6. [ Links ]
44. Engbers FH. Target controlled infusion in practice. Eur J Anesthesiol Suppl. 1995;12(10):88-90. [ Links ]
45. Moerman AT, Herregods LL, De Vos MM, Mortier EP, Struys MM. Manual versus target-controlled infusion remifentanil administration in spontaneously breathing patients. Anesth Analg. 2009;108(3):828-34. [ Links ]
46. O'Hare RA, Mirakhur RK. Intravenous anesthesia: Manual or target controlled infusion systems. Anesthesiology. 1999;91:A345. [ Links ]
47. Breslin DS, Mirakhur RK, Reid JE, Kyle A. Manual versus target-controlled infusions of propofol. Anaesthesia. 2004;59(11):1059-63. [ Links ]
48. Tafur LA, Serna AM, Lema E. Fentanilo PK/PD, un medicamento vigente. Rev Col Anest. 2010;38(1):68- 83. [ Links ]
49. Tafur LA, Gómez JM, Parra LE. Validación de nomogramas de remifentanil y propofol para la administración de anestesia total endovenosa. Rev Colomb Anestesiol. 2009;37(1):21-8. [ Links ]
50. Gómez JM, Tafur LA, Quintero I, Figueroa S, Serna A. Gutiérrez A. Infusión manual única de remifentanil y propofol para anestesia en cirugía laparoscópica ginecológica: serie de casos. Rev Esp Anestesiol Reanim. 2010;57(4):71-8. [ Links ]
51. Ithnin F, Lim Y, Shah M, Shen L, Sia AT. Tracheal intubating conditions using propofol and remifentanil target-controlled infusion: a comparison of remifentanil EC50 for Glidescope and Macintosh. Eur J Anaesthesiol. 2009;26(3):223-8. [ Links ]
52. Milne SE, Troy A, Irwin MG, Kenny GN. Relationship between bispectral index, auditory evoked potential index and effect-site EC50 for propofol at two clinical end-points. Br J Anaesth. 2003;90(2):127-31. [ Links ]
53. Xu Z, Liu F, Yue Y, Ye T, Zhang B, Zuo M, et al. C50 for propofol-remifentanil target-controlled infusion and bispectral index at loss of consciousness and response to painful stimulus in Chinese patients: a multicenter clinical trial. Anesth Analg. 2009;108(2):478-83. [ Links ]
54. Nunes CS, Ferreira DA, Antunes L, Lobo F, Santos IA, Amorim P. Individual effect-site concentrations of propofol at return of consciousness are related to the concentrations at loss of consciousness and age in neurosurgical patients. J Clin Anesth. 2009;21(1):3- 8. [ Links ]
55. Nunes CS, Ferreira DA, Antunes L, Lobo F, Amorim P. Propofol predicted effect concentrations at loss of consciousness are strongly correlated with predicted concentrations at recovery of consciousness. J Neurosurg Anesthesiol. 2004;16(4):342-3. [ Links ]
56. Tafur LA, Lema E. Aplicación práctica de los nomogramas de remifentanilo y propofol. Rev Col Anest. 2010;37(4):310-20. [ Links ]











 text in
text in