Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.27 no.4 Bogotá Oct./Dec. 2007
Artículo original
Disminución del número de neuronas que expresan GABA en la corteza cerebral de ratones infectados con rabia
Aura Caterine Rengifo, Orlando Torres-Fernández
Laboratorio de Microscopía, Instituto Nacional de Salud, Bogotá, D.C., Colombia
Recibido: 16/01/07; aceptado: 31/08/07
Introducción. Algunos signos clínicos de la rabia y estudios experimentales previos sugieren que esta infección viral podría afectar al sistema GABAérgico.
Objetivo. Evaluar el efecto de la infección con el virus de la rabia sobre la expresión de GABA en neuronas de la corteza cerebral de ratón.
Materiales y métodos. Se inocularon ratones adultos con virus CVS de la rabia por vía intramuscular. Los animales se sacrificaron en la etapa terminal de la enfermedad y se fijaron por perfusión con paraformaldehído al 4% y glutaraldehído al 1%. Se procesaron cortes coronales de cerebro obtenidos en un Vibratome®, mediante inmunohistoquímica para identificar neuronas GABAérgicas en la corteza cerebral. Se realizaron conteos y análisis cuantitativo de las neuronas positivas para GABA en muestras de ratones normales e infectados.
Resultados. En los animales infectados con rabia no se alteró el patrón de distribución de las neuronas GABAérgicas corticales pero su número disminuyó significativamente. El promedio de células positivas para GABA en 1 mm2 de corteza fue de 293±32 en los controles y de 209±13 en los infectados. Por otra parte, el valor promedio del área de los perfiles neuronales positivos para GABA aumentó significativamente de 104±8 µm2 en los controles a 122±10 µm2 en las muestras infectadas, debido a que la pérdida de células positivas para GABA fue más evidente en las neuronas de menor tamaño. No obstante, el rango de tamaños de las células inmunopositivas para GABA fue similar en muestras de animales normales e infectados.
Conclusiones. Este trabajo aporta nueva evidencia en favor de la hipótesis que propone la participación del GABA en la fisiopatología de la rabia.
Palabras clave: ácido gamma-aminobutírico, agentes neurotransmisores, corteza cerebral, inmunohistoquímica, interneuronas, rabia.
Decreased number neurons expressing GABA in the cerebral cortex of rabies-infected mice
Introduction. GABAergic neurons synthesize and release gamma-aminobutyric acid, the predominant inhibitory neurotransmitter in the brain. Certain clinical signs of rabies and previous experimental studies have suggested that rabies viral infections affect the host GABAergic system.
Objective. The effect of rabies virus infection on the expression of GABA was evaluated in neurons of the mouse cerebral cortex.
Materials and methods. Adult mice were inoculated by intramuscular injection with the standard strain of rabies (CVS virus). The animals were sacrificed in the terminal stage of the illness and perfused with 4% paraformaldehyde and 1% glutaraldehyde. Frontal sections were obtained in a Vibratome® and treated with appropriate immunohistochemical reactions for identifying the GABAergic neurons in the cerebral cortex. Counts and comparative quantitative analysis of the GABA+ neurons were compared in samples of infected and normal mice.
Results. In the animals infected with rabies virus, the distribution pattern of cortical GABAergic neurons was not changed, but their number diminished significantly. The mean value of GABA+ cells number in 1 µm2 of cerebral cortex was 293±32 in normal samples and 209±13 in infected samples. Despite the loss in GABA+ cell number, the average size of GABA+ cells per unit increased from 104±8 µm2 in normal mice to 122±10 µm2 in infected mice because the cell loss consisted more frequently of smaller neurons. Nevertheless, the rank of GABA+ cell sizes in infected samples was similar to normal samples.
Conclusion. This evidence supported the hypothesis that GABA is involved in rabies pathology.
Key words: gamma-aminobutyric acid, neurotransmitter agents, cerebral cortex, immunohistochemistry, interneurons, rabies.
La rabia es una zoonosis cosmopolita que causa la muerte a unas 60.000 personas al año, la mayoría en países del tercer mundo, debido principalmente a fallas en el control de la rabia canina (1,2). En Latinoamérica se ha logrado reducir el número de casos humanos de rabia transmitida por perros pero se ha incrementado el número de casos transmitidos por animales silvestres (3). Si bien las medidas sanitarias tomadas para reducir el número de casos de rabia en Latinoamérica han sido relativamente exitosas, su amenaza es permanente, como lo demuestran los brotes recientes que han afectado a comunidades colombianas (4,5). Aunque existen esquemas de vacunación contra la rabia, debido a su alto costo y a otros factores, éstos no se pueden aplicar masivamente en la población (6), por esta razón y porque se trata de una enfermedad mortal, es necesario encontrar tratamiento terapéutico que sólo será posible en la medida en que se avance en el conocimiento de su patogénesis (1,2,7).
En opinión de un grupo de científicos europeos la falta de conocimiento sobre los mecanismos patogénicos de la rabia, se debe en parte, a que no representa un problema de salud pública en los países desarrollados y a la falta de integración para la investigación entre virólogos y neurocientíficos (8). Se ha avanzado mucho en el campo de la virología de la rabia pero, paradójicamente, aunque el virus de la rabia ataca casi exclusivamente al sistema nervioso, es poco lo que se conoce sobre esta enfermedad desde la perspectiva de la neurociencia básica. Un ejemplo de ello es la escasa información que se encuentra sobre el efecto de esta infección en el metabolismo de los neurotransmisores (7).
Uno de los más importantes es el ácido gamma-aminobutírico (GABA), el principal neurotransmisor de efecto inhibitorio en el sistema nervioso central. En la corteza cerebral el GABA se sintetiza principalmente en las interneuronas. Éstas constituyen cerca del 30% de las neuronas corticales y, a través de sus conexiones con las células piramidales (el otro 70% de la población neuronal), contribuyen a modular la actividad sináptica de estas últimas. Las neuronas piramidales liberan glutamato, el más importante neurotransmisor excitador. Si se altera el equilibrio de la interacción GABA-glutamato, la función neurológica se deteriora (9-13).
Las neuronas piramidales se pueden reconocer fácilmente gracias a su morfología característica (14,15), sin embargo, para distinguir interneuronas, en un corte histológico de la corteza cerebral, se requieren procedimientos especiales; la identificación con marcadores neuronales mediante inmunohistoquímica es el método más utilizado actualmente (10,16). El primer marcador que permitió reconocer neuronas GABAérgicas por métodos inmunohistoquímicos fue la glutamato descarboxilasa (GAD) (EC 4.1.1.15), la enzima que cataliza la síntesis de GABA (9,10). Posteriormente se elaboraron anticuerpos anti-GABA (17,18) cuya sensibilidad es mayor (9,19).
El estudio del sistema GABAérgico ha adquirido gran importancia biomédica debido a que su disfunción se ha asociado con diferentes enfermedades neurológicas (11,13). Los signos clínicos de la rabia sugieren que la enfermedad afecta este sistema de neurotransmisión (20,21) y experimentalmente se ha demostrado efecto de la infección rábica sobre el metabolismo del GABA. La inoculación subcutánea del virus en ratas provocó una disminución transitoria en el contenido cerebral de GABA, cuantificada por un método de extracción del neurotransmisor a partir del tejido cerebral (22), mientras que en cultivos de neuronas embrionarias corticales de rata la infección afectó algunos mecanismos de transporte del neurotransmisor que podrían disminuir su poder inhibitorio (21). Los estudios en modelos animales con otros virus neurotrópicos, coinciden en que el sistema GABAérgico es vulnerable a las infecciones virales (23-26).
Nosotros hemos estudiado el efecto de la rabia sobre la expresión de calbindina y otras dos proteínas de enlace del calcio en el cerebro de ratones (27,28). Estas proteínas son marcadores de células GABAérgicas en la corteza cerebral (9,10,16,29) y en otras áreas del sistema nervioso, como el estriado, donde la mayoría de neuronas colocalizan GABA y calbindina (30,31). La inoculación de virus fijo por vía intramuscular provocó pérdida de la expresión de calbindina en la corteza y el estriado (27,28). Puesto que este fenómeno se observó en neuronas GABAérgicas es importante evaluar si la infección con el virus de la rabia afecta directamente al metabolismo del neurotransmisor. Una disminución en la síntesis de GABA alteraría su papel regulador sobre la neurotransmisión excitadora y se podría estar reflejando en algunos de los signos clínicos observados en muchos pacientes enfermos de rabia (20). En este informe se reporta, por primera vez, el efecto de la infección rábica in vivo sobre la expresión de GABA en neuronas corticales.
Materiales y métodos
Manejo de los animales e inoculación del virus de la rabia
El estudio se llevó a cabo en ratones (ICR hembras) de cuatro semanas de edad confinados en la sala de alta seguridad del Bioterio del Instituto Nacional de Salud (INS). El inóculo viral se obtuvo a partir de un macerado de cerebros de ratones lactantes infectados por vía intracerebral con virus fijo de la cepa CVS, suministrado por el Laboratorio de Virología del INS. Los procedimientos sobre inoculación y manejo de los animales de laboratorio se hicieron según las normas éticas y legales vigentes y fueron aprobados por el Comité de Ética del INS. Detalles de los mismos se publicaron anteriormente (27,28).
Una muestra del inóculo inicial se diluyó al 10% en una solución preparada en agua destilada con suero equino normal al 2% y antibióticos (200 Ul/ml de penicilina y 4 mg/ml de estreptomicina). El virus fue titulado por inoculación intracerebral de diluciones seriadas en ratones (DL50=104). Cada animal fue inoculado con 0,03 ml de la dilución 1/10 por vía intramuscular en la extremidad posterior izquierda equivalente a 1000 DL50. A los ratones utilizados como controles se les inyectó la misma cantidad de solución diluyente sin el virus. En total se trabajó con 10 animales infectados y 10 controles pero el estudio cuantitativo se llevó a cabo sólo con la mitad de las muestras. Se seleccionaron aquellos ratones que manifestaron síntomas y alcanzaron la fase terminal de la enfermedad casi simultáneamente.
Preparación del tejido: ensayos de fijación por perfusión
Los animales enfermos y sus controles se sacrificaron cuando los primeros alcanzaron el estado terminal de la enfermedad (siete u ocho días después de la inoculación). A cada uno de ellos se le suministró 0,2 ml de hidrato de cloral al 30% por vía intraperitoneal (350 mg/Kg). En tres minutos los animales estuvieron bajo anes-tesia profunda. Este es un método muy utilizado para animales de laboratorio en investigaciones del área de la neurociencia (15,32).
Con los animales anestesiados se llevó a cabo la fijación por perfusión intracardiaca. Inicialmente se dejó correr tampón salino de fosfatos a un pH de 7,3 durante 5 minutos (aproximadamente, 50 ml) y luego la solución con el fijador, preparado en el mismo tampón, durante 10 minutos (aproximadamente, 100 ml). Se ensayaron cinco fórmulas de fijación por perfusión mediante la combinación de paraformaldehído (PFA) y glutaraldehído (GA): PFA al 4% sin GA; PFA al 4% y GA al 0,2%; PFA al 4% y GA al 0,5%; PFA al 4% y GA al 1%; y finalmente, PFA al 0,5% y GA al 2,5%. Esta última fórmula se ensayó también mediante fijación por inmersión del cerebro completo, durante 24 horas, luego de hacer la perfusión con sólo PFA al 0,5%. Todas estas combinaciones se tomaron de las referencias citadas.
Para evaluar cada una de las formulaciones se trabajó con los cerebros de dos animales normales de la misma edad y sexo pero diferentes a aquéllos que fueron objeto del estudio del efecto de la rabia sobre la expresión del neurotransmisor GABA. Por razones que se discutirán más adelante se seleccionó la combinación PFA 4% y GA 1% para continuar con el trabajo. Después de la perfusión, se extrajeron los cerebros y se sumergieron en una solución de PFA al 4%, a 4°C durante mínimo 24 horas, antes de continuar con las siguientes etapas para el estudio inmunohistológico.
Inmunohistoquímica
En un Vibratome® se obtuvieron cortes coronales de los cerebros, cada uno de 50 µm de espesor, en sentido rostro-caudal a nivel del cuerpo calloso y la comisura anterior. Todo el procedimiento inmu-nohistoquímico se llevó a cabo en cajas de Petri pequeñas (2,5 cm de diámetro) dentro de las cuales los cortes se mantuvieron en flotación y agitación permanente a temperatura ambiente (20°C).
Para iniciar, las secciones de tejido cerebral se lavaron durante toda la noche en tampón salino de fosfatos y se utilizó este mismo tampón para preparar la mayoría de las soluciones de trabajo y para realizar los lavados después de cada tratamiento. Los cortes se pretrataron con cloruro de amonio (NH4Cl2) 0,05 M, por 30 minutos para inactivar los aldehídos (32) y con peróxido de hidrógeno (H2O2) al 3%, otros 30 minutos, para bloquear la peroxidasa endógena.
La permeabilización del tejido a la entrada de los anticuerpos se realizó mediante tratamiento con etanol diluido: 10%, 20%, 10%, por cinco minutos en cada solución. Para bloquear sitios inespecíficos se utilizó una solución con albúmina de suero bovino al 3% y suero normal de cabra al 3%, durante 30 minutos. A continuación se retiró el exceso de ésta y, sin lavar, se incubaron los cortes en la solución que contenía el anticuerpo primario durante 20 horas.
Se utilizó un anticuerpo anti-GABA (Sigma policlonal, 1:2.500). Al día siguiente se continuó con la incubación en anticuerpo secundario biotinilado anti-conejo IgG (Sigma 1:400) durante dos horas y luego en solución ABC (Vectastain) por dos horas más. El revelado de la inmunotinción se llevó a cabo con un estuche de diaminobenzi-dina-níquel (Vectastain). Previamente los cortes se habían tratado con cloruro de cobalto (CoCl12.6H2O) al 1% en Tris-HCl pH 7,4, durante 20 minutos, para intensificar la reacción.
Por último, los cortes se extendieron en láminas, se deshidrataron al ambiente y se montaron con citorresina. Algunos de los cortes de cada uno de los cerebros se utilizaron para confirmar el diagnóstico de rabia mediante inmunohistoquímica y verificar la presencia del virus en la corteza (27,33).
Análisis cuantitativo
Se seleccionaron cinco casos (unidades experimentales) con sus respectivos controles. En cada unidad experimental se escogieron cinco cortes (repeticiones) para realizar los conteos de células inmunorreactivas a GABA en la corteza cerebral. El área de conteo correspondió a una columna de 1 mm de ancho de la corteza frontal, a nivel del cuerpo calloso. En esta zona la altura de la corteza deshidratada se aproxima a 1 mm, por lo tanto, el área de conteo en cada repetición fue de 1 mm2 aproximadamente (27).
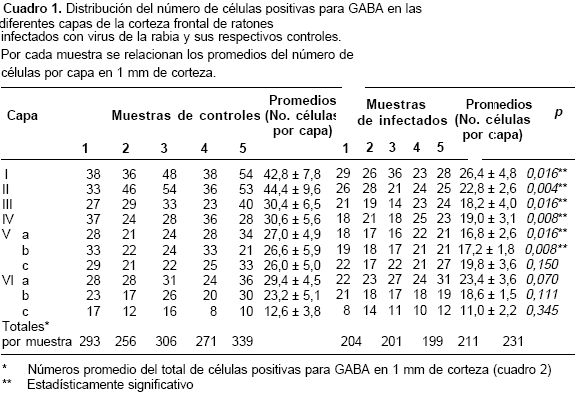
El método de contar células en columnas de una anchura determinada, que incluyan todo el espesor de la corteza, es recomendado por otros autores para minimizar el efecto de la deshidratación que hace parte del procesamiento histológico de la muestra (34). Se realizaron conteos de las neuronas inmunomarcadas en un microscopio Zeiss dotado con un micrómetro de malla Netzmiier de 1 mm2. Esta malla también fue de gran utilidad para hacer los conteos correspon-dientes a cada una de las capas corticales. Para delimitar estas capas se utilizó como guía el atlas de Valverde (35). Estos conteos se realizaron con el objetivo 10X del microscopio (cuadro 1).
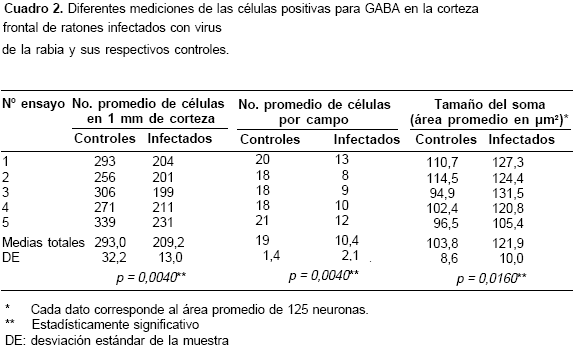
Un segundo método de conteo se llevó a cabo explorando campos al azar con el objetivo 40X dentro de la misma área delimitada para los conteos panorámicos. Se tomaron los datos promedio de tres campos por cada uno de los cinco cortes. Cada campo equivale a un área de 0,25 mm2 (cuadro 2).
Para realizar los conteos, las lecturas de las preparaciones histológicas se hicieron sin que los observadores conocieran si cada lámina correspondía a una muestra de un control o de un infectado. Los conteos registrados para el análisis cuantitativo los llevó a cabo el primer autor pero el segundo autor obtuvo resultados coincidentes con una muestra menor de preparaciones del mismo material.
La medición del tamaño (área) de los somas neuronales se realizó en un microscopio Axiophot Zeiss con ayuda del programa de análisis de imágenes KS-300. Para ello se seleccionaron campos con el objetivo 10X, uno por cada corte y se capturaron las imágenes. Luego se seleccio-naron al azar 25 neuronas por campo y se dio la orden al programa para medir el área de cada soma neuronal. Las mediciones se realizaron en cinco cortes por cada muestra, tanto en los controles como en los infectados (cuadro 2). Para el análisis estadístico se compararon los grupos control con los grupos problema y se analizaron con una prueba no paramétrica (prueba de rangos de Wilcoxon-Mann-Whitney de dos colas), aplicando una fórmula y una tabla diseñadas para trabajar con un número pequeño de muestras (36).
Resultados
Fijación del tejido
Cualitativamente, los mejores resultados para la visualización de células positivas para GABA en el tejido se obtuvieron con la combinación de PFA 4% y GA 1%. Con la fijación en sólo PFA 4% apenas se reveló la presencia de unas pocas células positivas para GABA en la corteza. La adición de GA al 0,2% o al 0,5% mejoró ostensiblemente la inmunorreactividad a GABA pero el GA al 1% dio lugar a una inmunotinción más intensa y nítida de las células GABAérgicas. No obstante, con ninguno de los métodos de fijación fue posible obtener buena inmuno-rreactividad de los procesos celulares (dendritas y axones). La combinación de PFA al 0,5% y GA al 2,5%, ya fuera por perfusión directa o por inmersión posterior a la perfusión con PFA al 0,5%, produjo amarillamiento del tejido cerebral y pérdida total de la inmunorreactividad a GABA.
Distribución y morfología de neuronas inmunorreactivas a GABA en la corteza de ratón normal
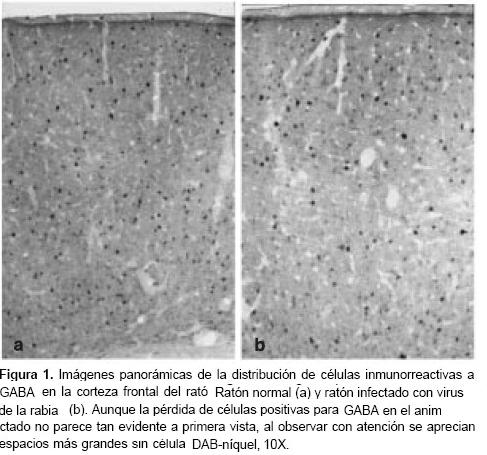
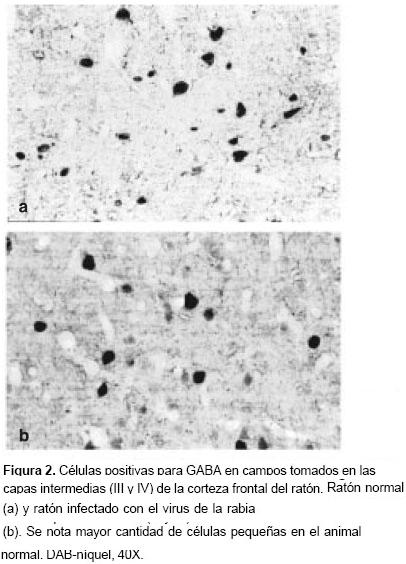
A primera vista se observaron neuronas positivas para GABA en todas las capas corticales con una distribución aparentemente uniforme (figura 1). No obstante, los conteos realizados en cada una de las capas de la corteza dieron como resultado una mayor concentración de células GABAérgicas hacia las capas superiores (I–II) (cuadro 1). El número promedio de neuronas positivas para GABA en una columna cortical de 1 mm fue de 293±32 en los controles (cuadros 1 y cuadro 2). Las neuronas inmunorreactivas a GABA presentaron un amplio rango de formas y tamaños (figura 2). Aunque la mayoría correspondían a formas isodiamétricas, también se hallaron células fusiformes y otras de contornos irregulares. El diámetro de las neuronas positivas para GABA osciló entre 6 y 22 µm (n=125) en las muestras de los controles.
Efecto de la rabia sobre las neuronas positivas para GABA
La infección provocó disminución en el número de células inmunorreactivas a GABA contadas en 1 mm de corteza cerebral frontal del ratón (p=0,004) (cuadro 2). Esta pérdida no es tan evidente en una vista panorámica de las preparaciones histológicas observadas al microscopio (figura 1). No obstante, al realizar los conteos los promedios de células positivas para GABA fueron inferiores en todas las capas corticales de los animales infectados, con una disminución estadísticamente significativa en las capas supragranulares (I-IV) y en la parte superior de la capa V (<cuadro 1.
La observación por campos seleccionados al azar (figura 2) confirmó la pérdida de células positivas para GABA en las muestras de ratones infectados con el virus de la rabia (p=0,004) (cuadro 2). A simple vista da la impresión de que se pierden las células positivas para GABA de menor tamaño (figura 2).
Esta apreciación se confirmó cuantitativamente puesto que la infección dio lugar a una diferencia significativa (p=0,016) en el valor promedio de las áreas de los perfiles de los somas neuronales inmunorreactivos GABA; éste fue mayor en los animales infectados (cuadro 2), pero no porque sus células hayan alcanzado mayor tamaño absoluto. El rango de áreas fue de 50-240 µm2 para las células positivas para GABA de las muestras control y de 65-242 µm2 para las muestras infectadas.
Discusión
La fijación con glutaraldehído en el estudio inmunohistoquímico de GABA.
Antes de que fuera posible aplicar la inmunohisto-química al estudio de neurotransmisores como el GABA, era necesario acudir a métodos bioquímicos que consistían en hacer extracción del compuesto a partir de una muestra de tejido (17,18,22-24). La ventaja de la inmunohistoquímica es que permite la localización precisa dentro de las células y tejidos de la sustancia que se busca (18,37).
Storm-Mathisen et al. (17,18) hicieron posible la visualización del GABA en los tejidos mediante una técnica inmunocitoquímica luego de obtener anticuerpos contra un conjugado del aminoácido y albúmina de suero bovino por acción del glutaraldehído (GA). Cuando los anticuerpos se han obtenido contra antígenos modificados por GA la presencia de éste en la solución de fijación incrementa la reacción antígeno-anticuerpo (37). A diferencia de otros antígenos en los que se afecta su inmunorreactividad cuando los tejidos se fijan con GA, el GABA sí lo requiere (18,37).
Combinaciones de PFA y GA, similares a las ensayadas por nosotros, han sido utilizadas en estudios inmunocitoquímicos de GABA en la corteza cerebral de diferentes especies (38-46). Somogyi et al. (47) no encontraron diferencias importantes para la inmunorreactividad del GABA si la concentración de GA era relativamente baja (0,05%) o más alta (2,5%). Dentro de este rango se halla la información consignada en la mayoría de referencias consultadas.
Nosotros obtuvimos buenos resultados con tres de las combinaciones de PFA al 4% y GA (0,2, 0,5 y 1,0%). Cualitativamente la fórmula PFA 4% y GA 1,0% nos ofreció imágenes con mayor intensidad de inmunotinción y por esta razón fue la seleccionada para llevar a cabo el estudio del efecto de la rabia sobre la expresión de GABA en la corteza cerebral. Pero si fuera necesario utilizar el mismo tejido para revelar la presencia de GABA simultáneamente con otros marcadores que pueden ser afectados por la fijación con GA la concentración de este fijador se debe bajar (47).
La información encontrada sobre estudios similares en ratón es escasa (18,45) y sus condiciones experimentales diferentes a la de nuestro trabajo. En el estudio pionero sobre la demostración inmunohistoquímica de GABA en neuronas de ratón y rata los animales fueron perfundidos con GA al 5% pero sin utilizar PFA (18). Otros autores obtuvieron buenos resultados con la fórmula PFA al 4% y GA% al 0,25% en la corteza embrionaria o neonatal de ratones (45). Inexplicablemente y tal vez por diferencias en las especies, la combinación PFA al 0.5% y GA al 2,5% que provocó amarillamiento en el tejido y pérdida total de la inmunorreactividad a GABA en nuestro estudio con ratones ha dado excelentes resultados en experimentos con otros roedores (40,46).
En conclusión, para tener éxito en la inmuno-histoquímica de GABA es importante incluir glutaraldehído como parte del fijador. Cada experimentador debe establecer su propia combinación de fijadores, no existe una fórmula única para todos los casos.
Distribución y características de neuronas positivas para GABA en la corteza
La distribución dispersa y aparentemente uniforme de las neuronas GABAérgicas observada en la corteza cerebral de ratón y la mayor concentración de ellas demostrada cuantitativamente hacia las capas supragranulares coincide, en gran parte, con la información publicada en estudios similares realizados en ratón (18,45,48), rata (18,38,39,46) y otros mamíferos (41-43,49).
Quizá la diferencia más importante en los resultados de este trabajo es que la mayor concentración de células positivas para GABA se evidenció en las capas I y II. Los pocos trabajos que se han hecho con esta especie, en condiciones experimentales diferentes, no aportan un patrón de comparación adecuado. En ratones muy jóvenes se halló más concentración de neuronas positivas para GABA en las capas II y III (45), mientras que la mayor densidad de neuronas positivas para GAD en ratones adultos se encontró en las capas III y VI (48). En otras especies también se ha encontrado mayor densidad en las capas II y III (42,43,49) mientras que algunos autores reportan distribución uniforme en todas las capas (38,41).
El tamaño y la morfología de las células positivas para GABA observado por nosotros en la corteza de ratón coincide con los datos hallados por otros autores en neuronas GABAérgicas de ratón (45,48), rata (38,39) y otras especies (40-43,49). Por otra parte, es posible que algunas células gliales, especialmente astrocitos, sean inmunorreac-tivas a GABA (38), puesto que parte del ciclo catabólico del GABA se lleva a cabo en ellas (12,13). No obstante, el contenido de GABA en células gliales del cerebro en el adulto se considera insignificante comparado con la concentración del neurotransmisor en neuronas GABAérgicas (11,50). De hecho, en la mayoría de artículos sobre inmunohistoquímica de GABA, citados en el presente trabajo, los autores omiten referirse a las células gliales como inmunorreactivas a GABA.
Efecto de la infección sobre las neuronas GABAégicas corticales
En el material de animales infectados no se observó alteración del patrón de distribución descrito para los controles. Quizá por esta razón, aunque hubo pérdida en el número de neuronas inmunorreactivas a GABA en la corteza en general, ésta no fue perceptible a simple vista. El estudio cuantitativo reveló que la disminución en el número de neuronas positivas para GABA fue estadística-mente significativa en la mayoría de las capas, excepto en las más inferiores.
Por otra parte, el valor promedio del área de las células positivas para GABA fue significativamente mayor en el material infectado. Esto coincide con la observación cualitativa que revela menor cantidad de células pequeñas en estas muestras. Además el rango del área de las células positivas para GABA fue similar en controles e infectados, especialmente en las de mayor tamaño. Por lo tanto, la infección parece afectar selectivamente la expresión de GABA en interneuronas de menor tamaño. La pérdida de células inmunorreactivas a un marcador, en este caso de GABA, plantea dos posibilidades: muerte neuronal o sólo pérdida de expresión del neurotransmisor. Se requiere investigación posterior de las neuronas implicadas con métodos citomorfológicos, citoquímicos, bioquímicos y electrofisiológicos para hallar la respuesta.
Con estos resultados tampoco se puede establecer una relación directa entre la pérdida de inmunorreactividad a calbindina en la corteza de ratones infectados con rabia, previamente reportada (27,28), y la pérdida de expresión de GABA, pues los dos marcadores presentan una distribución diferente. En trabajos futuros sería importante estudiar la colocalización de GABA, con marcadores más específicos de interneuronas corticales tales como las proteínas de enlace del calcio con el propósito de identificar los tipos de células en donde se pierde la expresión de GABA por efecto de la rabia.
Susceptibilidad del sistema GABAérgico a la rabia y otras infecciones virales
Los resultados de este trabajo contribuyen a reforzar la hipótesis sobre la participación del GABA en la fisiopatología de la rabia. En el hombre y otros huéspedes naturales esta enfermedad se caracteriza por presentar episodios con trastornos emocionales, fases alternadas de hiperexcitación y relajación, así como comportamiento agresivo y convulsiones generalizadas.
Según algunos investigadores estos signos clínicos hacen pensar que la rabia afecta al sistema GABAérgico (20,21). En un experimento con animales (22) y otro en cultivos celulares (21) se demostró efecto de la infección con virus de la rabia sobre la neurotransmisión GABAérgica. Igualmente por métodos de extracción se encontró disminución significativa en el contenido de GAD y GABA en la corteza y el estriado de ratones inoculados con el virus de la encefalitis equina venezolana (23). Un experimento similar en ratas confirmó la pérdida de GABA en el estriado (24). Es importante anotar que la infección con este virus no afectó el contenido intracerebral de la glutamato deshidrogenada (GDH) (EC 1.4.1.3) pero sí produjo disminución de GAD, una enzima que se halla exclusivamente en neuronas. Probable-mente, la infección afecta selectivamente a estas últimas (23).
En experimentos con otros virus neurotrópicos menos conocidos también se ha demostrado la susceptibilidad de las neuronas GABAérgicas a las infecciones virales. El virus Semliki Forest inoculado en ratones provocó aumento en la síntesis de GAD (25) mientras que el virus de la coriomeningitis linfocítica produjo pérdida de neuronas positivas para GABA en el giro dentado de ratas (26).
En conclusión, las neuronas GABAérgicas parecen ser muy vulnerables a los virus neurotrópicos y los resultados de nuestro trabajo aportan evidencia adicional en ese sentido. Hemos mostrado una disminución de número de células reactivas con el anticuerpo anti-GABA asociada con la infección con el virus de la rabia en ratones ICR hembras en estado terminal de la enfermedad.
En trabajos posteriores se debe profundizar en el tema para establecer si la pérdida de GABA se inicia en etapas tempranas de la infección, en qué tipo de neuronas ocurre dentro y fuera de la corteza y, en particular, cómo se afecta la síntesis de glutamato, el principal neurotransmisor excitador del sistema nervioso y que hace parte del mismo ciclo bioquímico del GABA.
Agradecimientos
A Colciencias y al Instituto Nacional de Salud por el apoyo económico y logístico. A Jaime Castellanos del Instituto de Virología de la Universidad El Bosque por su colaboración para llevar a cabo la titulación del virus.
Conflicto de intereses
Ninguno
Financiación
Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología Francisco José de Caldas, Colciencias y el Instituto Nacional de Salud, INS, proyecto código 2104-04-18104. Además la participación de uno de los autores en el trabajo (ACR), se realizó en el marco del programa Jóvenes Investigadores e Innovadores auspiciado por Colciencias y el INS. Convenio 046/2005.
Correspondencia:
Orlando Torres-Fernández, Laboratorio de Microscopía, Instituto Nacional de Salud, avenida calle 26 No. 51-60 otorresf@ins.gov.co
Referencias
1. Jackson AC. Rabies: new insights into pathogenesis and treatment. Curr Opin Neurol. 2006;19:267-70. [ Links ]
2. Dietzschold B, Schnell M, Koprowski H. Pathogenesis of rabies. Curr Top Microbiol Immunol. 2005;292:45-56. [ Links ]
3. Schneider MC, Belotto A, Adé MP, Leanes LF, Correa E, Tamayo H, et al. Epidemiologic situation of human rabies in Latin America in 2004. Epidemiol Bull. 2005;26:2-4. [ Links ]
4. Valderrama J, García I, Figueroa G, Rico E, Sanabria J, Rocha N, et al. Brotes de rabia humana transmitida por vampiros en los municipios de Bajo y Alto Baudó, departamento del Chocó, Colombia 2004-2005. Biomédica. 2006;26:387-96. [ Links ]
5. Dulce A, Goenaga N. Dos casos de encefalitis rábica en el distrito de Santa Marta, departamento de Magdalena. Inf Quinc Epidemiol Nac. 2007;12:17-28. [ Links ]
6. Briggs DJ, Dreesen DW, Wunner WH. Vaccines. En: Jackson AC, Wunner WH, editores. Rabies. San Diego: Academic Press; 2002. p.371-400. [ Links ]
7. Fu ZF, Jackson AC. Neuronal dysfunction and death in rabies virus infection. J Neurovirol. 2005;11:101-6. [ Links ]
8. Kristensson K, Dastur DK, Manghani DK, Tsiang H, Bentivoglio M. Rabies: interactions between neurons and viruses. A review of Negri inclusion bodies. Neuropathol Appl Neurobiol. 1996;22:179-87. [ Links ]
9. Jones EG. GABAergic neurons and their role in cortical plasticity in primates. Cereb Cortex. 1993;3:361-72. [ Links ]
10. DeFelipe J. Cortical interneurons: from Cajal to 2001. Prog Brain Res. 2002;136:216-38. [ Links ]
11. Petroff OA. GABA and glutamate in the human brain. Neuroscientist. 2002;8:562-73. [ Links ]
12. Bak LK, Schousboe A, Waagepetersen HS. The Glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer. J Neurochem. 2006;98:641-53. [ Links ]
13. Olsen RW, DeLorey TM. GABA and glycine. En: Siegel GJ, Agranoff BW, Albers RW, Fisher SK, Uhler MD, editores. Basic neurochemistry. Molecular, cellular and medical aspects. Philadelphia: Lippincott Williams & Wilkins; 1999. p.363-82. [ Links ]
14. Feldman ML. Morphology of the neocortical pyramidal neuron. En: Peters A, Jones EG, editores. Cerebral cortex. Cellular components of the cerebral cortex. Vol. 1. New York: Plenum Press; 1984. p.123-200. [ Links ]
15. Fairén A, Smith-Fernández A, DeDiego I. Organización sináptica de neuronas morfológicamente identificadas: el método de Golgi en microscopía electrónica. En: Armengol JA, Miñano FJ, editores. Bases experimentales para el estudio del sistema nervioso. Sevilla: Secretariado de Publicaciones de la Universidad de Sevilla; 1996. p.17-56. [ Links ]
16. Andressen C, Blümcke I, Celio MR. Calcium-binding proteins: selective markers of nerve cells. Cell Tissue Res. 1993;271:181-208. [ Links ]
17. Storm-Mathisen J, Bore AT, Vaaland JL, Edminson P, Haug FM, Ottersen OP. First visualization of glutamate and GABA in neurones by immunocytochemistry. Nature. 1983;301:517-20. [ Links ]
18. Ottersen OP, Storm-Mathisen J. Glutamate- and GABA-containing neurons in the mouse and rat brain, as demonstrated with a new immunocytochemical technique. J Comp Neurol. 1984;229:374-92. [ Links ]
19. Spreafico R, De Biasi S, Frassoni C, Battaglia G. A comparison of GAD- and GABA-immunoreactive neurons in the first somatosensory area (SI) of the rat cortex. Brain Res. 1988;474:192-6. [ Links ]
20. Isaacson RL. The neural and behavioural mechanism of aggression and their alteration by rabies and other viral infections. En: Thraenhart O, Koprowski H, Bogel HK, Sureau P, editores. Progress in rabies control. Rochester: Wells Medical; 1989. p.17-23. [ Links ]
21. Ladogana A, Bouzamondo E, Pocchiari M, Tsiang H. Modification of tritiated gamma amino-butyric acid transport in rabies virus-infected primary cortical cultures. J Gen Virol. 1994;75:623-7. [ Links ]
22. Khizhniakova TM, Promyslov MS, Gorshunova LP. The influence of rabies immunization of gamma-aminobutyric acid metabolism in the brains of animals. Biull Eksp Biol Med. 1976;81:184-5. [ Links ]
23. Bonilla E, Ryder E, Ryder S. GABA metabolism in Venezuelan equine encephalomyelitis virus infection. Neurochem Res. 1980;5:209-15. [ Links ]
24. Bonilla E, Prasad AL, Estévez J, Hernández H, Arrieta A. Changes in serum and striatal free amino acids after Venezuelan equine encephalomyelitis virus infection. Exp Neurol. 1988;99:647-54. [ Links ]
25. Barrett AD, Cross AJ, Crow TJ, Johnson JA, Guest AR, Dimmock NJ. Subclinical infections in mice resulting from the modulation of a lethal dose of Semliki Forest virus with defective interfering viruses: neurochemical abnormalities in the central nervous system. J Gen Virol. 1986;67:1727-32. [ Links ]
26. Pearce BD, Steffensen SC, Paoletti AD, Henriksen SJ, Buchmeier MJ. Persistent dentate granule cell hyperexcitability after neonatal infection with lymphocytic choriomeningitis virus. J Neurosci. 1996;16:220-8. [ Links ]
27.Torres-Fernández O, Yepes GE, Gómez JE, Pimienta HJ. Efecto de la infección por el virus de la rabia sobre la expresión de parvoalbúmina, calbindina y calretinina en la corteza cerebral de ratones. Biomédica. 2004;24:63-78. [ Links ]
28. Torres-Fernández O, Yepes GE, Gómez JE, Pimienta HJ. Calbindin distribution in cortical and subcortical brain structures of normal an rabies-infected mice. Int J Neurosci. 2005;115:1375-82. [ Links ]
29. DeFelipe J. Types of neurons, synaptic connections and chemical characteristics of cells immunoreactive for calbindin-D28K, parvalbumin and calretinin in the neocortex. J Chem Neuroanat. 1997;14:1-19. [ Links ]
30. Pickel VM, Heras A. Ultrastructural localization of calbindin-D28k and GABA in the matrix compartment of the rat caudate-putamen nuclei. Neuroscience. 1996;71:167-78. [ Links ]
31. Prensa L, Giménez-Amaya JM, Parent A. Morphological features of neurons containing calcium-binding proteins in the human striatum. J Comp Neurol. 1998;390:552-63. [ Links ]
32. Amadeo A, De Biasi S, Frassoni C, Ortino B, Spreafico R. Immunocytochemical and ultrastructural study of the rat perireticular thalamic nucleus during post-natal development. J Comp Neurol. 1998;392:390-401. [ Links ]
33. Sarmiento L, Rodríguez G, de Serna C, Boshell J, Orozco LC. Detection of rabies virus antigens in tissue: immunoenzymatic method. Patologia. 1999;37:7-10. [ Links ]
34. Leuba G, Kraftsik R, Saini K. Quantitative distribution of parvalbumin, calretinin and calbindin D-28K immunoreactive neurons in the visual cortex of normal and Alzheimer cases. Exp Neurol. 1998;152:278-91. [ Links ]
35. Valverde F. Golgi atlas of the postnatal mouse brain. Viena: Springer-Verlag; 1998.p.48-51. [ Links ]
36. Schefler WC. Bioestadística. México: Fondo Educativo Interamericano; 1981. p.218-21. [ Links ]
37. Hockfield S, Carlson S, Evans C, Levitt P, Pintar J, Silberstein L. Selected methods for antibody and nucleic acid probes. New York: Cold Spring Harbor Laboratory Press; 1993. p.111-226. [ Links ]
38. Meinecke DL, Peters A. GABA immunoreactive neurons in rat visual cortex. J Comp Neurol. 1987;261:388-404. [ Links ]
39. Ren JQ, Aika Y, Heizmann CW, Kosaka T. Quantitative analysis of neurons and glial cells in the rat somatosensory cortex, with special reference to GABAergic neurons and parvalbumin-containing neurons. Exp Brain Res. 1992;92:1-14. [ Links ]
40. Frassoni C, Radici C, Spreafico R, Curtis M. Calcium-binding protein immunoreactivity in the piriform cortex of the Guinea-Pig: selective staining of subsets of non-gabaergic neurons by calretinin. Neuroscience. 1998;83:229-37. [ Links ]
41. Gao WJ, Newman DE, Wormington AB, Pallas SL. Development of inhibitory circuitry in visual and auditory cortex of postnatal ferrets: immunocytochemical localization of GABAergic neurons. J Comp Neurol. 1999;409:261-73. [ Links ]
42. Hendry SH, Schwark HD, Jones EG, Yan J. Numbers and proportions of GABA-immunoreactive neurons in different areas of monkey cerebral cortex. J Neurosci 1987;7:1503-19. [ Links ]
43. Kisvárday ZF, Gulyas A, Beroukas D, North JB, Chubb IW, Somogyi P. Synapses, axonal and dendritic patterns of GABA-immunoreactive neurons in human cerebral cortex. Brain 1990;113:793-812. [ Links ]
44. del Río MR, DeFelipe J. Colocalization of calbindin D-28k, calretinin, and GABA immunoreactivities in neurons of the human temporal cortex. J Comp Neurol. 1996;369:472-82. [ Links ]
45. del Río JA, Soriano E, Ferrer I. Development of GABA-immunoreactivity in the neocortex of the mouse. J Comp Neurol. 1992;326:501-26. [ Links ]
46. Esclapez M, Campistron G, Trottier S. Immunocytochemical localization and morphology of GABA-containing neurons in the prefrontal and frontoparietal cortex of the rat. Neurosci Lett. 1987;77:131-6. [ Links ]
47. Somogyi P, Hodgson AJ, Chubb JW, Penke B, Erdei A. Antisera to gamma-aminobutyric acid. II. Immunocytochemical application to the central nervous system. J Histochem Cytochem. 1985;33:240-8. [ Links ]
48. Solberg Y, White EL, Keller A. Types and distribution of glutamic acid-decarboxylase (GAD)-immunoreactive neurons in mouse motor cortex. Brain Res. 1988;459:168-72. [ Links ]
49. Escobar MI, Palomino JC, Arévalo M, Pimienta HJ. Dorsolateral prefrontal cortex of the owl monkey: a qualitative and quantitative Nissl and GABA immnuno-staining study. Alzheimer Dis Rev. 1998;3:57-62. [ Links ]
50.Martin DL, Rimvall K. Regulation of ã-Aminobutyric acid synthesis in the brain. J Neurochem. 1993;60: 395-407. [ Links ]