INTRODUCCIÓN
La bacteria Vibrio cholerae habita naturalmente en aguas marinas y estuarinas (Colwell et al., 1977; Vezzulli et al., 2020) y es el agente causante del cólera, una enfermedad diarreica aguda, que puede producir la muerte por deshidratación, si no se trata a tiempo. Luego de siete pandemias en diferentes países del mundo, el riesgo de nuevos brotes de cólera permanece latente, siendo las zonas costeras tropicales de América Latina áreas particularmente vulnerables (Escobar et al., 2015). Las poblaciones costeras que viven en condiciones precarias de abastecimiento de agua potable y saneamiento básico y que derivan su sustento de la pesca son las más amenazadas, ya que V. cholerae se transmite por la ingestión de agua o alimentos contaminados, como peces y mariscos mal cocidos (World Health Organization [WHO], 2018). En la Ciénaga Grande de Santa Marta (CGSM) la vida de los habitantes está estrechamente ligada al agua, siendo la pesca su principal actividad económica y de subsistencia; sin embargo, sus necesidades básicas insatisfechas son de las más altas de la región (Vilardy y González, 2011).
Las aguas costeras juegan un papel fundamental en la persistencia, diseminación y transmisión de esta bacteria patógena a los humanos (Vezzulli et al., 2010), y por ello es necesario su vigilancia y monitoreo, como parte de la estrategia para prevenir y controlar nuevos brotes de la enfermedad. Además, para identificar las áreas vulnerables y las poblaciones en riesgo, es clave determinar las condiciones ecológicas del agua que promueven la persistencia y crecimiento de V. cholerae, y de este modo, desarrollar sistemas de alerta temprana (WHO, 2005).
Aunque el nicho ecológico de V. cholerae abarca un amplio rango de condiciones ambientales (Lipp et al., 2002), su presencia y proliferación se ha asociado a factores ambientales como la temperatura superficial del agua, pH y salinidad (Lobitz et al., 2000; Louis et al., 2003; Huq et al., 2005; Kopprio et al., 2017). Además, variables biológicas como el fitoplancton y el zooplancton constituyen reservorios importantes de V. cholerae, ya que esta bacteria puede formar biopelículas en la superficie de estos organismos (Colwell, 1996; Vezzulli et al., 2010; Neogi et al., 2012). De este modo, variables abióticas y bióticas pueden servir como factores indicadores para predecir la distribución temporal y espacial de nuevos brotes de cólera (Jutla et al., 2010).
La detección de V. cholerae aumenta con la temperatura del agua (Lipp et al., 2002); de hecho, los brotes de cólera se correlacionan fuertemente con los aumentos en la temperatura superficial del agua en épocas de verano, particularmente en zonas costeras templadas (Colwell, 1996; Pascual et al., 2000; Gavilán y Martínez-Urtaza, 2011; Xu et al., 2014). Sin embargo, en los ecosistemas estuarinos tropicales, donde la variación de temperatura es relativamente moderada, son los periodos de lluvias y sequías los que definen los patrones estacionales. Así, la salinidad puede variar ampliamente, disminuyendo en época de lluvias por la mayor entrada de agua dulce de los ríos, e incrementándose en época seca por las altas tasas de evaporación solar (Roldán y Ramírez, 2008). En consecuencia, en los estuarios tropicales la detección de especies de Vibrio puede estar siendo controlada más por la salinidad que por la temperatura (Lipp et al., 2001). De este modo, el efecto de los factores ambientales sobre la ocurrencia y distribución de V. cholerae puede ser específico para cada región.
En Colombia la ecología de V. cholerae en ecosistemas acuáticos ha sido un tema poco abordado; los estudios realizados se han enfocado en la evaluación de aguas de lastre descargadas por buques que ingresan al país, en las cuales se ha registrado la presencia de V. cholerae (Rodríguez Cuitiva, 2011). Otros estudios se han centrado en el aislamiento e identificación de especies de Vibrio a partir de organismos marinos. López et al. (2010) aislaron especies de Vibrio a partir de ostras recolectadas en la Ciénaga de la Virgen, una laguna costera ubicada al norte de la ciudad de Cartagena de Indias, identificando las especies V. alginolyticus, V. fluvialis, V. parahaemolyticus, V. carchariae, V. mimicus, V. vulnificus, V. cincimatiensis y V. campbelli, pero no V. cholerae.
El presente estudio determinó la variabilidad espacial y temporal de V. cholerae en la CGSM durante tres años (2016 a 2018), con el propósito de evaluar la influencia de la temperatura del agua y la salinidad como factores ambientales que inciden en la ocurrencia y distribución de esta bacteria en un estuario tropical.
MATERIALES Y MÉTODOS
Área de estudio
La CGSM es el complejo lagunar más extenso e importante de Colombia. Cuenta con un área aproximada de 1321,6 km2, conformada por la parte principal del plano deltáico del río Magdalena, la Isla de Salamanca, el complejo de ciénagas de Pajarales y la laguna principal (Gónima et al., 1998). Tiene una gran importancia socioeconómica debido a que provee servicios ecosistémicos para la seguridad alimentaria y la calidad de vida de las poblaciones autóctonas y aledañas (Vilardy y González, 2011; Zamora Bornachera et al., 2016; INVEMAR, 2019).
Medición de variables ambientales y recolección de muestras
Se midieron in situ la temperatura y salinidad del agua y se recolectaron muestras de agua superficial bimestralmente (enero, marzo, mayo, julio, septiembre y noviembre) durante los años 2016, 2017 y 2018, en once estaciones del complejo lagunar CGSM, para un total de 18 muestras por estación, es decir, una muestra por mes, por año en cada estación (Fig. 1).
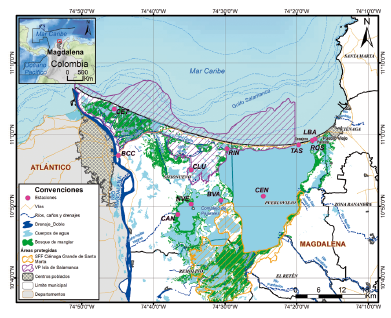
Figura 1 Área de estudio y ubicación de las estaciones de muestreo en la Ciénaga Grande de Santa Marta, Caribe colombiano
La temperatura y la salinidad se midieron en el agua superficial usando sondas portátiles calibradas, siguiendo los métodos de referencia SM-2550B y SM-2520B, respectivamente (Baird et al., 2017). Las muestras de agua fueron recolectadas en recipientes de polipropileno estériles de 500 mL y transportadas en neveras plásticas con hielo a la Unidad de Laboratorios de Calidad Ambiental Marina (LABCAM) del Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis"-INVEMAR, para el aislamiento y cuantificación de V. cholerae.
AISLAMIENTO, IDENTIFICACIÓN Y CUANTIFICACIÓN DE VIBRIO CHOLERAE
Las muestras se pasaron por filtros estériles Advantec de nitrocelulosa de 0,45 µm de poro, utilizando volúmenes entre 0,1 y 50 mL. Los filtros fueron transferidos a placas de agar tiosulfato citrato bilis sacarosa (TCBS) marca Oxoid. Éstas se incubaron a 35 ± 0,5 °C durante 18 ± 4 horas. Posteriormente, se seleccionaron las colonias presuntivas de Vibrio spp. (amarillas y verdes) y se realizó el recuento de unidades formadoras de colonia (UFC) de cada morfotipo (Nigro et al., 2011).
La identificación se realizó mediante diferentes pruebas de acuerdo con lo descrito por Baird et al. (2017), sembrando una colonia de cada morfotipo en agar TCBS, para obtener colonias aisladas y puras. Éstas últimas se repicaron en agar nutritivo con cloruro de sodio al 1 % y se incubaron a 35 ± 0,5 °C durante 18 ± 4 horas. Las colonias que crecieron fueron sometidas a la prueba de oxidasa, utilizando tiras Bactident oxidasa marca Merck. A partir de las cepas oxidasa positivas se identificó V. cholerae aplicando la batería de pruebas bioquímicas API 20E de Biomeriux, siguiendo las instrucciones del fabricante.
Análisis de datos
Para representar la ocurrencia de V. cholerae se usó la frecuencia relativa de detección, expresada como un dato de porcentaje. Para ello, se dividió el número de muestras en las cuales se detectó la bacteria (casos positivos) sobre el número total de muestras analizadas de interés (periodo, mes, estación), y se multiplicó por 100. Los valores de densidad promedio de V. cholerae se reportan como media geométrica.
Se realizaron análisis de varianza (ANOVA) a una vía para determinar si existían diferencias interanuales (entre años), estacionales (entre meses) o espaciales (entre estaciones) de temperatura, salinidad y densidad de V. cholerae. Cuando se presentaron diferencias, se realizó la prueba post hoc de la diferencia mínima significativa (DMS). Para ambas pruebas (ANOVA y DMS) se usó un nivel de significancia de 0,05.
Teniendo en cuenta la ocurrencia del evento El Niño 20152016 (National Oceanic and Atmospheric Administration [NOAA], 2020) y la marcada influencia que éste presentó sobre la salinidad en la CGSM, además de analizar y presentar valores promedio de salinidad y densidad de V. cholerae a partir de los tres años de estudio, se evaluó de manera independiente el periodo 2017-2018, al considerarse que este último refleja el comportamiento de las variables en años climáticamente "típicos".
Se realizó un análisis de regresión lineal para determinar la asociación entre la densidad de V. cholerae y las variables ambientales temperatura y salinidad. En este análisis sólo se incluyeron las muestras con valores de salinidad superiores a 0,1, con el fin de mostrar cómo es el comportamiento de V. cholerae en el rango de salinidad en el que se presentó la mayor frecuencia de detección y las concentraciones más altas; adicionalmente se calcularon los coeficientes de correlación de Spearman para evaluar el tipo de asociación presentada entre las variables. Los datos de densidad de V. cholerae fueron transformados aplicando logaritmo en base 10 tanto para la regresión lineal como para los ANOVAS. Los análisis se realizaron con el programa R.
RESULTADOS
Variables ambientales
La temperatura promedio del agua superficial de la CGSM durante el periodo de estudio presentó menor variación que la salinidad, con valores promedio entre 27,7 °C ± 1,4 y 33,5 °C ± 2,6 (Fig. 2a). Si bien no hubo diferencias estadísticamente significativas entre años (p = 0,35), sí las hubo entre meses (p < 0,01) para los tres años, hallándose una temperatura promedio menor en enero (29,5 °C ± 1,5) y marzo (29,2 °C ± 2,0), y mayor en julio (32,1 °C ± 2,2) y septiembre (31,8 °C ± 2,0) (Fig. 2b).
También se evidenciaron diferencias significativas entre estaciones (p < 0,01), siendo la temperatura promedio más baja en LBA (29,0 °C ± 1,4), CET (29,1 °C ± 1,4 y ROS (29,4 °C ± 1,6), y más alta en BVA (31,9 °C ± 1,6), CLU (32,0 °C ± 1,9) y NVE (32,5 °C ± 2,5) (Fig. 2c).
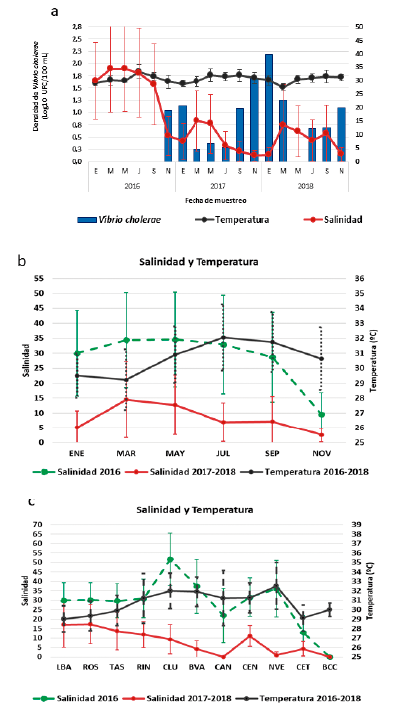
Figura 2 a) Variación temporal y espacial de la temperatura promedio, salinidad promedio y densidad media geométrica de Vibrio cholerae en el agua superficial de la CGSM, entre los años 2016 y 2018; barras de error = desviación estándar. b) Patrón temporal de las variables ambientales en la CGSM: salinidad promedio y temperatura promedio. c) Patrón espacial de las variables ambientales en la CGSM para cada estación de muestreo n = 11: salinidad promedio y temperatura promedio; barras de error = desviación estándar.
A diferencia de la temperatura, la salinidad varió ampliamente, registrándose valores promedio entre 2,2 ± 2,0 y 34,6 ± 15,8. Entre enero y septiembre de 2016, la salinidad promedio se mantuvo elevada (> 28,7), presentando un drástico descenso en noviembre del mismo año (9,6 ± 7,2) y enero de 2017 (7,6 ± 6,7). Entre enero de 2017 y noviembre de 2018, la salinidad promedio se mantuvo por debajo de 15,5, registrándose el 50 % de los meses por debajo de 8 (Fig. 2a).
La salinidad promedio en el año 2016 (28,4 ± 9,5) fue significativamente superior a la registrada en 2017 (8,18 ± 8,63) y 2018 (8,17 ± 9,59) (p < 0,01) (Fig. 2 b y c).
Considerando sólo los años climáticamente "típicos" (2017 y 2018), la salinidad promedio fue más baja en noviembre (2,5 ± 2,3) y enero (5,2 ± 5,5), y más alta en marzo (14,5 ± 12,8) y mayo (12,7 ± 10,1), evidenciándose diferencias significativas entre meses (p < 0,01) (Fig. 2b). Así mismo, las medidas de salinidad promedio más bajas se observaron en las estaciones BCC (0,01 ± 0,03), CAN (0,03 ± 0,09) y NVE (0,9 ± 1,7), y las más altas en LBA (17,2 ± 12,1) y ROS (17,4 ± 10,3); hallándose diferencias significativas entre estaciones (p < 0,01) (Fig. 2c). Al incluir el año 2016 en el análisis, se evidencian diferencias significativas entre meses (p < 0,01); los valores mensuales de salinidad promedio aumentaron casi el doble, presentándose el más bajo en noviembre (4,9 ± 5,49), y los más altos en marzo (21,1 ± 16,6) y mayo (20,0 ± 15,9). Igualmente, al incluir en el análisis el año 2016 se observa que las medidas de salinidad promedio incrementaron notablemente, a excepción de BCC, y son significativamente diferentes entre estaciones (p < 0,01); la salinidad más baja se registró en BCC (0,01 ± 0,02), CET (7,2 ± 7,07) y CAN (7,4 ± 13,2), y la más alta en LBA (21,4 ± 12,5), ROS (21,6 ± 11,5) y CLU (23,5 ± 22,7).
Variabilidad temporal de Vibrio cholerae
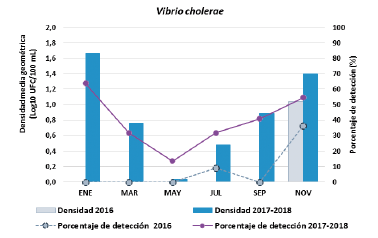
La densidad promedio de V. cholerae varió significativamente durante el periodo de estudio (p < 0,01). Entre enero y septiembre de 2016, V. cholerae se detectó en tan sólo el 0,02 % de las muestras (n = 55), en noviembre, se evidenció un rápido aumento en su frecuencia de detección y densidad promedio (36,4 %; 10,9 UFC/100 mL); entre enero de 2017 y noviembre de 2018, V. cholerae continuó siendo detectada en la CGSM, alcanzando su pico de ocurrencia y densidad promedio en noviembre de 2017 (63,6 %; 50,6 UFC/100 mL) y enero de 2018 (81,8 %; 154,6 UFC/100 mL) (Fig. 2a).
En 2016, la densidad promedio de V. cholerae (0,87 UFC/100 mL) fue significativamente menor que en 2017 (6,44 UFC/100 mL) y 2018 (8,66 UFC/100 mL) (p < 0,01). Excluyendo al año atípico (2016) del análisis, los meses que presentaron la mayor ocurrencia y densidad promedio de V. cholerae fueron enero (63,6 %; 46,53 UFC/100 mL) y noviembre (54,5 %; 25,32 UFC/100 mL), mientras que los valores más bajos se observaron en mayo (13,6 %; 1,09 UFC/100 mL) y julio (31,8 %; 3.04 UFC/100 mL) (Fig. 3).
Incluyendo el 2016, se mantuvo el mismo patrón estacional, pero en todos los meses disminuyeron considerablemente los valores de ocurrencia y densidad promedio de la bacteria; nuevamente, los más altos se observaron en enero (42,4 %; 10,27 UFC/100 mL) y noviembre (48,5 %; 19,14 UFC/100 mL), y los más bajos en mayo (9,1 %; 0,84 UFC/100 mL) y julio (24,2 %; 1,79 UFC/100 mL). En ambos análisis se evidenciaron diferencias significativas entre meses (p > 0,01).
Variabilidad espacial de Vibrio cholerae
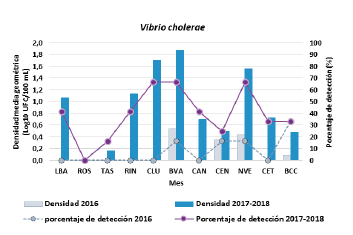
La densidad promedio de V. cholerae mostró una variación significativa en las distintas estaciones de muestreo (p < 0,01) (Fig. 4). La mayor densidad registrada en una muestra individual fue 54 800 UFC/100 mL, registrada de la estación BVA en noviembre de 2016; por el contrario, la bacteria no fue detectada en la estación ROS en ninguna de las muestras (n = 18).
Durante el periodo 2017-2018, las estaciones BVA (74,6 UFC/100 mL), CLU (50,0 UFC/100 mL) y NVE (36,8 UFC/100 mL) mostraron las mayores densidades promedio de V. cholerae en la CGSM, presentando además, el mayor porcentaje de muestras positivas para la bacteria (cada una 66,7 %; n = 12) (Fig. 4). Incluyendo el año 2016 en el análisis, las mayores densidades promedio se presentaron en las estaciones BVA (26,8 UFC/100 mL) y NVE (15,4 UFC/100), nuevamente, detectándose la bacteria en el 50 % de las muestras provenientes de ambos sitios; sin embargo, los valores absolutos de densidad promedio son notoriamente inferiores a los obtenidos cuando se consideran únicamente los años "típicos".
El papel de las variables ambientales en la distribución de Vibrio cholerae
V. cholerae no estuvo limitada por la temperatura del agua superficial de la CGSM, ya que se detectó en todo el rango de temperaturas registradas durante el periodo de estudio y aunque la densidad de V. cholerae presentó una correlación positiva con la temperatura del agua (r = 0,09), esta fue débil (Fig. 2a).
Por el contrario, su presencia en el agua sí estuvo controlada fuertemente por la salinidad (Fig. 2a). La bacteria estuvo prácticamente ausente (0,01 %) durante los meses con alta salinidad (> 28; enero - septiembre de 2016; (Fig. 3), observándose un aumentó en su ocurrencia y densidad al disminuir la salinidad; de hecho, las mayores densidades de este microorganismo se presentaron en los meses con menor salinidad (noviembre 2017-enero 2018) (Fig. 2a).
En la Figura 5a se muestra la densidad media geométrica y el porcentaje de detección de V. cholerae, en relación con 5 rangos de salinidad. En salinidades superiores a 15 (muestras positivas: 1,8 %), la bacteria estuvo prácticamente ausente, a pesar de que este rango de salinidad contiene el 37,4 % de las muestras. En contraste, la presencia de V. cholerae aumentó progresivamente en salinidades inferiores a 15, alcanzando el pico de detección y densidad promedio en muestras con salinidades entre 0,1 y 5 (65,7 %; 61,4 UFC/100 mL) (Fig. 5a). El análisis de regresión lineal mostró una correlación negativa entre el logaritmo base 10 de la densidad de V. cholerae y la raíz cuadrada de la salinidad (r = - 0,55) (Fig. 5b).
DISCUSIÓN
La ocurrencia y distribución de V. cholerae en la Ciénaga Grande de Santa Marta, estuvieron influenciados por la salinidad, que varió ampliamente durante el tiempo de estudio, debido a la naturaleza estuarina y semicerrada de este cuerpo de agua (Roldán y Ramírez, 2008). Los cambios en la salinidad presentados en la CGSM se generan por la mezcla de agua dulce aportada por el Río Magdalena y los afluentes de la Sierra Nevada de Santa Marta y las aguas marinas que ingresan continuamente a través de la Boca de La Barra (Wiedemann, 1973; INVEMAR, 2019).
Particularmente en el periodo estudiado se evidenció un cambio considerable de la salinidad, debido a que desde el año 2015 hasta los primeros meses del 2016 se presentó el evento climático El Niño, descrito como uno de los más intensos de la historia (NOAA, 2020). Este evento produjo la disminución drástica del caudal de los ríos que descargan agua dulce al sistema, ocasionando aumentos en la salinidad. A partir del mes de septiembre de 2016, iniciaron las lluvias, dando lugar a un descenso en la salinidad en todo el cuerpo lagunar (INVEMAR, 2017; Fig. 2a). Estos cambios climáticos mostraron una influencia marcada en el comportamiento de V. cholerae, ya que, al ingresar mayor cantidad de agua dulce al sistema, se generan condiciones que favorecen la proliferación de esta bacteria, detectándose con mayor frecuencia en muestras con salinidades entre valores de 0,1 y 10 (Fig. 5a).
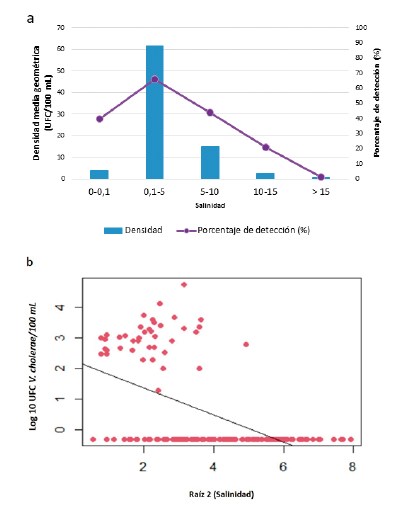
Figura 5 Presencia y abundancia de V. cholerae en respuesta a la salinidad. a) Detección y promedio geométrico de V. cholerae en distintos rangos de salinidad. b) Análisis de regresión lineal simple del logarítmico en base 10 de la concentración de V. cholerae en función de la raíz cuadrada de la salinidad, incluyendo sólo las muestras con salinidad mayor a 0,1 (r = -0,55).
Se han descrito diferentes rangos de salinidad considerados óptimos para el crecimiento de V. cholerae, entre los cuales se encuentran 15 y 25 (Borroto, 1998; Thomas et al., 2006) y cinco y 25 (Lipp et al., 2002). Sin embargo, en la CGSM la detección de V. cholerae fue muy baja en las muestras que registraron salinidades por encima de 15 (0,01 %; Fig. 5a). Este hallazgo coincide con lo descrito por Esteves et al. (2015), quienes evaluaron los cambios en las concentraciones de V. cholerae en un sistema de lagunas ubicadas en la costa francesa mediterránea, las cuales reciben aportes de agua de mar y agua dulce según las temporadas climáticas. Los autores encontraron que las mayores densidades de V. cholerae se registraron en salinidades entre cinco y 12, mientras que en salinidades mayores a 20 la concentración decaía drásticamente. Otro estudio realizado en la bahía Chesapeake (EE. UU.) sobre la cual desembocan varios ríos, mostró que la frecuencia de detección de V. cholerae fue menor en las muestras con salinidad superior a 14 (Louis et al., 2003). Cabe resaltar que además de la salinidad existen otros factores que influyen en la presencia de V. cholerae como son las concentraciones de nutrientes y la materia orgánica que en altas concentraciones influyen en la presencia y proliferación de esta bacteria en ecosistemas acuáticos (Borroto, 1997) y que incluirlos en próximos estudios permitiría fortalecer el conocimiento sobre esta bacteria.
Por otra parte, la temperatura promedio del agua superficial de la CGSM tuvo una menor variación durante el tiempo del estudio, con valores muy cercanos y dentro del rango descrito como óptimo para el crecimiento de V. cholerae (30 °C - 37 °C; Borroto, 1998). Sin embargo, debido a la baja variabilidad de la temperatura, esta variable no fue relevante para la ocurrencia y distribución de esta bacteria. A diferencia de lo que ocurre en zonas templadas y subtropicales, donde V. cholerae prolifera en verano, cuando aumenta la temperatura del agua (Colwell, 1996; Pascual et al., 2000; Xu et al., 2014; Di et al., 2017).
Cabe resaltar que la no detección de V. cholerae por métodos de cultivo convencionales no asegura la ausencia de este patógeno potencial, puesto que, aunque en condiciones ambientales como baja concentración de nutrientes, alta salinidad y bajas temperaturas se limita su proliferación en ecosistemas acuáticos, esta bacteria puede permanecer en un estado de latencia conocido como viable no cultivable (VBNC) en el cual se mantiene hasta que las condiciones sean favorables para su crecimiento (Jesudason et al., 2000; Lutz et al., 2013; Jayakumar et al., 2020; Kopprio et al., 2020).
La presencia de V. cholerae en distintas zonas de la CGSM, indica que este ecosistema tiene condiciones ambientales óptimas para la reaparición del cólera o la aparición de otras patologías asociadas con este microorganismo, convirtiéndose en un reservorio para esta especie, en el cual está presente a lo largo de todo el año. Teniendo en cuenta que V. cholerae prolifera y aumenta su concentración cuándo la salinidad baja, hay un mayor riesgo de que ocurra una epidemia de cólera durante épocas lluviosas y principalmente en las estaciones BVA y NVE donde se registraron las mayores densidades y que se encuentran cercanas a comunidades palafíticas.
Es importante mencionar que la variabilidad espacial mostró que en estaciones con similares condiciones de salinidad y temperatura los resultados en la detección de V. cholerae fueron diferentes, observando incluso que en la estación ROS, que presentó salinidades dentro del rango óptimo para el crecimiento de esta bacteria, no fue detectada durante todo el periodo estudiado. Lo anterior sugiere que existen otras variables que limitan y promueven la presencia de V. cholerae en los ecosistemas acuáticos y que deberían incluirse en próximos estudios para tener mayor conocimiento sobre las condiciones del agua que favorecen este microorganismo.
Este trabajo constituye una línea base para avanzar en el estudio de V. cholerae en ecosistemas acuáticos del país, así como para fortalecer los sistemas de vigilancia de las instituciones de salud en las regiones costeras sobre todo en las zonas con alta presencia de comunidades humanas.
CONCLUSIONES
En la CGSM, la presencia y distribución de V. cholerae están determinados en gran parte por la salinidad. Durante la época de lluvia, baja la salinidad y se generan condiciones propicias para la proliferación de este microorganismo, lo cual representa un factor de riesgo para las poblaciones que hacen uso del agua y de los recursos alimenticios que provee el sistema lagunar. Este conocimiento es un factor predictor de la proliferación de V. cholerae y constituye una herramienta que puede ser utilizada en la generación de alertas tempranas que conlleven a la aplicación de medidas preventivas.