1 Introducción
La adsorción puede definirse como la adhesión de partículas de una sustancia sobre la superficie de un material llamado adsorbente. Teniendo en cuenta la naturaleza de las fuerzas de adhesión que menciona Hougen, 1964 citado en Cuadros & Muleros 1, puede ser física (fisisorción) o química (quimisorción), Carballo 2 menciona que en la adsorción física las interacciones predominantes son de tipo Van der Waals, mientras que en la adsorción química las interacciones asemejan enlaces químicos.
Buena parte de la investigación en la producción de materiales adsorbentes está encaminada a la protección ambiental y, en especial, a la conservación del agua. La adsorción es un método sencillo para la eliminación de contaminantes en fase acuosa, debido a su alta eficiencia y la facilidad en el proceso 3.
El carbón activado es el adsorbente más versátil por su alta superficie específica, distribución polimodal de tamaños de poro, estructura porosa en forma de rendija y por su capacidad de presentar diferentes tipos de naturaleza química en su superficie. El tamaño medio del carbón en polvo es 15 - 20 µm, mientras que el granular suele ser de 0.3 - 3.0 mm 4.
Rodríguez 5) mostró que el consumo de carbón activado para aplicaciones en fase líquida está en una proporción muy elevada del uso total de este material, siendo en algunos países hasta del 80%. Las principales aplicaciones están relacionadas con el tratamiento de aguas: en países desarrollados una cuarta parte del carbón activado es empleado en agua potable que se emplea para desinfección. En aguas residuales, se consume aproximadamente una quinta parte del carbón activado utilizado en fase líquida.
Se puede preparar carbón activado a partir de materiales de origen lignocelulosico o de origen mineral por el método de activación física o activación química y, posterior activación con aire, vapor de agua o CO2 a elevadas temperaturas (700 - 1100 ºC) o a través de tratamientos químicos.
Desde el punto de vista del carbón activado como absorbente, se conocen diversos estudios concernientes a la descontaminación de aguas; materiales específicos como fenoles y metales pesados, en Vargas, Giraldo & Moreno 6. Se realiza la entalpia de inmersión de carbón activado preparado a partir de cuesco de palma africada en soluciones de 3-clorofenol. Así mismo, Contreras, Fuenmayor & Otros 7 realizan un estudio de la capacidad absortiva de carbón activado, preparado a partir del bagazo de la caña de azúcar para la adsorción de fenoles, presentando como resultados una estructura porosa adecuada para la adsorción de estos compuestos fenólicos.
La problemática de tipo ambiental, objetivo de la investigación, se refiere al fenol que, según Garrido et al citado en Ñungo, et al8 es uno de los contaminantes ambientales más peligrosos y frecuentes en aguas residuales industriales (químicas, petroquímicas y agroalimentarias), debido a su toxicidad, bioacumulación, poca biodegradabilidad y a su carácter cancerígeno.
De acuerdo con Aguado 9, los nitrofenoles hacen referencia a tres sustancias químicas como lo son: el 2 -nitrofenol, el 3 - nitrofenol y el 4-nitrofenol. Generalmente, cualquier persona puede estar expuesta al contacto con nitrofenoles, ya sea por su contacto con éste a través del suelo, el agua y el aire aunque la mayor parte se deposita en el agua y en el suelo, identificándose en las aguas de lluvia, en efluentes de aguas residuales de varias industrias y en el agua potable. Aún no se han encontrado en los alimentos. Howard 10 señala empresas de fabricación de hierro y acero y de plásticos como grandes contribuyentes de vertimiento de nitrofenoles a las aguas residuales.
La Agencia de Protección Ambiental (EPA) ha reglamentado reducir el contenido de fenol en aguas residuales a menos de 1 mg/L debido a su toxicidad. Las concentraciones de fenol por encima de 2 mg/L son tóxicas para la vida acuática y concentraciones entre 10 y 100 mg/L resultan en la muerte de la vida acuática en un período de 96 h. Aparte de su toxicidad y de ser cancerígeno, el fenol puede causar mal sabor y olor, incluso en bajas concentraciones. Por lo tanto es necesario que las aguas residuales que contengan fenol previamente, se les realice tratamiento cuidadoso antes de la descarga en los cuerpos de agua receptores.
Teniendo en cuenta la importancia de los nitrofenoles en el ambiente y que cualquier persona puede estar en contacto con esta sustancia, el estudio cinético de adsorción de 2- nitrofenol en función del tiempo sobre carbón activado resalta la importancia del material carbonoso para que éste sea empleado en procesos de descontaminación de aguas, lo cual se evidencia al determinar las constantes cinéticas, aplicando los modelos cinéticos de pseudo primer orden y pseudo segundo orden.
2 Metodología
En este trabajo se determinaron las constantes cinéticas de adsorción de 2-nitrofenol desde disolución acuosa sobre dos muestras de carbón activado (CAG) Figura 1 y (CAP) Figura 2, con disoluciones en un rango de concentración de 1 a 30 ppm de 2-nitrofenol.
Carbón activado: Se utiliza carbón activado granular CarbochemTM-PS230, cuyo precursor es cáscara de coco.
Características de Adsorción en fase acuosa
La concentración del 2-nitrofenol en disolución acuosa se determina por un método espectrofotométrico UV. La longitud de onda de máxima absorbancia (272.8 nm) en un equipo de la marca Hitachi 150.
2.1 Cinéticas de adsorción
Los datos cinéticos se obtuvieron al poner en contacto aproximadamente 0.400 g de las muestras carbonosas (CAP y CAG) con un volumen de 25 mL de disolución acuosa de fenol de concentración conocida a 400 mg*L-1. Para ello se hizo un seguimiento del sistema de adsorción por un período de 600 minutos, realizando lecturas de absorbancia cada 60 min.
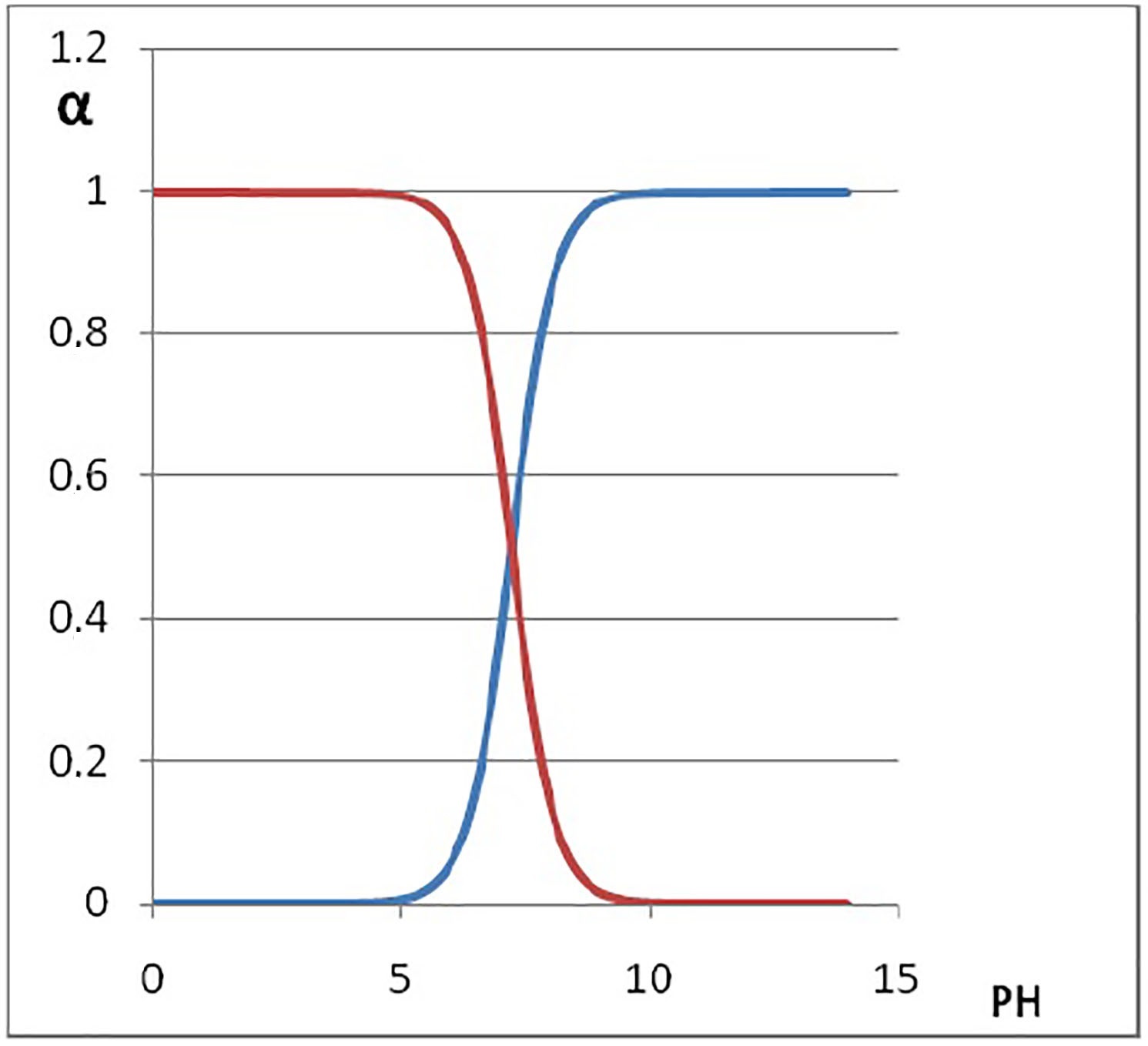
La Figura 3 muestra el diagrama de distribución de especies del 2-nitrofenol teniendo en cuenta el valor de la pka =7.21 cuya Ka tiene un valor de 6.61 x 10-8.
3 Resultados
3.1 Parámetros texturales y químicos para los dos carbones activados CAP y CAG
En la Figura 4, se muestran las isotermas de adsorción de N2 a 77 K, de los dos carbones activados utilizados en este trabajo, éstas son de tipo I de acuerdo con la clasificación IUPAC, típica de sólidos microporosos. En esta figura se puede observar que el volumen de gas adsorbido es mayor para el CAP respecto al CAG, además de evidenciarse mayor capacidad adsorbida a baja presión relativa lo que indica alta microporosidad para las dos muestras carbonosas.
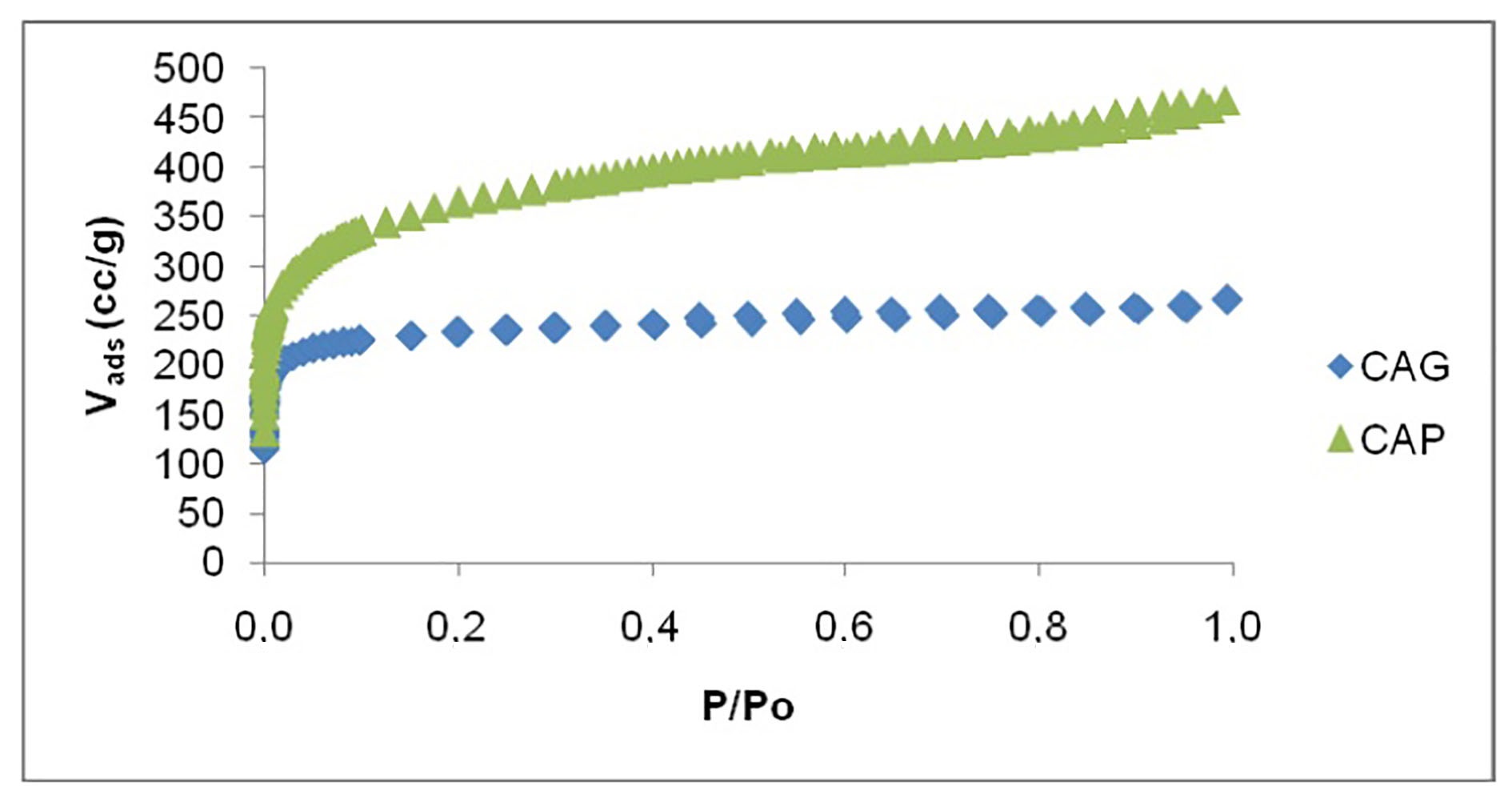
Figura 4 Isoterma de adsorción-desorción de nitrógeno a 77K para las dos muestras carbonosas (CAG y CAP).
En la Tabla 1, se presentan algunas de las propiedades físico-químicas correspondientes a cada uno de los carbones activados (CAP y CAG). Para las dos muestras carbonosas, se observa que el volumen de microporos se encuentra más desarrollado respecto al volumen de mesoporos, no obstante, hay un mayor desarrollo para el CAP respecto al CAG con valores de 0.45 cm3*g-1 contra 0.31 cm3*g-1 de acuerdo con el modelo DR. Ahora bien, este comportamiento se confirma si se comparara con el calculado por el método α con valores 0.54 cm3*g-1 y 0.34 cm3*g-1, respectivamente. Además, se observa que el área superficial aparente B.E.T es mayor para la muestra CAP con respecto a la muestra CAG con valores de 1352 m2*g-1 y 887 m2*g-1, respectivamente. Estos valores son cercanos a las Aequi calculadas a partir del modelo DR.
Tabla 1 Características texturales y químicas de los carbones activados CAG y CAP. aVtotal = volumen adsorbido a P/P o = 0.95, b = diferencia entre Vtotaly Va, c L = 10.8 / (Eo - 11.4), dSmi = 2000 Wo/ L
| A BET | Ecuación DR | Método a | Química superficial | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (m 2 *g -1 ) | V mpore | V total | V mesporo | E o | L (nm) c | S mi | A | V mpore | S a | Acidez Total | Basicidad Total | pH PZC | |
| Muestra | (cm 3 *g -1 ) | (cm 3 *g -1 ) a | (cm 3 *g -1 ) b | (kJmol -1 ) | (m 2 *g -1 ) d | equiv | (cm 3 *g -1 ) | (cm 3 *g -1 ) | (meq*g -1 ) | (meq*g -1 ) | |||
| (m2*g-1) | |||||||||||||
| CAG | 887 | 0.31 | 0.37 | 0.023 | 17.4 | 1.79 | 342 | 863 | 0.34 | 50 | 0.23 | 0.11 | 5.4 |
| CAP | 1352 | 0.45 | 0.64 | 0.1 | 13.2 | 5.9 | 153 | 1269 | 0.54 | 135 | 0.3 | 0.6 | 9.8 |
Por otro lado, con relación a la química superficial, se observa que la acidez total es aproximadamente 2 veces mayor que la basicidad total para el CAG lo que implica que este carbón es de carácter ácido con pHPZC = 5.4. Así mismo, para la muestra CAP se presenta un bajo contenido en grupos superficiales de carácter ácido, aproximadamente 2 veces menor respecto al contenido de grupos superficiales de carácter básico, por lo tanto, es un carbón de carácter básico con pHPZC = 9.8.
Luego de la obtención e interpretación de algunos parámetros texturales se evaluó, para cada uno de los carbones, la cinética de adsorción.
4 Resultados y discusión
Estudio Cinético: este estudio se realiza siguiendo el postulado que muestra Pinzón & Vera 11, Modelo Cinético de Primer Orden(Laceraron): La ecuación de Lagergren se basa en la capacidad de adsorción del sólido, donde a cada especie química presente en disolución se le asigna un sitio de adsorción del material adsorbente, lo que en términos de velocidad de reacción se expresa como:
Integrando la ecuación anterior y teniendo en cuenta las condiciones limites, se obtiene:
Donde k 1 es la constante de velocidad de adsorción de Lagergren (min-1); q t y q e son las cantidades de 2- Nitrofenol adsorbido a un tiempo t y en el equilibrio respectivamente, t (min). Murillo, Giraldo & Moreno 12.
Modelo Cinético de Pseudo Segundo Orden (Ho y Mackay): Ho y Mackay, en 1999 desarrollaron el modelo de pseudo-segundo orden con el fin de conocer el comportamiento del fenómeno de adsorción. La ecuación de la cinética de adsorción se expresa como:
Integrando la ecuación anterior se obtiene:
Donde k2 es la constante cinética de Pseudosegundo orden (g/mmol.min) y h=k2*qe2 siendo h (mmol/g.min) la velocidad inicial de adsorción. Pinzon & Vera 11.
Según los modelos cinéticos, se realiza la modelación matemática para cada uno de los carbones utilizados, carbón activado peletizado (CAP) y carbón activado granular (CAG).
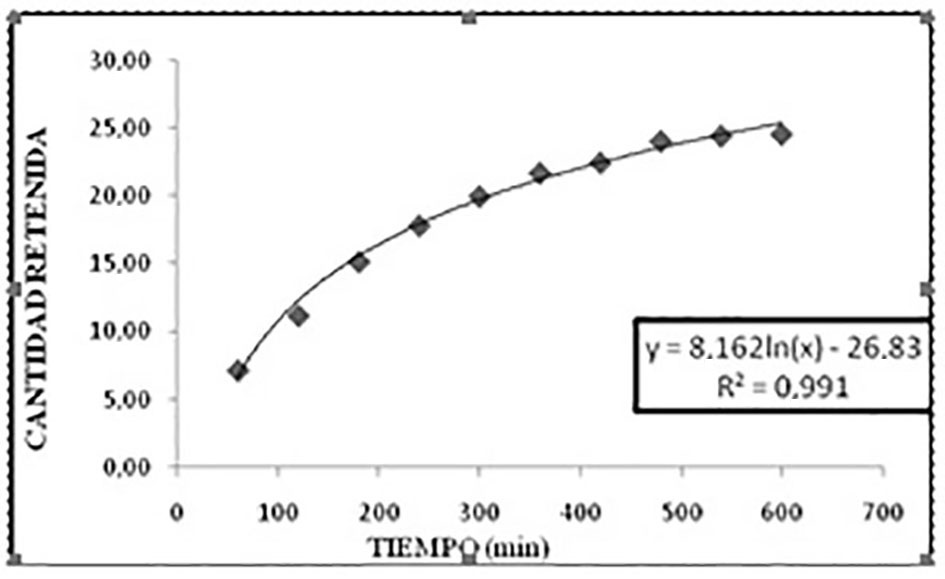
Se observa, en la Figura 5, la cantidad retenida en función del tiempo para una concentración inicial de 400 mg*L-1 de 2-nitrofenol. En ésta se aprecia que la muestra CAP mantiene la cantidad retenida constante desde los 540 min.
Luego de analizar la capacidad retenida en función del tiempo, se linealizaron los datos experimentales con el objetivo de deducir posibles interacciones, para ello, se aplicaron los modelos de pseudo primer orden y pseudo segundo orden tal como se ya se han descrito. En la Figura 6 y 7, se presentan los datos cinéticos linealizados a partir de los modelos antes mencionados para la muestra CAP.
Se observa que el modelo cinético al cual se ajusta la adsorción de 2-NF sobre el carbón activado peletizado (CAP) es un modelo de pseudo segundo orden, ya que el coeficiente de correlación lineal (R2) es mayor para esta grafica con un valor de 0.994 el cual es más próximo a 1 en comparación con el valor de la gráfica de pseudo primer orden que es de 0.917, lo cual se atribuye a que el mecanismo de adsorción, de acuerdo con los supuestos del modelo, corresponde a una quimisorción.
Según Campuzano 13, la quimisorción propuesta por Langmuir en 1916 se trata de una interacción más fuerte que la fisisorción donde: i) las entalpías de quimisorción son mucho mayores que las de fisisorción y del orden de las que se liberan en la formación de enlaces químicos, implica: ii) la formación de un enlace entre adsorbato y el adsorbente, además de: iii) la rotura y formación de enlaces, por lo que la molécula quimisorbida no mantiene la misma estructura electrónica (enlaces) que en fase gaseosa.
Para el caso de la muestra CAG, en la Figura 8, se evidencia la cantidad retenida en función del tiempo para una concentración inicial de 400 mg*L-1 de 2-nitrofenol. En ésta se aprecia que la muestra CAG mantiene la cantidad retenida constante desde los 540 min. Es así, que el tiempo de equilibrio se alcanza a los 600 min.
Luego de analizar la capacidad retenida en función del tiempo, se linealizaron los datos experimentales con el objetivo de deducir posibles interacciones. Para ello, se aplicaron los modelos de Pseudo primer orden y Pseudo segundo orden tal como se ya se han descrito. En la Figura 9 y 10, se presentan los datos cinéticos linealizados a partir de los modelos antes mencionados para la muestra CAG.
Para el proceso de adsorción de 2-NF sobre este carbón (CAG), se observa que el valor del coeficiente de correlación lineal (R2) es óptima para el modelo de pseudo segundo orden 0,995 en comparación con el valor del coeficiente del modelo de pseudo primer orden, 0,890, lo que indica que también el mecanismo de adsorción se asocia a un proceso de quimisorción para este carbón (CAG).
En la Tabla 2, se encuentran los valores de los parámetros calculados a partir de los modelos cinéticos de Pseudo primer y pseudo segundo orden para los dos carbones, encontrando que los valores son muy cercanos, sin embargo, el coeficiente de correlación lineal del CAG y CAP es más favorable en el modelo de pseudo segundo orden.
Tabla 2 Modelos cinéticos para CAP y CAG
| Muestra Carbón | Modelo cinético de Pseudo primer orden | Modelo cinético de Pseudo segundo orden | |||||
|---|---|---|---|---|---|---|---|
| K 1 (min -1 ) | qe (mg*g -1 ) | r 2 | K 2 | qe (mg*g -1 ) | r 2 | ||
| (g*mg -1 *min -1 ) | |||||||
| CAG | 8.73E-03 | 39.81 | 0.89 | 1.20 E-04 | 35.21 | 0.995 | |
| CAP | 7.16E-03 | 33.11 | 0.917 | 1.31E-04 | 33.78 | 0.994 | |
Teniendo en cuenta que el modelo que mejor se ajusta es el modelo de pseudo segundo orden y, si se tiene en cuenta el valor de la constante k2, que está relacionada con la velocidad de adsorción, se observa que este valor es mayor para la muestra CAP con respecto a la CAG.
Finalmente, como tendencia general para las dos muestras carbonosas, se concluye que el efecto cinético en la cantidad retenida de 2-nitrofenol es similar. Así mismo, es evidente que la cantidad retenida después de alcanzar el tiempo de equilibrio de adsorción es similar para los dos sistemas de adsorción.
En este orden de ideas, para evaluar la capacidad de adsorción de fenol, es necesario construir las isotermas de adsorción para poder predecir el mecanismo de interacción adsorbato-adsorbente.
5 Conclusiones
El carbón activado es un adsorbente eficiente cuando se trata con 2- nitrofenol, por tanto, puede ser útil en procesos que involucren la descontaminación de aguas.
Los datos obtenidos en el estudio de las cinéticas de adsorción de 2-NF, para las dos muestras carbonosas, se ajustaron al modelo de pseudo segundo orden para las dos clases de carbón, carbón activado granular (CAG) y carbón activado peletizado (CAP), indicando que el mecanismo de adsorción se atribuye a un proceso de quimisorción.