Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
BIOTECNOLOGÍA
INFLUENCIA DE BACTERIOCINAS PRODUCIDAS POR Lactobacillus plantarum LPBM10 SOBRE LA VIDA ÚTIL DE FILETES DEL HÍBRIDO DE CACHAMA Piaractus brachypomus x Colossoma macropomum EMPACADO AL VACÍO
INFLUENCE OF BACTERIOCINS PRODUCED BY Lactobacillus plantarum LPBM10 ON SHELF LIFE OF CACHAMA HYBRID FILLETS Piaractus rachypomus x Colossoma macropomum VACUUM PACKAGED
Héctor SUÁREZ M.1*, Alicia de FRANCISCO.2, Luiz H. BEIRÃO.2
1 Departamento de Ingeniería Agrícola y de Alimentos, Bloque 14 oficina 400, Universidad Nacional de Colombia, Calle 59A #63-20 Medellín-Colombia.
2 Departamento de Ciência e Tecnología de Alimentos, Centro de Ciências Agrárias, Universidade federal de Santa Catarina. Florianópolis, Brasil.
RESUMEN
El uso de algunos de los géneros de las bacterias ácidolácticas (BAL) como Lactobacillus, Leuconostoc, Lactococcus, o sus productos antimicrobianos como las bacteriocinas, son alternativas en la biopreservación de productos mínimamente procesados que son mantenidos bajo refrigeración. El potencial de biopreservación de un extracto crudo de bacteriocinas producidas por una cepa nativa de Lactobacillus plantarum LPBM10, se evalúa sobre filetes de híbrido de cachama Piaractus brachypomus x Colossoma macropomum empacados al vacío durante 30 días de almacenamiento a 3±0,5 0C. La evaluación se realiza por medio del recuento: mesófilos (heterótrofos), psicrófilos, esporas sulfitoreductoras, coliformes totales y fecales y presencia de Salmonella, teniendo en cuenta tres tratamientos: extracto crudo de bacteriocinas, ácido láctico y el control. El recuento de heterótrofos no presenta diferencia entre los tratamientos, mientras el recuento de psicrotrófilos alcanza valores de 5.2 ciclos log, 6.7 ciclos log y 6.4 ciclos log (P<0.05) para los filetes tratados con extracto crudo de bacteriocinas, ácido láctico y control, respectivamente. Con respecto a los coliformes totales se obtiene un recuento inicial de 2.6 ciclos log, el cual no cambió durante todo el estudio. En cuanto al recuento de coliformes fecales, al finalizar el periodo de almacenamiento, disminuyó 1.3, 1.5 y 2.1 ciclos log para los filetes control, tratados con extracto crudo de bacteriocinas y ácido láctico, respectivamente. El análisis de BVT-N muestra los mejores resultados para el tratamiento con extracto crudo de bacteriocinas y finaliza con 19.3 mg BVT-N/100g. Los resultados del análisis sensorial muestran el mayor rango de aceptabilidad para el tratamiento con extracto crudo de bacteriocinas.
Palabras clave: bacteriocinas, peces, Lactobacillus plantarum LPBM10, acuicultura, vida útil.
ABSTRACT
Some lactic acid bacteria genera (BAL) as Lactobacillus, Leuconostoc, Lactococcus or their antimicrobial products as bacteriocins are used as alternatives biopreservation of minimally processed foods kept under refrigeration. Potential Biopreservatives from a bacteriocin producer native strain, Lactobacillus plantarum LPBM10, was evaluated on fillets of cachama hybrid Piaractus brachypomus x Colossoma macropomum, vacuum-packed and stored at 30±0,5°C during 30 days. The evaluation was undertaken using three treatments, bacteriocins raw extract, lactic acid and control. There were not differences among treatments on Mesophylls count. Meanwhile, psychotrophylls count reached values for fillets treated with raw extract of bacteriocins, lactic acid and control, 5.2 cycles log, 6.7 cycles log and 6.4 cycles log (P<0.05), respectively. Regarding total coliforms, 2.6 cycles log of initial count was obtained, maintaining the same value until the end of storage. Faecal coliforms count, at the end of storage period diminished 1.3, 1.5 and 2.1 cycles log for fillets control treated with raw extract of bacateriocins and lactic acid, respectively. BVT-N analysis showed the best results on treatment with raw extract of bacteriocins and end with 19.3 mg BVT-N/100g. Sensorial analysis results showed the greater acceptability range for bacteriocins raw extract treatment.
Key words: bacteriocins, fish, Lactobacillus plantarum LPBM10, aquaculture, shelf life.
INTRODUCCIÓN
La carne de pescado, y en especial la de los filetes, es muy perecedera, su vida útil se ve limitada debido al deteriorio microbiano, lo que genera un alto riesgo para la salud de los consumidores cuando existen patógenos involucrados (2).
Los filetes de la cachama son altamente apetecibles en la nutrición. En algunos países de Suramérica se ha obtenido un híbrido entre la cachama blanca, Piaractus brachypomus, y la cachama negra, Colossoma macropomum, que alcanza notables ventajas en la producción acuícola. En el año 2003, en Colombia, la producción de la cachama se ha incrementado en 12.023 toneladas; resulta ser así la segunda especie (después de la tilapia, la más utilizada por la acuicultura) mientras que se reporta una producción total de 18.4333 toneladas en los países productores como Argentina, Brasil, Bolivia, Perú y Venezuela (1).
Es conocido que en la conservación del pescado por refrigeración y empaque al vacío para almacenamiento, algunos microorganismos pueden sobrevivir y crecer, incluyendo Salmonellas, coliformes y bacterias esporuladas. En este sentido, el uso de algunos de los géneros de las bacterias ácidolácticas (BAL), como Lactobacillus, Leuconostoc, Lactococcus, o sus productos antimicrobianos como las bacteriocinas, son alternativas en la biopreservación de productos mínimamente procesados que son mantenidos bajo refrigeración (3). Las bacteriocinas producidas por LAB son péptidos, generalmente degradados por proteasas intestinales, con específica actividad antimicrobiana y con diferentes aplicaciones en el campo de la protección de alimentos (4).
Diferentes autores destacan las especies del género Lactobacillus como los principales antagonistas de microorganismos patógenos y deterioradores en productos de pescado (5-8). Se ha observado que algunas especies de Lactobacillus producen una variedad de compuestos antimicrobianos que difieren en su espectro inhibitorio, modo de acción, estructura y propiedades bioquímicas. Se ha determinado que diferentes bacteriocinas producidas por Lactobacillus plantarum poseen efecto antagónico ante organismos gram positivos y, en algunos casos, en gram negativos. En este sentido, la plantaricina F, producida por Lactobacillus plantarum BF001, microorganismo aislado del catfish (Ictalurus puntactus), es efectiva frente a Lactobacillus, Lactococus, Listeria, Micrococcus, Leuconostocs, Pediococus, Staphylococcus, Streptococcus, Salmonella y Pseudomonas (9); sin embargo, varios estudios muestran diferentes bacteriocinas producidas por bacterias ácidolácticas (BAL) aisladas de carnes, pescados y productos lácteos, de las que sólo unas pocas han sido probadas y aplicadas en biopreservación de filetes de pescado (10-12).
El objetivo del presente trabajo fue evaluar el efecto de las sustancias antimicrobianas tipo bacteriocinas producidas por Lactobacillus plantarum LPBM10, sobre la vida útil de filetes de pescado empacados al vacío y almacenados a 3ºC, usando parámetros indicadores de calidad, microbiológicos, fisicoquímicos y sensoriales.
MATERIALES Y MÉTODOS
Muestras de peces
Los peces híbridos de cachama, Piaractus braquipomus x Colossoma macropomum, fueron obtenidos del Centro de Investigación Piscícola de la Universidad de Córdoba - CINPIC, Montería, Colombia, en septiembre de 2006. Los peces, capturados del estanque, fueron inmediatamente sacrificados por medio de punción en el cerebro y transportados al laboratorio. El peso y la longitud promedio de los peces fueron de 590 g y 32 cm respectivamente. Los filetes con piel se obtuvieron manualmente usando un cuchillo aséptico, su peso medio fue 32.4% del peso inicial de los peces.
Cada filete por separado fue empacado al vacío y almacenado bajo refrigeración (3 ± 0.5ºC) por un periodo de 30 días.
Los análisis fueron realizados durante los siguientes días de almacenamiento: 0, 5, 10, 15, 20, 25 y 30. Los filetes por triplicado fueron sometidos a análisis microbiológico, físico, químico y sensorial.
Producción y concentración de bacteriocinas a partir de L. Plantarum LPBM10
La cepa nativa de L. plantarum LPBM10 fue suministrada por el Laboratorio de Biotecnología Microbiana de la Universidad Nacional de Colombia, sede Medellín. Un inóculo inicial de 106 UFC/mL del L. plantarum LPBM10, fue cultivado en caldo MRS a 30 ºC por 72 horas en cámara de anaerobiosis, posteriormente centrifugado a 3000 rpm durante 20 minutos (13). Los sobrenadantes fueron esterilizados por filtración en membranas (Milipore, poro 0,45 mm/diámetro 47mm), y tratados con ácido tricloroacético para obtener la bacteriocina concentrada.
Determinación de la actividad del extracto crudo de bacteriocinas
El extracto crudo de bacteriocinas fue evaluado sobre Listeria monocytogenes mediante el método de difusión en pozos (14). Fue utilizado
104 – 105 UFC/mL de Listeria monocytogenes y se inoculó en caldo BHI mas 1% p/v de agar; posteriormente, formados los pozos e inoculados con 40mg del extracto crudo de bacteriocinas neutralizado y filtrado e incubado a 30oC durante 24 horas. Después del periodo de incubación con la presencia de halo inhibitorio se comprobó la actividad de la bacteriocina.
Tratamientos
El extracto concentrado de bacteriocina fue adicionado a la superficie de cada filete en cantidad de 1 mL utilizando una pipeta. Los tratamientos fueron los siguientes:
T1: Extracto concentrado de bacteriocina:
1 mL que contiene 40 mg de extracto concentrado de bacteriocina producido por L. plantarum LPBM10.
T2: Ácido láctico: 1 mL de ácido láctico ajustado a pH 6.32, estimado previamente durante el empaque al vacío del filete.
T3: Control: 1 mL agua destilada
Almacenamiento
Los filetes de cada tratamiento, incluyendo el control, fueron empacados en bolsas de polietileno de baja densidad con barrera de transmisión de oxígeno de 29-45 mL/O2/m2/ 24h/atm, medido a 23ºC, y barrera de permeabilidad a gases de 10–15 g/m2 / 24h /medido a 38ºC marca
CRYOVAC®, utilizando una empacadora de vacío WEBOMATIC® 82246 (West Germany).
Análisis microbiológicos
Se realizaron los siguientes análisis microbiológicos: recuento de mesófilos (heterótrofos) en placa, psicrotrófilos, coliformes totales, coliformes fecales, esporas sulfitoreductoras y presencia de Salmonella, según las Normas del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) destinados para el consumo humano (15).
Recuento de mesófilos en placa y psicrotrófilos: 10 g de la muestra fueron adicionados a 90 mL de agua peptonada 0.1% p/v, homogeneizados y realizadas las diluciones 101, 102 y 103 y se inoculó 1 mL de cada dilución en cajas de petri con 15 mL de agar Plate Count por el método vertido en profundidad, e incubadas a 35 ± 2°C durante 48 horas. Para psicrotrófilos fueron incubados a 4 ± 0.5°C durante 5-7 días. Los resultados fueron expresados en Unidades Formadoras de Colonia/mL, UFC/mL.
Determinación de Salmonella: Se adicionaron 25 g de la muestra homogeneizada a 225 mL de peptona buferada, se incubó a 35 ± 2°C por 16 a 24 horas. Se tomó un mL del cultivo, se adicionó a un tubo de ensayo con 10 mL de caldo tetrationato medio de enriquecimiento selectivo, agregando 2 gotas de Lugol y 2 gotas de verde brillante al 0.1% p/v, incubados a 35 ± 2°C por 18 a 24 horas. Luego se tomó una asada y se inoculó sobre el medio de cultivo selectivo agar XLD y agar SS por el método de agotamiento de superficie y se incubó a 35 ± 2°C por 24 horas.
Determinación de esporas sulfito reductoras: Se adicionaron 10 g de muestra homogeneizada a 90 mL de peptona universal 0.1 p/v y realizadas las diluciones 101, 102, 103. Luego se adicionó 1 mL de cada dilución en cajas de petri con agar SPS por el método de profundidad, incubado a 35 ± 2°C por 72 horas en anaerobiosis.
Determinación de coliformes totales y fecales: Se inocularon 10 g de muestra homogeneizada en nueve tubos de ensayo con 10 mL de caldo Fluorocult LMX, distribuidos así: a tres tubos se les adicionaron 10 mL de la muestra; a otros, 3 mL de la muestra, y a los 3 restantes se les adicionó 0.1 mL de la muestra. Se homogenizaron utilizando el vortex y se incubaron a 35 ± 2ºC por 24 a 48 horas. La lectura fue determinada por fluorescencia y presencia de indol, y los datos reportados como Número Más Probable (NMP).
Análisis químico
Para la determinación de bases volátiles totales de nitrógeno fue utilizado el método propuesto por Goulas & Kontominas (2005), en donde se molieron 10 g de muestra de carne de pescado con 50 mL de agua destilada usando un picador Moulinex®. El material fue transferido con 200 mL de agua destilada a un baker de 500 mL y destilado después de la adición de 2 g de MgO y una gota de silicona para prevenir la formación de espuma. Luego se llevó a un erlenmeyer de 250 mL, que contiene 25 mL de solución de ácido bórico 3% p/v, 0.04 mL de rojo metilo y azul de metileno como indicadores para el tratamiento del amonio. La destilación se continuó llevando a un volumen final de 125 mL del destilado obtenido. La solución de ácido bórico vira a verde cuando es alcalina por el destilado de BVT-N. La solución fue tratada posteriormente con solución 0.1 N de ácido hidroclórico. La destilación se concluyó cuando el color del destilado cambió a rosado por la adición gota a gota del ácido hidroclórico (16). La cantidad de BVTN en mg/100 g de carne de pescado fue calculada del volumen (V) de ácido hidroclórico adicionado y su concentración (C) por la siguiente ecuación:
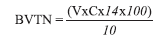
Evaluación sensorial
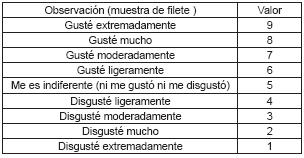
El análisis sensorial se llevó a cabo por el método tradicional de juzgar la calidad de filetes de pescado. Fueron evaluadas las características sensoriales como apariencia, color y aroma por cinco panelistas entrenados. El puntaje se basó en una escala hedónica de nueve puntos (Tabla 1), donde 1 corresponde a disgusté extremadamente y 9 gusté extremadamente. El valor sensorial de 4 fue tomado como el rango mínimo de aceptabilidad (17).
Tabla 1. Análisis sensorial
Análisis estadístico
Todos los ensayos fueron realizados por triplicado. El efecto de los diferentes tratamientos sobre los filetes empacados al vacío y refrigerados a
3 ± 0.5ºC, fue evaluado por análisis de variancia (ANOVA), aceptada como diferencia significativa P< 0.05 y fue utilizado el sofware Statgraphics (Statistical Graphics Corp. Rockville, MD, USA).
RESULTADOS Y DISCUSIÓN
Cambios microbiológicos
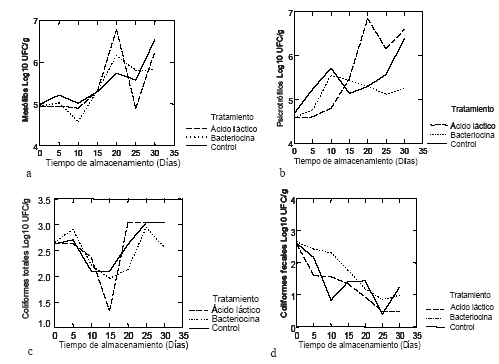
Los cambios en la microbiología de los filetes del híbrido de cachama durante el almacenamiento para los tres tratamientos se muestran en la figura 1.
Figura 1. Comportamiento microbiológico del extracto crudo de bacteriocinas producidas por L. plantarum LPBM10 en filetes de híbrido de cachama empacado al vacío durante 30 días de almacenamiento a 3ºC para mesófilos (a), psicrotrófilos (b), coliformes totales (c) y coliformes fecales (d).
El recuento inicial para mesófilos (4.8 log UFC-1) indica un buen estado inicial de calidad para los filetes. Los filetes inoculados con el extracto crudo de bacteriocinas alcanzaron 5.7 ciclos log para mesófilos a los 30 días de almacenamiento, frente a los filetes tratados con ácido láctico, 6.3 ciclos log y los filetes control, 6.6 ciclos log. Aunque no se presentó diferencia estadística (P>0,05) entre los tratamientos, se observa que en los filetes tratados con el extracto crudo de bacteriocinas, se redujo en 0,9 ciclos log el conteo de mesófilos frente a la muestra control. Para el día 10 de almacenamiento, el extracto crudo de bacteriocinas consiguió disminuir la población inicial de mesófilos, mostrando actividad bactericida. A partir del día 14 de almacenamiento se observó un re-crecimiento para mesófilos; sin embargo, el comportamiento del extracto crudo de bacteriocinas podría considerarse bacteriostático al final del periodo estudiado.
El conteo inicial para psicrotrófilos fue de 4.6 ciclos log, y alcanzó valores para los filetes tratados con extracto crudo de bacteriocinas, ácido láctico y control de 5.2 ciclos log, 6.7 ciclos log y 6.4 ciclos log (P<0.05), respectivamente, para el día 30 de almacenamiento. Los filetes tratados con el extracto crudo de bacteriocinas disminuyeron en mínimo 1.2 ciclos log, controlando la población de psicrotrófilos, comparado con los filetes control y 1.5 ciclos log frente al tratamiento con ácido láctico, al final del periodo de almacenamiento, mostrando un efecto bacteriostático. En los primeros 10 días de almacenamiento no se observó control de psicrotrófilos (incrementando de 1.3 ciclos log) por parte del extracto crudo tipo bacteriocinas; sin embargo, se observó comportamiento bactericida (disminución de 0.47 ciclos log) entre los días 10 y 25 de almacenamiento.
Para coliformes totales se obtuvo un conteo inicial de 2.6 ciclos log, valor que se mantuvo los 30 días de almacenamiento, logrando controlar la población en los filetes tratados con extracto crudo de bacteriocinas. Para los filetes tratados con ácido láctico y control, el valor alcanzado al final del periodo de almacenamiento fue de 3 ciclos log. A partir del día 5 de almacenamiento, los tres tratamientos tienen un comportamiento bactericida frente a coliformes totales y un re-crecimiento a partir del día 15; sin embargo, en los filetes tratados con extracto crudo de bacteriocinas, disminuyó la población incrementada de coliformes totales hasta valores similares a los del día 0, hacia el final del periodo de almacenamiento.
Los coliformes fecales iniciaron con recuento de 2.6 ciclos log; al finalizar el periodo de almacenamiento, disminuyeron 1.3 ciclo log, 1.5 ciclos log y 2.1 ciclos log para los filetes control, tratados con extracto crudo de bacteriocinas y ácido láctico, respectivamente. Es evidente que la disminución a lo largo del tiempo se debió a las condiciones generadas por el empaque al vacío, como es el efecto del CO2 producido por los filetes debido a la respiración anaeróbica y al desarrollo de bacterias ácidolácticas que serían antagonistas de coliformes fecales.
En las muestras de filete con los tratamientos utilizados no se detectaron Salmonella ni organismos sulfitoreductores.
Aunque el deterioro de los filetes de pescado en condiciones anaeróbicas es atribuido a las bacterias ácidolácticas BAL (18), existe una considerable confusión sobre el rol de este grupo en filetes de pescado empacados al vacío. Trabajos de inoculación de especies de Carnobacterium y Lactobacillus (19, 7) sugieren que el potencial deteriorador de las BAL es variable y las enzimas autolíticas pueden conducir a ello. Además, la utilización de extractos crudos de sustancias bacteriocinas, bacteriocinas o la asociación de BAL para preservar carne de pescado, muestra efectividad en la extensión de la vida útil, pero variabilidad en el efecto sobre algunos microrganismos. La utilización de salmón ahumado empacado al vacío (13), demostró efecto bactericida o bacteriostático dependiendo del número de células utilizadas: Lactobacillus casei fue bacteriostático cuando fue inoculado a 6 log UFC/g, pero bactericida a 8 log UFC/g; sin embargo, los mejores resultados se obtuvieron con la asociación de Lactobacillus casei y Lactobacillus plantarum con 6 log UFC/g de inóculo (20).
El efecto bacteriostático o bactericida observado en filetes de cachama usando el extracto crudo de bacteriocinas, muestra una cinética que podría explicarse por la interferencia en la matriz alimentaria de compuestos tales como grasa o enzimas proteolíticas, junto con la presencia de CO2 generado en el empaque al vacío. Varios autores consideran el empaque al vacío después de 48 horas para carnes y pescados frescos como un empaque de atmósferas modificadas (21, 22). Los resultados obtenidos en el presente trabajo concuerdan con los de otros autores cuando utilizaron pedazos de carne de salmón ahumado almacenados 20 días a 3ºC, tratados con una sustancia tipo bacteriocina (STB) producida por C. piscicola y empacados al vacío, donde en medio de crecimiento TSB no se observó inhibición; presenta el patógeno psicrotrófilo el mismo perfil de desarrollo que el control sin bacteriocina. Cuando se utilizó en salmón, experimentó una demora inicial en el crecimiento hasta los cinco días y mostró un efecto bacteriostático hasta los 15 días de almacenamiento (23). El fenómeno de re-crecimiento de psicrotrófilos luego de las 48h, también fue observado cuando se ensayó la adición de nisina, lactocina 705 y enterocina CRL35 frente a diferentes microorganismos psicrotrófilos en medio TSB (24).
La cinética de inhibición con disminución de viables al inicio o durante el periodo de almacenamiento, seguida de un re-crecimiento de los sobrevivientes, también ha sido reportada cuando se adicionan bacteriocinas o extractos crudos de bacteriocinas individualmente, mientras que en presencia de la combinación de varias sustancias antimicrobianas se produce inmediata inhibición de las cepas indicadoras ensayadas. Estos resultados sugieren la aparición de células resistentes en la población (25, 26). Por otra parte, la actividad del extracto crudo de bacteriocinas (40 mg/ml) podría haber sido insuficiente para la inhibición de mesófilos y coliformes fecales. Se considera que los factores intrínsecos y extrínsecos asociados con los alimentos pueden interferir con la efectividad de las bacteriocinas (27): ellas pueden ser inactivadas por componentes como proteasas, lípidos y microorganismos, o su actividad puede ser afectada durante el procesamiento (temperatura, exudado) (12). Además, la producción y persistencia de actividad de las bacteriocinas sobre los alimentos es muy difícil de medir, probablemente debido a la interacción con el producto y el empaque, donde la transferencia de la actividad podría ser observada de la carne de pescado al empaque por el almacenamiento (27, 28).
Cambios en las bases volátiles totales de nitrógeno (BVT-N)
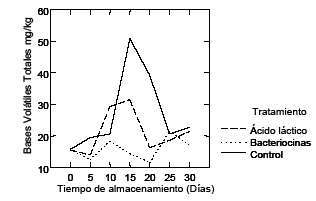
Los resultados de las BVT-N de filetes de híbrido de cachama durante el almacenamiento se muestran en la Figura 2.
Las bases volátiles totales incrementaron su valor inicial de 15.7 mg BVT-N/100 mg para el tratamiento control y ácido láctico hasta el día 15, sobrepasando el límite aceptado (30 mg BVT-N/100g) (29). Sin embargo, se observa disminución de los valores a partir del día 15, con un leve aumento hacia el final del periodo de almacenamiento. Por el contrario, en el tratamiento con extracto crudo de bacteriocinas, los valores se mantuvieron estables hasta el día 20 de almacenamiento, incrementando al día 25 y finalizando con 19.3 mg BVT-N/100 g (P<0.05).
Figura 2. Cambios en Bases Volátiles Totales (BVT) en filetes de híbrido de cachama empacados al vacío durante 30 días de almacenamiento a 3° C.
El incremento de los valores de BVT-N en los tratamientos con ácido láctico y control, frente al de extracto crudo con bacteriocinas, a lo largo del periodo de almacenamiento, podría estar influenciado por la interacción entre las bacterias ácidolácticas, originadas por el empaque al vacío, y la contaminación bacterial inicial (30). Otros autores atribuyen bajos valores BVT-N obtenidos en salmón ahumado por la interacción entre poblaciones de bacterias, cuando fue inoculado con L. sakei frente a psicrotrófilos productores de BVT-N (31). En el presente estudio, el tratamiento con extracto crudo de bacteriocinas muestra esta tendencia, al mantener controlada la población de bacterias picrotróficas. De otra parte, nuestros resultados no concuerdan con los obtenidos por otros autores (32), donde se obtuvieron altos valores para aminas biogénicas con sustancias bacteriocinas producidas por L. sakei en salmón ahumado.
Para el desarrollo de técnicas de biopreservación encaminadas a mejorar la vida útil y la seguridad en los alimentos, es esencial la comprensión de la ecología microbiana. La identificación del comportamiento de bacterias deterioradoras en pescado sometido a biopreservación ha presentado dificultad, probablemente porque diferentes grupos de bacterias están envueltas bajo diferentes condiciones (33), donde el sustrato, la composición de nutrientes, los parámetros físicos y químicos son determinantes para la selección, crecimiento y actividad deterioradora de microorganismos en carne de pescado biopreservada. Además, la interacción entre microorganismos determina la selección, metabolismo y subsiguiente ruta de actividad de los organismos deterioradores, dificultando la comprensión.
Análisis sensorial
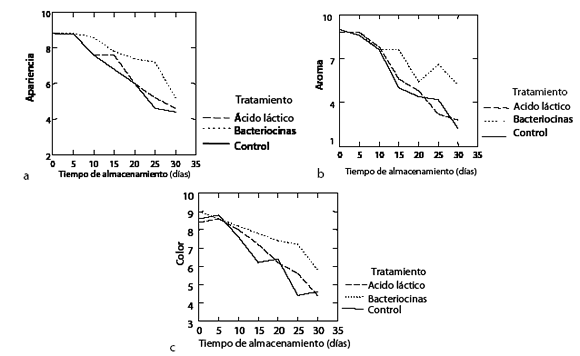
Los resultados del análisis sensorial de filetes de híbrido de cachama durante el almacenamiento aparecen en la Figura 3.
Figura 3. Cambios sensoriales en filetes de híbrido de cachama empacados al vacío durante 30 días de almacenamiento a 3ºC. Apariencia (a), color (b), aroma (c).
Con el incremento del tiempo de almacenamiento disminuyó el valor de aceptación en los atributos evaluados. Los menores puntajes fueron para los atributos de apariencia y color, superiores al límite de aceptabilidad estimado en 4. No obstante el tratamiento con extracto crudo de bacteriocinas consiguió el mejor puntaje al final del periodo de almacenamiento (P<0.05). Para el atributo aroma, el tratamiento con ácido láctico y control quedó por fuera del rango de aceptabilidad; sin embargo, el tratamiento con extracto crudo de bacteriocinas registró un alto grado de aceptabilidad por parte de los panelistas (P<0.05) al final del periodo de almacenamiento. Para los atributos de apariencia y color, el puntaje obtenido fue superior al límite establecido para el final del periodo, y resultó superior el tratamiento con extracto crudo de bacteriocinas (P<0.05).
La opacidad, la decoloración de la piel y la presencia de off oduor fueron las principales causas atribuidas a los bajos puntajes obtenidos en los tratamientos. Según los resultados de la prueba microbiológica y sensorial, podría considerarse a las enzimas proteolíticas como responsables del impacto sobre la pérdida de calidad de los filetes de pescado, pero no siempre son responsables por los característicos off flavor y off oduor, típicos de la actividad microbiana (34). También es posible que las bacterias psicrotróficas, aunque presentes en bajo nivel, participen en el deterioro, porque estos microorganismos pueden producir fuerte off oduor, lo cual se demostró cuando fueron inoculados en salmón ahumado refrigerado (35, 36). Similares resultados han sido reportados por otros autores (30), cuando utilizaron extracto crudo de bacteriocinas producidas por C. divergens V41 en salmón ahumado mantenido en refrigeración, donde fuertes off flavor y off oduor fueron detectados por el panel sensorial. Sin embargo, no se reporta una clara relación entre algunos microorganismos y cambios sensoriales en productos piscícolas empacados al vacío (37). En el presente estudio solamente se presentó rechazo sensorial para el atributo aroma en el tratamiento con ácido láctico y control, el día 25 de almacenamiento, y se halló diferencia estadística con respecto al tratamiento con extracto crudo de bacteriocinas. Este rechazo sensorial no coincide con el conteo de bacterias, porque no excedió el límite considerado como deteriorado (<107 ufc/g); sin embargo, el desarrollo de off odour es el resultado de la actividad microbiana (6). Es posible que la presencia de piel en los filetes incremente los conteos bacterianos iniciales e incida en el aroma con productos del metabolismo microbiano, donde se demuestra que el tratamiento con extracto crudo de bacteriocina fue efectivo.
El presente estudio contribuyó a reconocer el comportamiento de bacterias deterioradoras en filetes de cachama biopreservados con un extracto crudo de bacteriocinas. Es importante observar que los efectos preservativos no influyeron negativamente sobre las características sensoriales.
La actividad antagónica muestra ser un importante agente biopreservante, que podría ser utilizado en filetes de cachama empacados al vacío y refrigerados; esta consideración tendría validez en la medida que la matriz y la temperatura utilizadas facilitan la actividad de las sustancias bactericidas.
AGRADECIMIENTOS
Los autores agradecen a la profesora Olga Inés Montoya, directora del grupo de investigación en Biotecnología Microbiana de la Universidad Nacional de Colombia, por el aporte de la cepa de Lactobacillus plantarum LPMB10, y al profesor Víctor Atencio García, director del Centro de Investigación Piscícola de la Universidad de Córdoba, CINPIC, por el aporte de los peces requeridos para el presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. FAO. El estado mundial de la pesca y la acuicultura. Roma; 2004. [ Links ]
2. Zuckerman H, Avraham RB. Control of growth of L. monocytogenes in fresh salmon using microgardtand nisin. Lebens-Wiss-u-Technol 2002; 35:543–548. [ Links ]
3. Al-zoreky N, Ayres JW, Sandine WE. Characterization of propionibacterial growth metabolites inhibitory for gram negative bacterial. J Cultura and Dairy Prod 1993; 184: 4–13. [ Links ]
4. Vázquez JA, González MP, Murado MA. Preliminary tests on nisin and pediocin production using waste protein sources factorial and kinetic studies. Bioresource Techn 2006; 97:605–613. [ Links ]
5. Tomé E, Teixeira P, Gibbs PA. Anti-listerial inhibitory lactic acid bacteria isolated from commercial cold smoked salmon. Food Microbiol 2006; 23:399–405. [ Links ]
6. Dondero M, Cisternas F, Carvajal L, Simpson R. Changes in quality of vacuum-packed cold-smoked salmon (Salmo salar) as a function of storage temperature. Food Chem. 2004; 87: 543–550. [ Links ]
7. González-Rodríguez MN, Sanz JJ, Santos JA, Otero A, García-López ML. Numbers and types of microorganisms in vacuum-packed cold-smoked freshwater fish at the retail level. Int J Food Microbiol 2002; 77:161–168. [ Links ]
8. Lyhs U, Lahtinen J, Fredriksson-Ahomaa M, Hyytia-Trees E, Elfing K, Korkeala H. Microbiological quality and shelf-life of vacuum-packaged gravad' rainbow trout stored at 3 and 8ºC. Int J Food Microbiol. 2001; 70:221–230. [ Links ]
9. Fricourt BV, Barefoot SF, Testin RF, Hayasaka SS. Detection and activity of plantaricin F an antibacterial substance from Lactobacillus plantarum BF001 isolated of processed channel catfish. J Food Protection 1994; 57:698-702. [ Links ]
10. Campos CA, Rodríguez O, Calo-Mata P, Prado M, Barros-Velázquez J. Preliminary characterization of bacteriocins from Lactococcus lactis, Enterococcus faecium and Enterococcus mundtii strains isolated from turbot (Psetta maxima). Food Rese Int 2006; 39: 356–364. [ Links ]
11. Yamazaki K, Suzuki M, Kawai Y, Inque N, Montville T. Inhibition of Listeria monocytogenes in cold-smoked salmon by Carnobacterium piscicola CS526 isolated from frozen surimi. J Food Protec 2003; 66:1420–1425. [ Links ]
12. Duffes F, Leroi F, Boyaval P, Dousset X. Inhibition of Listeria monocytogenes by Carnobacterium spp strains in a simulated cold smoked fish system stored at 4 ºC. Int J Food Microbiol 1999; 47:33–42. [ Links ]
13. Ogunbanwo ST, Sanni AI, Onilude AA. African J Biotech. 2003; 2 (8), 219-227. [ Links ]
14. Lewus CB, Kaiser A, Montville TJ. Inhibition of food-borne bacterial pathogens by bacteriocins from lactic acid bacteria isolated from meat. Appl Environ Microbiol 1991; 57:1683-1688. [ Links ]
15. INVIMA. Manual de técnicas de análisis para control de calidad microbiológica de alimentos para consumo humano. Bogotá: INVIMA; 1998. [ Links ]
16. Goulas AE, Kontominas MG. Effect of salting and smoking-method on the keeping quality of chub mackerel (Scomber japonicus): biochemical and sensory attributes. Food Chem 2005; 93:511–520. [ Links ]
17. Amerine MA, Pongborn RH, Roescler EB. Principles of sensory evaluation of food. New York: Academic Press; 1965. [ Links ]
18. ICMSF. Microorganisms in foods: 6. Microbial ecology of food commodities. Baltimore: Blackie Academic & Professional; 1998. [ Links ]
19. Hansen LT, Huss HH. Comparison of the microflora isolated from spoiled cold-smoked salmon from three smokehouses. Food Res Int 1998; 31: 703–711. [ Links ]
20. Vescovo M, Scolari G, Zacconi C. Inhibition of Listeria innocua growth by antimicrobial-producing lactic acid cultures in vacuum-packed cold-smoked salmon. Food Microbiol 2006; 23:689–693. [ Links ]
21. Garcia T, Martín R, Sanz B, Hernández PE. Extensión de la vida útil de la carne fresca. I: Envasado en atmósferas modificadas y utilización de bacterias lácticas y bacteriocinas. Rev Esp Cienc Tecnol Aliment 1995; 35(1)1-18. [ Links ]
22. Quintavalla S, Vicina L. Antimicrobial food packaging in meat industry. Meat Sci 2002; 62:373-380. [ Links ]
23. Schöbitz R, González J, Vignolo G, Molina LH. Control de Listeria monocytogenes en salmón ahumado mediante la aplicación de bacteriocinas producidas por bacterias lácticas. La Alimentación Latinoamericana 2006; 264:64-69. [ Links ]
24. Vignolo G, Palacios J, Farías ME, Sesma F, Schillinger U, Holzapfel W, et al. Combined effect of bacteriocins on the survival of various Listeria species in broth and meat system. Curr Microbiol 2000; 41:410-416. [ Links ]
25. Crandall D, Montville T. Nisin resistance in Listeria monocytogenes ATCC 700302 is a complex phenotype. Appl Environ Microbiol 1998; 64: 231-237. [ Links ]
26. Schillinger U, Chung H, Keppler K, Holzapfel W. Use of bacteriocinogenic lactic acid bacteria to inhibit spontaneous nisin-resitant mutants of Listeria monocytogenes Scott A. J Appl Microbiol 1998; 85:657-663. [ Links ]
27. Duffes F, Corre C, Leroi F, Dousset X, Boyaval P. Inhibition of Listeria monocytogenes by in situ produced and semipuried bacteriocins of Carnobacterium spp. on vacuumpacked, refrigerated cold-smoked salmon. J Food Protection 2000; 62:(12)1394–1403. [ Links ]
28. Vaz-velho M, Todorov S, Ribeiro J, Gibbs P. Growth control of Listeria innocua 2030C during processing and storage of cold-smoked salmon-trout by Carnobacterium divergens V41 culture and supernatant. Food Control 2005; 16:541–549. [ Links ]
29. Leroi F, Joffraud JJ, Chevalier F, Cardinal M. Research of quality indices for cold-smoked salmon using a stepwise multiple regression of microbiological counts and physicochemical parameters. J Appl Microbiol 2001; 90: 578– 587. [ Links ]
30. Brillet A, Pilet M, Prevost H, Cardinal M, Leroi F. Effect of inoculation of Carnobacterium divergens V41, a biopreservative strain against Listeria monocytogenes risk, on the microbiological, chemical and sensory quality of cold-smoked salmon. Int J Food Microbiol 2005; 104: 309– 324. [ Links ]
31. Joffraud JJ, Cardinal M, Cornet J, Chasles JS, Léon S, Gigout F. Effect of bacterial interactions on the spoilage of cold-smoked salmon. Int J Food Microbiol 2006; 112: 51–61. [ Links ]
32. Jorgensen LV, Huss HH, Dalgaard P. The effect of biogenic amine production by single bacterial cultures and metabiosis on cold-smoked salmon. J Appl Microbiol 2000; 89:920–934. [ Links ]
33. Gram L, Huss H. Microbiological spoilage of fish and fish products. Int J Food Microbiol 1996, 33, 121–137. [ Links ]
34. Truelstrup L, Gill T, Drewes S, Huss H. Importance of autolysis and microbiological activity on quality of cold-smoked salmon. Food Res Int 1996; 29:(2)181–188. [ Links ]
35. Joffraud JJ, Leroi F, Roy C, Berdague JL. Characterization of volatile compounds produced by bacteria isolated from the spoilage flora of cold-smoked salmon. Int J Food Microbiol 2001; 66:175–184. [ Links ]
36. Stohr V, Joffraud JJ, Cardinal M, Leroi F. Spoilage potential and sensory profile associated with bacteria isolated from cold-smoked salmon. Food Res Int 2001; 34:797– 806. [ Links ]
37. Lyhs U, Korkeala H, Björkroth J. Identification of lactic acid bacteria from spoiled, vacuum-packaged gravad' rainbow trout using ribotyping. Int J Food Microbiol 2002; 72:147– 153. [ Links ]
Recibido: Noviembre 21 de 2007; Aceptado: Marzo 18 de 2008
* Autor a quien se debe dirigir la correspondencia: hsuarezm@unal.edu.co













 3
3