Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.3 Medellín Sept./Dec. 2010
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
OBTENCIÓN DE JARABES DE FRUCTOSA A PARTIR DE HIDROLIZADOS ENZIMÁTICOS DE ALMIDÓN DE ÑAME
(Dioscorea alata y Dioscorea rotundata)
FRUCTOSE SYRUP OBTENTION FROM ENZYMATIC HYDROLYSED OF YAM STARCH (Dioscorea alata and Dioscorea rotundata)
Jairo G. SALCEDO M.1; Everaldo J. MONTES M.2; JOSÉ E. Zapata M.3; Didier A. MÁRQUEZ H.4; Miguel DIAZ A.4
1 Universidad de Sucre. Departamento de Ingeniería Agroindustrial. Calle 25 No. 23-53. Sincelejo, Colombia, jairo.salcedo@unisucre.edu.co.
2 Universidad de Córdoba. Departamento de Ingeniería de Alimentos. Carrera 14D, No. 47-06. Montería, Colombia.
3 Universidad de Antioquía. Departamento de Ingeniería de Alimentos. A.A. 1226. Medellín, Colombia.
4 Universidad de Sucre. Departamento de Biología. Calle 25 No. 23-53, Sincelejo, Colombia.
RESUMEN
En este trabajo se evaluó el rendimiento de la producción de jarabes de fructosa a partir del almidón extraído de dos especies de ñame (Dioscorea alata var. Diamante y Dioscorea rotundata var. Espino). Se estableció un diseño experimental multifactor categórico completamente al azar con dos factores: concentración de sustrato en cinco niveles: 10, 20, 30, 40, 50% p/v, y la especie de ñame en dos niveles: Dioscorea alata, var. Diamante y Dioscorea rotundata, var. Espino. Para la obtención de fructosa, inicialmente se prepararon jarabes de glucosa por medio de hidrólisis enzimática del almidón de ñame, utilizando las enzimas de Novozymes®, alfa-amilasa Termamyl 120L (etapa de licuefacción) y aminoglucosidasa (AMG) 300L (etapa de sacarificación). En esta etapa los máximos equivalentes de dextrosa (ED) obtenidos son 98,28 y 96,84, para una concentración de sustrato del 30% p/v. Posteriormente se procedió a isomerizar los jarabes de glucosa a jarabes de fructuosa, utilizando la enzima inmovilizada Sweetzyme de Novozymes®.
Los mejores resultados se alcanzaron a una concentración de sustrato del 30% p/v para ambas especies de ñame, las cuales presentan concentraciones de 220,57 y 210,36 g de fructosa/L, con conversiones de glucosa a fructosa de 71,46% y 67,28% para ñame Espino y Diamante respectivamente. No se encontraron diferencias estadísticamente significativas entre las especies de ñame (D. alata var. Diamante y D. rotundata var. Espino), a un nivel de confianza del 5%, en cuanto a la producción de jarabe fructosado.
Palabras clave: alfa-amilasa, hidrólisis, ñame, rendimiento, sustrato.
ABSTRACT
This investigation evaluated the yield of fructose syrup production from extracted starch of two yam species (Dioscorea alata, var. Diamond and Dioscorea rotundata, var. Espino). The experiment was conducted using an at random experimental design of multiple categorical factor analysis with two factors: a substrate concentration factor at five levels: 10, 20, 30, 40, 50% p/v and the yam species factor at two levels (Dioscorea alata, var Diamond and Dioscorea rotundata, var Espino). To obtain fructose, initially glucose syrups were prepared by enzymatic hydrolysis of yam starch using the enzymes of Novozymes®, alpha-amylase Termamyl 120L (liquefaction stage) and AMG 300L (saccharification stage). At this stage, dextrose maximum equivalents (ED) obtained were 98.28 and 96.84 for a substrate concentration of 30% w/v. In a later stage isomerisation from glucose syrups to fructose syrups using the immobilized enzyme Sweetzyme of Novozymes® was carried out.
The best results were achieved with substrate concentrations of 30% p/v for both yam species, which showed fructose concentrations of 220.57 and 210.36 g/L with conversions of 71.46% and 67.28% in Espino and Diamond yams respectively. No statistically significant differences were observed between the yam species (D. alata var. Diamante and D. rotundata var. Espino) at a confidence level of 5%, regarding the production of fructose syrup.
Key words: alpha-amylase, hydrolysis, substrate, yam, yield.
INTRODUCCIÓN
El cultivo de ñame (Dioscorea spp.) tiene lugar frecuentemente en zonas económicamente deprimidas, y requiere innovaciones tanto en aspectos técnicos como de índole empresarial (1). Es el tercer tubérculo en importancia en el mundo, después de la yuca (Manihot esculenta Crantz.) y la papa dulce (Ipomoea batatas L. Lam.) (2, 3). Pertenece a la familia Dioscoreácea, la cual incluye cinco géneros y comprende cerca de 750 especies. Está provisto de tubérculos subterráneos con contenidos de almidón de más del 30% (30 - 32% Dioscorea alata y 34- 38% Dioscorea rotundata); sus f lores son unisexuales, actinomorfas y reunidas en racimos. Es una planta netamente tropical, que se desarrolla mejor con temperaturas entre 25 y 30°C y una precipitación superior a los 1000 mm/año. Su período vegetativo toma entre 8 y 11 meses; requiere humedad durante los cinco primeros meses de su desarrollo y necesita abundante luz para su mejor rendimiento en cultivo (2, 4, 5).
La mayor parte del ñame producido en Colombia se consume en el país; un porcentaje menor de la producción se exporta, principalmente a los mercados de Estados Unidos y Europa, para satisfacer las necesidades de la población de origen latino, y significan para el país más de US $2.5 millones anuales (1).
En la Costa Atlántica colombiana, la zona de mayor producción de ñame en el país, se trabajan alrededor de 29.757 ha, que involucran a 9.000 familias de pequeños agricultores, con un área promedio de 1,4 ha por familia, un rendimiento promedio de 11,9 ton/ha y una producción de 264.500 ton/año (6). En el año 2005, el primer productor de ñame en la costa Caribe Colombiana fue el departamento de Bolívar, con un área sembrada de 9.176 hectáreas y rendimientos promedio de 13.483 Kg/ha, seguido por los departamentos de Córdoba y Sucre, con 10.066 y 2.845 ha y rendimientos de 9.672, 9.163 kg/ha respectivamente (7).
La Dioscorea rotundata es también conocida como ''ñame de Guinea'', es originaria de África del Oeste y, sin lugar a dudas, la especie más popular de ñame en África, especialmente en Nigeria y Ghana. Sus rendimientos oscilan entre 3.000 y 15.000 lb/acre. Se trata de una especie de tronco espinoso y redondo en corte transversal y con amplias hojas en forma de corazón. Los tubérculos son relativamente pequeños, de forma cilíndrica y poco numerosos. Su peso varía habitualmente de 2 a 5 kg; su superficie es lisa y marrón y su carne blanca y firme (8).
La Dioscorea alata es también conocida como ''ñame alado'' o ''ñame de los retretes'' y su cultivo es el más extendido a nivel mundial. Es originaria del sureste asiático, de donde se extiende a Indonesia, África y América tropical (3). Esta especie debe su nombre al hecho de que posee troncos cuadrangulares alados. Las hojas son oviformes y generalmente más claras y grandes que las de D. rotundata. Muchas variedades muestran matices púrpuras sobre las hojas. Los tubérculos son muy variables: pesan de 5 a 10 kg, y llegan hasta más de 50 kg. En cuanto a la forma, son más o menos cilíndricos en la mayoría de los casos. La carne es blanca o posee matices púrpuras, la textura es ácuea. Esta especie se cultiva en América y concretamente en Colombia desde la llegada de los primeros barcos españoles cargados de esclavos africanos; por tanto es normal encontrarla asociada a las culturas negras (8).
La creciente demanda de etanol para la producción de combustibles y el montaje de plantas productoras de alcohol anhidro a partir de caña y maíz, han producido un alza de los precios del maíz, principal materia prima para la producción de fructosa. En consecuencia, es preciso buscar nuevas alternativas para la obtención de edulcorantes basados en la fructosa, porque ésta ofrece ventajas como edulcorante por sus propiedades sensoriales y nutricionales (9). En este panorama el ñame se presenta como una excelente alternativa para la producción de jarabe de fructosa, dado su alto contenido en almidón (3) y la posibilidad de hidrolizarlo a glucosa para luego isomerizarlo a fructosa.
En la literatura se da cuenta de trabajos para la producción de fructosa a partir de diversas materias primas de origen amiláceo como la yuca (10) y el plátano (Musa paradisiaca L.) var. Macho (11), así como estudios de cinética de isomerización de glucosa a fructosa con enzimas comerciales del tipo Sweetzyme, de Novozymes®, estableciendo velocidades de reacción y constantes de Michaelis-Menten (12). Se ha estudiado la eficiencia catalítica de glucosa isomerasa (GI) de Streptomyces rubiginosus inmovilizada, en la isomerización de glucosa a fructosa (13). Se ha modelado el comportamiento de reactores de lecho empacado estableciendo la influencia del número de Re y número axial peclet (Pea) en la capacidad de ejecución de los reactores (14). Se han hecho estudios sobre la producción y comercialización del ñame (3, 7), así como investigaciones orientadas a prevenir las enfermedades que lo aquejan (8). Sin embargo, son escasos los trabajos encauzados a la obtención de edulcorantes a partir de almidón del ñame, y específicamente enfocados en la obtención de fructosa.
En el presente trabajo se busca evaluar los rendimientos en la producción de jarabes de fructosa a partir de la hidrólisis enzimática del almidón extraído de dos variedades de ñame, Diamante y Espino, de las especies Dioscorea alata y Dioscorea rotundata respectivamente, utilizando las enzimas de Novozymes®: alfa-amilasa (Termamyl 120L), amiloglucosidasa (AMG 300L) y glucosa isomerasa (Sweetzyme®).
MATERIALES Y MÉTODOS
Este trabajo se realizó en el Laboratorio de Microbiología de la Universidad de Sucre, Colombia. La materia prima se recolectó en el corregimiento de la Ceiba, municipio de Chalán, departamento de Sucre, en tiempo de cosecha (10 meses), realizando un muestreo del área de cultivo. Se efectuó un cuarteo del cual se tomaron quince muestras, cada una de 2,0 kg de peso, de Dioscorea alata (Diamante), y veinte muestras, de 1,5 kg cada una, de Dioscorea rotundata (Espino), las cuales se dividieron en 16 partes, y se mezclaron para obtener una materia prima homogénea.
Diseño experimental
Se aplicó un diseño experimental multifactor categórico completamente al azar con dos factores: el factor concentración de sustrato en cinco niveles: 10, 20, 30, 40, 50% p/v, y el factor especie de ñame en dos niveles: Dioscorea alata (variedad Diamante) y Dioscorea rotundata (variedad Espino), con tres repeticiones, para un total de 30 unidades experimentales por especie.
Obtención del almidón
El almidón se extrajo de forma manual. Inicialmente se pesó el ñame fresco sin procesar, y posteriormente se secó y peló. Los tubérculos se lavaron con agua potable para eliminar las impurezas, se les retiró la epidermis con el fin de dejar la pulpa expuesta para liberar los gránulos de almidón contenidos en las células del parénquima mediante el rallado, el cual se practicó en seco con rallador manual. La masa rallada se suspendió en una solución de amoniaco (0,03M) durante cinco minutos con el objetivo de retirar los mucílagos y facilitar la operación de tamizado de acuerdo con la metodología descrita por Moorthy, 1994 (15). Se procedió al tamizado en un lienzo de tela de nylon; la sedimentación se efectuó en tanques plásticos de 100 litros durante 24 horas; se retiró el sobrenadante y luego el almidón se resuspendió en agua con el objetivo de eliminar la mayor cantidad de impurezas. El almidón se extendió sobre un plástico para obtener su secado aprovechando la energía solar y, una vez seco, se le determinó la humedad según el método, 930.15/90 de la AOAC (16), y luego se almacenó en envases plásticos secos y herméticamente sellados.
Producción de jarabes de glucosa
Para la licuefacción se adaptaron vasos de precipitados de 1 L, en los cuales se depositó 0.5 L de solución de almidón en concentraciones de 10, 20, 30, 40, y 50% p/v. A cada vaso de precipitados se le adicionó cloruro cálcico (CaCl2), hasta alcanzar una concentración de iones calcio de 70 ppm, se ajustó el pH a 6,5 y se agregó la enzima alfa-amilasa (Termamyl 120L de Novozymes®). Las soluciones se introdujeron en un baño termostatado a 90 ºC, con una agitación de 250 rpm y tiempo de residencia de 2 horas. Se hizo el seguimiento a la hidrólisis mediante el análisis de azúcares reductores, tomando muestras a las 0,33; 0,66; 1,00; 1,33; 1,66 y 2,0 h.
Durante la sacarificación, la solución resultante de la licuefacción se enfrió a 60ºC, se ajustó el pH a 4,5 con ácido sulfúrico 0,4 N y se estabilizó con una solución tampón de fosfato, luego se agregó la enzima amiloglucosidasa (AMG 300L), manteniendo una agitación de 250 rpm durante 2 horas. Se tomaron muestras a las 0,5; 1,0; 1,5 y 2,0 h para el seguimiento de la hidrólisis.
La relación enzima /sustrato se mantuvo constante en todos los ensayos: de 7,92 x 10-4 mL enzima/g de almidón para Termamyl 120L y de 9,75 x 10-2 mL enzima/g de almidón para AMG 300 L.
Determinación de equivalentes de dextrosa (ED)
La determinación de azúcares reductores (AR) se obtuvo según el método del ácido 3,5 dinitrosalicilico (DNS) descrito por Miller, 1959 (17), y el equivalente de dextrosa se determinó con la siguiente ecuación:
ED = (AR/M) * 100
AR = cantidad de azúcares reductores presentes en la muestra
M = peso de la muestra seca en gramos
Filtración
Con el fin de eliminar las impurezas del producto final, los jarabes de glucosa obtenidos en el proceso de licuefacción sacarificación se mezclaron con carbón activado a 30Cº. Posteriormente se sometieron a filtración con una bomba de vacío de 1/6 H.P modelo SA55NXGTE-4870 a 400 mmHg.
Conversión de jarabes de glucosa a jarabes de fructosa
Se tomaron 200 mL de jarabe de glucosa obtenido de la hidrólisis del almidón, a los que se les adicionaron iones Mg+2 y sulfito (SO2) hasta alcanzar una concentración de 100 ppm en ambos casos. El pH se ajustó a 7,5 con carbonato de sodio (Na2CO3). La isomerización de la glucosa se efectuó en un reactor diferencial de lecho fijo (relación diámetro:altura 1:20) a temperatura entre 58 y 60Cº, regulada por un baño termostatado. Se adicionaron 10 g de la enzima inmovilizada glucosa isomerasa (Sweetzyme de Novozymes®). El sustrato fue administrado con una bomba peristáltica (Maxterflex C/L® PUMP SYSTEM) a una velocidad de flujo de 2 mL/minuto.
Del reactor de lecho fijo se tomaron muestras cada hora durante 15 horas, a las cuales se les determinó el contenido de glucosa por el método de Glucosa Oxidasa/ Peroxidasa (GOD/POD), de acuerdo con las condiciones recomendadas por la firma BioSystems. Para este procedimiento se utilizó un fotocolorímetro (Microlab 200 de Merck®). Se calculó el contenido de fructosa por la diferencia entre las concentraciones iniciales y las finales de glucosa.
RESULTADOS Y DISCUSIÓN
Obtención del almidón de ñame
En el proceso de extracción del almidón de ñame se obtuvo un promedio 4,86 kg de almidón a partir de 30 kg de ñame Diamante (D. alata), que equivale a un rendimiento del 16,2%, superior al registrado para la misma especie por Hurtado et al., 1997 (18), y al de Díaz y Garay, 2004 (19), quienes reportaron 5,3 y 12,16% respectivamente. Para ñame Espino (D. rotundata) se obtuvo un rendimiento del 13,7% p/p, menor que el reportado por Hurtado et al., 1997 (18), de 16,6% p/p.
La literatura sobre el tema informa de bajos rendimientos del ñame con respecto a otros tubérculos, como la yuca (22,10 %) (10), lo cual se debe, posiblemente, a su polimorfismo característico y al grosor de su concha, que dificultan la operación de pelado ocasionando pérdidas de los rizomas. También puede atribuirse, en parte, al alto contenido de mucílagos que obstaculiza la sedimentación y origina no solamente pérdidas en la extracción sino también problemas en la calidad del almidón (20).
La humedad del ñame fresco fue de 64,85% para la variedad Diamante (D. alata) y 70,62% para la variedad Espino (D. rotundata), valores que se encuentran dentro del rango normal de humedad informado para estas especies (21).
En cuanto al almidón de ñame Diamante (D. alata), su humedad tuvo un valor de 12,42%, comparable al valor promedio para almidón de esta variedad de ñame reportado por Díaz y Garay, 2004 (19), y Osorio y Ramos, 2005 (22), con el 11,46% y 16,60% respectivamente. Para el almidón de ñame Espino (D. rotundata), se encontró humedad de 15,14% en base húmeda.
Producción de jarabes de glucosa
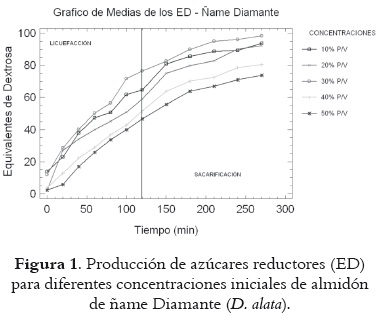
En la figura 1 se presentan los equivalentes de dextrosa (ED) obtenidos por licuefacción y sacarificación del almidón de ñame Diamante. Se observan diferencias en función de la concentración de almidón utilizada; así, las concentraciones del 10, 20 y 30% p/v tienen valores por encima de las demás concentraciones, y la del 30% p/v es la que exhibe el ED más alto (98.28 unidades), valor que se encuentra en el rango máximo reportado por la literatura (94-98 unidades de ED) (22).
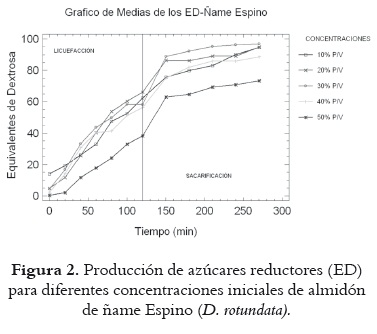
Los resultados de sacarificación y licuefacción en los almidones de ñame Espino se presentan en la figura 2, e indican marcadas diferencias en la producción de equivalentes de dextrosa en función de la concentración de sustrato utilizada; así, el valor máximo alcanzado es de 96,84 unidades de ED para la concentración del 30% p/v de almidón. Estos resultados son similares a los reportados por Pardo et al., 2004 (23), quienes obtuvieron ED de 96 unidades utilizando almidón de papa, lo que indica el potencial del ñame como materia prima para la producción de jarabes glucosados.
En las dos especies de ñame se advierte una tendencia creciente en los valores de ED cuando se pasa de 10% a 30% en la concentración de sustrato usada en la licuefacción – sacarificación. En ambos casos se obtienen valores bajos de ED al 40% p/v (80,38 y 88,65 unidades para Diamante y Espino respectivamente), y mínimos al 50% (73,66 y 73,27 unidades para Diamante y Espino respectivamente), lo que indica que la hidrólisis enzimática del almidón de ñame no se ve afectada de forma significativa por la variedad de ñame utilizado, pero sí por la concentración de sustrato. Estos valores de ED están próximos a los reportados por Chica, 1996 (24), para la hidrólisis del almidón de papa (85-90 ED), y a los de Lujan et al., 2001 (25), en la hidrólisis del almidón de yuca (ED de 88.34 unidades).
El hecho de que se observe un claro descenso en los valores de ED para concentraciones de almidón superiores al 30% p/v podría asociarse con algún tipo de inhibición de la enzima por parte del sustrato, o con el efecto de la concentración del sustrato sobre la fluidodinámica del sistema, puesto que un alto contenido de almidón puede aumentar la viscosidad del medio restringiendo las posibilidades de la interacción enzima-sustrato. Para aclarar este aspecto se requieren trabajos que profundicen en la cinética de la hidrólisis enzimática del almidón de ñame específicamente.
Conversión de jarabes de glucosa a jarabes de fructosa
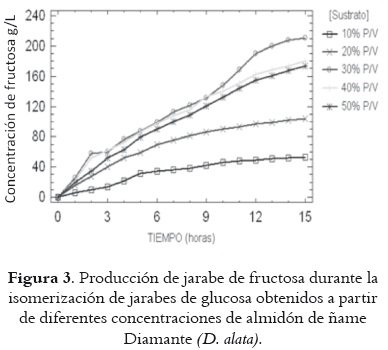
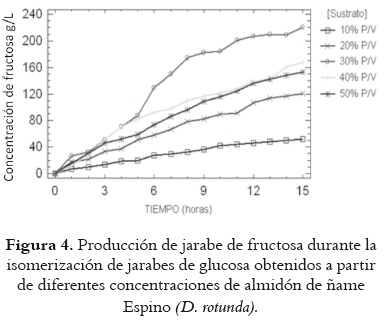
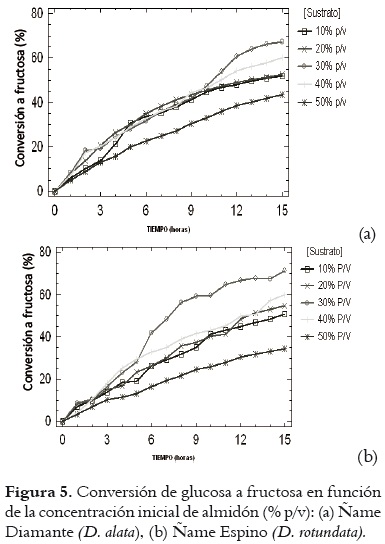
La concentración de fructosa obtenida en cada jarabe durante el proceso de isomerización del almidón de ñame Diamante y Espino puede apreciarse en las figuras 3 y 4. El comportamiento de las curvas para ambas variedades de ñame es semejante. Se registra una mayor producción de fructosa en los jarabes del 30% p/v de almidón, que llega a concentraciones de fructosa 210,3 g/L para ñame Diamante y 220,5 g/L para ñame Espino. En la figura 5 se presenta la conversión de glucosa a fructosa en función de la concentración inicial de almidón. Los resultados para la concentración de almidón del 30% p/v fueron de 67,3 y 71,4% para ñame Diamante y Espino respectivamente, y las más altas entre las evaluadas.
Los resultados obtenidos para concentraciones de almidón de 10, 20, 30 y 40% p/v destacan las posibilidades del ñame como fuente de fructosa vía hidrólisis enzimática e isomerización de glucosa, especialmente cuando se compara con otras fuentes de almidón exploradas con el mismo objetivo, como son los casos del plátano (11) y la yuca (26).
Evaluación de los rendimientos a jarabe de fructosa
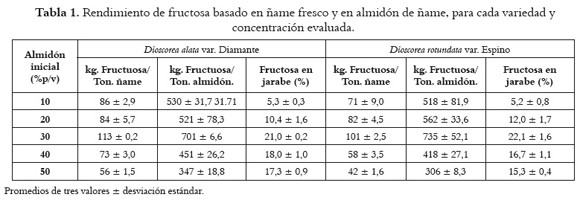
Para llevar a cabo estudios económicos en el montaje de este tipo de procesos es importante evaluar los posibles rendimientos de jarabes de fructosa a partir de ñame y de almidón de ñame Diamante y Espino respectivamente, así como la concentración de fructosa en los jarabes obtenidos en cada uno de los ensayos. En la tabla 1 se aprecian los rendimientos de fructosa calculados con base en ñame fresco y en almidón de ñame, para cada variedad de ñame y concentración de almidón inicial, utilizadas en este trabajo.
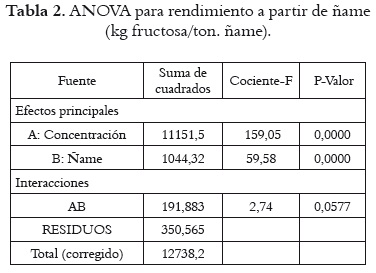
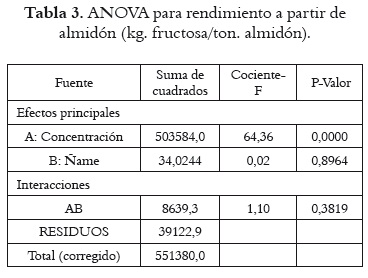
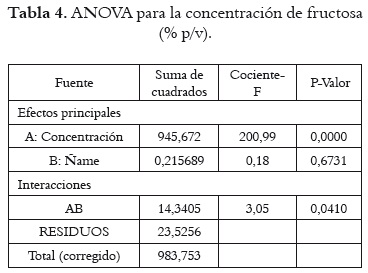
El análisis de varianza (ANOVA) de los rendimientos de jarabes de fructosa obtenidos a partir de ñame fresco se presenta en la tabla 2. En ella se observa que existe efecto estadísticamente significativo sobre el rendimiento, tanto por la concentración de almidón (P = 0,0000) como por la variedad de ñame (P = 0,0000). Sin embargo, para el rendimiento a partir de almidón hay efectos estadísticamente significativos por concentraciones de almidón (P = 0,0000), pero no por especies de ñame (P = 0,8964), como se muestra en la tabla 3.
De igual manera, en la tabla 4 se puede observar el ANOVA para la concentración de fructosa en el jarabe. En ella se observa que no se hay efecto estadísticamente significativo en cuanto a la especie de ñame, pero sí en cuanto a la concentración de almidón en la solución inicial (P = 0,0000). Esto se corresponde con el comportamiento de las curvas que se presentan en las figuras 3 y 4, que denota una tendencia similar en las dos variedades de ñame, con las más altas concentraciones de fructosa para el jarabe con 30% p/v de almidón inicial.
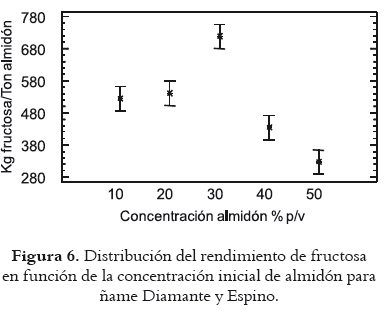
La figura 6 permite apreciar que los rendimientos de fructosa calculados basados en el almidón registran homogeneidad para las concentraciones de almidón del 10 y 20%. Dichos rendimientos se incrementan al pasar a la concentración del 30%, con valores de 701,22 kg. de fructosa/tonelada de almidón de ñame Diamante y 735,25 kg de fructosa/tonelada de almidón de ñame Espino, con valores muy inferiores para concentraciones de almidón del 40 y 50%. Consecuentemente, los rendimientos de fructosa calculados a partir de ñame fresco son mayores para los sustratos con 30% de almidón inicial, con valores de 113,60 kg. de fructosa/toneladas de ñame Diamante y 100,70 kg de fructosa/toneladas de ñame Espino. Así pues, la concentración del 30% de almidón resulta la más prometedora a la hora de avanzar en el desarrollo de sistemas para la explotación industrial del ñame con miras a la producción de jarabes de fructosa.
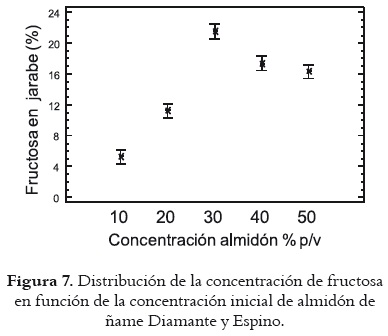
Según se observa en la figura 7, los jarabes que presentan mayor concentración de fructosa son los de 30% p/v. En ellos se obtienen 21,04% y 22,06% de fructosa para ñame Diamante y Espino respectivamente, ubicándose dentro de los jarabes de segunda generación (27). Lo siguen los jarabes de 40 y 50% p/v, cuyas concentraciones fueron de 18,03%; 16,74% y 17,37%; 15,29% para ambas variedades respectivamente.
CONCLUSIONES
En este estudio se encuentra que ninguna de las dos variedades de ñame evaluadas afecta de forma significativa la obtención de jarabe de glucosa y la conversión de glucosa a fructosa, mientras que la concentración de sustrato sí tiene un efecto importante. A partir de una concentración del 30%p/v de almidón es mayor la concentración de glucosa que se genera en el producto.
El comportamiento similar de ambas enzimas (alfa amilasa y AMG) en función de la concentración de sustrato permite apreciar el efecto de la concentración de sustrato sobre el sistema reaccionante, y plantea la necesidad de adelantar estudios que profundicen en la cinética de hidrólisis enzimática del almidón de ñame.
REFERENCIAS BIBLIOGRÁFICAS
1. Buitrago G, Guzman M. Ñame: Producción de semillas por biotecnología. Vol. 1. Bogotá, Colombia: Unibiblos; 2000. 112 p. [ Links ]
2. Marcos J, Lacointe A, Tournebize R, Bonhomme R, Sierra J. Water yam (Dioscorea alata L.) development as affected by photoperiod and temperature: Experiment and modeling. Field Crop Res. 2009 Apr 3; 111 (3): 262–268. [ Links ]
3. Bustamante SL, Guzmán M, Buitrago G. Caracterización molecular del germoplasma de ñame colombiano utilizando ''DNA Amplificaron Fingerprinting (DAF)'' en condiciones radiactivas. Revista Colombiana de Biotecnología. 2003 Dec; 5 (2): 57–63. [ Links ]
4. Rodríguez-Sanoja R, Ruiz B, Guyot JP, Sánchez S. Starchbinding domain affects catalysis in two lactobacillus α- amylases. Appl Environ Microbiol. 2005 Jan; 71 (1): 297–302. [ Links ]
5. Oke OL. Yam: a valuable source of food and drugs. World Rev Nutr Diet. 1972; 15: 156-184. [ Links ]
6. Alvis A, Vélez CA. Modelado del proceso de fritura del ñame (Dioscorea alata) mediante mediciones reológicas usando la metodología de superficie de respuesta. Información Tecnológica. 2008; 19 (5): 11-18. [ Links ]
7. Ministerio de Agricultura y Desarrollo Rural. Anuario estadístico del sector agropecuario [CD-ROM]. Bogotá, Colombia: Minagricultura; 2005. 1 CD-ROM. [ Links ]
8. Onyeka TJ, Petro D, Ano G, Etienne S, Rubens S. Resistance in water yam (Dioscorea alata) cultivars in the French West Indies to anthracnose disease based on tissue culture-derived whole-plant assay. Plant Pathol. 2006 Mar 3; 55 (5): 671–678. [ Links ]
9. Borges da Silva EA, Ulson de Sousa AA, de Sousa S, Rodríguez A. Analysis of the high-fructose syrup production using reactive SMB technology. Chem Eng J. 2006 May 15; 118 (3):167–181. [ Links ]
10. Salcedo J, Montes E, Pájaro J. Producción de jarabes de fructosa por medio de la hidrólisis enzimática del almidón de yuca de las variedades Corpoica m tai-8 y corpoica orense. Dyna. 2009 Feb 23; 76 (160): 121-130. [ Links ]
11. Hernández J, Rodríguez S, Bello L. Obtención de jarabe fructosado a partir de almidón de plátano (musa paradisíaca l.). Caracterización parcial. INCI. 2008 May; 33 (5): 372-376. [ Links ]
12 Bravo V, Jurado E, Luzón G, Cruz N. Kinetics of fructose-glucose isomerization with sweetzyme type A. Can J Chem Eng. 1998 Aug; 76 (4): 778-783. [ Links ]
13. Tukel S, Alagöz D. Catalytic efficiency of immobilized glucose isomerase in isomerization of glucose to fructose. Food Chem. 2008 Dec 1; 111 (3): 658–662. [ Links ]
14. Dehkordi AM, Safari I, Karima MM. Experimental and modeling study of catalytic reaction of glucose isomerization: Kinetics and packed-bed dynamic modeling. Aiche J. 2008 May; 54 (5): 1333–1343. [ Links ]
15. Moorty SN. Tuber crop starches. Thiruvananthapuram - India: Center Tuber Crops Research Institute; 1994. 40 p. [ Links ]
16. AOAC International. Oficial Methods of Analysis of AOAC International [CD-ROM]. USA. Cunniff, Patricia; 1995. 1 CD-ROM. [ Links ]
17. Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 1959 Mar; 31 (3): 426-429. [ Links ]
18. Hurtado J, Ortiz R, Rodríguez G, Dufour D. Procesamiento de ñame (Dioscorea alata, D. rotundata): estudio de la factibilidad técnica y económica para la producción de almidón y harina y de sus propiedades fisicoquímicas. [Internet]. Ibagué, Colombia: CORPOICA. 1997. [Actualizado 1 de enero de 2007; citado 18 de enero de 2008]. Disponible en: http://publications.cirad.fr/une_notice.php?dk=389809. [ Links ]
19. Díaz A, Garay A. Evaluación de las propiedades tecnofuncionales de los almidones de ñame a partir de cinco variedades de Dioscorea alata (9506-027, 9403-001, 9605-047, 9506-021, 9506-025). [Trabajo de pregrado]. [Córdoba-Colombia]: Universidad de Córdoba: 2004. 157 p. [ Links ]
20. Misaki A, Ito T, Harada T. Constitutional studies on the mucilage of ''yamanoino'' Dioscorea batatas decne, forma Tsukune: isolation and structure of a mannan. Agr Biol Chem Tokyo. 1972; 36 (5): 761 – 771. [ Links ]
21. Falade KO, Olurin TO, Ike EA, Aworh OC. Effect of pretreatment and temperature on air-drying of Dioscorea alata and Dioscorea rotundata slices. J Food Eng. 2007 Jun; 80 (4):1002–1010. [ Links ]
22. Osorio J, Ramos Y. Caracterización y evaluación de las propiedades tecnofuncionales de cuatro variedades de almidones de ñame Dioscorea alata (9506-016, 9605-046, 9605-052, 9605-061). [Trabajo de pregrado]. [Córdoba-Colombia]: Universidad de Córdoba: 2005. 148 p. [ Links ]
23. Pardo M, Rivera P, Castellanos O, Gonzáles G. Estudio cinético de la hidrólisis enzimática de almidón de papa. Ingeniería e Investigación. 2004 May; 54: 66-84. [ Links ]
24. Chica L. Sacarificación del almidón de papa. [Trabajo de pregrado]. [Bogotá-Colombia]: Universidad Nacional de Colombia: 1996. 165 p. [ Links ]
25. Luján D, Alvarino N, Durango A, Salcedo J. Estudios preliminares para la obtención de jarabes de glucosa a partir de la hidrólisis enzimática del almidón de yuca utilizando extractos crudos de alfa-amilasa (B. licheniformis) y glucoamilasa (A. niger). Temas Agrarios. 2001; 6 (12): 65-72. [ Links ]
26. Blanco J. Producción de jarabes especiales de alta fructosa (HFSS) a partir de jarabes de glucosa obtenidos de tres variedades de yuca (Armenia, Amarga y Chile) cultivadas en la región de Guanenta (Santander). Bucaramanga: Departamento de Química, Universidad Industrial de Santander; 2002. 81 p. [ Links ]
27. García M, Quintero R, López-Munguía A. Biotecnología alimentaria. México: Limusa; 1993. 635 p. [ Links ]
Recibido: Abril 22 de 2008
Aceptado: Agosto 19 de 2010