Introducción
El ciclo menstrual es la manifestación periódica mensual que realiza el sistema reproductor femenino en favor de la iniciación de un embarazo. Los ciclos ovulatorios normales se caracterizan por su regularidad, con fases lúteas de catorce días y niveles de progesterona mesoluteínica entre 10 y 20 ng/mL 1.
Anovulación es la falta de liberación de ovocitos por los ovarios. Es un desorden que ocurre en el 25-30% de la infertilidad. La anovulación está presente en el 5% de mujeres con ciclos regulares, cuando cursan con fases lúteas inadecuadas y baja producción de progesterona, y en el 100% de mujeres con ciclos frecuentes, infrecuentes y amenorreas. La anovulación se torna crónica cuando persiste por más de seis meses, conllevando alteraciones endocrinas con tres riesgos fundamentales: (i) hiperplasia endometrial secundaria a hiperestrogenismo crónico sin oposición con progesterona; (ii) igualmente, resistencia a la insulina y enfermedad cardiovascular, y (iii) osteoporosis, en caso de hipoestrogenismo crónico. Por otro lado, la infertilidad anovulatoria constituye un motivo de consulta en continuo crecimiento, debido a que las mujeres buscan embarazarse a edades superiores a los 35 años, cuando la reserva ovárica entra en disminución permanente, como se puede ir constatando con la paralela disminucón de folículos antrales y de la hormona antimülleriana (HAM) 2.
Amenorrea secundaria es la falta de menstruación por tres meses consecutivos, en mujeres con ciclos previos regulares, o de 6 meses con ciclos irregulares, aunque es más práctico considerar solo 3 meses en todos los casos. La amenorrea secundaria tiene una prevalencia del 3-4%, ocasionada por las mismas causas endocrinas de la anovulación, más un adicional de alteraciones uterinas. Por lo tanto, la prevalencia de anovulación y amenorrea secundaria son diferentes; además, porque las pacientes consultan unas veces por infertilidad anovulatoria y otras veces por amenorrea.
Metodología
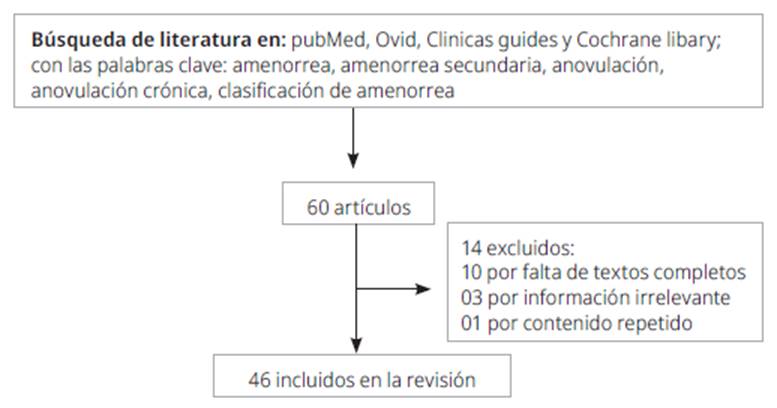
Este artículo es una revisión, con el objetivo de actualizar el enfoque y manejo de la anovulación y amenorrea secundaria. Para ello, se revisó la literatura médica de los últimos 10 años, en libros de texto, pubMed, Ovid, Clinical guidelines y Cochrane library, desde el primero de enero del 2010 hasta junio del 2020, en idiomas español e inglés, teniendo en cuenta las palabras clave. Finalmente se seleccionaron 3 libros de texto, de autores conocidos, con artículos pertinentes y 46 de 60 artículos (Figura 1).
Con los 5 artículos en libros de texto, y los 46 seleccionados en el flujograma, se obtuvo suficiente información para: (i) seleccionar la clasificación más didáctica, (ii) actualizar cada una de las causas, tanto de anovulación como de amenorrea secundaria y (iii) agrupar integralmente las causas, a fin de hacer un manejo de cada una de ellas con un enfoque comprensible, fácil y práctico.
Clasificación de la anovulación y amenorrea secundaria
En primer lugar, la amenorrea es primaria o secundaria. Sin embargo, es más prudente separar sus manejos. Si bien es cierto que, en general, tiene causas similares, es más prudente y fácil clasificarlas y manejarlas en forma separada. A juicio de muchos, es mejor clasificar la amenorrea primaria dependiendo de la presencia o ausencia de senos y de útero, dado que esos fenotipos femeninos muchas veces tienen cariotipos masculinos, 46 XY 3.
En segundo lugar, ante una paciente con amenorrea secundaria, lo primero que el médico debe hacer es descartar: (i) causas fisiológicas, como embarazo, lactancia y perimenopausia; (ii) causas iatrogénicas, como progestágenos, GnRHa, anticonceptivos hormonales, radioterapia, quimioterapia, etc., y (iii) amenorrea por enfermedades sistémicas, como alcoholismo, drogadicción, enfermedad hepática crónica, falla renal crónica, infecciones graves, inmunodeficiencias, etc.
Finalmente, nos quedamos con la anovulación y la amenorrea secundaria, ocasionadas por patologías endocrinas del eje hipotálamo-hipófisis-ovario (HHO), de la tiroides y de la cápsula suprarrenal, y una adicional de amenorrea de causa uterina. Para ellas hay numerosas clasificaciones, entre las que sobresalen la de la Organización Mundial de la Salud (OMS), la de la Sociedad Americana de Medicina Reproductiva y la clasificación en compartimentos.
Clasificación de la OMS
Incluye 7 grupos de amenorrea. Se presentará entre paréntesis el porcentaje de anovulaciones correspondiente a cada grupo 4.
Grupo 1. Hipogonadotrópica: falla hipotálamo-hipofisario (10%)
Grupo 2. Normogonadotrópica: disfunción hipotálamo-hipofisaria (85%)
Grupo 3. Hipergonadotrópica: falla gonadal (4%)
Grupo 4. Alteraciones uterinas
Grupo 5. Prolactinoma
Grupo 6. Hiperprolactinemia funcional
Grupo 7. Tumores hipotálamo-hipofisarios no hiperprolactinémicos
Esta clasificación presenta la tendencia de agrupar la anovulación en tres grupos: grupo I (hipogonadotrópicas), grupo II (normogonadotrópicas), grupo III (hipogonadotrópicas). Pero no incluye hipotiroidismo, hiperplasia adrenal, Síndrome de Cushing, ni tumores productores de andrógenos. Además, pone al síndrome de ovario poliquístico (sop) como una disfunción hipotalámica, a pesar de ser una compleja endocrinopatía en la que el ovario ocupa un protagonismo hiperandrogénico 5.
Clasificación de la Sociedad Americana de Medicina Reproductiva
Incluye una amplia distribución topográfica de difícil seguimiento, por incluir en un mismo grupo patologías muy heterogéneas 6.
Clasificación en compartimentos
De Speroff: mezcla primaria con secundaria en cuatro compartimentos ascendentes desde el punto de vista anatómico: útero, ovario, hipófisis e hipotálamo, desconociendo las causas tiroideas y suprarrenales 2.
De la sociedad española de fertilidad: las ubica en cuatro compartimentos descendentes, pero sin incluir causas tiroideas ni suprarrenales 7.
Clasificación en 5 compartimentos: publicada en 1993 por Rebar, ya integrando clínicamente la tiroides y la suprarrenal 8. No obstante, en Colombia la hemos ido modificando y actualizando, acorde a los avances en laboratorio hormonal e imagenología, hasta agrupar todas las causas de anovulación y amenorrea secundaria en 5 compartimentos, incluyendo la causa uterina de amenorrea. Así, queda completa, sencilla, fácil y práctica (Tabla 1) 1,9-12.
Tabla 1 Anovulación y amenorrea secundaria, clasificación etiológica en cinco compartimentos, con sus respectivas prevalências
1. Disfunción hipotalámica hipofisiaria (DHH)
Es una alteración que inicialmente tiene anovulación en ciclos regulares con gonadotropinas y estrógenos en los límites bajos de normalidad, después pasa a ciclos infrecuentes y, según la severidad, llega a amenorrea hipogonadotrópica-hipoestrogénica. Causa el 10% de la anovulación y el 15% de la amenorrea. Se caracteriza por la triada de estrés, alteraciones de peso y ejercicio físico intenso13.
El estrés físico y mental, fundamentalmente, producen aumento de hormona liberadora de corticotropina (CRH, por sus siglas en inglés), activando la producción de proopiomelanocortina, de donde se derivan las β-endorfinas que inhiben cantidad y frecuencia en bolos de GnRH; también por estrés hay producción de otros neurotransmisores inhibidores, como dopamina y serotonina. Adicionalmente, la DHH en mujeres jóvenes puede asociarse a problemas psiquiátricos, como bulimia y anorexia nerviosa. En consecuencia, a medida que van aumentándose los inhibidores del eje hipotalámico-hipofisiario-ovárico (HHO), van emergiendo ciclos menstruales con fase lútea inadecuada, ciclos menstruales infrecuentes y anovulación con amenorrea hipogonadotrópica-hipoestrogénica, y cuando el hipoestrogenismo persiste por mucho tiempo, pueden aparecer disminución de la densidad mineral ósea y trastornos cardiovasculares, incluyendo anomalías endoteliales y cambios en el perfil lipidico 14. La DHH es responsable del 1035% de la amenorrea secundaria, afectando aproximadamente a 1.6 millones de mujeres en EEUU y 17.4 millones universalmente 15,16.
Diagnóstico
Síntomas y signos: según la severidad, pueden abarcar desde ciclos normales frecuentes o infrecuentes hasta amenorrea, en mujeres estresadas y con índice de masa corporal (IMC) alterado, incluyendo también obesas sin otra etiología endocrina.
Paraclínicos: FSH primero normal y después baja o normal, al igual que los estrógenos. La resonancia nuclear magnética (RNM) debe ser normal y necesaria para descartar LHH (Figura 2).

Fuente: elaboración propia, a partir de 12.
Figura 2 Enfoque de anovulación y amenorrea secundaria. > PRL hiper-prolactinemia; RNM, resonancia nuclear magnética; DHH, disfunción hipo-tálamo hipofisiaria; LHH, lesión HH; SOP, síndrome de ovario poliquístico; HS, hiperplasia suprarrenal; IOP, insuficiencia ovárica prematura.
Tratamiento
El cambio de hábitos, hacia unos de vida saludable, puede ser la solución definitiva: dieta, ejercicio físico y manejo del estrés.
Anovulación: citrato de clomifeno o inhibidores de la aromatasa; o ampollas de FSH en pacientes hipogonadotropismo.
Amenorrea: se trata con anticonceptivos orales combinados (ACOS) o terapia hormonal cíclica de estrógenos-progestágenos (TEP) (Tabla 1)
2. Lesión hipotalámica hipofisiaria (LHH)
Es una amenorrea hipogonadotrópica-hipoestrogénica causante del 10% de la anovulación y del 15% de la amenorrea. Múltiples lesiones estructurales del hipotálamo y la hipófisis son las responsables 17.
Adenomas: son el 91% de masas selares y parase-lares. Selares de TSH, de GH, de ACTH, prolactinomas, FSH-LH (raros).
Tumores: craneofaringioma, cordoma, metástasis, meningioma, tumor de células germinales, ependimoma, hemangioma, linfoma primario, sarcoma, carcinoma sinusal, papiloma, Schwannoma, pituicitoma.
Quistes: aracnoideo, de Rathke, dermoide, epidermoide, quiste supraselar, mucocele.
Lesiones vasculares: aneurisma, fístula arteriovenosa de senos cavernosos.
Procesos infiltrativos: sarcoidosis, histiositosis, displasia fibrosa, hemocromatosis, hiperplasia hipofisiaria, absceso, hipofisitis, sinusitis esfenoidal, tuberculosis, cisticercosis.
Otros: síndrome de silla turca vacía (S. Sheehan), radioterapia, isquemia e infarto, hipofisectomía.
Diagnóstico
Signos y síntomas. Se presenta amenorrea acompañada de síntomas y signos neurológicos producidos por las lesiones estructurales HH, tales como: cefalea, hipertensión endocraneana y alteraciones de pares craneanos, entre otras. En la evaluación, generalmente, es necesario el concurso de endocrinólogos, neurólogos, ginecólogos y neurocirujanos.
Paraclínicos:
Gonadotropinas y estrógenos: bajos.
RNM: muestra las masas expansivas y procesos infiltrativos.
Test de GNRH : para diferenciar lesiones hipo-talámicas de lesiones hipofisarias (bolo subcutáneo de 100 mg de GNRH y se determina la respuesta de LH y FSH basal, a los 30' y a los 60'. Si se doblan los niveles de gonadotrofinas, tras el estímulo, se confirma integridad hipofisaria).
Megatest de reserva hipofisaria: para determinar si hay otras líneas hormonales comprometidas (se administra TRH + GNRH + CRH + GHRH y se valora la respuesta de TSH, LH, FSH, PRL, cortisol y GH).
Tratamiento
El tratamiento de la lesión generalmente es quirúrgico. Después de la cirugía, muchas pacientes quedan con panhipopituitarismo y necesidad de terapia de reemplazo hormonal para los ejes comprometidos: levotiroxina, para el tiroideo; corticoi-des, para el suprarrenal, y TEP para el ovárico.
Anovulación: etiológico e inducción de ovulación con gonadotropinas.
Amenorrea: etiológico y TEP (Tabla 2).
Tabla 2 Tratamiento de la anovulación y de la amenorrea secundaria.
LHH, lesión HH; DHH, difusión HH;>PRI, hiperprolactinemia; DA, dopamina; IOP, insuficiencia ovárica prematura TEP, terapia estrógenos-progestágenos; CC, citrato de Clomifeno. ACOS, Anticonceptivos orales combinados.
3. Hiperprolactinemia (>PRL)
La hiperprolactinemia es producida por numerosas causas, periféricas y centrales. No obstante, los prolactinomas hipofisarios constituyen más de la tercera parte de las amenorreas centrales, por lo cual se colocan en este compartimento, en donde hay otras lesiones tumorales, que por efecto de masa las producen. Las causas periféricas son fisiológicas, iatrogenias y enfermedades crónicas (Tabla 3). El principal control fisiológico endocrino de la PRL es ejercido por la dopamina (DA) producida en el mesencéfalo. La DA llega al núcleo arcuato e inhibe la producción de GnRH, y pasa por la eminencia media al sistema porta hasta llegar a inhibir los receptores D2 del lactotropo hipofisario. Otros controladores de menor importancia son el tono opioide, disminución del GAP, y la presión de pseudoprolactinomas sobre los axones dopaminérgicos a nivel tubero-infundibular. La inhibición del eje HHO se va acentuando de acuerdo con los niveles de PRL, resultando con ello, desde ciclos menstruales regulares con fase lútea inadecuada y ciclos infrecuentes, hasta amenorrea.
Tabla 3 Causas de la hiperprolactinemia
| Fisiológicas |
|
| Macroprolactinemia(10%) | IgG - Ligada a la PRL |
|---|---|
| Lesiones hipotalámico-hipofisiarias |
|
| Otras enfermedades | Hipotiroidismo, falla renal crónica. |
| Medicamentos |
|
Fuente: elaborado a partir de 12.
La PRL es una molécula monomérica de 23 kDa. Sin embargo, pueden estar circulando en sangre moléculas grandes de 50 kDa y grandes-grandes de más de 100 kDa constituyendo la macroprolactinemia. Estas macromoléculas producen confusión, porque son competentes inmunológicamente, dejándose medir, pero biológicamente incompetentes y por lo tanto no producen síntomas; sin embargo, pueden estar asociadas a la PRL Anormal, produciendo síntomas con niveles muy altos de PRL, por lo cual se debe descartar la macroprolactinemia en el laboratorio 18.
Diagnóstico
Signos y síntomas: ciclos infrecuentes, amenorrea, galactorrea (56%) más asociada a hiperprolactinemia tumoral en los que además pueden encontrase efectos de masa. Paraclínicos:
Prolactina: normal (pool). Cuando está entre 20 y 50 ng/mL se trata de hipotiroidismo, iatrogenia y trastornos funcionales; entre 50 y 100 ng/mL pueden ser microprolactinomas; y > 100 ng/mL son microprolactinomas, macroprolactinomas, o pseudoprolactinomas. En un estudio multicéntrico de 233 adolescentes, se encontraron niveles promedios de PRL de 69 ng/mL en trastornos iatrogénicos, 93.15 ng/mL en microprolactinomas y 241 ng/mL en macroprolactinomas 19.
Macroprolactina: se puede medir en el laboratorio, cuando la PRL sea mayor de 100 ng/mL en pacientes asintomáticas y sintomáticas con posible asociación.
RNM: diagnostica prolactinomas (40% de adenomas hipofisarios) y pseudoprolactinomas.
Campimetría o potenciales visuales evocados: pueden mostrar alteraciones visuales en caso de macroprolactinomas o pseudoprolactinomas.
Megatest de reserva hipofisiaria: ocasionalmente, es prudente realizarlos.
Tratamiento
Debes ser etiológico, con agonistas dopaminérgicos o cirugía. La bromocriptina y la cabergolina son los agonistas más usados. Se administran teniendo en cuenta tolerancia, riesgos y disponibilidad. Se inician a bajas dosis (1,25 cada noche de bromocriptina o 0.25 mg dos veces por semana de cabergolina) y se van aumentado hasta obtener la respuesta deseada. La bromocriptina también se puede aplicar intra-vaginalmente. Pero, usualmente, se prefiere cabergolina, por causar menores reacciones colaterales gastrointestinales y requerir solo dos dosis orales por semana, aunque se debe considerar el riesgo rarísimo de hipertrofia valvular cardiaca.
Hiperprolactinemia fisiológica: retirar la causa (prótesis mamaria, cicatrices en la línea mamaria, estímulo del pezón, etc.). Coadyuvar, si es necesario, con agonistas dopaminérgicos o clomifeno para la anovulación, y con Acos para la amenorrea.
Hipotiroidismo: levotiroxina.
Prolactinomas:
Cabergolina, como primera línea. La respuesta es favorable en el 100% de microprolactinomas y 70% de macroprolactinomas. Se van aumentando las dosis, controladas con PRL semanalmente para ajustarías; y si responden, se disminuye la PRL, la paciente menstrua entre 3 y 10 semanas y los macroadenomas disminuyen de tamaño al control de RNM o TAC a las 6 semanas. Siguiendo controles RNM a los 3 meses y anualmente, se puede bajar dosis después de un año y retirar, o descansar, si a los dos años la RNM es normal.
Resección tras esfenoidal, si no toleran agonistas dopaminérgicos, para 30% de macroprolactinomas que no responden a los agonistas, y para los pseudoadenomas. Pero, puede haber resecciones incompletas, recidivas y panhipopituitarismo posterior.
Radioterapia, como tercera línea de manejo, para recidivas.
Amenorrea: posterior a las resecciones de prolactinomas, en general las pacientes quedan con hipopituitarismo, en terapia hormonal de reemplazo con TEP, levotiroxina y corticoides.
Anovulación: Letrazole, clomifeno o gonadotropinas (en caso de hipopituitarismo).
Prolactinomas y embarazo: los microprolactino-mas crecen 3-5% durante el embarazo, por lo que se suspenden los agonistas dopaminérgicos; pero, los macroprolactinomas crecen un 15-20% durante el embarazo y sí ameritan continuar el tratamiento.
4. Síndrome de ovario poliquístico (sop)
Es la anormalidad endocrina más común de la mujer, tanto en anovulación como en amenorrea (Tabla 1). Se encuentra en el 10-15% de mujeres en edad reproductiva, dependiendo de la población estudiada. Se asocia a amenorreas secundarias (25%), anovulación crónica (70%), obesidad (40-80%), hirsutismo (50-80%), ciclos infrecuentes (80-90%) y resistencia a la insulina (52%). Genera alto riesgo futuro de síndrome metabólico, incluyendo DM2, hipertensión y ateroesclerosis 20.
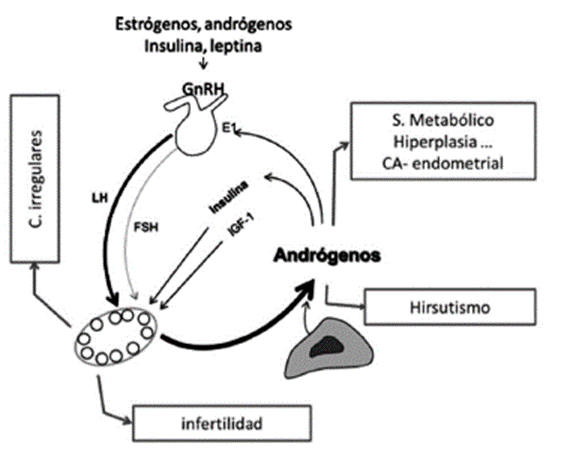
Fisiopatología: en el SOP se encuentran varias alteraciones derivadas de factores genéticos y ambientales (Figura 3) 12,21-23:
Mayor producción de LH que de FSH.
Aumento en la frecuencia de producción de GNRH, secundaria a la disminución de dopamina y al aumento de leptina e insulina.
Hiperinsulinemia y aumento de la IGF-I, debido a factores genéticos y ambientales (dieta y ejercicio) que resultan en: (i) aumento de ácidos grasos libres; (ii) alteración de la fosforilación de los sustratos de receptores de insulina, con serina a cambio de tirosina y la consiguiente alteración del glut-4 para internalizar la glucosa en las células, y (iii) presencia de marcadores de inflamación crónicos: CPR, ferritina, transferrina, leucocitos, TNFα, IL6, ILI8, PAH y haptoglobina en cadena a.
Aumento en la producción de andrógenos ováricos, por estimulación de la teca externa con LH e insulina, y dificultad de su aromatización en la granulosa ante las bajas concentraciones de FSH e interferencia de IGF-I en sus receptores 24.
Anovulación crónica al detenerse la maduración folicular en estadio antral, con acumulación de quistes foliculares menores de 10 mm.
Manifestación clínica de infertilidad, hirsutismo, ciclos infrecuentes y amenorrea.
Riesgos de diabetes II, síndrome metabólico, enfermedad cardiovascular, acantosis nigri-cans, cambios de humor, apnea obstructiva del sueño, hiperplasia endometrial y carcinoma de endometrio.
Diagnóstico
Es fácil cuando se tienen en cuenta los criterios diagnósticos (Tabla 4). Sin embargo, aún se discute si son más apropiados, en el diagnóstico de SOP, los criterios de Rotterdam o los de Tesaloniqui. En los criterios de Rotterdam del 2003, además de considerar los fenotipos que origina, se considera el diagnóstico con 2 de los 3 criterios iniciales, más el cuarto criterio. Los tres criterios de Tesaloniqui, realizados por la sociedad de exceso de andrógenos y la sociedad de SOP en 2009, al parecer son los más simples y apropiados 25:
Tabla 4 Criterios diagnósticos del SOP
NIH: National Institute of Health; ESHRE: European Society of Human Reproduction and Embriology; ASRM: American Society of Reproductive Medicine; AES and PCOS: Androgen Excess and Polycistic Ovarian Syndrome.
Fuente: elaborado a partir de 12.
Evidencia clínica o bioquímica de exceso de andrógenos.
Trastornos del ciclo y/o, ovarios poliquísticos (más de 12 micro quistes subcapsulares menores de 10 mm y volumen ovárico mayor de 10 cc).
Exclusión de otras causas de anovulación, relacionadas con exceso de andrógenos: hiperplasia suprarrenal, tumor productor de andrógenos, síndrome de Cushing, hiperprolactinemia e hipotiroidismo.
La resistencia a la insulina se presenta en el 51% de los casos. Es evidente cuando hay acantosis nigricans o cuando el test Homa (del inglés, homeostatic model assessment) es mayor a 3 (insulinita basal x glicemia basal en mg/dL / 405 = < 3 es lo normal). Sin embargo, no es un criterio diagnóstico de SOP 25.
Tratamiento del SOP
Manejo básico para todas las pacientes: (i) estilo de vida saludable, que incluye dieta y ejercicio físico para mantener un IMC normal. Cirugía bariátrica si IMC > 35 kg/m2. Con solo reducir 5% se aumenta la frecuencia de la ovulación 26. (ii) Metformina: para pacientes que tengan resistencia a la insulina, generalmente obesas, con hiperandrogenismo bien manifiesto y antecedentes familiares. Se benefician, especialmente, disminuyendo los riesgos de DM2 y de síndrome metabólico 27.
Tratamiento de la anovulación
En el 2010, la medicina basada en evidencias había colocado al citrato de clomifeno como la primera línea de tratamiento de la infertilidad, con iguales tasas de embarazos frente al letrozol (inhibidor de la aromatasa), pero menos costoso que este. Sin embargo, en 2017 un metanálisis concluyó que el clomifeno no es tan bueno, superándolo la combinación de clomifeno-metformina o de solo Letrazole 28. Y los metanálisis 2018 y 2019 del grupo Cochrane, con 42 RCT en 7935 pacientes, concluyeron que el letrozol es mejor que el clomifeno en tasas de embarazos (OR 1.56, 95% CI 1.37 - 1.78) y en tasas de recién nacidos vivos (OR 1.68, 95% CI 1.42 - 1.99) 29,30.
Por consiguiente, en la actualidad se maneja la anovulación, así 31-33:
Tratamiento de la amenorrea
Acos con progestinas antiandrogénicas. Útiles para manejar el hirsutismo al que se le agrega manejo cosmético facial con Eflornithine en crema y ocasionalmente espironolactona oral.
5. Insuficiencia ovárica prematura (IOP)
La insuficiencia ovárica prematura (IOP) o insuficiencia ovárica primaria, antes llamada falla ovárica prematura (FOP) es la pérdida temporal o definitiva de la función ovárica, en menores de 40 años. Esta amenorrea hipergonadotrópica-hipoestrogénica (Figura 2). Es potencialmente reversible, dado que 5-10% vuelven a tener ciclos menstruales intermitentes y embarazos espontáneos en 4.4%, razón por la cual la denominación IOP es más apropiada 34,35. La prevalencia de IOP en general es del 1% en sobrevivientes de cáncer; pero, en general es del 3.7% Y relacionada con la edad: entre 18 y 25 años 1/10.000, entre 25 y 30 años 1/1.000, y entre 35 y 40 años 1/100. Ocasiona por lo menos el 10% de anovulación y de amenorrea. Muchas IOP eran consideradas idiopáticas o iatrogénicas; sin embargo, los adelantos en secuenciación genética y biología molecular han ido aumentado sus causas, así:
Iatrogénicas (50%): oforectomías, radioterapia, quimioterapia, terapia uterina embolizante, endometriosis.
Autoinmunes (15-30%): acompañando a síndromes poliendocrinos autoinmunes (tipos I y II), S. de Smith, insuficiencia suprarrenal primaria, hipotiroidismo, etc.
Genéticas (30%): síndrome del X frágil, síndrome de Turner, síndromes genéticos (ataxia telangiectásica, síndrome de Fanconi, envejecimiento prematuro), entre otras
Metabólicas: galactosemia
Infecciosas: parotiditis, HIV, TBC, malaria, herpes, citomegalovirus
Tóxicas y ambientales: pesticidas, anestésicos, tabaco
Diagnóstico
Síntomas y signos: el hipoestrogenismo agudo ocasiona síntomas vasomotores y, si es crónico, pone a todas las pacientes en riesgo de vaginitis atrófica, trastornos de la libido, alteraciones psicológicas, osteoporosis y enfermedad cardiovascular.
Paraclínicos: FSH elevado y estrógenos bajos (Tabla 5).
Tabla 5 Valores hormonales
| Hormona | V. normal | Día del ciclo |
| FSH | 3 - 10 mUI/mL | 3-5 |
| LH | 2 - 10 mUI/mL | 3-5 |
| PRL | 0 - 20 ng/mL | 3-5 |
| TSH | 0.2 - 3.7 mUI/mL | 3-5 |
| Estradiol | 25 - 75 pg/mL | 3-5 |
| Progesterona | 10 -20 ng/mL | 21 (o M-7) |
| 17-OHP | <2 ng/mL | 3-5 |
| Testosterona libre | 0.2 - 2 pg/mL | 3-5 |
| Testosterona total | 15 - 70 ng/dL | 3-5 |
| DHEAS (20-30 años) | 6B - 270 μg/dL | 3-5 |
| DHEAS (30-49 años) | 4B - 240 μg/dL | 3-5 |
| HAM | 0.7 - 3.5 ng/mL | Cualquiera |
| Cortisol | 4 - 40 μg | Orina/24 hrs |
Tratamiento
Infertilidad: profilácticamente, con (i) criopreservación de embriones en pacientes con posibilidad de compañero masculino y (ii) criopreservación de ovocitos o de tejido cortical ovárico, en pacientes jóvenes con sospecha familiar de IOP o esperando manejos oncológicos. Embarazo lo antes posible con: (i) transferencia de embriones o fertilización in vitro (FIV) con los embriones u ovocitos preservados; (ii) si no se hizo profilaxis, es mejor realizar lo más pronto posible FIV con ovocitos donados; no es prudente esperar reversión espontanea de la IOP, o estimulación de inductores de ovulación. (iii) Últimamente se está intentando, en pacientes con HAM positiva, extracción por laparoscopia de tejido cortical ovárico para fragmentación capsular, estimulación y autotransplante, esperando reversión de la IOP y hasta embarazos espontáneos o con FIV 35,36.
Amenorrea: se trata con TEP cíclica.
6. Tumores productores de andrógenos
Los tumores que producen andrógenos excesivamente son ováricos o suprarrenales. Ocasionan desfeminización aguda, seguida de virilización y amenorrea. Representan el 1-2% de la amenorrea con hirsutismo severo. Los tumores virilizantes ováricos pueden ser de Sertoli-Leydig, de la teca granulosa, de células lipídicas, de células hiliares, de restos adrenales, disgerminomas y gonadoblastomas 37,38. Por su parte, los suprarrenales son adenomas y carcinomas 39.
Diagnóstico
Desfeminización, seguida de masculinización y amenorrea. Andrógenos muy altos. La ecografía muestra los tumores ováricos y la RNM los suprarrenales. Ocasionalmente, cuando la imagenología es negativa, se recurre al test de supresión ovárica con GnRHa para poder saber si son ováricos o suprarrenales.
Tratamiento
La resección quirúrgica resuelve la anovulación y la amenorrea. Los andrógenos bajan a niveles normales y el hirsutismo se resuelve paralelamente, cosméticamente.
Hipotiroidismo
El hipotiroidismo primario es el más frecuente (95%) y en mujeres mucho más que en hombres, en proporción 10/1. Ocurre en el 6% de la anovulación y hasta en el 12% de la amenorrea 40,41. El hipotiroidismo secundario (hipofisario) y el terciario (hipotalámico) son raros.
El hipotiroidismo afecta al eje HHO de varias formas, hasta producir amenorrea:
Dopamina aumentada: la hormona tiroidea disminuida produce retroalimentación negativa, aumentando la TRH, con estímulo paralelo de TSH y PRL, y la hiperprolactinemia aumenta la dopamina.
Esteroides sexuales aumentados: el hipotiroidismo produce disminución de la globulina tras-portadora de hormonas sexuales (SHBG), con la consiguiente elevación de estrógenos y andrógenos libres. Igualmente, la aromatización periférica de andrógenos contribuye al hiperestrogenismo.
Pico ovulatorio de LH alterado que conducen a falta de estímulo sobre el cuerpo lúteo.
Autoinmunidad afectando tanto a la tiroides, como al ovario.
Diagnóstico
Las pacientes presentan amenorrea, obesidad, intolerancia al frío, retardo mental, ptosis palpebral, bradicardia, constipación, mixedema y piel seca. TSH > 10mU/mL (entre 4 y 10 es subclínico), T4 libre baja, los anticuerpos antitiroideos (antitiroglobulina y an-tiperoxidasa) pueden estar positivos y la PRL elevada. El hipotiroidismo subclínico puede producir anovulación y el clínico anovulación y amenorrea.
Tratamiento
Levotiroxina hasta estabilizar la TSH < 2.5 mUI/ mL (Tabla 2). (i) Anovulación, ocasionalmente es necesario agregar letrazol o clomifeno. Amenorrea: si no revierte con levotiroxina, agregar ACOS.
8. Hiperplasia suprarrenal de aparición tardía
La hiperplasia suprarrenal, productora de amenorrea secundaria, es secundaria a bloqueos parciales enzimáticos en la esteroidogénesis de las cápsulas suprarrenales. El bloque más frecuente es el de la 21-hidroxilasa, seguido por el de la 11 -hidroxilasa. Con estos bloqueos se disminuye la síntesis de cortisol, se produce retroalimentación negativa con aumento crónico de ACTH, hasta producir hiperplasia de las cápsulas suprarrenales. Esos bloques enzimáticos desvían el metabolismo hacia la producción de progesterona, 17 hidroxiprogesterona (17-OHP) y andrógenos, con cuadro clínico de hiperandrogenismo y anovulación crónica 42,43.
Diagnóstico
Los bloqueos severos se manifiestan en la recién nacida con deficiencias graves de cortisol y aldosterona que, al no ser tratadas, ponen en peligro la vida. Cuando se manifiesta en forma tardía, en la mujer adulta, lo hace con un cuadro parecido al del SOP, con hirsutismo, ciclos infrecuentes y amenorrea. Pero se diferencia porque las pacientes tienen 17-OHP con niveles mayores a 10 ng/mL (normal < 2 ng/mL). En casos de 17-OHP entre 2 y 10 (zona gris) se realiza estímulo con ACTH para desenmascarar el diagnóstico.
Tratamiento
Corticoides: dexametasona 0,5 mg/día o su equivalente con prednisona (5 mg) o hidrocortisona (10 mg). (i) En anovulación, ocasionalmente, es necesario agregar letrazol o clomifeno. (ii) La amenorrea se maneja con Acos 43.
9. Síndrome de Cushing
El síndrome se caracteriza por síntomas y signos ocasionados por el exceso de cortisol en sangre. El hipercortisolismo se corrobora midiéndolo en orina de 24 horas o en saliva nocturna (11 pm). Tiene cuatro causas 44:
Iatrogénica, la más común
Adenomas suprarrenales: la ACTH es menor de 5 ng/mL y el TAC suprarrenal positivo para tumor
Tumor hipofisiario productor de ACTH (enfermedad de Cushing): la ACTH es mayor de 20 ng/mL y la RNM de hipófisis es positiva para tumor; en casos dudosos se miden gradientes de ACTH, cateterizando los senos venosos petrosos 45
Producción ectópica de ACTH o CRH (tumor bronco génico): la RNM hipofisaria es normal y la ACTH alta no se deja inhibir con dosis elevadas de dexametasona
Diagnóstico
Es una amenorrea con hiperandrogenismo, como el SOP, la hiperplasia y los tumores productores de andrógenos. Pero se diferencia de ellos porque las pacientes presentan fatiga persistente, depresión o cambios de humor, debilidad muscular, acumulación excesiva de grasa en mejillas (cara de luna llena) nuca (cuello de búfalo) y abdomen, estrías cutáneas, hirsutismo, presión arterial alta e hiper-glicemia. Una vez establecido el hipercortisolismo, su diagnóstico diferencial se realiza con anamnesis, ACTH plasmática, prueba de CRH, prueba de inhibición con dosis altas de dexametasona e imagenología. Ameritan remisión a Endocrinología, Medicina Interna o Cirugía.
Tratamiento
Etiológico, generalmente quirúrgico: sin embargo, inicialmente o cuando la cirugía no es exitosa, se trata con inhibidores de la síntesis esteroidea o antagonistas de los receptores de glucocorticoides (osilodrostat y levoketoconazole); además, cuando se extrae el adenoma hipofisario (enfermedad de Cushing), algunas mujeres quedan con hipopituitarismo, ameritando manejo de suplencias hormonales para ejes ovárico, tiroideo y suprarrenal.
Amenorrea: TEP
Anovulación: inducción con gonadotropinas 46.
Amenorrea uterina
La Amenorrea uterina sucede por falta de útero funcional, estando las pacientes endocrinológicamente normales. Ocurre por varias causas, en las cuales el test de estrógenos-progestágenos es negativo.
Adherencias intrauterinas (síndrome de Asherman)
Las adherencias obstruyen completamente la cavidad uterina, generalmente, secundarias a legrados enérgicos y repetidos en pacientes con abortos especialmente sépticos o por hemorragias puerperales. El síndrome de Asherman, ocurrido después de cesáreas o miomectomías, produce menstruaciones escasas, pero no amenorrea. El diagnóstico se hace por histerosonografia e histeroscopia. Y el tratamiento con adhesiolisis histeroscópica, complementado con balón de sonda de Foley intracavitaria, antibióticos y un ciclo de TEP con dosis altas de estrógenos 47.
Pérdida irreversible de la funcionalidad uterina
Necesitan útero subrogado o trasplante, en caso de infertilidad.
Estenosis cervical
Es una complicación rara de la conización cervical. Se produce amenorrea obstructiva con hematómetra dolorosa progresiva. La eco-tv hace el diagnostico. Se trata con dilatación cervical guiada por ecografía, sonda por una o dos semanas, antibióticos y un ciclo de TEP.
Enfoque de la anovulación y amenorrea secundaria
Primera consulta
Historia clínica: se descartan causas fisiológicas (no olvidar descartar embarazo), iatrogénicas y por enfermedades sistémicas crónicas. Se indaga por antecedentes que revelen anormalidades del eje endocrino reproductivo, tales como:
desarrollo de los caracteres sexuales secundarios
menarquia y características de los ciclos menstruales. Antecedentes gineco-obstétricos (intervenciones quirúrgicas, partos, hemorragia posparto, abortos, legrados)
historia sexual y métodos anticonceptivos
hirsutismo, acné, seborrea
galactorrea
enfermedades crónicas (diabetes mellitus, tiroiditis, enfermedad intestinal inflamatoria crónica, hepatopatías)
historia de traumatismos craneoencefálicos (infecciones, tumores del sistema nervioso central, galactorrea)
tratamientos con quimioterapia y/o radioterapia
estilo de vida, ejercicio físico y hábitos alimentarios. Pérdidas importantes o fluctuaciones de peso. Estrés emocional.
En el examen físico, se deben relevar aspectos importantes:
índice de masa corporal (IMC) (peso / talla2: normal 20 a 25 Kg/m2)
perímetro abdominal (normal < 88cm)
índice cintura/cadera (normal < 0.8)
hirsutismo, hipertricosis, alopecia, acantosis nigricans, acné, seborrea
campimetría por confrontación y valoración de movimientos oculares
tamaño y desarrollo de los senos (Tanner)
galactorrea
presencia de útero, a la especuloscopia y tacto bimanual
Perfil hormonal: muchas veces es posible, en la primera consulta, hacer un diagnóstico diferencial de la amenorrea. Sin embargo, se debe corroborar con perfil endocrino y test de útero funcional. Se solicitan las siguientes hormonas:
FSH, LH, PRL, TSH y E2 (si no hay hiperandrogenismo)
T total, T libre, DHEAS y 17 OHP, en caso de haber encontrado signos o síntomas de hiperandrogenismo (acné, hirsutismo, virilización)
HAM (hormona antimülleriana) cuando la consulta es por anovulación y la paciente tiene más de 35 años de edad
Formulación del test de función uterina: en esa primera consulta, también, se formula un ciclo de estrógenos-progestágenos (Estradiol 2 mg/día por 2 semanas + didrogesterona 10 mg /día la segunda semana) para evaluar la función uterina (hacerlo con solo progestágeno puede dar falso negativo muchas veces). El test tiene dos efectos: (i) evalúa la existencia, o no, de útero funcional, y (ii) la mayoría de las veces, al tratarse de úteros funcionales, tranquiliza la paciente una vez que menstrúe.
Segunda consulta
Diez días después de terminar el ciclo de estró-genos-progestágenos, si la paciente menstrúa por deprivación hormonal, se sabrá que el útero es normal. Si no sangra por deprivación, el diagnóstico es amenorrea uterina. Además, se evalúan los resultados del perfil hormonal (Tabla 5) y se confirma o cambia el diagnóstico realizado en la primera consulta. Se sigue el algoritmo de laFigura 2. Con este diagnóstico, en la mayoría de las veces, es posible iniciar el manejo correcto, bien sea de la amenorrea, bien de la infertilidad anovulatoria. No obstante, frecuentemente, es necesario profundizar la investigación en busca de una precisión diagnóstica, para poder dar el mejor manejo posible, con:
imagenología: (i) RNM ante la impresión diagnóstica de LHH, DHH, hiperprolactinemia, síndrome de Cushing, tumor androgénico suprarrenal; (ii) ecografía transvaginal, si SOP.
otras hormonas o megatest endocrinos: en la mayoría de las veces es necesario corroborar las alteraciones hormonales encontradas; realizar megatest de hormonas liberadoras, para investigar compromisos de otras líneas hormonales; cortisol en orina de 24 hrs o en saliva nocturna, si se piensa en S. de Cushing.
interconsultas: muchas veces, en casos de causas centrales y suprarrenales, se hará necesaria la interconsulta con psiquiatras, neurólogos, internistas, endocrinólogos y neurocirujanos.
Conclusión
La anovulación ocurre en el 30% de parejas infértiles y la amenorrea secundaria en el 4% de mujeres en edad reproductiva.
Si bien ambas pueden ser producidas por las mismas causas, la amenorrea presenta una causa uterina adicional en el 6% de las veces.
La clasificación etiológica en cinco compartimentos es una guía fácil de seguir, para lograr un correcto diagnóstico diferencial y manejos apropiados. Mucho más si contamos con laboratorio de hormonas e imagenología.
La amenorrea necesita tratamiento, y la anovulación, si hay infertilidad, para evitar los riesgos del hiperestrogenismo o del hipoestrogenismo crónicos.
La anovulación, muchas veces, puede ser manejada por ginecología general; pero la inducción monitorizada debe ser realizada por especialistas en infertilidad y endocrinología reproductiva.