1 Introducción
Los cultivos celulares integran el primer paso para la caracterización y tipificación de las líneas celulares, entre las cuales podemos indicar: poseer un aumento continuo en el número de células de forma espontánea o inducida, el predominio de uno o dos tipos celulares, conformación del cariotipo, definición del perfil molecular, el crecimiento homogéneo y uniforme, conservando, como línea celular continua, las mismas características a lo largo de las siguientes generaciones [1]. Generalmente, las líneas celulares poseen una vida finita que dependiendo del tipo celular se puede prolongar entre 20 y 100 generaciones; luego de estos eventos, usualmente las células entran en etapa de senescencia y mueren [2]. Sin embargo, algunas células evaden los controles del ciclo celular, dando lugar a líneas celulares de crecimiento continuo [3], ya sea mediante transformación celular inducida por virus, por la acción de medicamentos o espontáneamente luego de muchos subcultivos [4].
En la actualidad los cultivos celulares de insectos son utilizados en una amplia gama de investigaciones debido a que las proteínas de los insectos son de alta calidad, digestibilidad y constituyen una buena fuente de minerales y aminoácidos esenciales y no esenciales [5,6]; además, son de fácil manejo debido a que no requieren CO2 y se mantienen a temperaturas cercanas a los 28 °C; lo que genera gran interés para las industrias dedicadas a diferentes actividades en áreas biomédicas y biotecnológicas [7], en las cuales sobresale su uso como herramienta en la expresión de genes exógenos a partir de moléculas de ADN recombinante, en la producción de péptidos antimicrobianos (AMPs) [8], en el desarrollo del ciclo de vida de parásitos [ 9], en estrategias antivirales [10], en rutas metabólicas [11] y como sustratos para aislar, propagar e identificar arbovirus, entre otros [4].
La primera línea celular de Dípteros fue establecida en 1966 por Grace, a partir de larvas de Aedes aegypti próximas al estado de pupa [12]. Fue además Grace quien también formuló un nuevo medio de cultivo que lleva su nombre, el cual favorece el crecimiento y mantenimiento de líneas celulares derivadas de diferentes especies de insectos. Para el año 2010, en el mundo se habían establecido aproximadamente 500 líneas celulares del orden Diptera; sin embargo, en la actualidad se desconoce el número real que han sido obtenidas [13]. En Colombia, se han registrado aproximadamente 12 líneas celulares de este orden de insectos, las cuales incluyen especies de interés médico y veterinario; no obstante, hoy en día se continúa en esta labor, debido a sus múltiples aplicaciones y a las necesidades de apoyo que se requieren en diversos campos de investigación, contribuyendo desde nuestro país en el desarrollo de nuevas líneas celulares.
El propósito de esta revisión es presentar un panorama respecto a las diferentes líneas celulares de insectos, discutiendo sus principales características, tales como el tejido y especie de origen, la morfología celular, cariotipo, medios de cultivo empleados y condiciones ambientales y fisicoquímicas de los cultivos celulares, con particular referencia en el conocimiento sobre las líneas celulares de dípteros establecidas en Colombia. Adicionalmente, se incluyen las aplicaciones que dichas líneas celulares han presentado en estudios de interés en medicina humana y veterinaria.
2 Características de las líneas celulares de dípteros
2.1 Origen del cultivo y cambios genéticos
Debido a la amplia gama de usos de las líneas celulares, tanto a nivel biomédico como biotecnológico, es necesario conocer sus características morfológicas y moleculares, las cuales dependen en gran medida de la especie y el tejido de origen empleado para el cultivo celular [14]. Lo anterior con el fin de autenticar las líneas celulares y garantizar la confiabilidad en los resultados de investigaciones en las cuales estas sean empleadas [15]. Por otra parte, se ha implementando el uso de técnicas moleculares que permiten identificar el origen de las células, mediante la comparación de estudios moleculares como la reacción en cadena de la polimerasa (PCR), esta técnica permite comparar las secuencias de las células con las de la especie de origen del cultivo [16].
Teniendo en cuenta que los cultivos primarios se obtienen por crecimiento de células de un tejido de origen, es de esperar que éstos posean características propias de la fuente de donde derivan. Por ejemplo, si el cultivo primario proviene de un tejido embrionario los resultados serán comunidades celulares diversas, originadas de células pluripotentes, que dan origen a las poblaciones celulares diversas de los embriones; mientras que, si el cultivo evoluciona de un solo tejido de origen, el resultado registrará poblaciones celulares con muy baja diversidad genética [17]. Sin embargo, es necesario resaltar que el vínculo de dependencia genética con la especie de insecto de donde derivan los cultivos celulares se mantiene, lo cual posibilita su identificación, comparando el tejido de origen con la línea celular, mediante el uso de técnicas citogenéticas y moleculares [18, 19].
Dentro de los factores relevantes que favorecen el buen desarrollo en la etapa de iniciación de los cultivos celulares se encuentran las condiciones nutricionales, a través de medios de cultivos óptimos para la adaptación y proliferación celular, también de temperatura, usualmente 28 °C y de pH adecuados, el cual varía dependiendo del medio de cultivo entre 6.2 y 7.0 [20]. Cuando son suministrados y controlados apropiadamente dichos factores a los cultivos en desarrollo, estos pueden llegar a producir células capaces de realizar mitosis, aumentando así el número de éstas a través de los doblajes poblacionales, dando lugar a un cultivo primario, luego a subcultivos y posteriormente conducir a una línea celular con la capacidad de crecer continuamente [21]. No obstante, las líneas celulares presentan variaciones genéticas, resultando generalmente en aneuploidías, casi siempre con registros de números de cromosomas entre diploides y tetraploides, lo cual es considerado una evidencia de la transformación que puede dirigir la línea celular a la inmortalización [22, 23]; en esta tendencia, por ejemplo, existen tres líneas celulares para la especie Aedes triseriatus, las cuales se mantuvieron bajo las mismas condiciones, en medio de cultivo Mitsuhashi-Maramorosch suplementado con suero fetal bovino (SFB) al 20 % e incubadas a 28 °C. Estas fueron denominadas GRIP-1, GRIP-2 y GRIP-3 y han sido empleadas para describir las características de crecimiento de los virus La Crosse y trivittatus pertenecientes al orden de los buyavirales. Dichas líneas difieren entre ellas en las proporciones de las ploidias de sus cromosomas. La primera línea celular de esta especie establecida a partir de huevos embrionados de 7 días de incubación mostró 42 % de células diploides y 47 % tetraploides, mientras que GRIP-2 y GRIP-3 establecidas a partir de homogenizados de larvas recién nacidas de la misma especie se caracterizaron por tener 63 % y 59 % de células diploides y 31 % y 37 % de células tetraploides [11]. En contraste, otra línea celular establecida con larvas neonatas de la misma especie en 1984, presentó solamente células diploides (Tabla 1) [24]. Otro caso de cambio genético en líneas celulares de la misma especie se produjo en Aedes aegypti, por ejemplo, para esta especie se estableció una línea a partir de homogenizados de larvas a punto de convertirse en pupas, con medio Grace e incubadas a 30 °C, donde se observó que la mayoría de las células eran poliploides y no se encontraron células diploides, además, la mayoría presentó complemento cromosómico de 16 n, con una máximo de 32 n [12]; contrario a este evento, en otra línea celular establecida de huevos embrionados de esta misma especie y mantenida con Grace y L-15 (1:1), se observó en el subcultivo 60 que la población celular presentó en un 19 % aneuploidías, 16 % de triploidias y tetraploidias, siendo las más representativas las trisomías y monosomías [25].
Cabe anotar que solo en uno de los anteriores trabajos se mencionó el número del subcultivo seriado empleado para establecer la ploidia celular, la cual puede estar fuertemente influenciada por la edad de la línea en pases altos [26]. Por otra parte, las diferencias mostradas entre las líneas de la misma especie sugieren que iniciar líneas celulares de insectos puede ser una cuestión no solo de seleccionar el tejido de origen, sino también podría estar relacionada con un rango estrecho de horas dentro de cada estado de desarrollo biológico de dicho tejido, lo cual puede conllevar a obtener células con diferentes características [27].
3 Morfología y tipo de crecimiento
En cuanto a la morfología celular, las células de insectos tienden a tener tamaños pequeños, que van desde 17 hasta 30 |im, en relación con las células de mamífero, que usualmente se encuentran entre 10 y 100 |m. Sin embargo, la variable tamaño depende del ciclo celular y de las condiciones de crecimiento [28]. Se ha reportado que el tamaño de las células de mamíferos bajo condiciones in vitro puede ser entre 300 y 500 % mayor que su contraparte in vivo [29]. No obstante, aún se desconoce el efecto de las condiciones in vitro en células de insectos.
Se ha observado que la mayoría de las líneas celulares presentan células epiteloides, fibroblastoides, redondas y en menor proporción en forma de uso con diferentes tamaños dependiendo de la especie y el tejido de origen, por ejemplo la línea celular establecida a partir de larvas jóvenes de Anopheles stephensi, presentó principalmente células de tipo epiteliales con diámetros entre 4 a 9|jmyde 12 a 20 µm [27], por el contrario la línea celular establecida en 1971 para la misma especie, pero a partir de cortes extremos de larvas, presentó en pases avanzados células de tipo fibroblastoide y epitelioide en menor proporción; sin embargo, no se mencionó su tamaño. Además, en ambas líneas celulares no se observaron cambios en el complemento cromosómico, el cual se mantuvo diploide con tres pares de cromosomas [30] (Tabla 1). Otro ejemplo son dos líneas celulares de Culex tritaeniorhynchus, establecidas a partir de tejido embrionario, en la primera línea celular se observó que en el pase 45 se dio origen a cuatro tipos celulares: epitelial, tipo fibroblastoide, gigantes y células vacuoladas [31], mientras que la segunda línea de la misma especie denominada NIID-CTR, mostró en pases altos dos tipos celulares: en forma de huso y redondas [32]. En los dos casos anteriores, las líneas celulares se mantuvieron diploides (2n = 6) en los estudios cariológicos.
Este tipo de estudio de caracterización es importante ya que permite la autenticación de líneas celulares mediante cariotipos, así como con enfoques inmunohistoquímicos, los cuales son relevantes, ya que por ejemplo en la década de 50 y principios del 60, hubo aumento de la contaminación cruzada en diferentes laboratorios del mundo. En 1966 se estudiaron 18 líneas celulares humanas, las cuales se encontraban contaminadas con células HeLa, causando así pérdidas económicas, de tiempo y peor aún resultados erróneos en investigaciones [15]. Sin embargo, en todas las líneas de insectos presentadas en esta revisión, se realizaron estudios cariológicos (tabla 1); no obstante, este no es el único método para la autenticación de líneas celulares, constituye un buen criterio para identificar líneas celulares y relacionarlas a nivel taxonómico, además permite distinguir entre células normales y transformadas [14]. Otros métodos empleados para la caracterización y autenticación de líneas celulares de insectos incluyen técnicas moleculares, tales como: DNA fingerprinting, DNA profile, RAPD-PCR, análisis de ADN para la detención de contaminación intraespecies [15; 14] y datos derivados de diferentes tipos de secuenciamiento de nueva generación (NGS) [33], las cuales, la mayoría individualmente, se han implementado con el fin de garantizar la identidad celular y, además, consecuentemente, se recomienda monitorear el estado de las líneas celulares que se emplean en los laboratorios periódicamente.
Por otra parte, en cuanto al crecimiento celular existen dos tipos: el primero es en monocapa, el cual consiste en la capacidad de adherencia que presentan las células a una superficie de crecimiento; esta propiedad está relacionada con el tipo de células de las cuales se derivan los cultivos y depende, también, del tipo de proteínas presentes en su superficie, que incluyen proteínas de la matriz extracelular, las cuales se encargan de mantener unidas a las células y regular el crecimiento de las mismas in vivo. Macromolé-culas como el colágeno, la fibronectina, la laminina y proteoglucanos, permiten establecer interacciones con las proteínas de la membrana citoplásmica de la célula, denominadas moléculas de adhesión celular (CAMs), cadherinas e integrinas, esta última permite la adhesión en los cultivos en monocapa por medio de adhesiones focales; donde las células crecen hasta que cubren la superficie de soporte y establecen contacto entre las células, lo cual causa inhibición por contacto y detención del ciclo celular [14]. El segundo tipo de crecimiento es en suspensión, en el cual las células no se encuentran adheridas a una superficie sino dispersas en el medio, tal como ocurre corrientemente con células de la hemolinfa y sanguíneas o en cultivos celulares transformados donde las células han perdido o disminuido la síntesis de proteínas de anclaje y no desarrollan inhibición por contacto, particularmente como se ha registrado en algunas líneas celulares transformadas artificialmente [34, 35, 36]. En general, aunque la mayor parte de las líneas celulares de insectos crecen adheridas a una superficie, existen algunas líneas que han sido adaptadas para crecimiento en suspensión, como la línea Sf9 de Spodoptera frugiperda (Lepidotera) [37], la línea de Drosophila melanogaster (Diptera), proveniente de músculo adulto de la especie, que han sido empleadas en estudios de bioingenieria [38].
4 Factores nutricionales de los cultivos celulares
Un principio que se ha tenido en cuenta en la elaboración o modificación de medios de cultivo, destinados a la adaptación, proliferación y crecimiento de cultivos celulares in vitro de dípteros, es la composición de la hemolinfa. Sin embargo, sigue siendo un factor crítico para establecer con éxito los medios de cultivo, ya que estos proveen a las células de sales inorgánicas de importancia metabólica en las concentraciones adecuadas para mantener la presión osmótica en condiciones similares a la de las células in vivo. El bicarbonato de sodio (NaHCO3) es un metabolito principal, que está presente en medios como Grace, Schneider, y DMEM entre otros; ampliamente utilizados para el establecimiento de líneas celulares de insectos; en estos medios el NaHCO3 actúa como buffer, con el fin de mantener el pH de los medios cercano a sus valores normales y para que estos no generen interferencia con los procesos químicos y/o bioquímicos que ocurren en las células, constituyendo una variable importante ya que los productos del metabolismo celular son de naturaleza ácida y se requiere en el mantenimiento del pH óptimo en el cultivo celular que favorezca la actividad enzimática y se evite así el mal funcionamiento celular [60, 61].
Otros componentes de los medios de cultivo celular son los aminoácidos esenciales que favorecen la diferenciación celular y la síntesis de ADN durante el ciclo celular. Además, componentes como la glucosa en el caso de los medios Grace y DMEM y la dextrosa en Schneider proveen energía al cultivo celular con el fin de sintetizar ATP y cumplir sus funciones [62].
Adicionalmente, los medios de cultivo se suplementan con suero fetal, que proporciona una buena fuente de lípidos como: colesterol, fosfolípidos, triacilgliceroles, ácidos grasos, vitaminas lipídicas solubles y sus variantes esterificadas [61]. Existen sueros provenientes de especies como cabra, que proporciona valores de proteína aproximados de 0.77 g/ml, caballo 0.63 g/ml, conejo 0.55 g/ml y SFB 0.45 g/ml. Aunque el SFB brinda los valores de proteínas más bajos, este es el suero de predilección, ya que es de más fácil obtención debido a la comercialización de los bovinos.
5 Aplicaciones de líneas celulares de dipteros
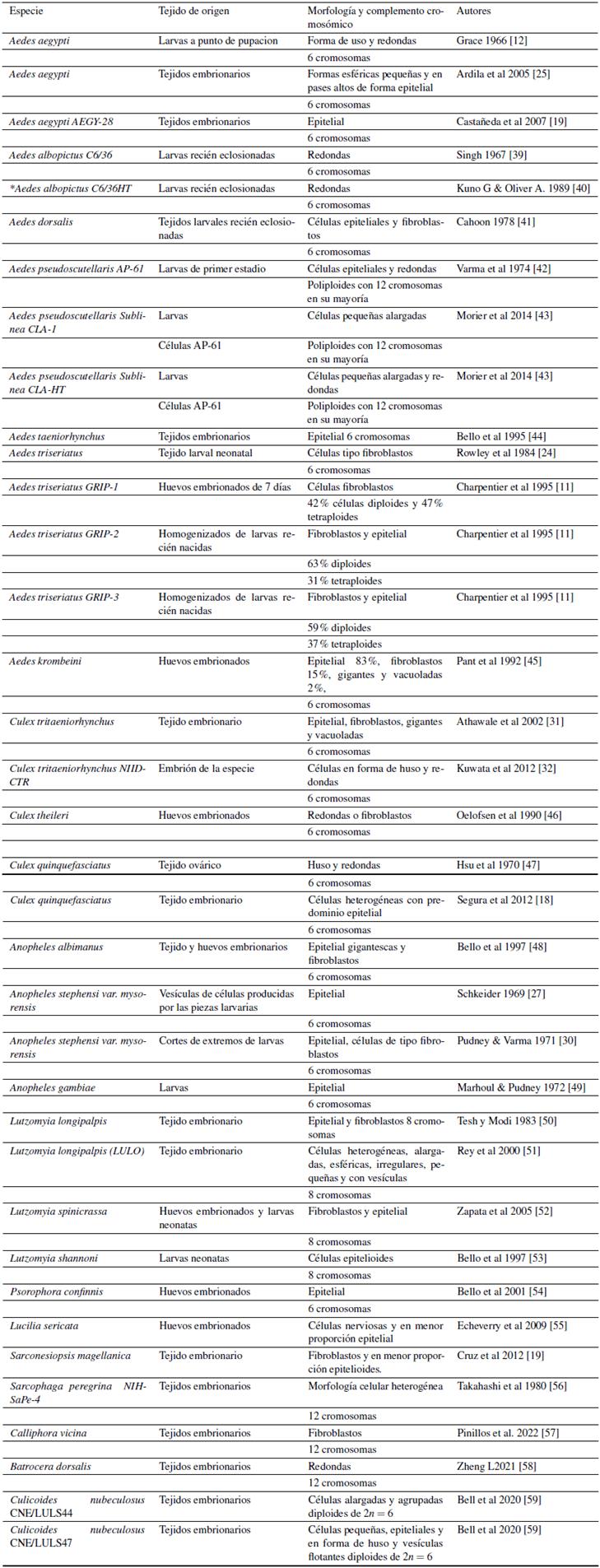
Las líneas celulares derivadas de mosquitos vectores proporcionan una herramienta relativamente simple para investigar la interacción entre el huésped y los virus transmitidos por mosquitos (Figura 1), la más empleada es la línea clonal C6/36, derivada de cultivos celulares obtenidos a partir de larvas recién eclosionadas de Aedes albopictus, utilizada, por ejemplo, para demostrar el mecanismo de entrada celular del virus del dengue (DENV) serotipos 1, 3 y 4, mediante inhibidores bioquímicos (cloruro de amonio, clorpromazina, dansilcadaverina y dynasore) de las proteínas clatrina y dinamina, mediante estos ensayos se logró establecer que la entrada de los virus en las células ocurre por endocitosis mediada por clatrina dependiente de pH ácido, estudiados mediante titulaciones de infectividad [63]. En contraste, se estableció que para la misma línea celular la entrada de DENV2 se encuentra mediada por receptores, seguido de endocitosis dependiente de clatrinas y pH ácido para el desnudamiento del virus [64]. Este tipo de investigaciones tienen gran potencial para entender el proceso de entrada del virus, así como establecer mecanismos para bloquear la entrada viral a las células. Otros estudios realizados en esta línea celular, han detectado la presencia de genomas defectuosos de DENV-2 luego de la infección persistente. En este caso, mediante ensayos de inmunofluorescencia, se demostró la presencia de la proteína viral E asociada con sincitios celulares en el cultivo, los cuales contenían estructuras de membrana dispuestas en forma circular y en algunos casos presentaban lisis, además, las partículas virales se encontraron exclusivamente en vacuolas localizadas en el citoplasma, proporcionando así información valiosa sobre los mecanismos a través de los cuales los arbovirus establecen y mantienen infecciones in vivo [65].
Estudios similares de infección con el DENV se han llevado a cabo en diversas líneas, un ejemplo, son las sublíneas derivadas de la línea celular AP-61, denominadas CLA-1 y CLA-1 HT establecidas a partir de Aedes pseudoscutellaris (Tabla 1) [44, 43]; las cuales se adaptaron a crecer a 33 °C y se infectaron con los cuatro serotipos del DENV, donde demostraron ser más susceptibles a este virus, detectando la infección por los cuatro serotipos pasadas 96 h pi en estas sublíneas. Demostrando ser útiles debido a su eficiencia para el aislamiento directo y proporcionando una ventaja sobre otras líneas celulares, ya que ofrecen una respuesta rápida a la infección, sumado a esto, CLA-1 y CLA-1 HT no requieren CO2 y el medio empleado para el crecimiento (L-15) no necesita adición de bicarbonato de sodio como tampón [43]. Otra línea celular de interés médico es la establecida a partir de Culex tritaeniorhynchus, la cual resultó ser eficiente para la replicación de DENV1, DENV2 y del virus de la encefalitis japonesa (EJV) las cepas Mie/41/2002 y JaGAr-01, las cuales se estudiaron mediante ensayo de plaqueo usando como matriz células Vero, durante dicho ensayo fue evidente la presencia de unidades formadoras de placas (UFP) desde el primer día para los dos virus estudiados [32]. Además, las líneas celulares de dípteros presentaron susceptibilidad a otros arbovirus. Por ejemplo, la línea celular de Aedes aegypti mostró ser altamente susceptible al virus Chikungunya (CHIKV) [66], la línea AP-61 fue susceptible al EJV y al virus del Nilo Occidental (WNV) [67], la línea celular de Aedes krombeini fue susceptible a CHIKV, así como a los virus Sindbis (SINV), DENV y WNV, muchos de los cuales afectan a los humanos.
Por otro lado, algunas líneas de Diptera han resultados pobremente susceptible o refractarias a la infección por arbovirus, por ejemplo, la línea celular Lulo del flebótomo Lutzomyia longipalpis fue pobremente susceptible a la infección por DENV2 a altos MOIs, por lo cual esta línea celular puede ser considerado una herramienta para entender los mecanismos a través de los cuales la célula puede evadir la replicación viral [68]. Al igual que esta línea celular, otras líneas celulares establecidas a partir de insectos, como CNE/LULS44 y CNE/LULS47, establecidas a partir de Culicoides nubeculosus, donde se estudió la replicación del virus lengua azul (familia Reoviridae), mediante la infeccion con dos cepas del virus BTV-1 (transmitía por el mosquito C. nubeculosus) y BTV-26 (no transmitido por insectos), se pudo observar que las células fueron susceptibles a la cepa BTV-1, pero refractarias a la cepa BTV-26, este tipo de células facilita la comprensión de los mecanismos de infección y liberación que subyacen a la competencia del vector y la transmisión del virus el cual afecta a bovinos [59]; finalmente, otro ejemplo, de líneas celulares refractarias es AEGY-28, establecida a partir de Ae aegypti, la cual resultó refractaria a la infección por FAV y DENV2 y se infirió como explicación a dicho evento que pudo estar asociado a la falta de tripsina en el cultivo celular, en razón a que en la infección natural la tripsina ofrece un clivaje proteolítico en la superficie del virión, facilitando la infección [69]. Lo anterior demuestra que la existencia de líneas celulares refractarias a la infección por virus, también juegan un papel importante en estudios relacionados con la comprensión de los mecanismos intrínsecos de la infección.
Las líneas celulares de insectos han jugado un papel importante en el descubrimiento de flavivirus específicos de insectos (ISF), los cuales no tienen ningún huésped reservorio vertebrado conocido y solo se ha identificado que afectan directamente a mosquito [Contreras & Uribe 2014]. Sin embargo, los ISF al estar asociados con el microbioma de los insectos pueden alterar la competencia de los insectos vectores mediante la modulación de las respuestas inmunitarias del hospedero, compitiendo con arbovirus por recursos y secretando factores anti-virales [71, 72]. Un ejemplo de este tipo es el virus agente de fusión celular (CFAV), el cual se descubrió por primera vez en la línea celular Ae. aegypti en 1975 [73]. Un estudio realizado en las líneas Aa20 sin infección con el CFAV y Aag2 con infección natural al mismo virus, buscaba reducir la replicación de este virus mediante la aplicación de RNAi contra el gen NS5; no obstante, al eliminar el tratamiento el virus tuvo una restauración rápida. Curiosamente, al infectar las líneas celulares con DENV y CFAV, se observó una interacción positiva que mejoró significativamente la replicación de DENV y viceversa, esto se debe a que la infección por CFAV aumenta la expresión de ribonucleasa kappa (RNASEK), la cual promueve la infección de virus que dependen de endocitosis y la entrada dependiente del pH por lo cual se aumenta la replicación del DENV [74]. Esto genera repercusiones secundarias ya que la presencia de CFAV mejora la replicación de arbovirus causantes de epidemias como el DENV [75]. Otros ISF descritos y caracterizados a partir de líneas celulares de insectos son: Quang Binh aislado de Cx. tritaeniorhynchus [76], el virus del río Kamiti de Ae. macintoshi [77], virus Nakiwogo de Mansonia africana [78] y virus Calbertado de Cx. tarsalis [79, 80] en los cuales se han realizado estudios de interacción entre falvivirus de interés médico y ISF.
Por otra parte, las células de insectos también se han utilizado para determinar la eficacia de especies de bacterias como inhibidores de virus (Figura 1); un ejemplo es Wolbachia pipientis una bacteria en-dosimbiótica presente en especies de insectos que bloquea la replicación de varios flavivirus patógenos. Esta bacteria se probó inicialmente en la línea celular Aag23 de Ae. albopictus, la cual se infectó con el DENV-2 y presentaba diferentes densidades de Wolbachia pipientis; en este estudio se evidencio que las copias del genoma del DENV-2 en las células aumentó cuando disminuía la densidad de Wolbachia [81]. Estudios similares se realizaron con diferentes cepas de Wolbachia como inhibidor de arbovirus de la familia Flaviviridae como CHIKV y Zika (ZIKV). Dentro de las cepas estudiadas, se encontró que WAlb es capaz de reducir las tasas de infección por ZIKV infectados por vía oral, pero no en Ae. aegypti con infección intratorácica por ZIKV e infección oral/ intratorácica por DENV [82]. Por otra parte, las cepas de WMelPop y WMelPop-CLA confieren protección inmunológica contra DENV y CHIKV, mientras que las cepas WMel y WMelpop mediante la alteración de contenidos de lípidos y colesterol bloquean al DENV y ZIKV [83, 84, 85, 86, 87, 88]; WMel también resulto ser eficiente en la reducción de ZIKV [89] y el DENV [90,91]. No obstante, todas las cepas de Wolbachia han demostrado ser eficientes en la reducción de flavivirus, por ejemplo, WPip en Ae. aegypti no mejoró la inmunidad innata del mosquito contra el DENV [86]. En Colombia, actualmente, se han implementado programas de liberación masiva para establecer a Wolbachia diferentes comunidades; la primer liberación se llevó a cabo en el municipio de Bello, Antioquia, por un periodo de dos años iniciando en el 2015; debido a los resultados obtenidos en este estudio piloto, se han realizado liberaciones a gran escala en Medellín, Itagüí, Sabaneta y Cali; donde se espera establecer no solo la reducción del dengue, sino también la de arbovivirus como CHIKV y ZIKV [92].
Otra aplicación de las líneas celulares de mosquitos es el uso de estas, para determinar la eficacia de compuestos o tratamientos antivirales y comprender la ruta de infección de los virus (Figura 1), un ejemplo, es el estudio realizado en células C6/36 donde se evalúo la eficiencia de bafilomicina A1 contra el virus EJ, donde se evidenció su capacidad para inhibir el crecimiento del virus JE y la fuerte relación existente entre la acidez intracelular y la etapa inicial de la infección por el virus de la EJ en las células C6/36 y Vero [93]. Otros compuestos evaluados para establecer su potencial como inhibidores virales, es el Sofosbuvir, el cual inhibe la polimerasa y fue aprobado por la Federación de Alimentos y Medicamentos (FDA) de Estados Unidos, contra el virus de la hepatitis C y a su vez es eficiente inhibiendo la polimerasa de Flavivirus con material genético de tipo ARN, como el ZIKV, DENV y YFV [94, 95, 96, 97] e interactuó con la proteína no estructural NsP4 del CHIKV, con el objetivo de disminuir la producción viral [98]; Por otra parte, la Suramina, un fármaco antiparasitario aprobado en Alemania, presentó actividad inhibitoria en la síntesis de ARN del CHIKV [99]; además, suprimió la replicación de ZIKV al interferir con la unión y liberación del virus a las células huésped [100]. No obstante, las líneas celulares de insectos también han sido empleadas para el estudio de virus de interés veterinario como el virus de la Estomatitis vesicular (VSV), peste equina africana (PEA) y EJ [46]; la línea celular obtenida de la especie Culex theileri, la cual es susceptible al virus de la fiebre del Valle del Rift (RVF) que afecta principalmente a bovinos [46]. Estos estudios, resaltan el amplio uso de las líneas celulares de insectos no solo en el ámbito médico, con la prueba de medicamentos de interés contra virus implicados en epidemias sino también en el campo de la medicina veterinaria [101].
Finalmente, en cuanto a los péptidos antimicrobianos (AMP) provenientes de insectos, el primer péptido inducible de insectos se obtuvo de la hemolinfa de especie Hyalophora cecropia en 1980, el cual recibió el nombre de Cecropinas y de las cuales se han descrito aproximadamente 150 péptidos provenientes de insectos agrupados en 4 familias: α-helicoidales (Cecropinas y moricina) péptidos con cisteína (defensina de insectos y drosomicina), péptidos ricos en prolina (apidaecina, drosocina y lebocina) y polipéptidos ricos en glicina (atacina y guanterina), con actividad contra bacterias grampositivas, gramnegativas y diferentes tipos de hongos [102, 103, 104]. En el orden Diptera se han identificado principalmente péptidos ricos en cisteína, en Sarcophaga peregrina se identificaron por primera vez como Sapecinas, las cuales contenían seis tipos de cisteínas que mostraron similitudes con las defensinas de los mamíferos y se denominaron defensinas de los insectos [105], en Ae. aegypti se detectaron defensinas A y B en la hemolinfa [106], las cuales tienen capacidad antibacteriana mediante la formación de canales con la membrana citoplasmática [107] y la interacción con fosfolípidos que inducen micro heterogeneidad en la membrana lipídica [108], causando daños en las bacterias. Además de su poder antibacterial y antifúngico, otros estudios de AMPs de insectos han demostrado su capacidad anticancerígena, mediante el uso de la hemolinfa y el cuerpo graso del tercer estadio larvario de Sarcophaga argyrostomase en células de cáncer de mama humano (MDA-MB-231), donde se evidencio que al aumentar las concentraciones hemolinfa y grasa corporal, se observó una correlación negativa con el porcentaje de viabilidad de células tumorales; esto se asocia al aumento de los AMPs en el tejido graso de los insectos (equivalente al hígado en mamíferos) como respuesta a los daños del tejido, evidenciando su actividad antimicrobiana y anticancerígenas en células MDA-MB-231 [109]; otro estudio, donde se evaluó la producción de AMPs en tejido graso junto con células de hemo-linfa de la especie Calliphora vicina, la producción de AMPs se estudió en cultivos celulares de esta especie; dentro de los resultados obtenidos, sugieren que las muestras evaluadas (cuerpo graso y las células sanguíneas), donde el cuerpo graso produce una defensina, cuatro diptericinas, una cecropina y un péptido rico en prolina. Mientras que los hemocitos presentaron al menos una defensina, una diptericina, una cecropina y un péptido rico en prolina los cuales concuerdan con los AMPs maduros presentes en la hemolinfa; adicionalmente, la mayor parte de los materiales antimicrobianos se origina en la grasa corporal y en menor proporción en los hemocitos [110]. Estos estudios demuestran la importancia de continuar estudiando la producción de AMPs de insectos, con el fin de explorar sus potenciales usos en medicina.
6 Aportes realizados en Colombia
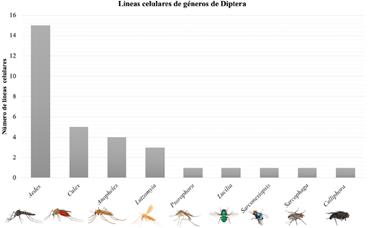
Globalmente, a la fecha, se han registrado aproximadamente 500 líneas celulares de diferentes especies de dípteros [13], entre los cuales sobresalen los generos Aedes con el mayor número de líneas celulares establecidas, seguido de Culex y Anopheles (Figura 2).
En América Latina, Colombia ha teneido una participación importante en el desarrollo de lineas celulares de insectos, se han reportado 12 líneas celulares provenientes de diferentes géneros de Diptera, derivadas de mosquitos, flebótomos y moscas necrófagas de la familia Calliphoridae.
En Colombia, la línea celular Lulo fue establecida a partir de larvas neonatas de Lutzomyia spinicrassa, inicialmente el cultivo evolucionó y formó una monocapa confuente 180 días después del explante y se caracterizó por presentar células de tipo fibroblastoides y epitelioide. La línea es mantenida en medio L-15 a 28 °C. Dicha línea celular fue empleada para permitir el desarrollo del parásito Leishmania braziliensis (Figura 1), causante de leishmaniasis cutánea en Colombia. Para tal fin, monocapas subconfluentes se infectaron con la cepa MHOM/CO/86/CL250 de L. braziliensis, donde se observaron formas promastigotas, sugieriendo la entrada del parásito a las células, además de la transformación en formas similares a las amastigotas dentro de ellas, demostrando la capacidad de estos cultivos como modelo para estudiar el ciclo de vida de L. braziliensis, así como identificar herramientas para establecer posibles mecanismos conducentes a la eliminación y control del protozoo [52].
Por otro lado, se estudió la susceptibilidad de la línea celular Lulo a la infección por los virus Mayaro (MAYV) (familia Togaviridae), Ilheus (ILHV) (familia Flaviviridae), Changuinola (CGV) (familia Reoviridae), punta toro (PTV) (familia Phenuiviridae) y estomatitis vesicular (VSV) (familia Rhabdoviridae). En este estudio se demostró la susceptibilidad de Lulo a la infección por tres de los cinco arbovirus evaluados, MAYV, CGV y VSV, por el contrario, la línea fue refractaria a la infección por ILHV y PTV. Otro aporte importante en este estudio es que ninguno de los virus produjo efecto citopático (ECP), esto permite la replicación de los virus, ya que las células sobreviven por periodos más largos; por otra parte, en los ensayos de interacción de Lulo con promastigotes de Leishmania chagasi, se observó que el parásito es capaz de sobrevivir y multiplicarse en las células Lulo, lo cual podría estar relacionado con los factores de crecimiento (Hierro) presentes en el cultivo que son sustancias fundamentales para la conservación del parásito [51]. Estos resultados son fundamentales para futuros estudios de interacción vector-parásito en el desarrollo de estas células con el objetivo de conocer el ciclo de desarrollo in vitro, a pesar de que este parásito es extracelular en el insecto.
Otro estudio relacionado con L. chagasi en células Lulo, se realizó mediante la infección de células Lulo y J774 (ratones) con promastigotes de L. chagasi durante 10 dpi, en los cuales se calculó el índice de infección, evidenciando un aumento gradual desde el día 2 en ambas líneas celulares; hasta el día 4 y 6 pi donde alcanzaron su pico máximo en las células J774 y Lulo respectivamente. Razón por la cual, las células Lulo podrían considerarse como un modelo alternativo para el estudio del ciclo biológico y la replicación intracelular debido al índice de reproducción del parasito [111]. Este tipo de estudios son importantes a nivel nacional, ya que en Colombia la leishmaniasis visceral es endémica [112]. Otro resultado importante durante este estudio fue la fuerte adhesión que presentaron los promastigotes a las células Lulo, esto puede deberse a los mecanismos de adhesión provocados por moléculas similares a las integrinas, entre el parásito y las células. Esta fuerte interacción entre el parásito y las células de Lulo, es equivalente a la que ocurre en el tracto digestivo del insecto y podría conducir a la adquisición de moléculas del insecto que actúan como opsoninas, lo cual a su vez está relacionado con los índices de replicación de este paracito en la línea celular Lulo [113]. Por otra parte, debido a la importancia de este paracito en Colombia y a la susceptibilidad de las células Lulo, se han realizado estudios constantes para establecer las condiciones ideales de replicación de L chagasi. En el 2008 Miranda y colaboradores [114], infectaron células Lulo con la cepa CL044B/84 de L chagasi, y las sometieron a diferentes variables ambientales y fisicoquímicas, dentro de las cuales se encuentran: el porcentaje de SFB, presencia o ausencia de hemolinfa, pH, osmolalidad y temperatura de incubación de las células infectadas; cada condición se evaluó a los días 3, 6 y 9 pi, encontrando los siguientes valores como los óptimos para alcanzar niveles relativamente altos de infección en los 3 días evaluados: SFB al 5%, con pH a 6.8, osmolalidad de 320 mOsm/Kg e incubados a 28°C; esto es importante para futuros estudios donde se deseen obtener altas tasas de replicación del parasito [115]. Con esta misma línea celular se han realizado estudios de interacción de diversas especies de parásitos del género Leishmania con las células Lulo [116, 117].
Otra línea celular empleada para el estudio de patógenos es Ae aegypti, la cual fue infectada con el parásito Leishmania panamensis cepa MHOM/CO/87CL412. Los cultivos celulares fueron estudiados mediante Microscopía de Luz de Alta Resolución (HRLM) y Microscopía Electrónica de Transmisión (TEM). Donde observaron pequeñas células de apariencia fibroblástica y células epiteliales con núcleo periférico, citoplasma voluminoso y vacuolado, en cuanto a la infección el porcentaje más alto fue (18.90%) de un total de 101 células en el día 6. Algunas células analizadas por TEM presentaron un citoplasma de aspecto vacuolado y algunas contenían parásitos, material fibrilar y otros estaban vacíos. Los resultados indican que las células de Ae. aegypti son susceptibles a la internalización, transformación y mantenimiento del parásito L. panamensis durante aproximadamente una semana [113].
Los dípteros vectores de enfermedades juegan un papel importante en el tratamiento de las enfermedades que transmiten, por esto se desarrollan líneas celulares de insectos vectores con el fin de conocer cómo se replica el virus; un ejemplo de esto, es la línea celular establecida a partir de tejido embrionario de Ae aegypti, en el 2005 la cual presentó mayoritariamente células epitelioides [25]. Esta línea celular se empleó en el 2007 para realizar ensayos de susceptibilidad a infecciones por arbovirus como el DENV (MOI1 y 5) y el virus de fiebre amarilla (MOI 0,02); en los resultados obtenidos no se observó inmuno-reactividad, ni antígeno, ni RNA viral por RT-PCR a partir de células infectadas para ninguno de los MOIs estudiados. Lo que sugiere que la línea celular de Ae. aegypti no es susceptible a la infección por ninguno de los virus estudiados [69], infiriendo que las líneas celulares establecidas a partir de la misma especie no se comportan necesariamente igual en cuanto a su susceptibilidad.
Por otra parte, en Colombia se han venido estableciendo líneas celulares a partir de tejido embrionario de especies de la familia Calliphoridae como Lucilia sericata, Sarconesiopsis magellanica y Calliphora vicina, especies de interés médico y forense; en las cuales se ha descrito la morfología celular de los cultivos, la caracterización citogenética y molecular, el medio de cultivo ideal para el crecimiento, etc. Sin embargo, estas líneas no han sido expuestas a la infección por arbovirus ni por protozoos [55, 118, 117, 19, 57]. Por el contrario, se han empleado para el estudio de AMPs de insectos, un ejemplo es la línea celular de Calliphora vicina, en la cual se estudiaron AMPs presentes en el tejido graso y la hemolinfa, donde se destacó la importancia de péptidos como defensina, diptericinas, cecropina y péptidos ricos en prolina; los cuales tienen propiedades antibacteriales (bacterias Gran positivas y Gran negativas) y antifúngicas [110]. Adicionalmente, se han realizado estudios anticancerígenos en células neoplásicas de humanos, en las cuales los AMPs de insectos disminuyeron la replicación celular; no obstante, estos últimos estudios no se han realizado en Colombia, pero representan nuevos enfoques para estudios posteriores [109].
7 Conclusiones
Existen múltiples líneas celulares que, si bien han sido caracterizadas morfológica, citogenética y mole-cularmente, aún no se han estudiado completamente sus aplicaciones en el aislamiento e identificación de virus, en la producción de proteínas recombinantes, pesticidas e insecticidas, vacunas, entre otros; Razón por la cual constituyen una línea de investigación de gran interés para futuros estudios.
En Colombia, se han registrado aportes importantes de cultivos celulares de insectos desde el siglo XX, estableciendo y caracterizando múltiples líneas celulares obtenidas de diferentes especies de dípteros y de diferentes tejidos como huevos, larvas y pupas; en las cuales se han realizado estudios relacionados con la susceptibilidad a infecciones con arbovirus y parásitos. Sin embargo, estudios recientes señalan la importancia de establecer diferentes líneas celulares de la misma especie empleando distintas etapas de desarrollo, ya que se ha demostrado que los cultivos celulares de una especie, presentan diferentes características que le permiten a las células ser más susceptibles a infecciones por parásitos o virus. Finalmente, el amplio número de estudios donde se emplean cultivos celulares de insectos destaca la importancia de crear un banco de células; donde los investigadores puedan acceder a las diferentes líneas celulares para realizar estudios