1. Introducción
La inseminación artificial (IA) es la biotecnología de mayor difusión entre los ganaderos del mundo, posee un gran impacto en el avance genético poblacional y costos reducidos [1]. La creciente necesidad de semen de toros de alto rendimiento genético, indujo el desarrollo y perfeccionamiento de las tecnologías de producción, desarrollo de protocolos de sincronización [1]. La IA permite aumentar el potencial de servicio de toros con alto valor genético, ya que en un servicio en potrero un solo toro podría servir en monta directa entre 30 a 50 hembras y en programas de inseminación artificial esta potencia aumenta drásticamente, debido a que por colecta se pueden generar un alto número de dosis inseminantes [2].
En las ganaderías actuales, una de las principales metas es mantener altas tasas de prenez, además, de poder programar adecuadamente los tiempos de parto, para que estos se puedan generar en los tiempos o épocas del año con la mayor disponibilidad de forrajes, con el objetivo de mejorar la rentabilidad de los sistemas de producción ganadera; la monta estacional es una estrategia de manejo en la que se promueve la concentración de actividad reproductiva en un periodo de tiempo determinado [3]. El semen puede usarse con dos métodos de conservation: uno es el congelado también denominado criopreservado, o puede usarse refrigerado. El semen congelado es almacenado en estado de congelation en nitrógeno líquido a -196°C, mientras el semen refrigerado es conservado en estado líquido a bajas temperaturas, pudiendo ser entre 15-20°C o 4-5°C [4].
Aunque el proceso de congelation se ha convertido en una rutina en la industria de la IA, existen múltiples variables que modifican la viabilidad del material a utilizar en la inseminación; [5], mencionan alteraciones de las membranas plasmaticas y acrosoma, cambios en el medio osmotico, alteration del mecanismo del calcio y en la actividad enzimática. Los cambios posteriores a la congelation producen la desestabilización de las membranas espermáticas. Teniendo en cuenta que los espermatozoides capacitados y/o con su reaction acrosomica desarrollada tienen una menor sobrevida, esto explica la disminución en la fertilidad del semen congelado [6] En general, la criopreservación da como resultado una disminución del 50% en la viabilidad de los espermatozoides [7].
Los espermatozoides que tienen su reaction acrosomica desarrollada, son más susceptibles a los cambios sufridos durante la congelation, lo cual explicaría la disminución en la fertilidad del semen congelado [2]. Con la implementation de semen refrigerado en un programa de Inseminación Artificial A Tiempo Fijo (IATF), existe un efecto positivo en cuanto a fertilidad, eficiencia y rentabilidad de la producción, disminuyendo notablemente el costo de preñez al utilizar menor número de espermatozoides por dosis, se podría por eyaculado tener mayor cantidad de dosis y preñar más vacas por servicio [8].
Mediante la conservation por refrigeration Abril-Parreño et al [9]. mencionan que hay una disminución en la actividad metabólica de los espermatozoides, produciendose una reducción en el crecimiento bacteriano, lo que lleva al eyaculado a extender su supervivencia. Según Upadhyay et al [10], el semen almacenado entre 5-8°C sobrevive entre 24-48 horas sin una disminución significativa en la motilidad y hasta 96 horas sin un marcado descenso en el porcentaje de fertilidad, sin embargo, una desventaja particular del semen fresco es su vida útil limitada, ya que se estima una vida útil de entre 2 y 4 días [9].
El uso de semen refrigerado incrementa la producción de dosis inseminantes, debido a que se evita alrededor del 50 % de mortalidad de las células, situación que es inevitable en el semen congelado [11]. Durante el uso comercial de semen refrigerado en paises donde se maneja de forma rutinaria, se ha reportado que este se conservó durante 3 días, existiendo una caida de la fertilidad a partir de las 48 horas post extraction [12]. Otra de las ventajas en el uso del semen refrigerado, es que los espermatozoides no se someten a estrés durante el proceso de congelación-descongelación, por lo cual, las dosis inseminantes con semen congelado presentan aproximadamente 10 veces menos espermatozoides [13].
Los programas de monta estacional se establecen con el fin de mejorar las condiciones para el momento del parto, además de esto, se establecen que los programas de inseminación artificial a término fijo (IATF) permiten una programación reproductiva más eficiente dado que se logra controlar la dinámica reproductiva en manifestaciones o programaciones de celos, de modo tal que se adapta a las exigencias de los programas de monta estacional [14]. Concentrar las épocas de parición y nacimiento de los terneros en los meses del año en donde se presenten las condiciones más optimas en lo referente a oferta de forrajes, clima y agua, con el fin de disminuir mortalidades, y aumentar la eficiencia reproductiva del hato [15].
Por lo tanto, el objetivo de la presente investigacion es evaluar la tasa de respuesta reproductiva (porcentaje de preñez) por inseminación artificial a tiempo fijo (IATF), utilizando semen refrigerado y semen congelado en programas de monta estacional con vacas Brahman en el trópico bajo colombiano.
2. Materiales y Metodos
2.1. Localización del proyecto
La presente investigación se desarrolló en el municipio de Maní, Casanare, Colombia, con latitud 4049'0" N, longitud 72016'59" W, a 179 msnm, con una precipitation anual de 1431 mm.
2.2. Manejo de las hembras
Las vacas incluidas en el estudio se encontraban sanas al examen semiológico completo y contaban con registro de desparasitación e inmunizaciones obligatorias. Se seleccionaron 140 vacas Brahman lactantes multíparas, entre 45 y 150 días postparto, con condición corporal promedio de 3.3; en una escala de 1 a 5. Todos los animales fueron manejados bajo las mismas condiciones medio ambientales donde la pradera fue manejada bajo un modelo de rotación con un día de ocupación, la finca maneja sistemas de fertirriego y los potreros se encuentran divididos por cerca electrica fija, cuentan con espacios para bebedero donde el agua se suministra Ad libitum y un espacio destinado para comederos, donde los animales eran suplementados con sal mineralizada.
2.3. Manejo en la estación de monta
El manejo de la estación de monta duró en promedio 105 días, comenzando en el mes de octubre y terminando en el mes de febrero, implementando programas de inseminación artificial a término fijo (IATF). Los servicios de las vacas se realizaron en lotes de 70 animales con una duración maxima de tres horas, para disminuir el estrés en los animales. Es importante mencionar que los terneros no fueron separados de las madres en ningún momento.
2.4. Manejo el sistema de IATF
El día del inicio del estúdio y de los tratamientos fue identificado como día 0; en este día se hizo un chequeo reproductivo completo, incluyendo palpación rectal y evaluación por ultrasonografía, con el fin de evaluar estructuras anatómicas a nivel de ovario (evaluando ciclicidad), cuernos y útero y descartar así animales con anormalidades del tracto reproductivo. Una vez identificadas las vacas con ciclicidad ovarica (por presencia de folículos y cuerpos luteos) se inicio el protocolo de la IATF: en el día 0 el dispositivo DIV + 2mg de benzoato de estradiol, en el día 8 el retiro de dispositivo + 2mg de PGF2 + 1mg de cipionato de estradiol + 400UI de eCG y el día 10 se realizó el proceso de IA con una dosis de 60 millones de espermatozoides por pajilla para el Grupo servido con el semen congelado y de 80 millones de espermatozoides por pajilla para el Grupo servido con el semen refrigerado. Los dispositivos DIV usados fueron de segundo uso y no se uso GnRH en el protocolo. El diagnostico gestacional fue determinado a los 35 días post inseminacion a traves de palpación rectal y ultrasonografía transrectal.
2.5. Manejo del toro
Para el análisis experimental, se trabajó con semen de un solo toro de la raza Brahman, el cual mostró excelente actitud reproductiva y las siguientes características espermáticas previamente confirmadas: olor sui generis, apariencia cremosa, motilidad masal de 5, motilidad progresiva individual del 80 %, y anormalidades primarias menores a 10 % y totales menores a 25 %.
2.6. Grupos experimentales
Las vacas fueron divididas aleatoriamente en dos (2) Grupos experimentales de 70 vacas cada uno, donde cada vaca se tomó como una unidad experimental. Cada Grupo se diferenció por el tipo de manejo de semen, en donde el Grupo 1 fue manejado con semen congelado y el Grupo 2 con semen refrigerado. Todos los animales se manejaron bajo los mismos parámetros productivos para evitar sesgos experimentales. Para el caso del Grupo 1 (semen congelado), el toro fue colectado por electro eyaculación con el uso de un (Electrojac 5®, Ideal Instruments, Lansing, MI, USA) sometiendo al toro a impulsos eléctricos de creciente intensidad que se detuvieron en el momento en que comenzó la eyaculación, la mayoría de las veces se logró recolectar el material en el primer ciclo, pero si la muestra recolectada no tenía una cantidad aceptable (menor a 3 cm3), se procedía con la obtención de una segunda muestra. La congelación, se realizó 3 meses antes de iniciar la investigación junto con el programa de IATF. Para el caso de Grupo 2, el semen fue colectado y preservado el mismo día del programa de IATF.
2.7. Evaluacion de características espermáticas
En las colectas realizadas, luego de la extracción del semen, se extrajeron muestras con micro pipeta para evaluar volumen (en Ml) y el color (determinado por su aspecto y asociándolo a su calidad: blanco cremoso o blanco lechoso).
Para la motilidad masal (Se usó una alícuota de semen puro (20 µl) sobre una lámina portaobjetos en el microscopio óptico con objetivo de 10X, en placa térmica a 32.5 °C. Se estimó mediante una valoración subjetiva del movimiento masivo de los espermatozoides, con un rango de 0 a 5. Para la motilidad individual progresiva: se usaron (10 µl) de semen en un portaobjetos, se cubrió con un cubreobjetos, ambos atemperados a 37 °C se observó con el lente de 40X, se evaluó el movimiento progresivo rectilíneo que atraviesan el campo observado, la concentration se hizo en la cámara de Neubauer, según la técnica descrita por Herrera & Rigoberto, con la variante del uso de agua bidestilada para inmovilizar a los espermatozoides [16].
Luego de evaluar las características espermáticas, se realizó el proceso de congelation (Grupo 1) y de refrigeration (Grupo 2). Se uso el diluyente continental ONE-STEP™. El semen fue prediluido en una proporción 1:1 con la fracción A del diluyente a una temperatura de 35°C durante 15 minutos y posteriormente se agregó el resto de la fracción A y se enfrió a 5°C. Una vez a 5°C se dejó equilibrar durante 2 horas, tiempo en el cual se agregó una cantidad igual de diluyente B a 5°C [17].
El semen se envasó en pajillas de 0.5 Ml, posteriormente se dejó equilibrando durante 4 horas a 5°C, al cabo de este tiempo para el Grupo 1, se congeló en vapores de N2 durante 10 minutos a 4cm de altura sobre el nivel del N2 y utilizando lotes de 72 pajillas. Después de los 10 minutos fueron agrupadas en los goblets de a cinco pajillas por goblets y dos goblets por escalerilla para luego ser depositadas directamente en el termo con N2 líquido a una temperatura de -196 °C. Los valores deseables de los espermatozoides congelados se pueden ver en la Tabla 1 [18].
Tabla 1: Características deseables de los espermatozoides congelados [18]
| Características | Valores |
|---|---|
| Motilidad espermatica | ≥ 30% |
| Vigor | ≥ 3 |
| N° espermatozoides por | 10x106 espermatozoides |
| paleta (0.25 a 0.50 ml) | moviles |
| Espermatozoides normales | ≥ 70% |
| Defectos mayores | ≤10% |
Los parámetros y valores mínimos para aceptar el semen descongelado para el servicio, se definen según el Colegio Brasileiro de Reproducción Animal -CBRA-), estos son determinados inmediatamente después de descongelado el semen y luego de 2 horas de incubación a 36°C por medio de la prueba de termorresistencia, dichos valores pueden verse en la tabla 2 [18].
3. Análisis de datos
Se utilizaron estadísticos descriptivos para las características del semen congelado y refrigerado, y para hallar la tasa de preñez del estudio, se realizó la prueba chi cuadrado para determinar las diferencias estadísticas entre el uso de semen congelado y refrigerado en los protocolos de IATF, con un intervalo de confianza del 95 %, útilizando el programa estadístico SPSS®.
Tabla 2: Parámetros y valores mínimos para aceptar el semen descongelado para el servicio [18]
| Características | Vigor |
|---|---|
| Movimiento en masa | ≥3 |
| Motilidad espermatica | ≥ 60% |
| Vigor | ≥3 |
| Concentration espermatica | -350x106ml |
| Nú mero total de espermatozoides | 3-5 x 109 |
| eyaculado | |
| Espermatozoides morfologicamente normales | ≥ 70% |
| Defectos mayores | ≤ 10% |
| Defectos menores | ≤ 20% |
| Defectos individuales mayores | ≤ 5% |
| Defectos individuales menores | 10% |
4. Consideraciones eticas
El proyecto se realizó bajo los aspectos éticos que figuran en la resolución 8430 de 1993 emanada por el Ministerio de Salud de Colombia, además, se cuenta con el aval del comité de bioética de la Universidad Pedagógica y Tecnológica de Colombia UPTC.
5. Resultados y discusión
5.1. Características seminales
Como se puede observar en la tabla 3, el semen refrigerado presento un porcentaje de motilidad progresiva individual del 80% respectivamente y 3952 millones de espermatozoides móviles totales, evidentemente superior al semen congelado el cual mostro un 50% de motilidad progresiva individual y 1080 millones de espermatozoides móviles totales. De igual manera el rendimiento del semen refrigerado es superior, al obtener una concentration de 80.8 millones de espermatozoides móviles por dosis inseminante.
De acuerdo con lo anterior, la concentración de espermatozoides por dosis (pajilla) junto con la Motilidad progresiva individual, es superior en el semen refrigerado, lo cual estaría podría estar directamente relacionado con la mayor tasa de preñez en el Grupo de vacas manejadas con semen refrigerado, ya que según Sweett et al, la mayor tasa de preñez se puede conseguir manejando ganado con alta fertilidad junto con semen bueno y de alta calidad [19].
Los valores obtenidos para las características espermáticas del semen refrigerado, coinciden con los valores encontrados por Herrera & Rigoberto, quienes reportan valores de 6.8-4.33 Ml de volumen y 86.0 % de espermatozoides motiles en el semen descongelado de alta calidad en toros [16].
En el caso de los valores obtenidos para las características espermáticas en el semen congelado, Según Pandapotan et al, se pueden deber a que los contendores de almacenamiento, la frecuencia de las actividades de transporte y la duración del viaje durante la distribución de la muestra, provocarían cambios de temperatura y, por lo tanto, tendrían un impacto en la calidad de la muestra [20]. Por el contrario, Til et al, informaron, que la distribución o transporte de semen congelado no afectaría la calidad del semen siempre que permaneciera sumergido en nitrógeno líquido a una temperatura de -196°C [21]. Esto sugiere que la distribución del semen congelado en el estudio actual se adhirió a estas medidas y, como resultado, no se observan alteraciones en las características espermáticas del semen congelado a causa de la temperatura.
La motilidad de los espermatozoides determina la capacidad de los estos para fertilizar un ovulo, por lo tanto, es una característica importante en la evaluación de la calidad del semen antes y después de la descongelación [22]. Pandapotan et al., encontraron resultados similares de motilidad progresiva individual en semen descongelado, con valores de 45.93 ± 0.55% - 71.12±2.53% [23], lo cual es similar a lo encontrado en este estudio para los dos tipos de semen utilizados, lo cual estaría por encima del valor mínimo aceptable del 40 % de espermatozoides motiles después de la congelación y descongelación, indicado por Zewdie et al [24].
Los resultados del porcentaje de vitalidad del semen refrigerado y congelado, después de ser descongelados, concuerdan con lo encontrado por Pandapotan et al, en donde se evidencio que la viabilidad del semen descongelado estuvo entre 62,98±0,01 % y 85,08±0,04% [23, 24]. Pandapotan et al. agregaron que el nivel de motilidad y viabilidad de los espermatozoides después del proceso de crio conservación puede disminuir en un 25-75% 23. Esto ocurre por la presión que se produce en los espermatozoides durante el proceso de crio preservación, debido a la deshidratación celular, las altas concentraciones de solutos y los cambios en la motilidad progresiva individual, siendo cambios funcionales y de daño estructural [26].
Las anomalías espermáticas altas tendrán un impacto negativo y afectaran la fertilidad [27]. El porcentaje de anomalías espermáticas totales en el semen refrigerado descongelado del presente estudio coincide con lo encontrado por Pandapotan et al. quienes evidenciaron un 4,03±0,01 %-9,07±0,01 % de anomalías en el semen descongelado [23], por lo anterior las anomalías espermáticas encontradas en este estudio para el semen congelado descongelado son altas. Gerber et al. Informaron que los toros con anormalidades espermáticas totales >17% tendrían bajas tasas de fertilization [28]. Kumar et al. también informaron que las anomalías máximas de los espermatozoides en el ganado eran de menos del 20 %, de las cuales los toros con buena fertilidad presentaban una anomalía total que oscilaba entre el 8 % y el 12%. Las anormalidades de los espermatozoides en el semen refrigerado en el actual estudio son relativamente bajas, lo que indica que el este semen descongelado es de buena calidad, lo que no se puede afirmar para el semen congelado que presento el mayor porcentaje de anormalidades [27].
6. Preñez
De acuerdo con la tabla 4, se encontraron diferencias estadística-mente significativas entre los dos tratamientos, (p <0,05), en donde el porcentaje de preñez fue mayor para el semen refrigerado, con 60 %, (n =42) mientras que para el semen congelado el porcentaje de preñez fue del 41 %. (n=29).
Se evidencia que la tasa de preñez general está en el 49.4% por IATF con semen congelado; eso significa que el número de servicios por concepción es de 2.11; esta es la cantidad de pajillas necesarias para realizar una preñez en la ganadería, sin embargo, se resalta que con la utilización de semen refrigerado se logró aumentar la tasa de preñez a un 60 % en el programa de IATF.
En general, los programas de IATF muestran ser positivos con respecto a los porcentajes de preñez, es así como Borges et al, reporta que el porcentaje de preñez puede estar alrededor del 50- 60 %, según el nivel de ciclicidad de los animales utilizados y según su condición corporal [8]. Según Robin, la diferencia entre el semen fresco versus semen congelado no es significativo en la actualidad sobre la tasa de preñez [28]. Sin embargo, en investigaciones realizadas por Sales et al, se obtienen un mayor número de preñez con la utilización de semen refrigerado [17], dado que en el semen criopreservado la tasa de daños a la población espermática que sobrevive al proceso de congelación es más alta y que en este se observa menor fertilidad debido a una menor viabilidad de los espermatozoides luego del proceso de descongelación por disminución de los espermatozoides vivos [15], al igual, Ponce et al, respaldan que el aumento en el porcentaje de preñez usando semen refrigerado se puede dar debido a que en el proceso de refrigeration se presentan menos daños sobre los espermatozoides, dado que no están siendo sometidos al estrés del proceso de congelación-descongelación [18]. Por tanto, la fertilidad del semen congelado es inferior a la del semen almacenado en estado refrigerado [17, 18]. Borges et al, concluyo que la utilización de semen refrigerado puede ser una buena alternativa ya que al utilizar la mitad de la dosis de semen logro alcanzar un 10% más de preñez [8].
Tabla 3: Características del semen congelado y refrigerado. Grupo 1 semen congelado, Grupo 2 semen refrigerado.
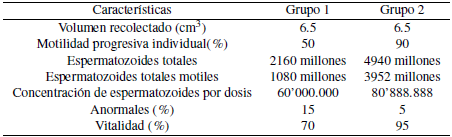
Tabla 4: Porcentaje de preñez útilizando semen congelado y semen refrigerado en los protocolos de IATF.

Borges et al, menciona que la implementación de semen refrigerado en sistemas de IATF podría aumentar la eficiencia y la rentabilidad de la producción, disminuyendo notablemente el costo de preñez al utilizar menor número de espermatozoides por dosis y, por ende, por eyaculado se podrían tener mayor cantidad de dosis y preñar más vacas por salto [8], también recomienda que al usar semen refrigerado este se emplee dentro de las 24 horas de obtenidos el eyaculado, para obtener mejores resultados, dado que se conserva mejor la motilidad masal, la individual progresiva y el porcentaje de espermatozoides vivos [8].
7. Conclusiones
Se concluye que el semen refrigerado es estadísticamente superior, ya que presento la mejor relation entre espermatozoides moriles por dosis inseminantes y motilidad progresiva individual, mientras que el semen congelado mostro una calidad inferior, demostrando que la crio preservación altera la integridad de los espermatozoides, siendo contraproducente en los protocolos de inseminación artificial a tiempo fijo. De igual manera, la tasa de preñez fue notoriamente superior en las vacas inseminadas con semen refrigerado, ya que la cantidad de espermatozoides motiles presentes en cada pajilla, aumentaron la probabilidad de lograr la preñez en las vacas del Grupo 2.














