1. Introducción
El lago de Tota conforma el humedal de alta montaña mas extenso del país [1] y la segunda cuenca con mayor extension en Sur América. Se encuentra ubicado en el departamento de Boyacá específicamente entre los municipios de Aquitania, Tota y Cuítiva [2]. Esta cuenca hidrográfica se caracteriza por presentar servicios eco sistémicos de gran trascendencia para la población, entre ellos se destaca: abastecimiento de agua para el consumo, actividades productivas e industriales y el aprovisionamiento de alimentos [3]. Actualmente, es posible evidenciar una serie de problemáticas ambientales que repercuten en la funcionalidad del lago y, en consecuencia, en las poblaciones que allí habitan. Dentro de las principales fuentes de contaminación se encuentran: la escorrentía de agentes químicos (plaguicidas) empleados en los cultivos de la zona, especialmente de cebolla larga (Allium fistulosum) [1], la eutrofización, debida a la pérdida total de fosforo causada por el uso excesivo de plaguicidas organofosforados [4] y las constantes fumigaciones [5].
El uso persistente de plaguicidas se constituye como un grave problema de salud publica a nivel mundial debido a la morbilidad y mortalidad que estos agentes químicos pueden causar. Dado que los plaguicidas son sustancias que se han empleado para prevenir, destruir, repeler o mitigar plagas tanto en la agricultura como en la lucha contra vectores, su uso ha traído beneficios, pero también ha generado riesgos para el hombre, los animales y el medio ambiente [6]. Las actividades agroindustriales representan serios problemas de intoxication para la población humana, de hecho, el Instituto Nacional de Salud de la mano con el Sivigila [7] reportaron en su investigation 8245 intoxicaciones en el 2013, seguido por 9214 en 2014 y 8732 casos de intoxicaciones para el 2015 en Colombia. Aun más preocupante, en el departamento de Boyacá los plaguicidas son la primera causa de intoxication, así mismo, el 44,7 % de los casos se produjeron con mayor frecuencia en zonas rurales, en donde se informa que sus principales causas fueron ocupacional y accidental [8].
En Colombia y en Boyacá, son pocos los estudios que evidencian el efecto deletéreo de los plaguicidas sobre el material genético de diferentes especies, incluyendo a humanos y a peces. Lo anterior, muestra la necesidad del uso de modelos biológicos como el pez cebra, que permita la evaluación de un posible dano genético por exposición a plaguicidas, así como realizar seguimiento a las poblaciones expuestas a los mismos.
Las investigaciones realizadas hasta la fecha muestran que el pez cebra (Danio rerio) es un modelo biológico de gran importancia para el desarrollo de estúdios de genotoxicidad por exposición a plaguicidas. Lo anterior debido a la alta sensibilidad de este organismo a los cambios ambientales y su alta homología con el genoma humano [9]. De hecho, en los últimos anos, el pez cebra se ha convertido en un importante modelo biológico para las actividades científicas y experimentales, incluidos los estudios que buscan comprender la dinámica (dano del ADN) de diversas sustancias toxicas. Por ejemplo, investigaciones recientes indican que su genoma es aproximadamente la mitad del tamaño de la mayoría de los genomas de los mamíferos y contiene alrededor de 4,6 picogramos (pg) de ADN que se encuentran distribuidos en 25 pares de cromosomas [10].
Este organismo, además de poseer genes similares a los humanos, se destaca por compartir un alto nivel de homología fisiológica en donde se incluye el cerebro, el tracto digestivo, la musculatura y el sistema inmune innato. Por tanto, es posible inducir diferentes mutaciones genéticas o activar vías de señalización mediante el uso de productos químicos, así como inducir tumores en una amplia variedad de órganos [11] como el hígado, el pancreas, el canal intestinal, la piel, los músculos, la vasculatura y los testículos. Adicionalmente, el pez cebra tiene la capacidad de imitar el carcinoma humano en el sentido de que exhibe aneuploidía masiva y heterogeneidad en el mismo tumor [12].
Teniendo en cuenta lo anterior, el objetivo de este estudio fue estandarizar técnicas de citogenética de bandas (Bandeo GTG) y de citogenética molecular (FISH) sobre larvas de pez cebra, y de esta manera postular su uso como modelo biológico en estudios de genotoxicidad. El éxito de los estúdios citogenéticas depende de que los cromosomas se hayan diseminado correctamente y de una correcta expresión de patrones de bandeo. Sin embargo, la inconsistencia de la distribución cromosómica óptima sigue siendo un problema importante en los estúdios citogenéticos.
2. Materiales y métodos
2.1. Preparación de acuarios y alimentación
La preparación de los acuarios se realizó mediante el uso de agua con pH entre 6.5 y 7.0, grava (para que los desechos orgánicos y los huevos queden fijos y no en suspensión), adorno artificial (para simular en lo posible el entorno natural) y dos sistemas de filtración. La alimentación se realizo 3 veces al día, empleando tanto alimento vivo (Artemia salina) como comida en hojuelas.
2.2. Obtencion de larvas
Los huevos fueron retirados de la grava mediante el uso de una aspiradora de bomba manual, luego fueron lavados y finalmente transferidos a caja de Petri conteniendo agua destilada. Las cajas de Petri conteniendo los huevos fueron incubadas a 28°C por un periodo de 72 - 90 horas.
2.3. Obtención de metafases y núcleos interfásicos
La obtención de las suspensiones celulares conteniendo las metafases y los núcleos interfásicos (pellets), se realizó usando protocolos de recolección previamente estandarizados en el laboratorio de investigation BIOEDUQ de la Universidad del Quindío. Brevemente, larvas de 3 a 6 días post eclosión, fueron depositadas en tubos eppendorf conteniendo solución de colchicina 0.15 % + DMSO 2%, por 6 horas. Transcurrido este tiempo, las larvas fueron tratadas con solución hipotónica (KCl 0.075 M) por 18 minutos y fijadas tres veces con fijador carnoy (Metanol - Acido acético 3:1).
2.4. Extendidos metafísicos y dispersión de los cromosomas
Para la realización de los extendidos metafísicos se usó un baño serológico. Brevemente, doce (12) microlitros de la suspension celular en fijador carnoy obtenida previamente, se dejaron caer sobre un portaobjetos desde una altura de 1 cm y con grado de inclination de 45°C. Con el objetivo de lograr una correcta dispersion de los cromosomas, la suspensión celular (conteniendo las metafases y nucleos interfásicos) fue extendida sobre portaobjetos secos, o con agua, o con fijador carnoy. Así obtenidos, los extendidos metafásicos fueron expuestos a diversas condiciones de temperatura y humedad (Tabla 1).
Específicamente, los portaobjetos con los extendidos cromosómicos fueron colocados sobre un baño serológico a 68T°C hasta la evaporation total del fijador carnoy. El baño serológico se utilizó para proporcionar la humedad y la temperatura adecuada para el secado de las células y la propagación de los cromosomas. De la misma manera, se realizaron los extendidos cromosómicos a T° ambiente con una humedad relativa del 78 %.
2.5. Analisis Citogenéticos - Bandeo G con tripsina y Giemsa (Bandeo GTG)
Las placas conteniendo las metafases obtenidas previamente, fueron deshidratadas a 80°C durante 2 horas e incubadas en tampon 2xSSC por 30 minutos. Luego las preparaciones fueron sometidas a tripsina a concentration de 0,25 % (Gibco, Life Technologies, Nebraska, USA) por diferentes tiempos, incluyendo: 1 segundo, 2 segundos, 3 segundos y 4 segundos. El establecimiento del tiempo adecuado en tripsina se constituye como un paso primordial en la obtención de un patron de bandas específico para cada cromosoma. Pasado el tiempo de incubación en tripsina, las preparaciones metafásicas fueron coloreadas con Giemsa (Sigma, St. Louis, MO, USA) por 10 minutos. Finalmente, las metafases bandeadas fueron visualizadas y analizadas usando un microscopio Olympus. Las imágenes fueron adquiridas mediante el uso del software Cytovisión System 7.4 (Leica Biosystems Richmond, VA, USA).
2.6. Hibridacion In Situ (FISH) por Fluorescencia
FISH se realizó sobre núcleos interfásicos y metafases usando sondas NOR (Nucleolar Organizing Regions) humanas, marcadas con fluorocromo rojo (LPE NOR, Cytocell, Cambridge). Las sondas NOR son específicas para los genes de ARNr ubicados en los brazos cortos de los cromosomas acrocéntricos. Estos genes de ARNr son de importancia crítica para la viabilidad celular. Las NOR contienen grupos de genes que codifican las tres moleculas de ARNr estructural más grandes (5.8S, 18S y 28S). La localization cromosomica de los principales ADN ribosomicos (18S, 5.8S y 28S), correspondientes a NOR, aplicando FISH sobre cromosomas de pez cebra ha sido reportada en estúdios previos [13]. Se analizaron ocho areas seleccionadas al azar utilizando un microscopio Olympus con el software citogenetico Cytovision System 7.4 (Leica Biosystems Richmond, Inc.).
3. Resultados y discusión
La agricultura, específicamente el monocultivo de cebolla larga es sin duda la actividad que genera el mayor grado de transformation en la cuenca del Lago de Tota. Como se indicó anteriormente, son múltiples los efectos que se presentan como consecuencia del uso y manejo inadecuado del material organico, de productos químicos de uso agrícola (plaguicidas y fungicidas) y de las aguas de riego y escorrentía utilizados para esta labor productiva. Estos tres elementos, sumados a la densidad e intensidad del cultivo, son la base de las tensiones ambientales en este ecosistema [14]. Dichos efectos han sido evaluados principalmente mediante caracterizaciones fisicoquímicas de agua y sedimentos, análisis toxicológicos en algunos vertebrados e invertebrados presentes en el cuerpo de agua y la identification de los plaguicidas utilizados en la cuenca. Sin embargo, los estúdios de genotoxicidad por exposición a plaguicidas son escasos o nulos por lo que, a la fecha, la frecuencia y el tipo de dano celular y genético generado por la exposición a los compuestos tóxicos presentes en el lago de Tota son desconocidos.
Durante décadas, el pez cebra se ha empleado para pruebas de toxicidad ambiental y calidad del agua, siendo la primera especie de pez en la que se desarrollaron experimentos asociados con la carcinogénesis. El pez cebra es un organismo importante para el estudio de vertebrados en una gran variedad de disciplinas biológicas debido a su alta fecundidad y rápida generation que favorecen los análisis genéticos, además, pueden ser facilmente mantenidos en acuarios. Por ello, esta especie ha adquirido gran importancia en los últimos años ya que ha resultado ser un excelente modelo para la investigation de diversas patologías y enfermedades humanas, entre ellas el cancer [15, 16], en química toxicológica, estúdios de neurobiología (neuroanatomía y neuroquímica) [17] y en la evaluación morfológica de los efectos de la exposición ambiental a variedad de compuestos [18].
El pez cebra y el humano comparten gran parte del genoma (aproximadamente el 70 %), incluyendo el 82 % de genes asociados a enfermedades como el cáncer, el Alzheimer, el Parkinson y algunas cardiopatías [19]. A este respecto, se han realizado descripciones detalladas de la anatomía del embrión y la larva del pez cebra y se han desarrollado metodologías robustas que permiten la experimentación, destacando el estúdio de la mutagénesis a gran escala en este modelo biológico para indagar acerca de las alteraciones cromosómicas numéricas (aneuploidía) y estructurales, la función de los genes y la heterogeneidad característica de enfermedades como el cáncer [20].
Este organismo, además de poseer genes similares a los humanos, también se destaca por compartir un alto nivel de homología fisiológica, en donde se incluye el cerebro, el tracto digestivo, la musculatura y el sistema inmune innato, por lo que se estima que aproximadamente se pueden reproducir en el pez cebra 8 de cada 10 enfermedades humanas [21], incluyendo la inducción de tumores en una amplia variedad de órganos como el hígado, el pancreas, el canal intestinal, la piel, los músculos, la vasculatura y los testículos [11]. Adicionalmente, es posible evaluar diferentes mutaciones genéticas o activar vías de señalizacion mediante el uso de productos químicos.
La incorporation del pez cebra al listado de animales empleados en los procedimientos experimentales ha supuesto la consolidación de este modelo animal. De hecho, su uso se ha incrementado debido a sus ventajosas características, permitiendo enfocar numerosas áreas de estudio desde nuevas perspectivas [22]. Por ejemplo, en diversos estudios de toxicidad se ha determinado la capacidad del pez cebra para regenerarse, adaptarse y responder inmunológicamente a altas concentraciones de sustancias químicas como el arsénico, el plomo y el glifosato [23]. Sumado a estos factores, su estúdio representa un gran valor para la salud y la prevention, pues la exposición humana a químicos ambientales se asocia con toxicidad aguda y consecuencias a largo plazo que incluyen anomalías congénitas y crónicas, cancer e incluso, muerte [18].
Los embriones de pez cebra expuestos a carcinógenos exhiben una amplia variedad de neoplasias que se derivan principalmente de tejidos epiteliales, mesenquimáticos y neurales, donde el hígado representa el principal órgano afectado por la exposición a este tipo de agentes en cualquier etapa de desarrollo [24]. Muchos de estos agentes tóxicos se introducen en el medio ambiente especialmente por medio del vertimiento de aguas residuales en fuentes hídricas y conforme pasan los años, la presencia de estas sustancias tiende a ser mayor. De acuerdo con ello, la contaminación de ecosistemas acuaticos y su efecto sobre las poblaciones que allí habitan, han sido reconocidas como una de las principales emergencias ambientales actuales [25].
Considerando lo anterior, el pez cebra se constituye como un excelente modelo biológico y en un prototipo ideal para la evaluación de los efectos genotóxicos por exposición ocupacional o ambiental a sustancias químicas [25] debido a su sensibilidad a los contaminantes, sensibilidad evidenciada por daño al material genético (rupturas, inserciones y delaciones cromosomicas). Además, en la actualidad existen pocos modelos animales en los que sea posible estudiar los efectos de la exposición a sustancias toxicas [18]. Las investigaciones realizadas hasta la fecha muestran que el pez cebra es un modelo biológico de gran importancia para el desarrollo de estudios de toxicidad y genotoxicidad por exposición a pesticidas presentes en fuentes de agua como el lago Tota.
La orientación citogenética en investigaciones acerca de genotoxicidad por exposición a contaminantes ambientales sobre organismos modelo y/o especies centinela está poco desarrollada a nivel nacional. Concretamente son escasos los estudios que indagan acerca del daño causado al material genético en peces expuestos a sustancias toxicas o aguas contaminadas con dichos agentes, y aun más limitada es la aplicación de técnicas de citogenética de bandas y molecular para la evaluación de los posibles efectos producidos sobre los cromosomas de este grupo de vertebrados. Adicionalmente, la evaluación de micronucleos en eritrocitos de sangre periferica junto con el ensayo cometa, son los biomarcadores mayormente utilizados en estudios de genotoxicidad en peces. Lo anterior debido a la rapidez y sensibilidad de las técnicas para identificar el daño al ADN, así como un alto valor predictivo en la detection de efectos citogenéticos causados por exposición a contaminantes ocupacionales y medioambientales [26, 27]. Tales factores han incentivado el uso de estas metodologías en las investigaciones enfocadas en evaluar toxicidad y daño genetico en peces en Colombia, siendo objeto de estudio especies ícticas de importancia comercial del río Magdalena [28], ademas de otras como Prochilodus magdalenae y Oreochromis sp. [29].
Los estúdios desarrollados hasta la fecha evidencian la importancia de la implementación de un modelo biológico como el pez cebra para la evaluación de alteraciones cromosómicas (en los 25 pares de cromosomas del pez cebra [10]) de tipo numérico y estructural, inducido por la exposición a genotóxicos, como los encontrados con mayor frecuencia en análisis toxicológicos de aguas del Lago de Tota, y que incluyen a los plaguicidas Mancozeb y Malathion.
Las pruebas de genotoxicidad aplicadas en peces tienen como principio el aislamiento celular y la cuantificación del daño causado al material genético [30], aplicaciones en las cuales el análisis citogenético y las técnicas de bandeo, como el bandeo GTG, proporcionan herramientas robustas para la observation de la estructura de los cromosomas en vertebrados superiores, incluidos los humanos [31]. El éxito de los estúdios citogenéticos depende, entre otros, de la correcta diseminación o dispersión de los cromosomas, y del establecimiento del tiempo adecuado en tripsina. No obstante, la inconsistencia de la distribución cromosómica optima y la obtención de un patron de bandas específico para cada cromosoma, siguen siendo importantes limitantes en los estudios citogenéticos.
Considerando lo anterior, la primera parte de este estudio se enfocó en determinar las condiciones de extendido, tempera-tura y humedad óptimas para la obtención de metafases con una adecuada dispersion cromosomica, puesto que de esta caracterización depende en gran medida la separación o dispersión de cromosomas, ya que la velocidad de la evaporation del fijador carnoy incide directamente en la distancia entre cromosomas. Para lo anterior, se analizaron los efectos de la altura de cada de la suspensión celular, el estado del portaobjetos (seco, con agua o con fijador carnoy), el tiempo de secado, la proportion de fijador, la temperatura y la humedad relativa sobre la calidad de los extendidos metafísicos.
La evaluación de éstas variables permitió determinar que la humedad sobre el portaobjetos fue la variable que más afectó la dispersion cromosomica. Se obtuvo una mejora constante en factores de dispersion como un area de metafase más grande, menos superposiciones de cromosomas o frecuencias más bajas de metafases rotas cuando los portaobjetos con los extendidos metafísicos fueron expuestos a una temperatura de 68°C y una humedad relativa de 90 %. Esto se logro realizando el extendido de las metafases sobre portaobjetos de vidrio secos colocados en un baño de agua cubierto a 68°C. Lo anterior se explica por el hecho que, a esta temperatura y humedad la velocidad de evaporation del fijador carnoy es menor, lo que conduce a que los cromosomas se dispersen lentamente a medida que el fijador se evapora, por lo que a mayor velocidad de evaporation del fijador menor dispersion cromosomica y viceversa, evidenciando una relation inversamente proporcional entre estas variables (Figura 1).
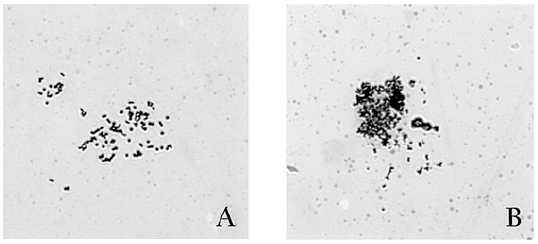
Figura 1: Dispersion cromosomica en pez cebra (Danio rerio). Extendidos metafásicos expuestos diferentes condiciones de temperatura y humedad. A) Metafase con una correcta dispersion cromosomica, sometida a una T° de 68°C y humedad relativa del 90%. B) Metafase con reducida dispersion cromosomica, sometida a T° ambiente y humedad relativa del 78 %.
Con el objetivo de obtener un patron de bandas específico para cada cromosoma, se procedió a la estandarización de diferentes tiempos de incubación con solución de tripsina al 0,25%. A pesar de que se usaron diferentes tiempos (1 segundo, 2 segundos, 3 segundos y 4 segundos) no fue posible evidenciar un patrón de bandas claro, siendo la principal limitante el tamaño de los cromosomas (Figura 2).

Figura 2: Cromosomas pez cebra (Danio rerio) obtenidos mediante la técnica Bandeo GTG. Se observan cromosomas con buena morfología y longitud. Sin embargo, el patrón de bandeo GTG no se evidencia claramente.
Esta limitante ha sido reportada en estudios previos, en donde ha sido indicado que los cromosomas de los peces son más pequeños y presentan un rango más estrecho de valores de GC % en genomas completos [32, 33]. De hecho, investigaciones recientes [34] indican que específicamente para el pez cebra, la aplicación de citogenética de bandas ha demostrado varias dificultades relacionadas con la correcta clasificación de los cromosomas basados en su tamaño, patron de bandas y morfología, por lo que los esfuerzos realizados con el objetivo de estandarizar metodologías de bandas cromosómicas, especialmente bandeo G, han sido poco exitosos al no producir patrones de bandas utilizables en estos organismos [31].
A pesar que se obtuvieron cromosomas con buena morfología y tamaño, no fue posible evidenciar un patron claro y óptimo de bandeo. Sin embargo, se destaca el hecho de que el uso de la citogenética de bandas en este modelo, así como el protocolo estandarizado propuesto para la obtención de metafases con una adecuada dispersión cromosómica (Tabla Suplementaria 1), puede ser aprovechado para el análisis de alteraciones de tipo numérico y por tanto, para la evaluación de inestabilidad cromosómica numérica por exposición a agentes genotóxicos.
Adicionalmente, es importante resaltar que las metafases y núcleos interfásicos obtenidos se constituyen como muestras importantes para la evaluación de alteraciones cromosómicas numéricas y para el estúdio de inestabilidad cromosomica mediante FISH.
Las investigaciones realizadas hasta la fecha demuestran las dificultades que representa la estandarización de técnicas de citogenética de bandas no solamente sobre el pez cebra, sino sobre los peces en general, por lo que la estandarización de técnicas de citogenética molecular (FISH) se constituye como necesaria y prometedora en la evaluación de daño cromosómico por exposición a agentes genotóxicos.
En FISH, sondas locus específicas, Centroamérica y/o NOR son usadas para identificar la presencia tanto de alteraciones de tipo numérico como estructural, por lo que su uso podría permitir, no solo indagar acerca de los efectos deletéreos sobre el número de cromosomas del pez cebra y por ende la evaluación de inestabilidad cromosómica, sino incrementar las posibilidades de utilizar este modelo en estudios de investigación biomédica.
De hecho, los resultados obtenidos en este estudio permiten postular el uso de sondas NOR en la evaluación de inestabilidad cromosómica numérica en pez cebra. Lo anterior teniendo en cuenta que, las variaciones en el número de cromosomas pueden ser facilmente evidenciadas por el conteo del numero de señales fluorescentes en extendidos tanto metafásicos como de nucleos interfásicos. Específicamente, el uso de la sonda NOR (LPE NOR. Fluorocromo rojo. Cytocell) sobre núcleos interfásicos de larvas del pez cebra, permitió identificar variaciones en el número de las señales emitidas por núcleo analizado, las que oscilaron entre 6 y 10 señales (Figura 3). Nuestras observaciones son concordantes con estudios previos en pez cebra [13], en donde fueron observadas entre siete a ocho señales de ADNr por núcleo interfásico.
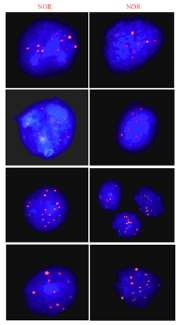
Figura 3: Imagenes representativas de FISH en larvas de pez cebra (Danio rerio). FISH se realizo sobre núcleos interfásicos usando sondas NOR (Regiones Organizadoras Nucleolares), específica para los genes de ARNr marcada con espectro rojo.
La implementation de protocolos de citogenética molecular como FISH, se encuentra ampliamente extendida en la detección de alteraciones cromosomicas tanto numéricas como estructurales, las cuales se pueden analizar mediante la localización, disposition y recuento de secuencias individuales de interés, y visualizar a traves de fluoroforos unidos a la sonda de hibridación en células en metafase e interfase por igual [35]. Sin embargo, a pesar de los enormes y rápidos avances en esta técnica molecular, la introducción de FISH para el estudio de alteraciones cromosomicas causadas por sustancias químicas aun no está generalizada [36], por lo que su aplicación en estúdios de genotoxicidad usando como modelo biológico el pez cebra, es prometedora. Considerando lo anterior, como resultado de este estudio se propone un protocolo para la realization de ensayos FISH usando sondas NOR sobre preparados metafásicos y de núcleos interfásicos obtenidos del pez cebra (Tabla Suplementaria 2). Se considera que la implementation de este protocolo se constituye como una alternativa viable en la investigation de genotoxicidad sobre este organismo.
En lo que respecta al tipo de sondas específicas usadas con mayor frecuencia en pez cebra, es escasa la information disponible, por lo que los investigadores han empleado sondas de ADN para regiones cromosómicas específicas de este bio-modelo y sondas NOR humanas.
El uso de sondas para regiones cromosómicas específicas se ha convertido en una herramienta útil para estúdios de identification y confirmation de translocaciones inter cromosomicas y delaciones terminales, ya que facilitan un análisis rápido y preciso de la inestabilidad genomica y la susceptibilidad al cáncer en ensayos de pez cebra haploide [37]. En lo que respecta al uso de sondas NOR humanas, ha sido indicado que dichas sondas son ideales para estúdios citogenéticos porque proporcionan señales de hibridación aptas para el reconocimiento cromosomico directo en preparaciones de cromosomas en metafase, y una enumeración cromosómica precisa en núcleos interfásicos [38]. Teniendo en cuenta que el pez cebra y el ser humano comparten gran parte del genoma (aproximadamente el 70%) [19], la implementation de las sondas NOR se constituye como una buena alternativa en estúdios de genotoxicidad sobre pez cebra [13].
4. Conclusiones
El uso del pez cebra como modelo biológico, es sin duda una herramienta clave para lograr dilucidar el efecto deletéreo sobre los cromosomas por exposición a agentes genotóxicos, incluyendo a los plaguicidas.
Nuestros hallazgos nos permiten indicar qué si bien la citogenética de bandas se constituye como una excelente herramienta en la evaluación de alteraciones cromosómicas numéricas y estructurales en seres humanos, su uso es limitado en el pez cebra debido al corto tamaño de los cromosomas, siendo este un impedimento para la correcta obtención de un patron de bandas adecuado. Sin embargo, se resalta que si bien, no fue posible obtener un patron de bandeo optimo en los cromosomas del pez cebra, el uso de la citogenética de bandas en este modelo puede ser aprovechado para el análisis de alteraciones de tipo numérico y por ende para la evaluación de inestabilidad cromosómica numérica por exposición a agentes genotóxicos. Considerando lo anterior, se recomienda el uso de FISH con sondas NOR, como una técnica optima y confiable en la evaluación de daño genotóxico por exposición a plaguicidas, usando como modelo biológico el pez cebra.
Los resultados de este estudio representan un punto de partida para desarrollar estrategias y estúdios dirigidos a salvaguardar las fuentes hídricas del país y así mismo, la salud de las poblaciones que habitan en las zonas aledañas.

















