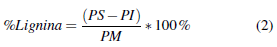1. Introducción
Los residuos agroindustriales son recursos renovables, un tipo de biomasa, disponible en grandes cantidades y rica en polisacáridos. Es una fuente de almacenamiento potencial de azucares fermentables, aprovechable como materia prima alternativa en procesos biotecnológicos [1, 2, 3]. De acuerdo a su composición, la biomasa puede ser: Lignocelulósica, rica en azúcar, almidón, aceite y proteína. Según su origen, puede clasificarse en: agrícola, forestal, acuática, subproductos, residuos y desechos. En este último punto se encuentran los subproductos agrícolas o residuos de cultivos, que se generan en la producción, cosecha y procesamiento de productos agrícolas, tales como paja y cáscaras de cereales o frutas, además de los subproductos animales de la ganadería [4].
Las características fisicoquímicas de estos, indican su potencial de uso para la generación n de energía mediante la combustión de la biomasa, producción de vectores energéticos (biogas, bioetanol, biodiesel, biohidrógeno) o en la obtención de moléculas plataformas para la manufactura de biomateriales, bioquímicos, entre otros [5]. A nivel mundial, se generan anualmente millones de toneladas de residuos agrícolas, cuya disposición y manejo es una preocupación para los entes involucrados. Una estrategia rentable, ecológica y sostenible para la gestión de estos residuos, es su conversión en productos utiles [6].
Ecuador es un país con una economía agrícola, cuyos residuos generados por dicha actividad, pueden ser revalorizados a traves de la obtención de nuevos productos. Entre los principales cultivos se registran 38 rubros cultivables, donde se encuentran el plátano y la yuca [7]. El plátano (Musa paradisiaca), tiene alto contenido de almidón y material lignocelulosico. La yuca por su parte es uno de los cultivos más importantes para la seguridad alimentaria del país, con algunas aplicaciones en la industria textil, alimentación animal y fabricación n de papel. En ambos casos, se genera durante la cosecha biomasa residual (hojas, tallo, etc.) considerada como desecho [8, 9, 10].
La transformación de estos residuos en productos, incluyen procesos de tratamiento previo de tipo físico, químico, biológico o una combinación de estos. La hidrólisis es uno de los pretratamientos que se utiliza para el fraccionamiento de los componentes mayoritarios de la biomasa (celulosa, hemicelulosa y lignina); con el fin de convertir las cadenas poliméricas en azucares menos complejas (mono y disacaridos). Dependiendo del agente hidrolizante que se utilice en el pretratamiento, se puede hablar de una hidrólisis acida, alcalina, con líquido iónico, micro-ondas, ultrasonido, explosión de vapor, agua caliente líquida, a base de amoníaco, biológico y electrohidrolisis [11].
Los resultados de investigaciones previas, muestran el potencial de la hidrólisis para remover la lignina y descomponer la celulosa y hemicelulosa, en azucares fermentables. Diferentes pretratamientos químicos se aplicaron en hojas y tallos de yuca, para evaluar su incidencia en la producción de azucares reductores totales durante una posterior etapa de hidrólisis enzimática [12]. De manera similar, se han evaluado tres pretratamientos (mecánico, mecánico-químico y mecánico-térmico) en residuos del plátano, para la obtención de jarabe glucosado mendiante hidrólisis enzimática. Independientemente del tipo de pretratamiento que se aplique, se reportan incrementos en los concentración de azucares alcanzando hasta 5,91 g/L y 3,7 g/L de glucosa para los residuos del banano y yuca, respectivamente [12, 13].
El interés actual existente en el uso de biomasas para brindar una solución ambiental, a la vez que se obtienen productos con valor agregado, motivo la realización de esta investigation. Es por ello, que su propósito fue el de evaluar métodos de pretratamiento químico en residuos de cáscara de yuca y plátano para la extracción de azucares fermentables, las cuales son moléculas plataforma para los procesos de biorrefinación. Este trabajo servira para futuras investigaciones, donde se pretenda utilizar la biomasa en esquemas de biorrefinación, para su posterior revalorization.
2. Materiales y métodos
La secuencia experimental que se llevó a cabo en esta investigación, se expone en la figura 1 y se describe a continuation.
2.1. Selección y preparación de los residuos
Las cascaras de plátano (CP) y yuca (CY), se obtuvieron de los residuos generados en mercados locales, restaurantes y productores de snacks localizados en el canton Portoviejo, provincia de Manabí, Ecuador. Estas fueron sometidas a un lavado, secado en estufa marca Memmer durante 48 horas (BP a 50 °C, CP a 60 °C), luego fueron molidas en un molino marca FLAM-MC001 y finalmente tamizadas en un tamiz N° 20.
2.2. Caracterización de los residuos
Los residuos se caracterizaron en cuanto a humedad, cenizas, celulosa, hemicelulosa, lignina, amilosa y amilopectina. La humedad se determinó por gravimetría, según lo descrito en la norma ASTM D4442-20 [14]. El contenido de cenizas se calculó siguiendo la metodología establecida en la norma TAPPIT-211 [15]. La hemicelulosa se cuantifico de acuerdo a lo señalado en la norma TAPPI T-212 [16].
El contenido de celulosa y lignina Klason se determino siguiendo lo descrito por Domínguez-Domínguez et al. [17].
Para la celulosa se tomó 1g de muestra, se agregaron 15 mL de CH 3 COOH al 80 % (w/w) y 1,5 mL de HNO3, en agitación durante 20 minutos. Se filtro y se lavo con C 2 H 5 OH, se seco en una estufa marca Memmer (130° C, 1h) y se peso. Se introdujo en una mufla marca Termolyne (545 °C, 2h), se enfrió y se pesó. Los resultados se obtuvieron usando equ1.
Donde PS, PI y PM son el peso seco, peso incinerado y peso de la muestra respectivamente.
Para determinar la cantidad de lignina se tomo 1 g de muestra, se agregaron 70 mL de solución al 1,25% (w/w) de H 2 SO 4 con agitación constante durante 2 horas, se filtro y lavo con agua destilada. Se añadieron 30 mL de H 2 SO 4 al 72 % (w/w) con agitación constante durante 4 horas. Se filtro y lavo con agua destilada, se seco a 130 °C y se peso. Finalmente se incinero a 545 °C durante 2 horas. El calculo se realizó utilizando equ 2
El contenido de amilosa se calculó por espectrofotometría con una longitud de onda de 620 nm, según lo expresando en la Norma ISO 6647-1 [18]. La cantidad de amilopectina, se obtuvo por diferencia porcentual respecto a la amilosa.
2.3. Tratamiento de los residuos
Cada uno de los residuos se sometió a una hidrólisis química, bajo un diseño factorial 23 (tabla 1). Para la hidrólisis acida (Ac) se utilizaron soluciones de H2SO4 y en el caso de la hidrólisis alcalina (Al) se trabajó con soluciones de NaOH. Se tomaron 2 g de muestra (CP, CY), a la cual se incorporaron 30 mL del reactivo según el tipo de hidrolisis y se dejó durante el tiempo de reacción establecido, a una temperatura de 75 °C. Posteriormente, se enfrió y se separó por medio de papel filtro CHM de 125 mm. Una vez que se separaron los sólidos del líquido, se cuantificaron los azucares reductores totales (ART) presentes en la disolución [19].
2.4. Determinación de ART
La cantidad de azúcares reductores obtenida luego de la hidrólisis, se determinó a través del método de aícido 3,5-dinitrosalicílico (DNS), usando glucosa como patrón [20]. Para la preparación del reactivo, se pesaron 5 g de DNS, 150 g de tartrato de Na-K y 8 g de NaOH. El NaOH se disolvio en 200 mL de agua destilada y se añadió en agitación el tartrato de Na-K. Se adicionó agua destilada hasta completar 400 mL y luego se incorporó el ácido 3,5 dinitrosalicílico. Se dejo en agitación durante 8 horas, se enraso a 500 mL y se filtro. La curva estandar de glucosa se construyo tomando soluciones de 0.4 - 1.6 g/L, a las cuales se les aplicó el método DNS. Luego se llevaron al espectrofotometro y se leyó la absorbancia respectiva, a una longitud de onda 540 nm.
Para medir la concentración de ART, se tomo 0,5 mL de la muestra del residuo hidrolizado y se adicionó 0,5 mL del reactivo DNS. Luego se agito y se llevo a ebullición durante 5 minutos. Se enfrio a temperatura ambiente y se anadio 5 mL de agua destilada, manteniendo la agitation. Se leyó la absorbancia en el espectrofotómetro con una longitud de onda de 540 nm.
2.5. Análisis estadístico
Cada una de las experimentaciones llevadas a cabo en la investigación se realizaron por triplicado. Los resultados de la caracterización de los residuos fueron sometidos a un análisis estadístico descriptivo (media, desviación estandar). Asimismo se realizó un ANOVA, para determinar la incidencia que tienen los factores evaluados en la variable respuesta. Tanto el análisis estadístico de los datos como las representaciones gráficas, se realizaron usando el software Rstudio versión 4.1.0.
3. Resultados y discusión
3.1. Caracterización de residuos
El valor promedio y la desviación estándar para cada uno de los parámetros evaluados en la caracterización de los residuos (CP y CY), se exponen en la tabla 2.
Tabla 2: Caracterización de los residuos.
| Variable | CP (X̅ ±σ) | CY (X ±σ) |
| Humedad, % | 13,70 ± 0,56 | 15,67 ± 0,45 |
| Cenizas, % | 9,00 ± 1,41 | 8,67 ± 1,53 |
| Amilosa, % | 17,07 ± 0,25 | 20,60 ± 0,44 |
| Amilopectina, % | 82,93 ± 0,25 | 79,40 ± 0,44 |
| Celulosa, % | 29,00 ± 3,61 | 28,67 ± 1,53 |
| Hemicelulosa, % | 26,67 ± 1,53 | 6,67 ± 2,08 |
| Lignina, % | 19,17 ± 0,68 | 19,75 ± 0,64 |
En trabajos con cascara de plátano, se reporto una humedad de 26,11 % y cenizas de 12,68 %, superior a la encontrado en esta investigación [21, 22]. En estudios con la cascara de yuca, registraron un contenido de humedad entre 11-12% y 0,20-0,40% de cenizas [23]. Las diferencias entre los valores obtenidos, podrían atribuirse a las características edafoclimáticas y al tipo del manejo de los cultivos [24], así como a las variaciones meteorológicas y climáticas estacionales, del lugar de procedencia[25].
Para el contenido de amilosa se registran valores de 22,6529,31 % para la amilosa de la cascara de plátano [26]. Por su parte, para la cascara de yuca se registra entre 16,39-21,61 % de amilosa y 78,39-83,61 % de amilopectina [27, 28]. El contenido de amilosa afecta las propiedades funcionales del almidón, y una modificación de este puede conducir a características deseadas para determinados productos como mayor cristalinidad, solubilidad, viscosidad, poder de hinchamiento, formación de geles fuertes y resistentes al cizallamiento [27, 29].
Respecto al contenido de celulosa, hemicelulosa y liginina, se reportan valores de 19,33-20,90%, 7,92-11,43% y 18,11-21,12% para la cascara de plátano [30, 31] y de 11,8043,63 %, 10,38-38,80 % y 7,20-7,65 % para la cascara de yuca respectivamente [32, 33, 34]. La biomasa lignocelulosica está compuesta principalmente de dos polisacáridos (celulosa y hemicelulosa) y lignina. La celulosa y la hemicelulosa se convierten en azucares fermentables a partir de la transformación de la hexosa (glucosa, galactosa, etc.) y la pentosa (xilosa, arabinosa, etc.) [35]. Por ello, se espera que mientras mayor sea el contenido de celulosa y hemicelulosa en la biomasa residual, mayor sea la cantidad de azucares fermentables que se obtengan en la hidrolisis.
3.2. Cuantificación de los ART
Para cada tratamiento aplicado a los residuos, se determinó la concentración de los azucares reductores. La curva patron de glucosa que se utilizó, se presenta en la figura 1. Así mismo, los resultados de ART para los hidrolizados de los residuos se presentan a continuación en las figuras 3 y 4.
La mayor concentración de ART en la hidrolisis acida fue de 1,49 + 0,06 g/L para la cascara de plátano y de 1,95 + 0,08 g/L para la cáscara de yuca, la cual se obtuvo al utilizar una concentración de 2 % de H 2 SO 4 . En lo referente al tratamiento alcalino, la maxima cuantificación de ART se obtuvo al emplear 1 % de NaOH, alcanzando concentraciones de 2,35 + 0,06 g/L y 1,80 + 0,07 g/L, para la cascara de plátano y cáscara de yuca. En ambos casos, los mejores resultados se registraron con tiempo de reacción de 60 minutos.
En una investigación similar, se obtuvo una concentración de azucares reductores de 1.93 g/L y 1.98 g/L para el almidón de cascara de banano y cascara de yuca respectivamente, al realizar una hidrolisis enzimática [28]. Una concentración de 3.09 g/L, mayor a la reportada en está investigation, se obtuvo para la cáscara de yuca mediante la combinación de hidrolisis térmica e hidrólisis enzimática [36]. Del mismo modo, se registró una concentración de 5.70 g/L de azucares reductores en cascara de plátano, al emplear un método de hidrolisis enzimática con la enzima celulosa y un tiempo de reacción de 4 horas [30].
La menor producción de ART, puede asociarse con la menor deslignificación de la biomasa. Estudios previos demuestran, que una dosis química más alta del reactivo usado en la hidrolisis, aumenta los contenidos de ART. Una situación similar sucede con el tiempo de reacción, puesto que al extender el tiempo de residencia de 30 a 60 minutos se noto un incremento considerable en la concentración de azucares reductores [35].
Altas concentraciones de ART favorecen el proceso de fermentación alcohólica para la producción de vino blanco, así como la fermentación lactica para la obtención de acido láctico [37, 38]. El azucar de segunda generación es el componente principal de las biorrefinerías que producen de manera sostenible [39]. Su producción es el paso previo a la fermentation, con la cual es posible obtener una variedad de bioproductos y con ello revalorizar la biomasa.
3.3. Análisis estadístico
Se áplico un ANOVA, para determinar si existían diferencias significativas entre las medias de cada una de las variables consideradas en el diseño de experimentos planteado: T: tipo de hidrolisis, C: concentración (C), tiempo (t) (tablas 3 y 4).
Tabla 3: Resultados del ANOVA para CP.
| Factor | Suma cuadrado | Valor F | p-valor |
|---|---|---|---|
| T | 2,048 | 43,212 | 2,1E-6 |
| C | 0,019 | 0,395 | 0,537 |
| t | 0,234 | 4,939 | 0,038 |
| T:C | 0,182 | 20,575 | 3,37E-4 |
| T:t | 0,271 | 30,629 | 4,53E-5 |
| C:t | 3E-4 | 0,038 | 0,848 |
| T:C:t | 0,353 | 39,887 | 1,031E-5 |
Tabla 4: Resultados del ANOVA para CY.
| Factor | Suma cuadrado | Valor F | p-valor |
|---|---|---|---|
| T | 0,009 | 0,089 | 0,768 |
| C | 0,020 | 0,192 | 0,666 |
| t | 0,007 | 0,068 | 0,797 |
| T:C | 1,691 | 503,435 | 4,68E-13 |
| T:t | 0,105 | 31,366 | 2,85E-5 |
| C:t | 0,001 | 0,279 | 0,849 |
| T:C:t | 0,267 | 79,416 | 2,111E-8 |
Para los residuos de CP, todos los factores evaluados (excepto la concentración del reactivo), además de las respectivas interacciones, reportaron un p-valor ¡0,05 indicando su incidencia sobre la producción de los ART. En cuanto a CY, solo la interacción T:C, T:t y T:C:t, resulto ser significativa sobre la obtención de azucares. De acuerdo con García y Peralta [40], un mayor tiempo de reacción facilita la liberación de azucares reductores. Del mismo modo, un tratamiento más intenso sobre el residuo provoca un mayor rompimiento de la estructura lignocelulosica, lo que a su vez favorece la liberación de una mayor cantidad de ART [40].
4. Conclusiones
La hidrólisis química es un procedimiento que se aplica en la deslignificación de la biomasa. Este es un pretratamiento que se emplea en procesos de biorrefinación, donde se extraen azucares para posteriores procesos de fermentation. Dentro de las condiciones establecidas en esta investigación, se determinó que es posible alcanzar una producción cercana a 2 g/L de ART para cada tipo de residuo. La mayor concentración de azúcares reductores depende del tipo de biomasa utilizada, puesto que los mejores resultados para la cascara de plátano se obtuvieron con la hidrolisis alcalina, mientras que para la cascara de yuca se registraron al trabajar con la hidrolisis acida. Con ambos pretratamientos independientemente del residuo empleado, se alcanzó una mayor producción a los 60 minutos, lo cual indica que la concentración de ART aumenta al incrementar el tiempo de reacción. Aunque se demostró la utilidad de hidrólisis química para obtener azucares fermentables, según lo consultado bibliográficamente, es posible que dichos resultados se puedan mejorar al emplear hidrolisis enzimática, térmica o una combinación de estos métodos.