1. Introducción
Las especies del género Klebsiella (K.) pertenecen a la familia Enterobacteriaceae, bacterias Gram-negativas, no móviles, generalmente capsuladas, anaerobias facultativas, ubicuas y se encuentran distribuidas en el ambiente como el agua y el suelo [1]. El género comprende ocho especies pero se destaca K. pneumoniae por ser responsable de la mayoría de las infecciones animales, humanas y es considerado multirresistente a antibióticos [2], se encuentra de forma nativa en los tractos respiratorio y gastrointestinal de humanos, animales domésticos y salvajes con posibles vínculos zoonóticos [3], además, es catalogado como contaminante común en ambientes clínicos, alimentos crudos y listos para consumir como carne, verduras frescas, leche, pescado y alimentos callejeros [4].
Aunque K. pneumoniae está comúnmente asociada con infecciones nosocomiales, se han reportado algunos alimentos como vector de transmisión [5]. La infección por esta bacteria patógena causa enfermedades como meningitis, bronquitis, bacteriemia, neumonía e infecciones urinarias [2, 4, 5], que afectan principalmente a recién nacidos, personas mayores y pacientes con sistemas inmunológicos débiles [3].
Por otro lado, K. pneumoniae forma parte del microbioma causante de mastitis clínica y subclínica en ganado lechero [6]. Se transmite de animales infectados a sanas, siendo considerada la segunda causa más común de mastitis bovina y la más perjudicial en la disminución de la producción y calidad de la leche, así como en términos económicos [7]. Se han reportado cepas de K. pneumoniae en diversas matrices alimentarias y aislamientos de animales en producción resistente a antibióticos; la OMS ha clasificado a K. pneumoniae como patógenos prioritarios críticos en su lista de bacterias resistentes a los antibióticos que necesitan nuevos tratamientos [8, 9].
Los microrganismos probióticos alteran principalmente la homeostasis intestinal debido a la secreción de metabolitos con propiedades antimicrobianas que actúan como estimulantes inmunológicos, mejoran la resistencia y estimulan el proceso de digestión, lo que conduce al bienestar general [10, 11]. Además, se consideran una alternativa preventiva para al uso de antibióticos en salud animal y humana [12,13]. Para lograr los beneficios en el hospedero las bacterias probióticas deben ser viables y estar disponibles en altas concentraciones (típicamente 106- 107UFC/g) [14].
Algunos autores mencionan que la incorporación en diversas matrices alimentarias es ideal para suministrar probióticos a los animales en comparación con la aplicación directa a los sistemas de cría [15]. Se ha demostrado en diversos estudios que algunas especies del género Lactobacillus (L), modulan las poblaciones patógenas: L. casei, controla la poblaciones de coliformes en pollos [15]; L. reuteri, inhibe el crecimiento de Helicobacter pylori [16]; L. plantarum, contrarresta Escheri-chia coli [17]; y L. lactis, presenta potencial para disminuir poblaciones de bacterianas patógenas [11].
Los Lactobacillus tiene una amplia aplicación gracias a la producción de ácido láctico, ácidos orgánicos, PS) y, metabolitos secundarios con propiedades antibacterianas, antioxidantes, reológicas y conservación de alimentos [18]. Además, se pueden encontrar en alimentos fermentados de forma natural o añadidos como yogurt, encurtidos, kéfir, kombucha, miso, tempeh, pan, kimchi, masa madre, quesos madurados, leche, productos cárnicos, chocolates, cereales, frutas y verduras [19-22].
Las células probióticas libres son menos eficientes y disminuye la biodisponibilidad bajo condiciones adversas (humedad, temperatura, presión y paso por el sistema gastrointestinal superior); sin embargo, la micorencapsulación es una técnica que permite crear un ambiente que mejorar la supervivencia frente a medios inadecuados y aumentar el efecto de su actividad [23,24]. Se han utilizado varias técnicas de encapsulación para la microencapsulación de probióticos, incluyendo extrusión, liofilización, secado por aspersión, emulsificación, coacervación, electrohilado y electropulverización [25], se usa ampliamente el secado por aspersión debido a su eficiencia, bajo costo operativo, es adecuada para aplicaciones industriales, es altamente reproducible, prolonga el tiempo de conservación, facilita iberación gradual y controlada de bioactivos [26].
Los métodos para la evaluación de digestión in-vitro son adecuados para simular la digestión de alimentos, su implemen-tación permite simular de manera controlada y reproducible las condiciones del ambiente gastrointestinal, que facilita el estudio del comportamiento y eficacia de los probióticos [27]. El éxito de la implementación de probióticos en la alimentación depende de las evaluaciones in-vitro que permiten predecir respuestas in-vivo [28].
El objetivo de la investigación es evaluar el potencial inhibitorio de Lactobacillus lactis microencapsulado mediante secado por aspersión sobre Klebsiella pneumoniae bajo condiciones gastrointestinales in-vitro.
2. Metodología
En la investigación se usaron las cepas comerciales L. lactis ATCC 19435 y K. pneumoniae que se compraron a los distribuidores MDM Científica S.A, Medellín, Colombia.
Se realizaron estudios preliminares a la cepa láctica para caracterizar sus propiedades generales; para ello se evaluó crecimiento a dos temperaturas diferentes (34°C y 42°C) (anaerobiosis) [29], ensayos de producción de gas, y actividad de catalasa [29].
Se realizó cinética de fermentación de L. lactis por 24 horas a 37°C (anaerobiosis) y se tomaron muestras cada 3 horas para determinar las variables cinéticas UFC/mL, consumo de azúcar (mg/L) [30], producción de proteínas (mg/L) [31] , pH y producción de ácido láctico [32].
La microencapsulación de L. lactis mediante spray-drying se hizo bajo los siguientes parámetros de equipo: temperatura de entrada 155 °C, temperatura de salida 75 °C en un ciclo de 2 horas. Se preparó 500 mL de suspensión en combinación con inóculo láctico + maltodextrina (5 % p/p = 25g) + inulina (5 % p/p = 25 g). El producto microencapsulado se acopió en bolsas metalizadas zipper a temperatura ambiente (18 °C) durante 50 días.
Para evaluar la estabilidad del microencapsulado después del proceso de secado por aspersión y almacen por 50 dias, se evaluaron los parámetros fisicoquímicos viabilidad ( %), humedad ( %) Aw, humedad (%), solubilidad ( %), humectabilidad (minutos), eficiencia de microencapsulación (%), morfología y tamaño de cápsula [33].
El microencapsulado se sometió a pruebas gastrointestinales in-vitro, de acuerdo a los métodos propuestos por Brodkorb et al [27] y Guo et al [25]. Se incorporó 1 g de microencapsulado en 100 mL de agua destilada. Se introdujeron 25 mL de una solución tampón fosfato (0.1 M; pH 6) y 10 mL de HCl 0.2 M, seguido de una agitación durante 5 minutos (Fase I). El pH se ajustó a 2 mediante la adición de HCl 1 M, y se mezcló adecuadamente con la incorporación de 1 mL de una solución de pepsina en HCl 0,2 M (con una concentración de 25 mg/ml), el recipiente se selló y se incubó a 40°C durante 120 minutos (Fase II). Posteriormente, se añadieron 10 mL de una solución tamponada de fosfato (0,2 M; pH 6,8) y 5 mL de una solución de NaOH 0,6 M para mantener un pH constante de 6,8 (usando NaOH 1 M). Se agregó 1 mL de una solución de pancreatina de 100 mg/ml (porcina, grado VI, Sigma n.P-1750), y los recipientes se sellaron para ser incubados a 37 °C durante 300 minutos (Fase III). Se tomó 1 mL de muestra de cada fase para el recuento en placa.
Finalmente, se evaluó la capacidad inhibitoria de la cepa láctica frente a la cepa patógena, para ello se utilizaron 4 métodos: I. discos de agar impregnados, II. PADS impregnados, III. Capa sencilla, IV. difusión en doble capa con las concentraciones de 80 μL, 90 μL y 100 μL, respectivamente, el criterio de selección como inhibición positiva fue halo mayor o igual a 2 mm, según lo establecido por Jurado-Gámez et al [34]. Un halo de inhibición son zonas sin crecimiento bacteriano que se forman alrededor de colonias y se miden en mm, lo cual es un indicio del control biológico de un microorganismo [35].
Para la evaluación de las variables fisicoquímicas de micro-encapsulación, simulación gástrica e inhibición se utilizó estadística descriptiva con un nivel de significancia del 5 %. Para la cinética de fermentación se tomaron cinco muestras por cada parámetro en cada tiempo, y se utilizó un diseño de medidas repetidas en el tiempo con un tratamiento medio MRS como factores fijos y el tiempo como factor aleatorio a un nivel de significancia del 5 %. Los resultados se organizaron en una hoja Excel® y los análisis se realizaron en el software estadístico R (4.0.0, 2018).
3. Resultados y discusión
La evaluación de crecimiento bacteriano a temperaturas diferentes mostró densidades de UFC iguales a 3,2 x 1010 UFC/mL para 34 °C y 3,1 x 108 UFC/mL para 42 °C, y resultados negativos para la producción de gas y actividad de catalasa. Las pruebas mencionadas junto a la tinción de Gram, se usan para clasificar BAL por características fisiológicas y bioquímicas [36]. Las variaciones de las condiciones de temperatura para crecimiento de Lactobacillus tienen efecto directo sobre la población bacteriana, la producción de ácidos grasos de cadena corta (a. acético, a. propiónico y a. isovalérico) y producción de gas; sin embargo, las BAL responden a cambios de temperatura como forma de adaptación a las condiciones ambientales [37,38]. Si bien el crecimiento de BAL se da entre el rango 30 °C a 42°C, el máximo crecimiento se presenta a 37 °C, temperatura a la cual la producción de ácido láctico predomina. Estudios realizados por Hadinia et al [37] y Sánchez [39] presentan datos similares al presente estudio, donde el mayor crecimiento microbiano se expresa en torno a los 37 °C.
De acuerdo con lo expuesto por Zhang et al [40], factores como la temperatura, concentración de glucosa, cultivo iniciador y el tiempo de fermentación afectan significativamente la producción de Lactobacillus; además, indican que la fermentación a 37 °C potencializa la producción de EPS. Durante el proceso fermentativo se liberan EPS, polímeros ramificados de azucares o derivados con valor comercial debido a sus propiedades como texturizantes alimentarios y sus atributos promotores de salud [41], los EPS se caracterizan por funcionar como una capsula protectora que envuelve las células como mecanismo de protección contra fagocitosis, desecación, estrés osmótico y para fines terapéuticos por sus propiedades antimicrobianas, inumomuduladoras, antiinflamatorias, antioxidantes, antivirales y reducción de colesterol [42].
Los resultados correspondientes a la prueba de catalasa indican lo mencionado por Freire et al [36], quienes manifiestan que las BAL son las únicas carentes de catalasa (enzima que degrada el peróxido de hidrógeno H 2 O 2) que pueden crecer en condiciones aeróbicas, es decir, no hay producción de burbujeo ni efervescencia cuando se exponen la BAL al peróxido de hidrógeno. Sánchez et al [39], obtuvieron resultados negativos para catalasa en 17 cepas de Lactobacillus aisladas, al igual que Alizadeh et al [43], quienes reportan catalasa negativa para L. plantarum. Las bacterias del género LLactobacillus generalmente no producen gas durante la fermentación de carbohidratos, por tanto, no se observa la formación de burbujas o cambios en el medio, tal como lo mencionan Minervini y Calasso [44].
Hu et al [45] suministraron L. plantarum a cerdos logrando disminuir la emisión de NH 3 fecal; además, la acción de probióticos en dietas reduce los niveles de amoniaco y de materia orgánica volátil en cerdos en fase de crecimiento [45]. Por otra parte, en la elaboración de queso estilo cheddar la producción de gases indeseables se presenta a temperaturas de 12 °C por la acción de L. wasatchensis [38]. La producción de gas se puede presentar a diferentes temperaturas entre cepas de BAL, por lo que es recomendable controlar y evaluar las condiciones de fermentación.
Los datos obtenidos de la cinética de fermentación indican que la fase exponencial de crecimiento para L. lactis ocurre a las 12 horas, con los siguientes valores: 23.30 Ln UFC/mL, consumo de azúcar de 6.32 mg/L, producción de proteína de 5.21 mg/L y un 1.34% de ácido láctico (Figura 1). Al igual que la cinética de fermentación realizada por Alvarez et al [46] para evaluar L. casei en suero de leche desproteinizado, el efecto de la acumulación de ácido láctico en el medio de cultivo inhibe el crecimiento de la biomasa y decrece en el tiempo después de alcanzar un punto máximo de UFC (Figura 1).
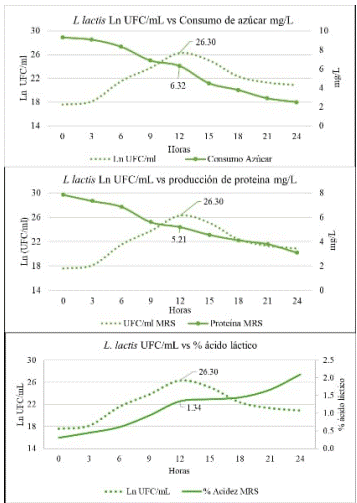
Figura 1: Parámetros de cinética de fermentación para la cepa L. Lactis: Ln UFC \ mL, consumo de azúcar, consumo de proteína y % ácido láctico
El tiempo de latencia para L. lactis fue de 3 horas, similar a los resultados encontrados por Goranov et al [47] para las cepas L. casei spp. rhamnosus y L casei spp. casei, periodo en el cual las células comienzan a sintetizar estructuras celulares y enzimas necesarias de adaptación al medio de cultivo y aprovechar las fuentes de nitrógeno y carbono para el crecimiento y desarrollo celular; además, los autores reportan una fase exponencial final a las 24 horas con crecimiento alrededor de los 1013 UFC/mL para las dos cepas estudiadas.
El consumo de azúcar como fuente de carbono en BAL crece a medida que incrementa la producción de UFC, donde se han reportado valores de consumo de azúcar en fase exponencial de 1.79 mg/L para L. gasseri [48] y 6.98 mg/L para L. plantarum [17]. Las bacterias absorben y utilizan todo tipo de fuentes de carbono como materia prima para la síntesis biomasa y como principal fuente de energía para el metabolismo bacteriano [49]. De acuerdo a lo mencionado por Bolívar-Jacobo et al [50], una mayor disponibilidad de proteínas y consumo de las mismas, principalmente proteínas séricas, favorecen el crecimiento de BAL. Romero- Benavides et al [48], reportan valores para consumo de proteína en L. gasseri de 0.66 mg/L y Jurado-Gámez et al [51] un consumo de 1.61 mg/mL para L. plantarum.
De acuerdo con Wu et al [52], las BAL producen grandes cantidades de ácidos orgánicos como el ácido láctico y el ácido acético en el proceso de metabolismo, lo que reduce el pH del del medio de fermentación y mejora la ventaja de supervivencia frente a otras bacterias, tal como se presenta en la figura 1. Además, mencionan que el pH es un parámetro importante para la actividad enzimática, por lo que todo el metabolismo del microorganismo se ve afectado entorno a las diversas variables del proceso fermentativo, y sugieren que el control de pH puede mejorar la producción de ácido Gamma-aminobutírico (GABA).
Los parámetros fisicoquímicos del microencapsulado, evaluados bajo los criterios establecidos para el proceso de spray-drying, arrojaron los siguientes resultados: viabilidad del 2,8x1010 UFC/mL, humedad del 4.3%, Aw de 0.42, solubilidad del 82 %, humectabilidad en 1:56 minutos y una eficiencia de microencapsulación del 89 %. La caracterización mediante microscopía electrónica de barrido (SEM) reveló que las partículas que componen el polvo microencapsulado son esféricas-regulares, con una capa externa lisa, y un diámetro de partícula que oscila entre 4.58 y 6.14 μm (Figura 2).
Yin et al [53], microencapsularon L. rhamnosus mediante secado por aspersión con proteína de suero lácteo y goma arábica, como resultado obtuvieron tamaños de partícula desde los 20.25 μm hasta 38.16 μm, viabilidad de 1,25x1010 UFC/g, humedad de 4.07 a 4.94 %, higroscopicidad de 6.42 a 9.06 g/100 g y Aw de 0.152 a 0.196. La higroscopicidad es la capacidad de los polvos para absorber la humedad del entorno, que afecta la estabilidad fisicoquímica, vida útil y fluides de polvos [54].
Sarabandi et al [54], reportan valores de solubilidad entre 94.31 a 98.78% y humectabilidad de 7 a 262 segundos (s); además, mencionan que el tiempo de humectabilidad y los valores de solubilidad se ven influenciados por el tipo de material microencapsulado. Los valores obtenidos para Aw y humedad están por debajo de los limites críticos establecidos para alimentos o sustratos en polvo, previniendo la muerte celular por largos periodos de almacenamiento [53].
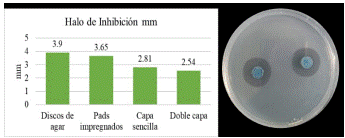
Figura 3: Halos de inhibición formados por L. lactis sobre K. pneumoniae. Halos formados por discos de agar.
El recuento UFC en la evaluación gastrointestinal in-vitro indicó crecimientos de 3,2 x 109 UFC/mL, mayor al recomendado en literatura. Sultana et al [55], recomiendan que se deben suministrar probióticos en una concentración de 106 a 107 UFC/mL a través de los productos alimenticios, de esta manera garantizar colonización a nivel intestinal. Chen [56], demuestra la protección de L. bulgaricus mediante la microencapsulación por extrusión con leche y aliginato y sometido a condiciones gastrointestinales (jugo gástrico 2.5 pH y sal biliar 1 %) con una tasa de supervivienvia del 100 %.
El bajo nivel de pH (acidez) en tracto gástrico, enzimas digestivas y bilis en tracto intestinal afectan la cantidad de células probióticas viables que determina los beneficios en la salud humana [56]; sin embargo, la microencapsulación de probióticos ofrece protección contra factores limitantes de las células que surgen durante la producción alimentaria o en el tracto gastrointestinal humano y/o animal [57]. En este sentido, González et al [58], microencapsularon (secado por aspersión) oleuropeína (compuesto fenólico antioxidante, antihipertensivo, hipoglucemiante, actividad hipocoleste-rolémico y cardioprotector) con inulina y maltodextrina, obteniendo mayor disponibilidad del compuesto bioactivo después de someter a condiciones gastrointestinales con maltodextrina, posiblemente por la mayor solubilidad en agua. Al igual, Sultana et al [55], evaluaron células libres de L. casei y microencapsulados en jugo de naranja, en 30 días las células libres se redujeron de 7.88 log UFC/mL a 5.47 UFC/mL, en contraste, el material encapsulado no disminuyó significativamente.
Los resultados obtenidos en las pruebas de inhibición muestran el potencial inhibitorio de L. lactis sobre K. pneumoniae (Figura 3). El estudio de inhibición de L. lactis sobre K. pneumoniae indica que mediante los cuatro métodos evaluados la BAL tiene la capacidad de controlar el crecimiento de la bacteria patógena. El método con mayor inhibición fue el disco de agar y el de menor inhibición fue doble capa; todos los halos formados por los diferentes métodos, en diferentes condiciones y concentraciones, demuestran que tanto biomasa como el sobrenadante de L. lactis inhiben el crecimiento de K. pneumoniae.
Los microorganismos responsables de las ETA Enfermedades Transmitidas por Alimentos) corresponden a los géneros Salmonella, Klebsiella y Shigella [59], aunque se ha reportado que estas bacterias patógenas son resistentes a los antibióticos existe la posibilidad de controlarlas con el uso de BAL [60], de esta forma los probióticos se convierten en un Sistema alternativo en salud preventiva y seguridad limentaria. El potencial bactericida de las BAL se da gracias a la formación metabólica de ácidos orgánicos, la acidificación del ambiente, la adhesión celular, el biofilm y el control de genes virulentos (atpD, aguD) [61]. Las cepas probióticas tienen propiedades intrínsecas de cada especie y presentan mecanismos diferentes para la inhibición y el crecimiento de biomasa [34].
Khongkool [62], evaluó la actividad probiótica de L. plantarum dando como resultado la inhibición de bacterias patógenas como E. coli, S. aureus, P. aeruginosa, K. pneumoniae and S.typhimurium. Liu et al [63], evaluaron el poder inhibitorio de L. johnsonii sobre K. pneumoniae obteniendo halos de inhibición de 1.955 cm a 1.755 cm, resultados similares a la presente investigación que sugieren que Lactobacillus podría competir por los sitios ecológicos limitados en el complejo ambiente intestinal; evitar que Klebsiella y otras bacterias patógenas se adhieran y se reproduzcan; y mejorar la capacidad de la mucosa intestinal para sintetizar y secretar péptidos antimicrobianos [63].
4. Conclusiones
La microencapsulación de L. lactis con inulina y maltodex-trina como material encapsulante presentó parámetros de viabilidad y supervivencia aceptables, que al ser sometidos a condiciones gastrointestinales In-vitro, mostró una supervivencia del microrganismo mayor a 107 UFC/mL. L. lactis presentó actividad inhibitoria sobre K. pneumonie y podría competir con K. pneumonie por sitios ecológicos intestinales. Los halos de mayor inhibición se presentaron por discos de agar que se caracteriza por el contacto directo entre la cepa láctica y la cepa patógena, además, la evaluación con los pads impregnados indican que los productos generados por el crecimiento bacteriano contenidos en el sobrenadante tienen efecto sobre la bacteria patógena.
















