1. Introducción
El cáncer de seno (CS) es una enfermedad común, y representa uno de los mayores problemas de salud en el mundo. Se estima que esta neoplasia constituye aproximadamente el 22.9 % de los cánceres que presentan las mujeres, siendo el cáncer con mayor tasa de incidencia (aproximadamente 2.3 millones de casos en 2020) [1] en este grupo poblacional [2]. La tasa de incidencia del CS varía de acuerdo con la ubicación geográfica de las pacientes. Además, ha sido indicado que el curso de la enfermedad en la población más joven es más grave que en mujeres de edades más avanzadas [3]. Según las cifras más recientes de la Agencia Internacional en Investigación de Cáncer (IARC), en 2020 se presentaron aproximadamente 113.221 casos nuevos de cáncer en Colombia, de los cuales 15.509 correspondieron a CS. En ese mismo año se estimó que fallecieron aproximadamente 4.411 mujeres a causa de esta neoplasia, la cual representa el 17.7% de todos los casos de cáncer en el país World Health Organization [WHO] & IARC, 2020). Las tasas de supervivencia están relacionadas en gran medida con la optimización de los procedimientos que conducen a la detección y diagnóstico temprano. Actualmente la quimioterapia convencional y la radioterapia, siguen siendo ampliamente utilizadas como tratamiento, pero pueden generar graves efectos secundarios y en algunos casos resistencia [4]. Considerando lo anterior, se requiere el desarrollo de tratamientos blanco específicos, que permitan tanto mejorar la respuesta como reducir los efectos secundarios. Dentro de estos potenciales tratamientos, se encuentran las nanopartículas (NPs). Las NPs, son partículas microscópicas (Unión Internacional de Química y Aplicada - IUPAC, 2012) con propiedades especiales como la estabilidad y conductividad, que les permiten ser ampliamente utilizadas en medicina [5]. Los sistemas de administración de fármacos con NPs pueden brindar una gran y prometedora oportunidad para combatir el CS, debido a que, a diferencia de los sistemas de administración de fármacos tradicionales, permiten que se genere una acumulación superior en el sitio del tumor mediante diferentes mecanismos activos o pasivos logrando así su lenta liberación [6]. Adicionalmente, brindan un tiempo de circulación más prolongado y permiten que la penetración en las membranas celulares sea más eficiente, mejorando en términos de rendimiento, la orientación, longevidad y sensibilidad del fármaco [7]. El direccionamiento de las NPs puede darse de manera activa o pasiva. La dirección pasiva facilita que se produzca el depósito del nanovector dentro del microambiente tumoral, ya que, este posee características distintivas inherentes que normalmente no se encuentran en los tejidos sanos. El suministro de la NP está asociado a su tamaño, forma y carga superficial [8]. Por su parte, la orientación activa de la NP se realiza mediante el uso de ligandos químicos tales como anticuerpos, péptidos, vitaminas, hormonas y carbohidratos [9]. Por lo anterior, las NPs construidas a partir de nanomateriales funcionales presentan un enorme potencial en aplicaciones biotecnológicas y biomédicas.
Los estudios alrededor del uso de NPs para el tratamiento de CS han incrementado desde el año 2015 [10]. De hecho, investigaciones recientes demuestran como el CS puede ser tratado con NPs fabricadas con ligandos de orientación y agentes terapéuticos comúnmente usados en el tratamiento de CS metastásico [10]. Por ejemplo, el receptor 2 del factor de crecimiento epidérmico humano (HER2), es en la actualidad ampliamente utilizado como objetivo dado que, es uno de los principales biomarcadores en CS [11,12]. Considerando lo anterior, esta revisión se centra en estudios recientes que destacan el uso de NPs como un sistema prometedor para la administración dirigida de fármacos en el tratamiento de CS.
2. Administración dirigida de farmacos
Las vías de administración de fármacos quimioterapéuticos enfrentan algunos obstáculos antes de llegar al sitio objetivo. Dentro de estos obstáculos se encuentra el riesgo de la degradación prematura del fármaco, así como la distribución de manera desigual del mismo en los tejidos. Lo anterior, ha conducido a la administración de altas dosis del fármaco, con el objetivo de obtener la respuesta terapéutica máxima, a pesar de los efectos secundarios que se puedan producir [13].
Los efectos secundarios y la resistencia a los tratamientos en cáncer, ha conducido en los últimos años, a que la investigación dirigida al desarrollo de terapias personalizadas y blanco especificas se intensifique [14, 15]. Dentro de estas terapias, las tecnologías de administración de fármacos como las NPs, se constituye como una prometedora oportunidad para mejorar la respuesta al tratamiento en cáncer.
Las NPs comprenden una serie de moléculas terapéuticas como fármacos de moléculas pequeñas (péptidos o proteínas), las cuales se encuentran encapsuladas en materiales como los liposomas o en nanopartículas poliméricas e inorgánicas [16]. El uso de NPs para la administración de fármacos ha aumentado en las últimas décadas [17], de hecho, se ha podido demostrar que el potencial antitumoral de estas aumenta luego de la administración, en comparación con la administración del mismo con un perfil de fármaco libre [18]. De resaltar, que el crecimiento de la nanotecnología ha conducido a que se desarrollen diferentes agentes de nanomedicina, que permiten mejorar la respuesta a los tratamientos en CS.
Las NPs presentan múltiples ventajas tanto para el diagnóstico como para el tratamiento del CS [19]. Por ejemplo, los nano transportadores modifican las propiedades farmacocinéticas de los fármacos, para aumentar su eficacia, lo que significa que el medicamento se libera en el sitio objetivo en un momento determinado de manera progresiva. Otra ventaja es que varios nanomateriales pueden ser utilizados en su fabricación, como los polímeros, las partículas metálicas y lípidos. Sin embargo, es importante resaltar, que características como la forma y el tamaño, dependen principalmente del sistema de administración del fármaco [20]. Otras ventajas de la administración de fármacos en NPs incluyen: la reducción de los efectos secundarios, la reducción del uso de altas dosis, y la reducción de resistencia a los fármacos mediante el aumento de la especificidad [21].
La orientación del nano transportador se puede realizar de dos maneras: pasiva y activa. En la orientación pasiva de las NPs se aprovechan las variaciones anatómicas de los tejidos tumorales (Figura 1A). Por ejemplo, los rápidos procesos de angiogénesis [22], y el microambiente tumoral en CS, caracterizado por la presencia de una vasculatura hiper permeable, un drenaje linfático deficiente y una matriz celular desorganizada, permiten que el nano transportador penetre de forma específica a través de los vasos sanguíneos y se retenga en el tumor, a pesar de la aparente eficiencia que el sistema de progresión tumoral puede presentar [23]. No obstante, ha sido indicado que solo el 1 % de las NPs han logrado una penetración eficaz y retención del fármaco en el tumor, dado que, la NP se encapsula en un endosoma que progresivamente libera el fármaco. De acuerdo con ensayos con modelos animales como el ratón, el bajo porcentaje de penetración posiblemente esté relacionado con la heterogeneidad clonal [24].
En la orientación activa, se utilizan ligandos como proteínas, péptidos, anticuerpos y hormonas en la superficie de las NPs para permitir el reconocimiento, a través de la unión específica a receptores expresados en las células tumorales. Por ejemplo, en CS los receptores que se constituyen como blancos específicos incluyen: al receptor del factor de crecimiento epidérmico (EGFR), HER2, CD-44, transferrina, folato y estró-genos, entre otros [25] (Figura 1B). Si bien, puede existir un direccionamiento efectivo a la zona del tumor, los estudios preclínicos demuestran que la orientación activa presenta una serie de limitaciones relacionadas principalmente con la mala penetración en el microambiente tumoral e hipoxia [26].
Una característica importante de las NPs a tener en cuenta, es la relacionada con la posibilidad de estas para modificar los procesos biológicos, lo que ha conducido a que sean ampliamente utilizadas en medicina. A lo anterior se suma que las NPs son fabricadas con biomateriales que mejoran la solubilidad, la persistencia circulatoria, la liberación dirigida, la inmuno-compatibilidad y reducen la citotoxicidad generada por los medicamentos de uso tradicional [27].
Normalmente los fármacos utilizados para terapias en cáncer son sólidos coloidales que van desde 2 nm a 1000 nm, los cuales, en algunos casos, desencadenan respuestas inmunológicas. Mientras que, en la administración con NPs el fármaco de interés se disuelve, posteriormente es encapsula-do y adherido dentro de los nano transportadores, ya sea en un sistema vesicular en donde el fármaco está en una cavidad rodeada por una membrana polimérica, o por medio de nano esferas donde el fármaco es uniformemente dispersado [28]. En comparación con las micropartículas, el sistema de administración con NPs resulta prometedor debido a que por su pequeño tamaño pueden atravesar sitios de inflamación, tumores y micro capilares, por tal razón se puede dar una administración intravenosa adecuada disminuyendo la formación de émbolos o trombos .
A pesar de lo prometedora que resulta la técnica basada en administración dirigida de fármacos, se han identificado algunas desventajas en cuanto a la eficiencia de entrega del fármaco en el tumor a razón de la auto agregación de las NPs por la afinidad que tienen los compuestos con los que son construidas [18]. Para mitigar la auto agregación, se ha optado por modificar los nano transportadores mediante la sustitución con compuestos más estables. Un ejemplo característico, lo constituye la modificación del nano transportador a base de apatita carbonatada, donde el Ca2+ fue sustituido parcialmente por Mg2+ y Fe3+, formando NPs de apatita de carbonato (CA) de Fe/Mg (Fe/Mg-CA) [18].
3. Administración dirigida a receptores sobre expresados
Este método de administración asociado a la orientación activa de las NPs, usa los antígenos o receptores expresados en los tejidos tumorales, con el objetivo de aumentar la concentración local del fármaco en el tumor y disminuir la afectación de los tejidos sanos [11]. Los ligandos dirigidos se clasifican en 3 grandes grupos que incluyen: proteínas, ácidos nucleicos y ligandos receptores [3, 11].
3.1. Ligandos dirigidos basados en proteínas
Los ligandos dirigidos basados en proteínas pueden incluir anticuerpos o polipéptidos. Los anticuerpos son apropiados para la terapia dirigida debido a su alta afinidad de unión a su antígeno objetivo [11]. Ejemplos específicos del uso de NPs en CS lo constituye los tratamientos dirigidos hacia los receptores con actividad tirosina kinasa (RTK), tales como el EGFR [19], el factor de crecimiento endotelial vascular (VEGFR) [11] y el receptor-2 de factor de crecimiento epidérmico humano (HER2) [30]. Específicamente, el EGFR se activa mediante la unión de su ligando específico, desencadenando posteriormente una cascada de señalización celular que modula la proliferación celular, la adhesión, transcripción y angiogénesis [31] (Figura 2A). El EGFR presenta una expresión aberrante (sobre expresión) en tumores sólidos de diferentes tipos de cáncer incluido el CS [32], siendo por ende un blanco terapéutico usado actualmente en pacientes con esta neoplasia. En el tratamiento de pacientes con CS con sobre expresión de este receptor, han sido usadas NPs compuestas por una zona hidrófoba que aumenta la solubilidad del fármaco, y por proteínas que funcionan como ligandos de EGFR permitiendo su reconocimiento y entrada a la célula. Ejemplos específicos de su aplicación lo constituye el realizado en líneas celulares con sobre expresión de EGFR, en donde la administración de NP-paclitaxel disminuyó significativamente el crecimiento tumoral [33]. NP-paclitaxel, corresponde a una nano partícula que contiene paclitaxel, un fármaco que interrumpe la dinámica microtubular normal necesaria para la división celular y los procesos de interfase (mantenimiento de la forma celular, la motilidad, etc.), conduciendo a la activación de la muerte celular programada o apoptosis [34]. Adicionalmente, se han desarrollado NPs conjugadas con polietilenglicol (PEG), un polímero estructural (altamente soluble) utilizado en la construcción de las mismas, debido a su función como antibioincrustante (compuestos químicos que tienen la propiedad de evitar que las sales del agua se depositen o precipiten en cualquier superficie), y su optimización en la orientación y biodisponibilidad de los fármacos [32]. Si bien, PEG presenta alta solubilidad, algunas de las NPs han sido modificadas mediante la formación de nano emulsiones, las cuales son cinéticamente estables y permiten el incremento en la solubilización y la permeación de la NP [35, 36]. Sin embargo, es de resaltar que se han desarrollado NPs cargadas con paclitaxel, sin necesidad de incorporar emulsionante con el fin de disminuir los efectos secundarios [32] (Figura 2B). En resumen, las NPs conjugadas con proteínas y péptidos dirigidas al EGFR proporcionan una orientación hacia el CS contribuyendo al tratamiento del mismo.
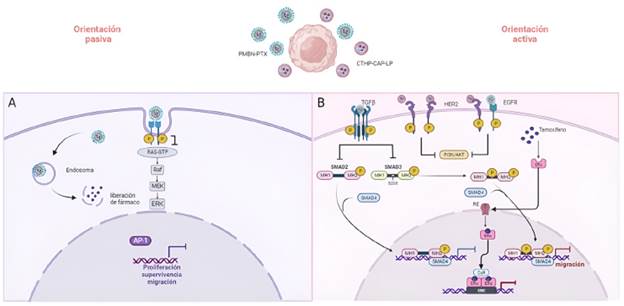
Figura 1: Administración dirigida de fármacos con NPs. El proceso de administración dirigida con NPs, inicia con la administración vía intravenosa. Una vez en el torrente sanguíneo se genera quimio orientación de las NPs que le permiten reconocer las células tumorales. A) La orientación pasiva mediante una NP de tipo MPC-co-n-butil metacrilato-co-p-rdtrofeniloxicarbonil poli (etilenglicol) metacrilato cargada con paclitaxel (PMBN-PTX). B) En la orientación activa se utilizan NPs de tipo liposoma modificados con quitosano dirigido (CTHP-CAP-PL) provistos de acuerdo al receptor blanco de fármacos (como tamoxifeno), con el fin de bloquear vías celulares desde el receptor.
En lo que respecta al VEGFR [11], conjugado de NPs con péptidos dirigidos a este receptor, han sido también usados como estrategias terapéuticas. El VEGFR se encuentra asociado a procesos de angiogénesis en diferentes tipos de cáncer [8, 37]. Por lo tanto, dirigirse a este receptor en las membranas de las células endoteliales vasculares, puede inhibir la angiogénesis y proporcionar un efecto antitumoral [3]. De hecho, un estudio reciente mostró la eficiencia del uso de NPs cargadas con paclitaxel y conjugadas con K237 (péptido que se une a VEGFR), en la inducción de apoptosis y necrosis en un modelo de xenoinjerto de CS MDA_MB_231 [38].
3.2. Ligandos dirigidos basados en ácidos nucleicos
Los ligandos dirigidos basados en ácidos nucleicos conocidos como aptámeros, son pequeños oligonucleótidos de ADN o ARN monocatenario que se producen in vitro a través de un proceso conocido como evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) (Figura 3A). SELEX, permite generar aptámeros específicos para una molécula inorgánica u orgánica, una proteína, una célula e incluso un órgano objetivo [2, 3]. Al igual que los anticuerpos, los aptámeros acceden a las células diana a través de endocitosis mediada por receptores al unirse a los ligandos de la superficie celular [39]. A partir de ello, los aptámeros unidos a NPs de fármacos también pueden facilitar la internalización del fármaco [39] (Figura 3B). Dado que los aptámeros de los ácidos nucleicos funcionan in vivo a través del plasma sanguíneo, se deben considerar varias limitaciones de su uso. Por ejemplo, al ser polinucleótidos, los aptámeros de ácidos nucleicos son naturalmente susceptibles a la degradación enzimática por exo y/o endonucleasas, lo que conduce a una reducción media circulatoria. Este inconveniente se puede solucionar incorporando bases de nucleótidos no naturales (ácidos nucleicos bloqueados y desbloqueados) y tapando los extremos del aptámero, minimizando las enzimas degrada-doras. También, se pueden diseñar mediante la conjugación con un polietilenglicol (PEG) terminal (Figura 3C). Para este caso, se ha identificado el uso del aptámero del ARNsi, el cual es un dúplex de ARN sintético diseñado para dirigirse específicamente a un ARNm en el citoplasma e inducir la degradación del ARNm con fines terapéuticos [40]. Sin embargo, la administración in vivo del ARNsi a células cancerosas específicas ha sido un reto debido a la corta circulación sanguínea y a la degradación del ARNsi, para contrarrestar estos desafíos, se requieren sistemas de administración de fármacos adecuados que los protejan de la degradación y permitan la administración intracelular. Entre los diversos vehículos de administración disponibles, las nanopartículas lipídicas se han convertido en la principal opción [41]. Incluso, se ha demostrado que en células de CS HER2 positivas, el ARNsi se une selectivamente a la proteína HER2, y las NPs empleadas inhiben significativamente el crecimiento del tumor [42].
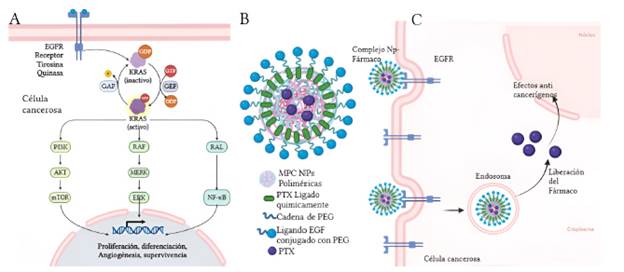
Figura 2: Nanopartícula polimérica y cascada de señalización mediada por el EGFR. A) Activación de EGFR mediante la unión de su ligando específico, desencadenando una cascada de señalización celular que modula la proliferación celular, así como procesos de adhesión, transcripción y angiogénesis. B) Nanopartícula polimérica. Se muestra su disposición micelar de conjugados PEG (Polietilenglicol) con proteínas y el fármaco encapsulado. C) Internacionalización de la NP en la célula diana por medio de endocitosis. El entorno ácido de un endosoma temprano provoca la disolución de las NP endocitadas, lo que da como resultado su disolución y liberación del fármaco.
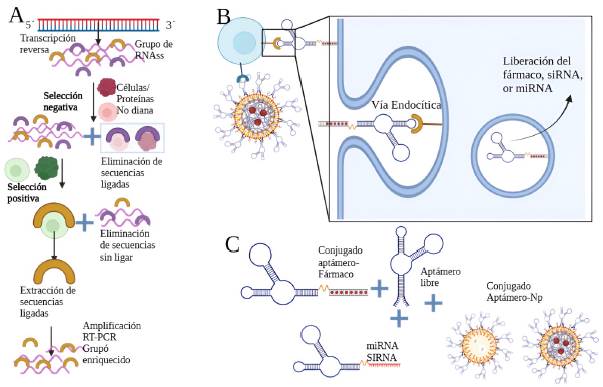
Figura 3: Aislamiento del aptámero e interacción con la célula cancerígena. A) Generación de aptámeros de RNA mediante la metodología SELEX. B) Unión específica de los aptámeros a su objetivo en la superficie celular. Los agentes terapéuticos conjugados con aptámeros o las NPs encapsuladas con fármacos se internalizan en las células cancerosas por endocitosis mediada por receptores. C) Enfoques de los conjugados: aptámero libre, conjugados de aptámero-fármaco, sistema de administración de aptámero-nanopartícula-fármaco y conjugado aptámero-miRNA o siRNA
3.3. Ligandos de los receptores
Los ligandos de los receptores han sido implementados en las estrategias de focalización y direccionamiento de las NPs [3]. Tal es el caso de la administración dirigida por el ligando de folato. Este ligando se utiliza a menudo para dirigirse a las células tumorales que sobre expresan su receptor, incluyendo CS, cáncer de ovario y cáncer de endometrio [8, 39]. Por ejemplo, en un estudio realizado por [43] se sintetizó un nano portador de TiC>2 modificado con polietilenglicol (PEG) y dirigido hacia el ácido fólico (FA-PEG-TiCy, el cual estaba cargado con curcumina y ácido salvianólico B. Los resultados mostraron que al combinar y administrar dos fármacos simultáneamente se ejerce una tasa de respuesta tumoral más alta y rápida con respecto a un solo fármaco o una combinación secuencial del mismo [44,45]. Por lo tanto, se ha evidenciado que la curcumina inhibe la proliferación de células tumorales e induce la apoptosis en las células tumorales al suprimir la vía Akt-mTOR-p70S6K, activando la vía de señalización ERK1-2 e induciendo la detención del ciclo celular en G2/M [46]. Además, ha sido indicado que la curcumina interfiere con la vía de señalización PI3K-Akt, lo que conduce a la supresión de la proliferación, invasión y migración celular en varias células cancerosas, incluidas las células de CS triple negativas. Estudios adicionales, mostraron que la curcumina también inhibe la angiogénesis y regula negativamente la expresión de genes relacionados con la angiogénesis, por ejemplo, VEGF, Matriz metalopeptidasa 9 (MMP9), Angiopoyetina-1 (ANG1), Angiopoyetina-2 (ANG2) [47, 48]. Con respecto al mecanismo anticancerígeno del ácido salvianólico, ha sido indicado que este induce la apoptosis en células U87 de glioma humano, a través de la generación de especies reactivas de oxígeno (ROS) mediada por p38 [49]. Teniendo en cuenta las evidencias de los efectos antitumorales de estas dos sustancias, fue posible evidenciar que las NPs cargadas con folatos mostraron mayor citotoxicidad, conduciendo a una mayor actividad anti proliferativa y a una mejor captación intracelular en las líneas celulares de CS, MCF7 y MDAMB-231. Considerando lo anterior, el nano portador FA-PEG-TiO2 se constituye como un enfoque prometedor para la terapia dirigida en CS [18, 43]. Aunque se ha informado que la administración conjunta de medicamentos es exitosa, existen casos en los cuales hay limitación en la entrega conjunta de fármacos debido a las diferentes polaridades moleculares, tal es el caso del uso combinado de curcumina y piperina. La difícil encapsulación en sistemas de administración convencionales de estos fármacos, implica el diseño de NPs magnéticas poliméricas [50].
4. Tipos de nanopartículas con uso terapéutico
Considerando las propiedades de las NPs como nano transportadores, los ensayos para posicionarlas como alternativas de tratamiento han aumentado, logrando ampliar las opciones de nanomateriales que se pueden utilizar. Tales materiales se pueden clasificar en NPs liposomales, de carbono, proteínas y oro [51, 52].
4.1. NPs liposomales
Los liposomas suponen un buen nano transportador, ya que tienden a acumularse e incorporarse en la bicapa celular de las células cancerosas. Con el objetivo de aumentar la vida media y la eficacia de orientación de la NP, se ha provisto a esta de ligandos los cuales siguen en desarrollo para obtener una circulación del nano transportador más prolongada sumada a una liberación controlada del fármaco encapsulado [53].
Las NPs liposomales se caracterizan porque son vesículas esféricas que se forman gracias a la incorporación de varias capas de fosfolípidos, el núcleo es hidrofílico y se encuentra envuelto por una bicapa lipídica que es hidrofóbica [10]. En este tipo de moléculas se pueden llegar a encapsular sin ningún inconveniente, agentes terapéuticos hidrofílicos, hidrófobos y anfifílicos. Estas características también son parte de las NPs lipídicas sólidas, un tipo de sistema coloidal que contienen lípidos fisiológicos dispersos en una solución tensioactiva acuosa o agua, pero permanecen sólidos en el entorno corporal, las cuales reemplazaron algunos sistemas coloidales (emulsiones, liposomas) [54]. De hecho, ha sido demostrado que la encapsulación del fármaco, en ambos casos, reduce drásticamente la toxicidad que este puede generar antes de llegar al sitio objetivo. Por ejemplo, recientemente fue demostrado que el paclitaxel (fármaco comúnmente utilizado en CS), al ser encapsulado no generó efectos tóxicos como cuando su administración es en forma de fármaco libre [55].
4.2. NPs de carbono
Los estudios realizados con NPs de carbono son reducidos. De hecho, hasta hace poco tiempo se empezó a implementar como una posible alternativa de tratamiento. Hasta el momento se sabe que la toxicidad que se produce es muy baja, que el área de superficie específica es alta y que además podrían llegar a incorporarse grupos funcionales de gran versatilidad [56].
4.3. NPs de proteínas
Las NPs de proteínas han ido adquiriendo importancia debido a que, al ser biomateriales, producen baja toxicidad, inmunogenicidad y biodegradabilidad. Por lo anterior pueden llegar a diseñarse multímeros con capacidad de auto ensamblación. Adicionalmente, el uso de las NPs de proteína sugieren cambios en la presión osmótica dentro de las células, lo cual afecta el proceso de metástasis en el CS y representa una ventaja prometedora en etapas avanzadas del cáncer [57]. Paralelamente, este tipo de nano transportadores puede proveerse de ligandos en la superficie que facilita el paso por las barreras extra e intracelulares aumentando la especificidad [58]. Lo anterior podría conducir a que la entrega dirigida de fármacos se dé de forma eficaz. De hecho, la eficiencia de estos nano transportadores ha sido demostrada en estudios recientes. Por ejemplo, en el tratamiento de CS se demostró que con la encapsulación del anticuerpo monoclonal herceptin (Trastuzumab) se logró un aumento en la apoptosis de las células cancerosas, así como una disminución en la proliferación celular [59]. De la misma manera, el uso de conjugados de fármacos en ratones con CS, mostraron reducción en el crecimiento tumoral [60].El uso de las NPs de proteína sugieren cambios en la presión osmótica dentro de las células, lo cual afecta el proceso de metástasis en el CS y ha sido [57].
4.4. NPs radioactivas
La medicina nuclear ha permitido que a través de la radiación se logré proporcionar datos funcionales al momento del diagnóstico en varios tipos de cáncer, entre estos, el CS [61]. De igual forma, los avances en esta rama de la medicina han postulado a las NPs de carbono, liposomales y poliméricas, como potenciales vehículos de radiofármacos altamente específicos [62]. Los nanosistemas pueden diseñarse por medio de la incorporación de elementos radioactivos como el oro, el cual puede someterse a altas concentraciones de neutrones para obtener NPs radioactivas en el núcleo, las cuales podrían transportar cargas de radionucleidos que emiten partículas beta (3) y alfa (a) que son eficaces dada la alta ionización que producen [63].
Algunas de las limitantes que hasta el momento se han podido evidenciar es que las NPs radiactivas deben permanecer en el cuerpo durante un período de tiempo determinado, para así evitar la exposición prolongada del paciente a la radiación y que se vean afectados tejidos sanos [64].
5. Implicaciones del diseño o material de las NPs en el CS
La evidencia clínica sugiere que la eficacia de la terapia con NPs depende en gran medida de la absorción celular activa [65, 66]. La absorción está influenciada por el tamaño, la forma, las propiedades superficiales y la concentración de las partículas. Las técnicas de modificación química de la superficie se han empleado ampliamente para mejorar la interacción entre la célula y las NPs. Sin embargo, el uso de solventes orgánicos agresivos es una preocupación importante durante estos procesos, lo que podría imponer problemas a la viabilidad celular [67]. Estudios recientes, reportan una ventaja importante relacionada con el tamaño de la NP, puesto que este determinará el tiempo de circulación medio en la sangre y a su vez determinará sus propiedades fisicoquímicas y biológicas. Sin embargo, un tamaño muy pequeño puede ser una desventaja, ya que la NP puede perderse fácilmente al ingresar al organismo o ser filtrada directamente por los riñones, de ahí que se haya establecido un rango óptimo que oscila entre 10 y 100 nm para aplicaciones biomédicas in vivo [68]
Dadas las diversas barreras fisiológicas y celulares a las que se enfrenta la administración de NPs, el control de liberación puede afectar la eficacia terapéutica. Para ello, las NPs se modifican con el fin de efectuar una liberación controlada de la misma. El objetivo principal de estos sistemas es alinear los perfiles de liberación del fármaco con la cinética de las NPs [66]. Por ejemplo, se diseñó un sistema de NPs poliméricas para administrar secuencialmente un agente anti angiogénico seguido de un agente quimioterápico [69]. Este procedimiento desencadenó el cierre vascular y atrapó las NPs dentro de un tumor antes de liberar el quimioterapéutico, dirigiendo así temporalmente la liberación del fármaco para que coincidiera con el momento en que la enfermedad era susceptible de tratamiento. Si bien, la función principal de los ligandos dirigidos es potenciar la captación celular en las células cancerosas y minimizar la acumulación en el tejido normal, se ha sugerido que las propiedades coloidales de las NPs determinarán su bio distribución, mientras que el ligando de orientación funcionará para aumentar la captación intracelular en el tumor objetivo. Si esto resulta ser así en general, la afinidad del ligando de orientación y la densidad de la superficie de la NP determinarán la captación celular [70].
A pesar de los buenos resultados observados con respecto al uso de las NPs [32, 42, 43, 71], es importante continuar con estudios que permitan dar solución a problemas como la dificultad de controlar el tamaño de las nanopartículas durante la síntesis. Siendo por ende importante y necesario, implementar metodologías que permitan mejorar significativamente la eficacia de los tratamientos [68]. Así mismo, se evidencia que es fundamental conocer las características fisiológicas del tipo de cáncer con el fin de aprovecharlas y así realizar el respectivo direccionamiento y efectuar el sistema idóneo de administración de las NPs [66]. Por otro lado, la importancia de definir plenamente la biocompatibilidad de las nanopartículas en los seres humanos, es absolutamente necesario [70, 72], puesto que la toxicidad significativa asociada a las NP, las actividades fuera de su objetivo y la baja biocompatibilidad limitan su utilización para tratamientos terapéuticos contra el cáncer y pueden ser peligrosos para los pacientes con cáncer en condiciones potencialmente mortales [73]. Por ejemplo, en estudios con modelos animales, los análisis de la toxicidad de las nanoestructuras, no revelaron efectos perjudiciales para partículas magnéticas de 50 nm recubiertas de sílice [72], pero sí toxicidad para nanotubos de carbono [74], óxido de zinc, óxido de titanio, la plata y el oro [73]. Respecto a los ensayos clínicos hay algunos que aún se encuentran en curso, sin embargo, NPs magnéticas y de óxido de hierro ya están siendo empleadas con fines diagnósticos para la obtención de imágenes de ganglios linfáticos [75].
6. Conclusiones
La intensa investigación acerca de la biología molecular, genética, fisiología y morfología de los tumores cancerígenos ha dado como resultado la identificación de una gran variedad de objetivos moleculares prometedores para la orientación y la terapia dirigida del tumor. En consecuencia, el enfoque ideal para la administración de fármacos ha sido orientado a la aplicación de la nanomedicina mediante el diseño de diversas NPs. La comprensión de las múltiples barreras biológicas y farmacéuticas alrededor de la implementación de las mismas ha contribuido con el desarrollo de nano portadores inteligentes, es decir, un sistema dirigido al tumor que suministra agentes terapéuticos de forma selectiva a las células cancerosas mediante el reconocimiento de la fisiología del tumor. Para la orientación activa de las NPs, han sido usados varios ligandos de diferentes tamaños y componentes moleculares para dirigirse a receptores específicos que se sobre expresan en las células de CS. Los estudios preclínicos en animales demostraron que los complejos de fármacos NP dirigidos mejoraron la internalización celular y el índice terapéutico de los fármacos contra el cáncer. En algunos casos, redujeron los efectos secundarios no deseados y la quimio resistencia en las células de CS en comparación con los fármacos libres. A partir de estos resultados, las NPs se consideran un sistema prometedor para la administración dirigida de fármacos. Sin embargo, es importante el desarrollo de investigaciones adicionales que aborden la tasa de internalización de las NPs cargadas de fármaco y los mecanismos de liberación del fármaco dentro de la célula diana.















