1. Introducción
La productividad agrícola ha aumentado significativamente en las últimas décadas gracias a las tecnologías desarrolladas durante la revolución verde y la expansión del uso de la tierra y el agua. Los avances en la agricultura han contribuido a la seguridad alimentaria del planeta y creado oportunidades para el desarrollo empresarial como principio del desarrollo económico, siendo una fuente de empleo para millones de personas [1, 2]. Se estima que en el 2050 la población mundial alcanzará los 9.500 millones de personas, lo que significa que la demanda de alimentos aumentará aproximadamente un 70 %. Para satisfacer esta necesidad, se necesita una seguridad alimentaria estable a través de la agricultura sostenible [3, 4, 5]. Sin embargo, para lograr este objetivo de producción agrícola, es necesario agregar grandes cantidades de fertilizantes químicos al suelo como nitrógeno y fósforo, los cuales afectan negativamente la fertilidad y diversidad microbiana del suelo, además de contaminar las aguas superficiales y subterráneas [1, 2, 6, 7]. La acumulación de fertilizantes químicos en el medio ambiente está relacionada con variaciones en factores ambientales y climáticos, como la temperatura, precipitaciones, sequías e inundaciones; y con la propagación de plagas y enfermedades resistentes a diferentes compuestos químicos [8, 9]. Además de la aplicación de fertilizantes químicos y pesticidas, la contaminación de los suelos por metales pesados es ocasionada por el rápido crecimiento industrial, la minería, el riego con aguas residuales, la deposición atmosférica, y el vertido inadecuado de productos petroquímicos y de residuos metálicos [10]. Lo anterior afectaría considerablemente el rendimiento de los cultivos.
El uso de biofertilizantes en la producción agrícola no solo contribuye a la biodiversidad del suelo, sino que también satisface la creciente demanda de alimentos sanos, seguros y sostenibles en el largo plazo [11,12]. Las rizobacterias promotoras del crecimiento vegetal (PGPR) se encuentran en la rizosfera y raíces, y ofrecen interesantes ventajas en plantas, como el aumento de la disponibilidad de nutrientes, la resistencia al ataque de patógenos y la remediación de la contaminación por metales pesados, generando un mejor rendimiento en cultivos de importancia económica. La promoción del crecimiento en las plantas es mediada por mecanismos directos e indirectos de las PGPR, como la producción de sideróforos, que son compuestos orgánicos de bajo peso molecular, utilizados para tomar el Fe+3 de diferentes hábitats terrestres y acuáticos y ponerlo a disposición de las células microbianas y vegetales.
Las bacterias que producen sideróforos y que han sido reportadas como PGPR, pertenecen a los géneros Alcaligenes, Aeromonas, Azoto-bacter, Arthrobacter, Azoarcus, Azospirillum, Acinetobacter, S. Agrobacte-rium, Aneurinibacillus, Bacillus, Beijerinckia, Brevibacillus, Burkholderia, Enterobacter, Gluconacetobacter, Gluconobacter, Herbaspirillum, Klebsiella, Paenibacillus, Pseudomonas, Rhizobium, Rhodococcus, Saccharothrix, Serratia, Thiobacillus y Variovorax [13-16].
La síntesis de sideróforos generalmente se asocia con la multiplicación y el desarrollo de la virulencia de los patógenos, pero también están implicados en diversas funciones que favorecen el crecimiento de las plantas [17-20]. Aunque la función principal de los sideróforos es tomar el Fe+3, también pueden desempeñar un papel importante en la desintoxicación de muestras contaminadas con metales pesados uniéndose a una amplia gama de metales tóxicos, como Cr3+, Al 3+, Cu2+, Eu3+ y Pb2+ [10].
Esta revisión detalla la síntesis, transporte y regulación de los sideróforos bacterianos; y las posibles funciones de las PGPR productoras de sideróforos, que pueden participar en la biorremediación de suelos contaminados por metales tóxicos, y su efecto en el crecimiento vegetal.
2. Sideróforos
2.1. Importancia del hierro en los seres vivos
El hierro es el cuarto elemento y el segundo metal más abundante en la tierra; y es esencial para la vida de todos los organismos porque interviene en procesos celulares como la síntesis de ADN, el ciclo de los ácidos tricarboxílicos, la cadena de transporte de electrones, la fosforilación oxidativa, la fijación de nitrógeno y la biosíntesis de compuestos aromáticos [21,22]. En condiciones fisiológicas, el hierro puede existir en dos estados de oxidación, ferroso (Fe2+) y férrico (Fe3+) [23]. Su importancia biológica resulta de su incorporación a proteínas mononucleares o binucleares y formas más complejas como parte de grupos mixtos hierro/azufre o grupos hemo [24]. Su reducción reduce la síntesis de ADN e inhibe el crecimiento bacteriano, provocando cambios morfológicos en las bacterias [21]. La síntesis de proteínas fijadoras de hierro reduce su disponibilidad, y es un mecanismo de defensa utilizado por el huésped para prevenir infecciones; el exceso de hierro libre puede causar toxicidad mediante la formación de especies reactivas de oxígeno [25].
La disponibilidad de hierro ferroso en el suelo es baja, con concentraciones en el rango de 10-10 a 10-9 M y con niveles requeridos por los organismos vivos de 10-7 a 10-5 M [10, 26]. Debido a la baja disponibilidad de Fe3+ en el suelo, las bacterias han adquirido diversas formas de captación, de las cuales la producción de sideróforos es el principal mecanismo de quelación del hierro [2, 27]. Sin embargo, las bacterias Gram-negativas patógenas pueden presentar otras formas de absorción de hierro, como la expresión de la lactoferrina y la transferrina, el sistema FeO, y el grupo hemo [21, 28,29].
La mayoría de las bacterias tienen sistemas de captación de hierro mediados por sideróforos (del griego sideros que significa hierro y phores que significa portador) [10, 27]. Los sideróforos son moléculas pequeñas, de peso molecular de 500 a 1500 daltons, con fuerte afinidad por el hierro férrico (Fe+3) de 1020 a 1030 M-1, sintetizados por diversas bacterias como Pseudomonas, Azotobacter, Bacillus, Enterobacter, Serratia, Azospirillum, Rhizobium, Mesorhizobium, Brevibacillus, Pseudomonas y Paenibacillus [2,30-33]. Los sideróforos son ampliamente reconocidos como factores de virulencia de bacterias patógenas [21, 34-39]. Sin embargo, los sideróforos de bacterias también contribuyen a la absorción de hierro que promueve el crecimiento de las plantas, cambiando la forma insoluble del hierro en soluble [2, 21, 33, 40].
Para evitar la acumulación de hierro libre en las células, todos los organismos, incluidas las plantas, realizan una regulación precisa de la homeostasis del hierro que incluye los procesos de captación, transporte y almacenamiento de este metal [41]. Las plantas requieren el hierro en forma Fe+2 para el desarrollo de la clorofila y enzimas relacionadas con la respiración celular, y diferentes procesos metabólicos, como el ciclo del ácido tricarboxílico, la fosforilación oxidativa y la fotosíntesis; sin embargo, aunque en el suelo el hierro es un elemento abundante, su disponibilidad es baja por encontrarse en forma de iones férricos y ser poco soluble [2, 20, 40, 42]. La clorosis férrica es una alteración nutricional de algunos suelos causada por la baja disponibilidad de hierro en las plantas, afectando su crecimiento y provocando un descenso en la productividad de los cultivos. La clorosis se manifiesta en plantas como una diferencia entre el tejido verde y el menos verde (o amarillo), ocasionado por la escasez de clorofila [43]. La accesibilidad del hierro en el suelo para las plantas disminuye con el aumento del potencial redox y pH del suelo [44]. Una variedad de PGPR pueden colonizar la rizosfera y aumentar la absorción de hierro por las plantas mediante la síntesis y liberación de sideróforos en condiciones apropiadas, aumentando y regulando así la biodisponibilidad del hierro [45].
En deficiencia de hierro se activa una red de eventos metabólicos para coordinar la movilización del hierro almacenado hacia las raíces para su absorción y distribución en la planta. En dicotiledóneas y monocotiledóneas no gramíneas, se establece un mecanismo de absorción de hierro basado en la reducción, conocido como estrategia I de adquisición de hierro. Esta estrategia implica tres pasos para la captación de hierro: liberación de protones para mejorar la movilidad del hierro, reducción de Fe3+ a Fe2+ e importación de Fe2+. En la estrategia II, las plantas responden al estrés por Fe produciendo fitosideróforos que se secretan en la rizosfera y actúan como quelantes de alta afinidad para formar complejos Fe3+-fitosideróforo, que son transportados al interior de la célula mediante el transportador Fe-fitosideróforo YS1 (en maíz) o YSL (en otras gramíneas). Además, los microorganismos del suelo producen y liberan sideróforos para facilitar la movilidad y la absorción del hierro por las plantas [46-48].
2.2. Síntesis de sideróforos
Los sideróforos se descubrieron en la década de 1950 al identificar el ferricromo A y la micobactina en los hongos Ustilago sphaerogena y Mycobacterium johnei, respectivamente [49, 50]. Hasta la fecha se han identificado más de 500 sideróforos diferentes, lo que revela su importancia, especificidad y variedad; y se clasifican en sideróforos microbianos y fitosideróforos [2,51,52]. La variación en la estructura de los sideróforos se asocia con diferencias en la afinidad del hierro, el pH óptimo y la capacidad de evadir la lipocalina 2, una molécula producida por el huésped que inactiva algunos sideróforos [53]. Dependiendo de los grupos químicos implicados en la unión del hierro, los sideróforos bacterianos se pueden dividir en tres grandes familias: hidroxamatos, carboxilatos y catecolatos/fenolatos (Figura 1) [54]. Cada familia de sideróforos tiene características diferenciales que afectan a la afinidad por el hierro, sin embargo, todos utilizan átomos de oxígeno cargados negativamente para coordinar la unión con el ion férrico (Fe+3). También se han caracterizado sideróforos de tipo mixto con grupos químicos de unión a hierro poco comunes como aminas o estructuras heterocíclicas, por ejemplo, la pseudobactina, anguibactina, pyoverdina, yersiniabactina, micobactina o aerobactina (Figura 1) [26, 51, 55-57]. Los grupos de unión a hierro suelen ser bidentados y formar complejos de coordinación pseudo-octaédricos y hexadentados alrededor del ion férrico [32].
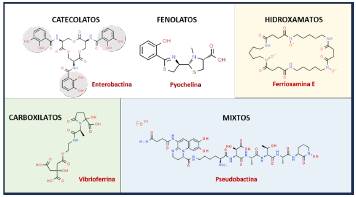
Figura 1: Ejemplos representativos de las principales clases de sideróforos. Los cuatro tipos principales se distinguen por el grupo funcional que interviene en la quelación del hierro.
De acuerdo a su estructura química y grupos de unión al metal, las tres familias de sideróforos presentan diferentes características. Los hidroxamatos tienen menor afinidad por el hierro que los catecolatos; los carboxilatos son más eficientes en la quelación del hierro férrico a pH ácido que los catecolatos o hidroxamatos; mientras que los carboxilatos tienen menos éxito como quelantes del hierro a pH fisiológico, comparados con los catecolatos o hidroxamatos [53].
Diversos estudios muestran que las bacterias pueden producir varios tipos de sideróforos, por ejemplo: P. aeruginosa (pyoverdina y pio-quelina), E. coli (enterobactina y aerobactina) y Streptomyces coelicolor (deferroxamina E, deferroxamina B y coelichelina). La producción de múltiples sideróforos, que tienen un comportamiento distinto y son capaces de unirse a los iones metálicos con diferentes afinidades, pue-de favorecer la supervivencia y el crecimiento de microorganismos en diferentes ambientes [27, 28].
La mayoría de los sideróforos se sintetizan mediante péptidos sintetasas no ribosomales (NRPS) o por sistemas mixtos de NRPS-sintetasas policétidas. Otros sideróforos bacterianos se sintetizan a través de vías independientes de las NRPS, como las estafloferrinas A y B en Staphylococcus aureus, la petrobactina en Bacillus anthrasis y la alcaligina en Bordetella pertussis [56, 58]. La NRPS consta de tres dominios básicos: un dominio A para el reconocimiento del sustrato, un PCP (proteína portadora de peptidilo) que contiene sustrato activado y un dominio C para la formación de enlaces peptídicos. También contienen varios dominios que incorporan ciclaciones o modificaciones al compuesto final [59].
La biosíntesis de sideróforos en bacterias es inducida por deficiencia de hierro intracelular y está regulada por el represor Fur [56]. Durante la síntesis de enterobactina, los genes entB, entC y entA codifican las funciones necesarias para la producción de ácido 2,3-dihidroxibenzoico o DHBA a partir de corismato. El DHBA es el grupo funcional de los sideróforos de tipo catecolato. Una vez que se sintetiza DHB, la acción secuencial de las NRPS EntE, EntB (C-terminal) y EntF ensamblarán la enterobactina a partir de los tres elementos de DHBA y L-serina [60, 61]. Después de sintetizados, los sideróforos son secretados al medio extracelular por tres tipos de transportadores: la superfamilia de facilitadores principales, la super-familia de resistencia, nodulación y división celular y la superfamilia ABC (Figura 2) [56].

Figura 2: Producción de sideróforos. a. Biosíntesis y secreción. La mayor parte de los sideróforos son sintetizados por grandes complejos enzimáticos formados por sintetasas de péptidos no ribosomales (NRPSs) o bien por sistemas mixtos NRPS-sintetasas policétidas (PKS). Una vez producidos, los sideróforos son secretados al medio extracelular, a través de diferentes sistemas de transporte, como la superfamilia de facilitadores principales (MFS), la superfamilia de resistencia, nodulación y división celular (RND) y la superfamilia ABC. b. Captación del Fe-sideróforo. El complejo Fe+3-sideróforo será adquirido por la bacteria a través de transportadores específicos que los libera en la región del periplasma, para luego ser conducidos a través de la membrana interna mediante transportadores, generalmente del tipo ABC. En el citoplasma, el hierro se libera rápidamente del complejo sideróforo mediante reductasas citoplasmáticas.
2.3. Transporte de sideróforos
Los microorganismos que requieren hierro secretan sideróforos al entorno extracelular que, gracias a transportadores específicos, capturan el hierro en complejos muy estables. En las bacterias Gram-negativas, este proceso comienza con la unión del complejo Fe+3-sideroforo a transportadores específicos de la membrana externa dependientes de TonB o TBDT (TonB-dependent transporters). Los TBDT más estudiados son FepA (enterobatina), FhuA (ferricromo) y FecA (citrato férrico) en E. coli y FpvA y FptA en P. aeruginosa. El sistema TonB proporciona la energía que impulsa el transporte del ferri-sideróforo hasta el periplasma. Una vez liberados en el periplasma, los sideróforos se unen rápidamente a proteínas de unión periplásmica específicas y son conducidos a través de la membrana interna mediante transportadores, generalmente del tipo ABC [25, 56, 62, 63]. El sistema de transporte ABC consta de dos proteínas: la primera actúa como permeasa permitiendo que la membrana se separe y la segunda proteína se encarga de proporcionar la energía necesaria para el proceso de transporte [56,62]. Una vez en el citoplasma, el hierro se libera rápidamente del complejo sideróforo mediante reductasas citoplasmáticas, que parecen no ser específicas del sistema de adquisición de hierro (Figura 2) [64]. E. coli exhibe un mecanismo alternativo en el que el hierro se libera en el citoplasma mediante enzimas con actividad esterasa que degradan el sideróforo [56].
2.4. Regulación de los sistemas de sideróforos
En bacterias Gram negativas la regulación del metabolismo del hierro suele estar mediada por el represor Fur. En condiciones de abundancia de hierro, la proteína Fur se une al ADN en una secuencia palindrómica conservada denominada "cajas Fur", reprimiendo la transcripción de los genes implicados en la absorción de hierro. Cuando los niveles de hierro intracelular son bajos, la proteína Fur pierde su afinidad por el ADN, aumentando así la transcripción genética. Por lo tanto, la transcripción de los genes responsables del metabolismo del hierro está regulada por la concentración de hierro intracelular [56, 65-67]. E. coli exhibe un mecanismo regulador diferente para la adquisición de citrato férrico, que responde a la presencia de un ligando en la superficie celular [68]. Aunque el hierro es esencial para el crecimiento, niveles elevados son tóxicos porque pueden generar radicales hidroxilo a través de las reacciones de Fenton y Haber-Weiss. Por tanto, es necesario controlar los mecanismos de adquisición de hierro [69, 70].
3.1. Contaminación y biorremediación
La expansión en la industria, agricultura, y urbanización, impulsada por el crecimiento de la población, es considerada la mayor fuente de contaminación ambiental, principalmente, por metales pesados, pesticidas y disolventes clorados [71]. Los suelos agrícolas pueden contaminarse por la rápida acumulación de metales pesados y metaloides procedentes de la aplicación indiscriminada de fertilizantes químicos y pesticidas, por el riego con aguas residuales, por los residuos de la minería, y por el derrame de productos petroquímicos [10, 72]. Se estima que el uso de fertilizantes en el planeta supere los 150 millones de toneladas en el 2050 [73]. Los fertilizantes y pesticidas empleados en la producción agrícola contienen cantidades considerables de Cu, As, Co, Cr, Mo, Sr, Ti, V, Mn, Fe, Ni, Zn, Cd, Pb, Hg, Br y Sc [74]. Otros fertilizantes utilizados, como el estiércol, purines, compost y lodos de aguas residuales, contienen metales como el Cd, Cr, Cu, Ni, Pb, Zn y Hg [75]. La contaminación por metales pesados está afectando drásticamente la seguridad alimentaria y salud pública [76].
En concentraciones elevadas en el suelo, los metales son tomados por las raíces y transportados a diferentes partes de la planta, causando un estrés oxidativo por la producción de especies reactivas de oxígeno, síntesis de etileno y reducción de la captación de hierro. Lo anterior afecta el normal metabolismo de la planta y provoca una reducción en el crecimiento, calidad y productividad de los cultivos [77]. Del mismo modo, la contaminación por metales pesados en el suelo puede causar importantes efectos en las comunidades microbianas; como la reducción de la biomasa microbiana total, disminución en el número de poblaciones específicas y cambios en la estructura de la comunidad microbiana [78].
Las tecnologías de limpieza convencionales, como el lavado de suelos y la electrorremediación, suelen ser demasiado costosas para restaurar los lugares contaminados por metales pesados y, además, suelen afectar negativamente la textura y materia orgánica de los suelos [79]. Mientras que la biorremediación, utilizando plantas, microorganismos o la combinación de ambos, es una tecnología emergente y ecológicamente adecuada para absorber, acumular y detoxificar contaminantes en el suelo, mediante procesos físicos, químicos y biológicos. Las plantas consideradas potenciales para la biorremediación requieren de un crecimiento rápido y una gran cantidad de biomasa para tolerar y acumular altas concentraciones de metales; estas plantas se conocen como hiperacumuladoras. Sin embargo, la mayoría de estas plantas no son adecuadas para aplicaciones de fitorremediación, por tener crecimiento lento en presencia de altas cantidades de metales pesados [80]. Una mejor alternativa para la biorremediación, es el uso de rizobacterias, que reducen considerablemente la acumulación de metales en las plantas y en el suelo. Las PGPR pueden eliminar parte de la toxicidad de los metales para las plantas y mejorar su crecimiento y nutrición mediante la disminución del nivel de etileno, la producción de sideróforos para la movilización de metales pesados (Figura. 3) y el aporte de nutrientes esenciales a las plantas y su limitación para los fitopatógenos [10,27,81, 82].
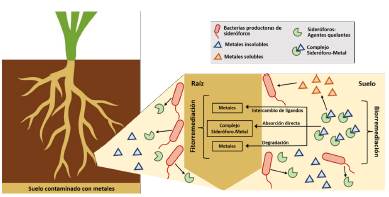
Figura 3: Actuación de las bacterias productoras de sideróforos en la biorremediación de suelos contaminados con metales tóxicos. Los sideróforos de bacterias de la rizosfera solubilizan los metales pesados mediante la formación de complejos. Las plantas pueden absorber los metales de los complejos metal-sideróforo, a través de procesos como la degradación de los quelatos y la liberación de metales, la absorción directa de complejos metal-sideróforo o mediante una reacción de intercambio de ligandos.
3.2. Sideróforos como quelantes de metales pesados
Muchos metales pesados son necesarios en cantidades traza para un metabolismo celular eficiente, pero son letales en concentraciones elevadas, alterando la estructura de los ácidos nucleicos y las proteínas, y en consecuencia, pueden afectar la integridad de la membrana celular microbiana o provocar la lisis celular. Los metales pesados también forman precipitados o quelatos con metabolitos esenciales [83].
Aunque la función principal de los sideróforos es captar el hierro, también pueden reconocer una amplia gama de metales pesados, sin embargo, este complejo sideróforo-metal no entra en la célula de forma eficaz, desintoxicando eficazmente el entorno para la comunidad microbiana [10]. La producción de sideróforos está regulada, por diversos factores, como la concentración de metales pesados; observándose, por ejemplo, que la adición de Al, Cu, Ga, Mn y Ni en un medio de crecimiento limitado en hierro, puede inducir la producción de pioverdina en P. aeruginosa [84].
Los sideróforos pueden cambiar los estados de oxidación de metales pesados como Cd, Cu, Ni, Pb, Zn, Th, U y Pu, para hacerlos menos tóxicos. Se ha demostrado en P. aeruginosa, que los receptores FpvA y FptA de pioverdina y pioquelina, respectivamente, se unen con mayor afinidad a la forma férrica del sideróforo, y con menor afinidad a los complq'os sideróforo-metal (Al, Mn, Ag, Co, Ga y Ni) [85]. La pioverdina y la desferrioxamina B, forman complejos con cationes divalentes y trivalentes, principalmente con Cr3+, Cr2+, Al3+, Cu2+, Eu3+, Pb2+, Ag+, Cd2+, Co2+, Hg2+, Mn2+, Ni2+, Ga3+, Sn2+ , Tb3+ , Tl+ y Zn2+ . Tras la formación de los complejos, se reduce la disponibilidad de estos iones, provocando la desintoxicación del suelo [86, 87].
3.3. Aplicaciones de las bacterias productoras de sideróforos
Diversos trabajos han reportado el uso de PGPR, productoras de sideróforos, como biorremediadores en diferentes cultivos (Tabla 1).
Hofmann y colaboradores (2020) evidenciaron la reducción en la concentración de metales pesados en lodos biometálicos y suelos contaminados con Cd, Zn, Ni, Co, Cu, Pb, mediante el tratamiento con Ralstonia metallidurans y Cupriavidus necator productoras de sideróforos [27]. También se reportó que los sideróforos desferrioxamina B, desferrioxamina E y coelichelina, de tipo hidroxamato, producidos por Streptomyces acidiscabies E13 y S. tendae F4 aumentaron la absorción de Al, Cu, Mn, Ni, U y Cd por plantas de judías (Vigna unguiculata) y girasol, reduciendo la formación de radicales libres, lo que impidió la degradación de las auxinas microbianas que promueven el crecimiento vegetal [56, 88]. La inoculación de los aislados Bacillus sp. RJ16, Bacillus sp. Ba32 y B. cereus SRA10, productores de sideróforos, en suelos contaminados de Cd, Pb, Ni y Cr, estimularon el crecimiento de plantas de tomate y mostaza (Brassica juncea) [82].
El cadmio es un contaminante muy extendido con un alto riesgo para el medio ambiente y los seres humanos. Serratia marcescens S27 y P. aeruginosa aislados de suelos contaminado con Cd y productores de sideróforos, mostraron una buena absorción del metal en los ensayos in vitro e in vivo, y un mayor crecimiento en plantas de guisantes (Pisum sativum L) sembradas en suelo contaminado con Cd [102,103]. Aunque el cobre es un elemento esencial, su exceso puede provocar efectos negativos en las plantas y riesgos para la salud pública. La utilización como bioinoculante del complejo B. aerophilus TR15c, productor de sideróforos, y Pseudomonas sp. TR15a productora de la enzima ACC deaminasa, mejora el crecimiento y la acumulación de cobre en girasol [104].
El plomo es un metal pesado no esencial para los seres vivos, que se encuentra en todos los ambientes y no es biodegradable. Por su elevada toxicidad es responsable de graves problemas sanitarios y medioambientales, lo que demanda medidas de remediación adecuadas [105,106]. La producción de pioverdina (P. aeruginosa), azotochelina (A. vinelandii) y schizokinena (B. megaterium) se relacionan con la fijación del plomo y otros metales tóxicos, como el cromo, aluminio y cobre [51, 94]. Otro estudio también evidenció que P. aeruginosa, P. fluorescens y Ralstonia metallidurans, productoras de los sideróforos pioverdina, pioquelina y alcaligelina E, respectivamente, provocan una mayor absorción de Pb y Cr cuando son inoculadas en suelos de cultivos de maíz [56]. Los aislados P. aeruginosa 4EA, P. aeruginosa PAO1 y P. putida KNP9 producen sideróforos pioquelina y pioverdina, que reducen la concentración de Pb2+ en ensayos in vitro y en raíces y brotes de plantas de judías (V radiata) [106,107].
4. Conclusiones
Está demostrado que los microbiomas nativos presentes en los cultivos vegetales contribuyen en el aumento de la supervivencia de las plantas bajo estrés abiótico y biótico, donde las PGPR se utilizan como una tecnología sostenible para promover la productividad de los cultivos, actuando como biofertilizantes, biocontroladores o biorremediadores. Los diferentes mecanismos empleados por las PGPR productoras de sideróforos para controlar la toxicidad ocasionada por la acumulación de metales en el suelo, son los últimos avances en la aplicación de la biorremediación bacteriana de metales pesados en diferentes agrosistemas. En esta revisión se evidencia el efecto benéfico de los sideróforos producidos por las PGPR en el crecimiento de las plantas, mediante la eliminación de la toxicidad en suelo causada por ciertos metales. Sin embargo, se requieren de estudios funcionales que permitan comprender la base molecular de la implicación de los sideróforos bacterianos en la biorremediación. Una estrategia para la promoción de la productividad de los cultivos, es aislar, identificar y evaluar nuevas cepas bacterianas productoras de sideróforos de la rizosfera, para determinar la información genética implicada en la expresión de las características que favorecen el crecimiento de las plantas, y mediante ingeniería genética, generar nuevas aplicaciones biotecnológicas en la agricultura y biorremediación.
















