Introducción
Una de las estrategias más utilizadas en el tratamiento de diversas enfermedades hematológicas es el trasplante de progenitores hematopoyéticos 1)(2. Dentro de las modalidades, según el donante de progenitores, encontramos el autólogo, en donde las células a infundir son del paciente, y el alogénico, en donde las células a infundir son de un donante compatible 3.
El objetivo de esta modalidad de tratamiento es erradicar la enfermedad de base con altas dosis de quimioterapia ± radioterapia, seguido de la infusión de progenitores hematopoyéticos previamente colectados 4.
El mieloma múltiple es la indicación más frecuente de trasplante autólogo, siendo el tratamiento de elección en los pacientes de reciente diagnóstico y sin comorbilidades importantes. En los pacientes con linfomas de Hodgkin y no Hodgkin, así como en aquellos con tumores de células germinales, se considera una opción de elección como terapia de rescate en casos de recaída o refractariedad tras una primera línea de tratamiento, o incluso como consolidación posterior a una primera línea de quimioterapia en pacientes con linfomas del manto y linfomas de alto grado 5)(6.
Posterior a la colecta de células progenitoras, estas deben ser almacenadas mientras el paciente recibe la terapia de acondicionamiento (quimioterapia a altas dosis y/o radioterapia). Tradicionalmente, este almacenamiento se realiza adicionando dimetil sulfóxido a las células colectadas y posteriormente congelándolas a temperaturas entre -190 y -80 grados centígrados 7)(8.
En la actualidad, se ha estudiado y evaluado la posibilidad de almacenar los progenitores hematopoyéticos sin criopreservar, refrigerándolos a una temperatura de 4 °C, con el objetivo de reducir costos, eliminar barreras de acceso, evitar técnicas complejas y disminuir las reacciones adversas.
El presente trabajo de investigación tiene como finalidad profundizar en el conocimiento acerca de las técnicas de trasplante autólogo sin criopreservación, su historia, técnicas de realización, ventajas y desventajas en comparación con la criopreservación estándar.
Se han evaluado los resultados en cuanto a seguridad, eficacia, viabilidad celular, recuperación hematológica, tasa de fracaso, efectos adversos y mortalidad. Se ha encontrado que la refrigeración de las células hematopoyéticas a 4 °C, hasta por 6 días, mantiene un número suficiente y adecuado de progenitores para lograr una completa y rápida reconstitución hematopoyética luego de la administración de dosis mieloablativas de quimioterapia.
Por lo tanto, la técnica de trasplante autólogo sin criopreservación puede ser una alternativa estándar en pacientes con linfomas y mieloma múltiple, siempre que se realice en centros idóneos, con infraestructura y personal médico experto en el manejo de patologías hematooncológicas benignas y malignas, pero que carecen de la capacidad para realizar criopreservación. Los estudios actuales respaldan su eficacia y seguridad.
Metodología
Se realizó una revisión sistemática de la literatura utilizando las siguientes bases de datos:Scopus,MEDLINE/PubMedyClinicalTrials. Se incluyeron ensayos clínicos aleatorizados, revisiones sistemáticas, estudios prospectivos y retrospectivos, sin límite temporal de publicación. Se excluyeron estudios en los que participaron pacientes con patologías distintas a las hematooncológicas o que no cumplieron con los criterios de inclusión previamente definidos.
Las ecuaciones de búsqueda bibliográfica paraPubMedfueron: exp Lymphoma AND Multiple Myeloma AND #1 OR #2 (para PubMed: #1 OR #2) AND exp Cryopreservation AND bone marrow AND peripheral blood #4 OR #6 AND non-cryopreserved AND noncryopreserved AND non-frozen AND Nonfrozen AND #8 OR #11 OR #3 AND #7 AND #12. ParaScopus, la ecuación de búsqueda se definió como: Lymphoma OR Multiple Myeloma AND Cryopreservation OR bone marrow OR peripheral blood AND non-cryopreserved OR noncryopreserved OR non-frozen OR nonfrozen. EnClinicalTrialsse identificaron un total de dos artículos de interés relacionados.
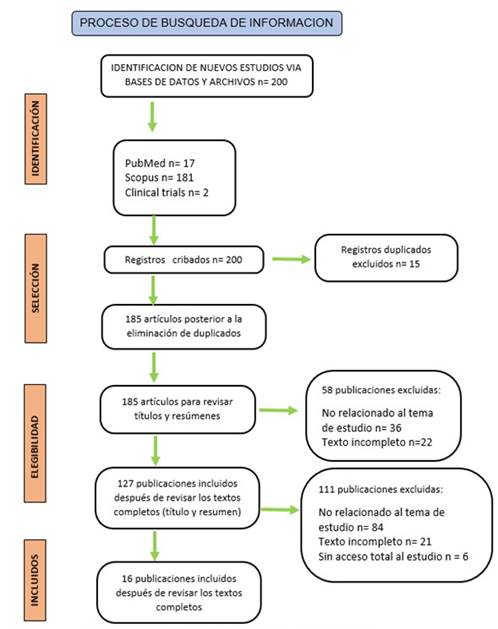
Se obtuvo un total de 200 artículos publicados, los cuales fueron transferidos a la plataformaRayyanpara evaluar duplicados. Se excluyeron 15 publicaciones por duplicación, quedando 185 artículos para continuar el proceso de filtrado. Posteriormente, se excluyeron 58 artículos por no cumplir con los criterios de inclusión en el título y el resumen. Durante el cribado por texto completo, de los 127 artículos restantes, se excluyeron 111 publicaciones. Finalmente, se seleccionaron 16 artículos para realizar la revisión sistemática de la literatura.
Es importante señalar que no se encontraron ensayos clínicos aleatorizados. Las publicaciones seleccionadas incluyen en su mayoría estudios retrospectivos, reportes de experiencias clínicas, revisiones literarias y solo una revisión sistemática, lo que limita significativamente el alcance de la presente revisión (Figura 1).
*Elaboración propia
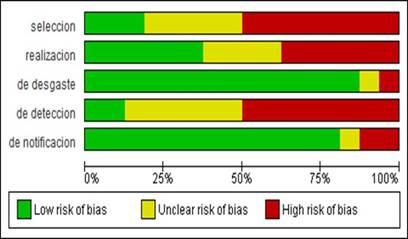
Siguiendo las recomendaciones de la Colaboración Cochrane, se realizó una evaluación del riesgo de sesgo en cada estudio incluido. Los artículos seleccionados bajo el modelo PRISMA (Figura 1) fueron evaluados mediante el softwareRevMan. Este software, desarrollado por la Colaboración Cochrane, permite analizar el sesgo según los siguientes criterios: sesgo de realización, sesgo de selección, sesgo de detección, sesgo de desgaste y sesgo de notificación.
Con base en estos cinco criterios, se determinó si cada estudio tenía un riesgo de sesgo alto, poco claro o bajo. Cada artículo fue evaluado por los investigadores, quienes adjuntaron una justificación detallada para cada calificación asignada (Figuras 2 y 3).
*Elaboración propia
*Elaboración propia
Resultados
1. Características de la población de los estudios publicados:
La población objetivo está compuesta por adultos, en su mayoría con mieloma múltiple. La edad promedio en los estudios de mayor tamaño no está reportada, así como tampoco el género de los participantes. En un estudio no se informó la media de edad, pero la población fue muy específica, incluyendo tanto pacientes con linfoma como con mieloma múltiple. Cabe destacar que toda la población estudiada es mayor de 30 años, lo cual demuestra la ausencia de población pediátrica (Tabla 1).
2. Características del almacenamiento no criopreservado y porcentaje de viabilidad:
La temperatura promedio de almacenamiento sin criopreservar fue de 4 °C, definida como óptima. El período de almacenamiento varió entre 2 y 6 días, sin afectar la viabilidad celular (1,4).
3. Estancia hospitalaria:
Seis publicaciones reportaron un promedio de 16,8 días de hospitalización para pacientes sometidos a trasplante autólogo sin criopreservación. En un estudio (9), la estancia hospitalaria post-reinfusión de progenitores no criopreservados fue mayor, con 22 días, en comparación con otra publicación (10), donde solo se requirieron 10 días de hospitalización tras la reinfusión de progenitores.
4. Días de injerto mieloide y plaquetario según la clasificación por estudio:
Para el injerto mieloide:
Muestra completa: media de 15,8 días.
Dividido por mieloma y linfoma: 10 días para mieloma y 12,5 días para linfoma.
Dividido por criopreservado y no criopreservado: 16,5 días para criopreservado y 9,5 días para no criopreservado.
Para el injerto plaquetario:
Muestra completa: media de 29,5 días.
Dividido por mieloma y linfoma: 11 días para mieloma y 13,5 días para linfoma.
Dividido por criopreservado y no criopreservado: 17 días para criopreservado y 15,5 días para no criopreservado.
5. Efectos adversos presentados post-infusión de derivados autólogos no criopreservados:
El efecto adverso más frecuente fue la mucositis (grado no especificado), seguida de neutropenia febril y, con menor frecuencia, síntomas gastrointestinales como náuseas, vómitos y diarrea (Tabla 2). Un estudio reportó infecciones secundarias a la neutropenia, y otro describió un caso de falla ventilatoria (13).
6. Mortalidad y supervivencia asociadas o no al trasplante de derivados autólogos no criopreservados:
Los reportes sobre mortalidad y supervivencia indican que un estudio (11) informó 60 muertes a los 100 días postransfusión, mientras que, en una publicación posterior (11), se registraron 17 muertes a los 30 días postransfusión, con una tasa de supervivencia que superó la mortalidad entre 46 pacientes. Otro estudio (12) registró 2 muertes a los 30 días postransfusión, mientras que la tasa de supervivencia fue de 112 pacientes. En otro análisis (9), no se reportaron muertes asociadas a la transfusión de derivados autólogos no criopreservados; al contrario, se informó una mayor supervivencia. Por último, un estudio adicional (13) reportó una mortalidad asociada al trasplante del 2 %. (Tabla 3).
La media del porcentaje de mortalidad a los 30 días fue del 2,84 % (rango: 2-3), reportada en cuatro estudios (1,13,17,21).Por otro lado, la media de mortalidad a los 100 días fue del 19,41 % (rango: 2-27)
Tabla 1 Características de la población de los estudio publicados

*NO CRIO: trasplante autólogo con progenitores refrigerados, no crio preservados, CRIO: trasplante autólogo con progenitores previamente crio preservados
*Elaboración propia
Tabla 2 Eventos adversos asociados al trasplante
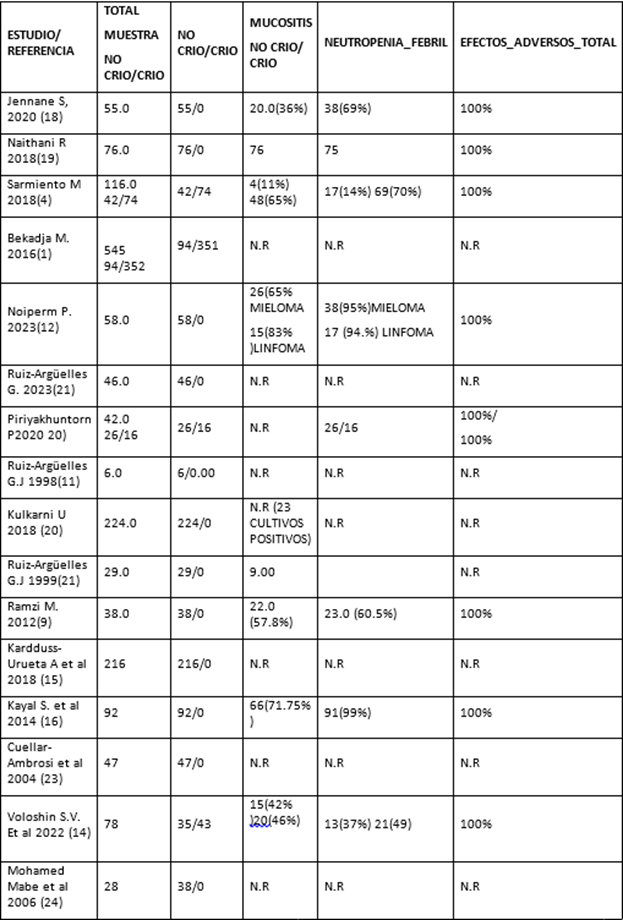
*NO CRIO: trasplante autólogo con progenitores refrigerados, no crio preservados, CRIO: trasplante autólogo con progenitores previamente crio preservados, N.R: No reportado
*Elaboración propia
Tabla 3 Dia del injerto, supervivencia y mortalidad asociada al trasplante

*NO CRIO: trasplante autólogo con progenitores refrigerados, no criopreservados, CRIO: NO CRIO: trasplante autólogo con progenitores refrigerados, no criopreservados, CRIO trasplante autólogo con progenitores previamente criopreservados, N.R: No reportado, N.A. No aplica, MRT #(%): Mortalidad
*Elaboración propia
Discusión
A pesar de los datos positivos reportados, es importante resaltar que en esta revisión sistemática no se encontraron ensayos clínicos aleatorizados que compararan los métodos de conservación de progenitores hematopoyéticos autólogos criopreservados y no criopreservados. Además, se excluyó un mayor número de artículos de los que fue posible incluir.
La viabilidad media documentada de los productos no criopreservados se encuentra entre el 85 % y el 96 %, mientras que la de los criopreservados oscila entre el 93,5 % y el 95 %. Sin embargo, muchos estudios no reportaron datos de viabilidad. A pesar de que algunos estudios indicaron un alto porcentaje de viabilidad, incluso superior al observado con las técnicas tradicionales de criopreservación 4, en la mayoría de los casos hubo limitaciones en el acceso a la información. Adicionalmente, la gran mayoría de los estudios no compararon ambas técnicas, sino que se limitaron a reportar experiencias de casos donde no se empleó la criopreservación. Esto evidencia la falta de datos, lo cual genera cierto grado de sesgo de información que podría derivar en resultados no confiables.
La mayoría de los estudios incluidos fueron retrospectivos, aunque también hubo algunos prospectivos con muestras previamente seleccionadas, donde no se llevó a cabo un proceso de aleatorización para recibir la intervención. Además, en muchos casos se desconoce la aplicación del cegamiento, tanto en los participantes como en los investigadores, en relación con la intervención de interés.
Dentro de los aspectos positivos, se destaca el bajo riesgo de sesgo en el reporte de los resultados finales y en el sesgo de desgaste, ya que más del 70 % de las publicaciones indicaron que la muestra de la población no se vio afectada por abandono, y los resultados fueron presentados en su totalidad.
La mortalidad relacionada con el trasplante, el tiempo de estancia hospitalaria, la reconstitución hematológica, los eventos adversos y el fallo del injerto fueron similares en los grupos analizados. Además, los costos fueron menores en los procedimientos sin criopreservación. No obstante, es necesario realizar más estudios para corroborar estos hallazgos.
Conclusiones
El trasplante autólogo de progenitores hematopoyéticos sin criopreservar es una alternativa factible y segura, especialmente en instituciones con recursos limitados.
Los estudios analizados han reportado resultados positivos en cuanto a viabilidad, tiempo de reconstitución hematológica, eventos adversos, días de estancia hospitalaria y mortalidad temprana.
La temperatura de almacenamiento ideal es de 4 °C, permitiendo la conservación de los progenitores hasta por 6 días y manteniendo una viabilidad promedio no inferior al 90 %. El tiempo promedio de reconstitución hematológica es similar al evidenciado en los productos criopreservados. En un estudio, este tiempo fue incluso menor (14); sin embargo, en otros, se observó un tiempo mayor de recuperación hematológica 1)(4)(10. Es destacable que, a pesar de este tiempo prolongado de recuperación, los días de estancia hospitalaria fueron menores en los estudios que utilizaron progenitores no criopreservados 4)(10.
Los eventos adversos más frecuentes tras la infusión fueron la mucositis y la neutropenia febril. No se encontró evidencia que relacione la incidencia de eventos adversos con algún método específico de almacenamiento de progenitores. La mortalidad relacionada con el trasplante fue similar en ambos grupos y significativamente menor en los estudios más recientes.
En conclusión, el almacenamiento a corto plazo de progenitores hematopoyéticos autólogos a una temperatura de 4 °C es una práctica segura y efectiva. Este método logra una reconstitución hematológica dentro del tiempo promedio observado en pacientes que reciben progenitores criopreservados. En contraste, los costos asociados a la refrigeración son significativamente menores que los de la criopreservación. Además, al evitar esta última, se eliminan las posibles complicaciones y efectos tóxicos relacionados con la administración de dimetilsulfóxido durante la reinfusión. Asimismo, se reducen los costos económicos derivados de los procesos de criopreservación, congelación, almacenamiento y descongelación de células progenitoras.
Esta técnica representa una alternativa viable para centros con recursos económicos limitados, que no cuenten con la infraestructura necesaria para crioconservación, pero que dispongan de personal capacitado y de infraestructura adecuada para manejar patologías hemato-oncológicas y sus complicaciones. Esto podría mejorar significativamente el acceso a esta terapia para un mayor número de pacientes.