Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.1 Santa Marta Jan./June 2021 Epub Sep 18, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.1.1084
Artículos de Investigación
Seguimiento al estado de las poblaciones de once peces óseos y cartilaginosos en el Santuario de Fauna y Flora Malpelo, Pacífico colombiano
1Fundación Malpelo y Otros Ecosistemas Marinos, Bogotá, Colombia.
2Fundación Malpelo y Otros Ecosistemas Marinos, Bogotá, Colombia. chaquea2896@gmail.com
3Fundación Malpelo y Otros Ecosistemas Marinos, Bogotá, Colombia. faunamarina@fundacionmalpelo.org
4Fundación Malpelo y Otros Ecosistemas Marinos, Bogotá, Colombia. n.velez858@gmail.com
5Fundación Malpelo y Otros Ecosistemas Marinos, Bogotá, Colombia. sbessudo@fundacionmalpelo.org
To determine trends over time in the relative abundance of species prioritized in the Malpelo Fauna and Flroa Sanctuary Management Plan, underwater visual censuses were done from April 2009 to August 2019. Data were collected for five species of bonefish: bluefin trevally (Caranx melampygus), longfin yellowtail (Seriola rivoliana), yellowfin tuna (Thunnus albacares), leather bass (Dermatolepis dermatolepis) and sailfin grouper (Mycteroperca olfax), and six cartilaginous fish: spotted eagle ray (Aetobatus laticeps), silky shark (Carcharhinus falciformis), Galapagos shark (Carcharhinus galapagensis), whitetip reef shark (Triaenodon obesus), whale shark (Rhincodon typus) and scalloped hammerhead shark (Sphyrna lewini). A negative non-significant trend in abundance through time was observed for most of the evaluated species, except A. laticeps and T. obesus, which showed positive non-significant trends. The hammerhead shark (S. lewini) was the only species that showed a statistically significant decrease in abundance over time. The results of this study highlight the urgent need to establish more effective fisheries management and regulation measures that promote the conservation of important fish species, not just inside the sanctuary but also within the Tropical Eastern Pacific.
KEYWORDS: Marine protected area; Relative species abundance; Frequency of observation; Tropical Eastern Pacific.
Con el objetivo de determinar tendencias en la abundancia relativa a través del tiempo para especies priorizadas dentro del Plan de Manejo del Santuario de Fauna y Flora Malpelo, se realizaron censos visuales submarinos (CVS) entre abril de 2009 y agosto de 2019. Se colectaron datos para cinco especies de peces óseos: jurel azul (Caranx melampygus), bravo (Seriola rivoliana), atún aletiamarillo (Thunnus albacares), cherna (Dermatolepis dermatolepis) y mero (Mycteroperca olfax), y seis especies de peces cartilaginosos: raya águila (Aetobatus laticeps), tiburón sedoso (Carcharhinus falciformis), tiburón de Galápagos (Carcharhinus galapagensis), tiburón aletiblanco de arrecife (Triaenodon obesus), tiburón ballena (Rhincodon typus) y tiburón martillo (Sphyrna lewini). En términos generales, se observó una tendencia negativa no significativa en la abundancia relativa a través del tiempo para la mayoría de las especies evaluadas, exceptuando A. laticeps y T. obesus, las cuales mostraron tendencias positivas no significativas. El tiburón martillo (S. lewini) fue la única especie que mostró una disminución estadísticamente significativa de su abundancia a través del tiempo. Los resultados de este estudio evidencian la necesidad apremiante de establecer medidas más eficientes de manejo y de regulación pesquera, que promuevan la conservación de especies importantes de peces no sólo dentro del santuario sino a lo largo del Pacífico Oriental Tropical.
PALABRAS CLAVE: Área marina protegida; Abundancia relativa; Frecuencia de observación; Pacífico Oriental Tropical.
INTRODUCCIÓN
Los peces óseos y cartilaginosos son organismos clave en los ecosistemas que habitan, ya que juegan papeles importantes y únicos que permiten mantener las relaciones tróficas estables y representan un indicador de la salud del ecosistema (Jennings y Kaiser, 1998; Navia et al., 2017). Al eliminar estas especies se puede generar un desequilibrio importante, impacto que puede extenderse a otras especies y, por ende, provocar el colapso de todo el ecosistema (Navia et al., 2007, 2012, 2016; Bornatowski et al., 2014; Dulvy et al., 2014). Particularmente, los peces cartilaginosos o elasmobranquios (tiburones y rayas) poseen características que los hace un grupo especialmente vulnerable comparado con algunos peces óseos (Stevens et al., 2000; Myers y Worm, 2005), ya que presentan un ciclo de vida lento y poco resiliente (Bonfil, 1997; Lucifora, 2003; Ladino, 2014).
Existe un consenso a nivel mundial sobre el aumento en la degradación de los ecosistemas marinos y el colapso de la mayoría de las poblaciones de peces, principalmente debido a la sobreexplotación pesquera (Dulvy et al., 2014; White et al., 2015). Según un informe de las Naciones Unidas, la pesca ilegal y no reglamentada, sumada a los efectos de la creciente acidificación de los océanos, cambio climático y el aumento de la eutrofización, representan las mayores amenazas para las especies marinas; dicho informe resalta que la fracción de los stocks pesqueros biológicamente sostenibles ha disminuido de 90 % a 66,9 % entre 1974 y 2015 (United Nations, 2019). A pesar de esta crítica situación, los países suelen tener dificultades a la hora de tomar acciones concretas de conservación, debido a la falta de información acerca de las tendencias en el estado de las poblaciones de especies vulnerables y a la deficiencia en el establecimiento de regulaciones pesqueras. Es por este motivo que una de las estrategias más comunes que se ha desarrollado para la conservación de estas especies son las áreas marinas protegidas (AMP) (Graham et al., 2003). Esta medida de conservación consiste en establecer legalmente sectores con diversos propósitos, entre los cuales se pueden destacar la protección de especies y hábitats marinos, la restauración de reservas pesqueras y la administración de actividades turísticas (Pomeroy, 2007). Se ha demostrado que en estas AMP la diversidad y biomasa de grandes peces suelen ser superiores a las de zonas aledañas, dependiendo de factores del AMP tales como tamaño, antigüedad y tipo de protección (Edgar, 2011; Edgar et al., 2014). Inclusive son numerosos los casos donde los beneficios son percibidos por las comunidades colindantes, pues el denominado “efecto rebose” fomenta el flujo de peces desde la AMP hasta las zonas aledañas, donde pueden ser aprovechados sosteniblemente (Graham et al., 2003; Grüss et al., 2011; Graham y McClanahan, 2013; Stuart-Smith et al., 2013).
El Santuario de Fauna y Flora Malpelo (SFF Malpelo) es un AMP de gran importancia a nivel regional, pues representa un punto de conectividad entre ecosistemas costeros y oceánicos. Adicionalmente, hoy en día es mundialmente reconocida por albergar una gran diversidad y abundancia de organismos marinos, entre los que se destacan particularmente los grandes cardúmenes de tiburón martillo (Sphyrna lewini) y tiburón sedoso (Carcharhinus falciformis). Esta AMP, junto con La Reserva Natural de Galápagos (Ecuador), el Parque Nacional Isla del Coco (Costa Rica), el Parque Nacional Natural Gorgona (Colombia) y el Parque Nacional Coiba (Panamá), componen el Corredor Marino del Pacífico Oriental Tropical (CMAR), iniciativa que busca promover el aprovechamiento sostenible de la diversidad biológica en el área alrededor de estas AMP (CMAR, 2015).
Lamentablemente, alrededor del mundo la mayoría de las AMP carecen de datos periódicos o registros históricos que permitan conocer el impacto a largo plazo sobre las especies y ecosistemas que estas áreas pretenden proteger (Barnett et al., 2012). Esto es debido a limitaciones económicas y logísticas que tienden a incrementarse en islas oceánicas como Malpelo. No obstante, en el SFF Malpelo se ha logrado realizar monitoreos anuales de su fauna con el fin de establecer sus tendencias poblacionales. En el presente estudio se evalúan y discuten los valores de abundancia relativa y frecuencias de observación para once especies de peces monitoreadas durante once años (2009 - 2019). Las especies monitoreadas fueron: el jurel azul (Caranx melampygus), el bravo (Seriola rivoliana), el atún aletiamarillo (Thunnus albacares), la cherna (Dermatolepis dermatolepis), el mero (Mycteroperca olfax), la raya águila (Aetobatus laticeps), el tiburón sedoso (Carcharhinus falciformis), el tiburón de Galápagos (Carcharhinus galapagensis), el tiburón aletiblanco de arrecife (Triaenodon obesus), el tiburón ballena (Rhincodon typus) y el tiburón martillo (Sphyrna lewini). Los resultados de este estudio serán útiles para evaluar y mejorar la efectividad del manejo y las medidas de conservación actuales de estas poblaciones en el SFF Malpelo.
ÁREA DE ESTUDIO
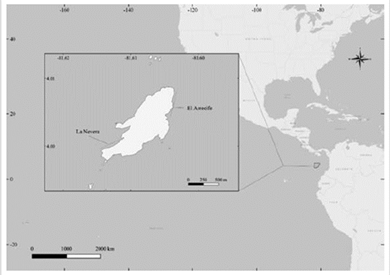
El SFF Malpelo posee actualmente 2´709 600 ha de extensión, dentro de las cuales la Isla de Malpelo (4 °0 ‘N, 81°36’W) es la única parte emergida. Malpelo se encuentra en el Pacífico Oriental Tropical (POT) a 490 km de la costa colombiana de Buenaventura (Figura 1). La isla está rodeada por once pináculos y tiene una extensión de 1,2 km2, siendo la cima de una cordillera submarina que se eleva desde los 4 000 m de profundidad (Keisser y Hoffman, 1975; Caita y Guerrero, 2000). En cuanto a sus condiciones oceanográficas, existen cuatro corrientes que influyen en Malpelo: la Contracorriente Ecuatorial del Norte, la Contracorriente Ecuatorial del Sur, la Corriente de Colombia y la Corriente Ciclónica de Panamá. Debido a sus interacciones, es posible diferenciar dos épocas claras: una de aguas frías y otra de aguas cálidas. La primera va de enero a abril, presentando temperaturas superficiales de alrededor de 23 °C, mientras que la época de aguas cálidas va de mayo a diciembre, cuando en promedio las temperaturas están alrededor de 27 °C (Rodríguez-Rubio y Giraldo, 2011).
MATERIALES Y MÉTODOS
Fase de campo
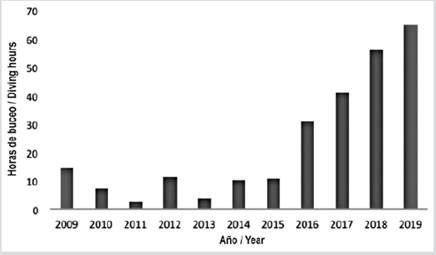
Los datos usados en el estudio provienen de los censos visuales submarinos (CVS) desarrollados por el grupo de monitoreo de peces del SFF Malpelo, en inmersiones de alrededor de 60 minutos entre 2009 y 2019. Estos censos fueron hechos por buzos previamente entrenados para la identificación de fauna del Santuario, registrando la abundancia de algunas especies priorizadas como Valores Objeto de Conservación (VOC), la zona de muestreo, la fecha, la hora, la temperatura, la visibilidad y el tiempo de buceo (Schmitt et al., 2002; Auster et al., 2005). Durante las inmersiones los datos fueron tomados siempre por el buzo más experimentado y fueron sus conteos los que se tuvieron en cuenta para registrar en los censos respectivos con el propósito de evitar sobre estimaciones. A pesar de que en Malpelo existen 32 sitios de buceo, en cada salida solo es posible monitorear entre 5-7 de ellos. Condiciones como las fuertes corrientes y el oleaje del área hacen que estas zonas monitoreadas sean altamente variables y dependientes de las condiciones climáticas de cada día. Más del 75 % de los monitoreos de cada expedición fueron realizados en los sitios conocidos como El Arrecife y La Nevera (Figura 1), que son las zonas más protegidas del oleaje y las más biodiversas, ya que en ellas se han observado las mayores formaciones coralinas del área y numerosas estaciones de limpieza. Los recorridos en El Arrecife y en La Nevera siempre son los mismos, variando únicamente la dirección según la corriente. Por lo anterior, en el presente estudio solo fueron utilizados y analizados los datos de estos dos sitios de buceo. El esfuerzo de muestreo, representado en horas de buceo por año, ha aumentado en los últimos años (Figura 2) debido a que, en adición a las expediciones científicas, el sector turístico realizó viajes de ciencia ciudadana, permitiendo que los investigadores aumentaran el número de inmersiones en los últimos cuatro años y así obtener datos valiosos.
Procesamiento de datos
En primer lugar, se seleccionaron las once especies de interés basados en el Plan de Manejo del SFF Malpelo. La matriz de datos fue filtrada hasta obtener solo los datos de El Arrecife y La Nevera.
Para cada año se obtuvo la frecuencia de observación con el propósito de evaluar variaciones en la probabilidad de avistamiento de las especies de interés. Para ello se contó el número de inmersiones realizadas y el porcentaje que representaron los buceos en los cuales el conteo de individuos fue mayor a cero, es decir en los que hubo avistamiento.
Para el cálculo de abundancia relativa (individuos avistados/hora de buceo) se tuvo como base el número de individuos observados dividido en el tiempo de buceo en horas (Soler et al., 2013). Posteriormente, se promediaron los datos de El Arrecife y La Nevera para cada especie y se obtuvo un dato de abundancia relativa por expedición. Para cada año, se promediaron por separado los datos de las expediciones realizadas durante época cálida y época fría debido a las grandes oscilaciones en abundancia que presentan varias especies dependiendo de la época. En este sentido, el valor de abundancia relativa registrado para cada año de muestreo corresponde a un promedio entre épocas cálida y fría.
Con el fin de examinar las tendencias de las poblaciones a lo largo del tiempo, se graficó la abundancia relativa anual de cada especie durante los once años de recolección de datos y para el análisis estadístico se realizó una prueba de regresión lineal entre las abundancias y los años, siempre teniendo un N=11 por los once años de muestreo. Para la interpretación de los resultados se tuvieron en cuenta los hábitos y distribución de las especies evaluadas. Las especies se separaron en tres grupos: 1) peces asociados al arrecife, 2) especies altamente pelágicas y móviles de difícil monitoreo, y 3) especies de elasmobranquios que son comunes y con algún grado de residencia dentro del santuario.
RESULTADOS Y DISCUSIÓN
La abundancia de todas las especies fue altamente variable entre los años, en contraste con la frecuencia de observación que fue más estable (Figuras 3, 4 y 5). En general se observaron tendencias negativas, aunque no significativas, en la abundancia relativa de las especies evaluadas a través del tiempo, exceptuando a Aetobatus laticeps y Triaenodon obesus, las cuales mostraron tendencias positivas (Figura 5a, c).
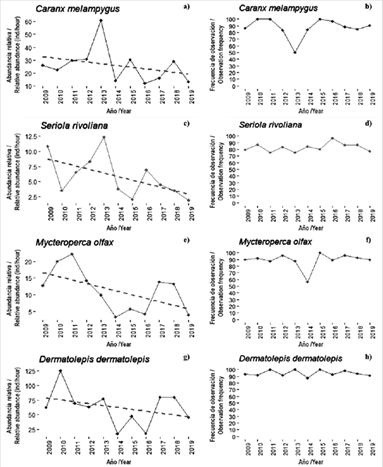
Figura 3 Abundancia relativa promedio (individuos/horas de buceo) y frecuencia de avistamientos entre 2009 - 2019 para C. melampygus, S. rivoliana, M. olfax y D. dermatolepis en el SFF Malpelo.
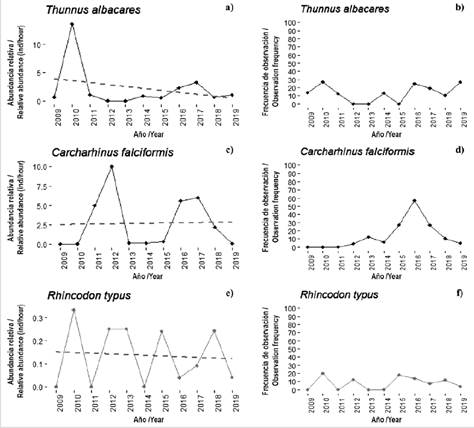
Figura 4 Abundancia relativa promedio (individuos/horas de buceo) y frecuencia de avistamientos entre 2009 - 2019 para T. albacares, C. falciformis y R. typus en el SFF Malpelo.
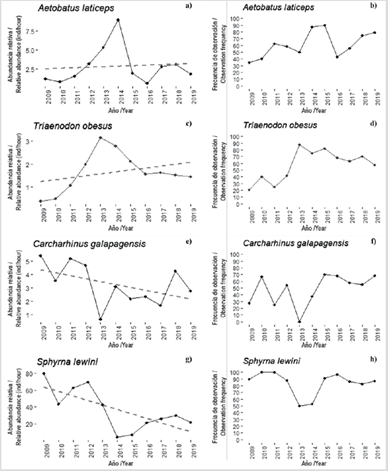
Figura 5 Abundancia relativa promedio (individuos/horas de buceo) y frecuencia de avistamientos entre 2009 - 2019 para A. laticeps, T. obesus, C. galapagensis y S. lewini en el SFF Malpelo.
Los peces asociados al arrecife y con hábitos gregarios mostraron una tendencia a disminuir su abundancia a través de los años, pero esta no fue significativa en ningún caso S. rivoliana (r = -0,534, P = 0,09), M. olfax (r = -0,475, P = 0,140), C. melampygus (r = -0,271, P = 0,419 y D. dermatolepis (r = -0,275, P = 0,413). No obstante, todas las especies en este grupo tuvieron frecuencias de observación de más del 80 % en la mayoría de los años (Figura 3b, d, f, h), las cuales pueden ser explicadas por el uso que estas especies hacen de los arrecifes. Por ejemplo, especies como C. melampygus, D. dermatolepis, S. rivoliana y M. olfax forman agregaciones alimenticias siguiendo la actividad de forrajeo y caza de otras especies como la morena Gymnothorax dovii (Quimbayo et al., 2014). Estas asociaciones interespecíficas, sumado a la búsqueda de refugio, sugieren que es importante su asociación con las formaciones coralinas de Malpelo, razón por la cual se mantienen los avistamientos constantes en estos sitios de buceo. Estas especies son observadas constantemente asociadas a las formaciones coralinas en Malpelo en sus estadíos de juvenil y adulto, pero se desconoce su comportamiento larvario y se presume que las larvas conectan a las poblaciones de Malpelo con las de otras áreas dentro del POT gracias a corrientes que las dispersan (Wood et al., 2016). En zonas aledañas como Galápagos, poblaciones de M. olfax han registrado cambios significativos en la presencia y talla de grandes individuos reproductivos, exponiendo la sobre explotación que sufre esta especie a nivel local (Usseglio et al., 2016). Considerando que estas especies habitan el CMAR y sus distribuciones incluyen áreas marinas fuera del SFF Malpelo, la tendencia de disminución en sus abundancias relativas podría reflejar las presiones que sufren las poblaciones a nivel regional.
En contraste, T. albacares mostró abundancias relativas muy bajas, poco fluctuantes (excepto por un pico en 2010) y una tendencia negativa, aunque no significativa (r = -0,270, P = 0,422). Adicionalmente, la frecuencia de observación varió entre 0 y 30 % a través de los años (Figura 4a, b). El pico observado en 2010 puede explicarse por la presencia de un cardumen mientras se realizaba el censo. Las metodologías para cuantificar individuos de esta especie son limitadas y requieren de esfuerzos adicionales que se salen del alcance de este estudio. Esto es debido, en primer lugar, a que se trata de una especie de pez netamente pelágica que no frecuenta las zonas donde se realizaron los buceos. En segundo lugar, su condición de especie altamente migratoria, que viaja en grupos de cientos o miles de ejemplares (Lan et al., 2013, Bessudo y Lefèvre, 2017), hace que sea una especie difícil de monitorear y cuyos conteos son poco precisos por la dificultad de cuantificar individuos en grupos tan numerosos.
Limitaciones similares a las anteriores se encontraron al monitorear el tiburón sedoso (Carcharhinus falciformis), especie para la cual no se observó una tendencia significativa (r = 0,210, P = 0,535; Figura 4c). Se observó con una frecuencia que no superó 30 %, excepto en el año 2016 cuando alcanzó valores cercanos al 60 % (Figura 4d). Dichos resultados son poco concluyentes y deben ser examinados con cautela teniendo en cuenta la dificultad de monitorear especies como esta, con hábitos oceánicos que además no es residente de Malpelo y presenta alta movilidad en grupos muy numerosos, difíciles de contar. Es importante resaltar que los grandes cardúmenes suelen ser observados exclusivamente entre mayo y octubre (Bessudo y Lefèvre, 2017) y no suelen acercarse a las zonas como El Arrecife y La Nevera, sino que frecuentan un bajo al norte de Malpelo conocido como El Acuario, que no fue incluido dentro del estudio por las condiciones de buceo que lo hacen un lugar complejo para la toma de datos.
Especies altamente móviles como el tiburón ballena (Rhincodon typus) son también difíciles de monitorear. En el presente estudio su abundancia relativa fue altamente fluctuante, sin tendencias significativas (r = -0,068, P = 0,843) y con una frecuencia de observación muy baja, siendo siempre menor al 20% (Figura 4e, f). En Malpelo se pueden observar ocasionalmente individuos solitarios y de paso que residen entre una y dos semanas entre junio y septiembre (Bessudo et al., 2016). Los resultados reflejan una abundancia baja y variable con una frecuencia de observación que es también consistentemente baja. Esto podría ser explicado por el hecho de que es una especie solitaria, pelágica y migratoria.
Por otro lado, se observaron tendencias ligeramente positivas no significativas en las abundancias relativas de poblaciones de A. laticeps (r = 0,075, P = 0,827) y T. obesus (r = 0,329, P = 0,323), acompañadas de un aumento en la frecuencia de observación (Figura 5 a, b, c, d). Tanto la raya águila como el tiburón aletiblanco de arrecife son en Malpelo especies con hábitos solitarios o de agregaciones poco numerosas (Bessudo y Lefèvre, 2017). Aetobatus laticeps tiende a alcanzar la madurez sexual relativamente temprano en comparación con otros elasmobranquios (Schluessel et al., 2010) y a pesar de ser la raya más común de Malpelo, hasta la fecha no se han realizado estudios de movilidad y distribución de la especie dentro del AMP. Sin embargo, se ha planteado la hipótesis de que podría ser residente con base en avistamientos durante todo el año y registros de individuos en todos sus estadios de desarrollo, incluso se han documentado hembras teniendo crías (Bessudo y Lefévre, 2017). Así mismo, T. obesus es uno de los tiburones más comunes en los ecosistemas de coral del POT y con tendencia a la filopatría (Randall, 1977; Peñaherrera et al., 2012; Mejía-Falla et al., 2014). Estudios con telemetría acústica han revelado altos periodos de permanencia dentro del AMP y, de hecho, es probable que tenga todo su ciclo de vida dentro del santuario, pues se han observado en todos sus estadios de vida (Ladino et al., 2016). En un estudio anterior se reportaron comportamientos estables para estas dos especies (Soler et al., 2013), por lo que estos registros, sumados a los aumentos sutiles que se han registrado en cuanto a abundancia relativa y frecuencia de encuentro en ambas especies, sugieren que Malpelo podría representar un lugar clave en la recuperación y posible reproducción de estas especies.
El tiburón de Galápagos (Carcharhinus galapagensis), a pesar de mostrar una frecuencia de observación altamente fluctuante (Figura 5e, f), presentó una tendencia negativa no significativa en su abundancia relativa (r = -0,472, P = 0,143). En Malpelo suele ser común encontrárselo durante todo el año en pequeños grupos de menos de tres individuos, aunque ocasionalmente se han visto congregaciones de hasta 40 individuos en frenesí reproductivo (Bessudo y Lefèvre, 2017). Los resultados sugieren que durante los buceos es alta la probabilidad de encontrarse con individuos de esta especie, aunque con el paso de los años parece que estos encuentros son con grupos cada vez más pequeños. Es importante tener en cuenta la movilidad de esta especie al evaluar los datos obtenidos, se ha postulado que su ámbito doméstico es menor a 150 km2 (Kohler y Turner, 2001; Holzwarth et al., 2006; Meyer et al., 2010) y algunos animales marcados con telemetría satelital y acústica mostraron amplios periodos de residencia (Ladino et al., 2016), aunque también se han registrado algunas migraciones hacia otras islas del CMAR. Estos movimiento se realizan probablemente con fines reproductivos, ya que no se han registrado individuos de tamaños menores a los 120 cm dentro del Santuario y además Malpelo carece de ecosistemas como costas y estuarios que sirvan de áreas de crianza (Ladino et al., 2016). Estas movilizaciones fuera de las AMP podrían considerarse un factor de riesgo en el cual los grupos de tiburones se exponen a peligros como la pesca, la cual podría causar disminuciones en sus poblaciones.
La especie bandera del santuario, el tiburón martillo (Sphyrna lewini), fue la única especie evaluada que presentó una disminución significativa en su abundancia relativa (r = -0,689, P = 0,019), con una dismunición de 73,3 % entre 2009 y 2019 (Figura 5g). No obstante, su frecuencia de observación se mantuvo por encima de 80 % (excepto en 2013 y 2014; Figura 5h), lo que quiere decir que en general esta especie se observa muy frecuentemente, pero en grupos que han reducido su número preocupantemente a través de los años. Estos resultados son coherentes con lo reportado en otras islas del CMAR. Por ejemplo, en las islas Galápagos, la abundancia de tiburones martillo disminuyó 50 % entre 1985 y 2015 (Peñaherrera-Palma et al., 2017), y en la isla del Coco se reportó una disminución en la abundancia de alrededor de 43 % entre 1993 y 2013 (Nalesso, 2014; White et al., 2015). Así mismo, en Australia el Departamento de Agricultura de Queensland reportó un descenso poblacional de 73 % entre 2005 y 2016. Esta crítica situación está relacionada con los grandes rangos de movimiento de esta especie. Los estudios de telemetría en la región han demostrado que los tiburones martillo se mueven por todo el POT, entre las islas oceánicas (Bessudo et al., 2011), los montes submarinos (Chávez et al., 2020) y las zonas costeras para tener a sus crías (Quintanilla et al., 2015; Salinas-de-León et al., 2017; Bessudo y Ladino, 2019; Zanella et al., 2019). Esto resalta la necesidad de implementar corredores biológicos protegidos entre las islas del POT (Grüss et al., 2011; Migramar, 2016) y la importancia de identificar y proteger las áreas de crianza de las especies.
CONCLUSIONES
En general se observaron tendencias negativas no significativas en la abundancia relativa de las especies evaluadas, exceptuando a Aetobatus laticeps y Triaenodon obesus, los cuales mostraron tendencias positivas no significativas.
No se observaron variaciones significativas en las abundancias relativas de especies que aparentemente pasan su ciclo de vida completo en el santuario, lo que puede responder a que Malpelo es un AMP que ha aplicado medidas de manejo como la prohibición de la pesca, la ampliación de su área y el fortalecimiento del control y vigilancia, que tienen como objetivo detener el deterioro de las poblaciones dentro del área.
Por otro lado, se evidencia un declive significativo en las poblaciones de tiburón martillo, probablemente asociado al hecho de tener ámbitos domésticos muy amplios que sobrepasan los límites de las AMP (Costa et al. 2012). Los resultados dejan en evidencia la importancia de mantener un monitoreo a largo plazo en un ecosistema como el de Malpelo, pues a pesar de estar alejado de las actividades humanas, no es ajeno al impacto que dichas actividades están generando en el océano. Además, expone la necesidad de proteger a las especies marinas más allá de las fronteras del AMP, trabajando conjuntamente en la conectividad de la región y las regulaciones pesqueras de las zonas aledañas.
AGRADECIMIENTOS
El proceso de protección del SFF Malpelo se ha logrado gracias al apoyo de múltiples aliados, dentro de los cuales se encuentran diversas organizaciones, institutos y personas. Queremos agradecer particularmente el apoyo brindado por Parques Nacionales Naturales de Colombia, Fondo para la Acción Ambiental y la Niñez, Conservación Internacional, Biodiversity Conservation Colombia, Nausicaá, Fundación Príncipe Alberto II de Mónaco, Gobierno y Armada Nacional de Colombia, y a la tripulación de las Motonaves María Patricia, Ferox y Seawolf. Finalmente, queremos destacar a Colombia Dive Adventures por su apoyo en las campañas de ciencia ciudadana
REFERENCIAS
Auster P., B. Semmens and K. Barber. 2005. Pattern in the cooccurrence of fishes inhabiting the coral reefs of Bonaire, Netherlands Antilles. Environ. Biol. Fishes, 74: 187-194. [ Links ]
Bessudo, S. y F. Ladino 2019. Identificación de áreas de crianza del tiburón martillo (Sphyrna lewini) en el Pacífico colombiano. Inf. Final, Fundación Malpelo y Otros Ecosistemas Marinos. Bogotá, 19 p. [ Links ]
Bessudo, S e I. Lefèvre. 2017. Guía de peces isla Malpelo. Bogotá. 360 p. [ Links ]
Bessudo, S., G. A Soler, A.P Klimley, J. T. Ketchum, A. Hearn and R. Arauz. 2011. Residency of the scalloped hammerhead shark (Sphyrna lewini) at Malpelo Island and evidence of migration to other islands in the Eastern Tropical Pacific. Environ. Biol. Fishes, 91(2): 165-176. [ Links ]
Bessudo. S., F. Ladino., L. Quintero., G. Soler., P. Salinas y M. Hoyos. 2016. Resultados preliminares sobre los patrones de movimiento de los tiburones ballena (Rhincodon typus) en el Pacífico Oriental Tropical. V Encuentro Colombiano sobre Condrictios. Bogotá. [ Links ]
Bonfil, R.1997. Status of shark resources in the southern Gulf of Mexico and Caribbean: implications for management. Fish. Res., 29(2): 101-117. [ Links ]
Bornatowski, H., A. Navia, R. Braga, V. Abilhoa and M. Corrêa. 2014. Ecological importance of sharks and rays in a structural foodweb analysis in southern Brazil. JMS, 71(7): 1586-1592. doi: 10.1093/icesjms/fsu025. [ Links ]
Caita, C. y R. Guerrero. 2000. Geología de la Isla Malpelo. Informe técnico. Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales. [ Links ]
Chávez, E. J., R. Arauz, A. Hearn, E. Nalesso y T. Steiner. 2020. Asociación de tiburones con el Monte Submarino Las Gemelas y primera evidencia de conectividad con la Isla del Coco, Pacífico de Costa Rica. Rev. Biol. Trop., 68: 320-329. [ Links ]
Clarke, S. C., S. J. Harley, S. D Hoyle and J. S. Rice. 2013. Population trends in Pacific Oceanic sharks and the utility of regulations on shark finning. Cons. Biol., 27(1): 197-209. [ Links ]
CMAR (Corredor Marino del Pacífico Este Tropical). 2015. Qué es el CMAR. http://cmarpacifico.org/web-cmar/quienes-somos/que-es-el-cmar. [ Links ]
Costa D. P, G. A. Breed, P. W. Robinson. 2012. New insights into pelagic migrations: implications for ecology and conservation. An. Rev. Ecol., Evol., System., 43:73-96. doi:10.1146/annurev-ecolsys-102710-145045. [ Links ]
Dulvy, N. K., S. L. Fowler, J. A. Musick, R. D. Cavanagh, P. M. Kyne, L. R. Harrison, J. K. Carlson, L.N.K. Davidson, S. V Fordham, M. P. Francis, C. M. Pollock, C. A. Simpfendorfer, G. H. Burgess, K. E. Carpenter, L. JV Compagno, D. A. Ebert, C. Gibson, M. R. Heupel, S. R. Livingstone, J. C. Sanciangco, J. D. Stevens, S. Valenti and W. T. White. 2014. Extinction risk and conservation of the world’s sharks and rays. eLife 3:1-34. [ Links ]
Edgar. G and J. Graham. 2011. Does the global network of marine protected areas provide an adequate safety net for marine biodiversity? Aq. Cons. Mar Freshw Ecosyst, 21(4): 313-316. [ Links ]
Edgar, G., R. Stuart-Smith, T. Willis, S. Kininmonth, S. Baker, S. Banks, N.S. Barrett, M.A. Becerro, A.T. F. Bernard, J. Berkhout, C.D. Buxton, S.J. Campbell, A.T. Cooper, M. Davey, S.C. Edgar, G. Försterra, D.E. Galván, A.J. Irigoyen, D.J. Kushner, R. Moura, P. E Parnell, N.T. Shears, G. Soler, E.M. A. Strain and R.J. Thomson. 2014. Global conservation outcomes depend on marine protected areas with five key features. Nature, 506(7487): 216-220. doi: 10.1038/nature13022 [ Links ]
Graham, N. A. J., R. D. Evans and G. R. Russ. 2003. The effects of marine reserve protection on the trophic relationships of reef fishes on the Great Barrier Reef. Environ. Cons. , 30(2):200-208. [ Links ]
Graham, N. A. J. and T. R. McClanahan. 2013. The last call for marine wilderness? BioScience, 63(5):397-402. [ Links ]
Grüss, A., D.M. Kaplan, S. Guénette, C.M. Roberts and L. W. Botsford. 2011. Consequences of adult and juvenile movement for marine protected areas. Biol. Cons., 144(2): 692-702. [ Links ]
Holzwarth, S. R., E. E. DeMartini, B. J. Zgliczynski and J. L. Laughlin. 2006. Sharks and jacks in the northwestern Hawaiian Islands from towed-diver surveys 2000-2003. Atoll Research Bulletin. [ Links ]
Jennings, S. and M. J. Kaiser. 1998. The effects of fishing on marine ecosystems. Adv. Mar. Biol., 201-352. doi:10.1016/s0065- 2881(08)60212-6 [ Links ]
Ketchum, J. T., A. Hearn, A. P. Klimley, C. Peñaherrera, E. Espinoza, S. Bessudo and R. Arauz. 2014. Inter-island movements of scalloped hammerhead sharks (Sphyrna lewini) and seasonal connectivity in a marine protected area of the eastern tropical Pacific. Mar. Biol., 161(4): 939-951. [ Links ]
Kiesser, A. and J. Hoffman. 1975. Reconnaissance and mapping of Malpelo island. En: Graham, J. (Ed). The Biological Investigation of Malpelo Island, Colombia. Smithson. Contr. Zool., (176): 13 -16. [ Links ]
Kohler, N. E. and P. A Turner. 2001. Shark tagging: a review of conventional methods and studies: 191-224. In: Tricas, T. C and S.H. Gruber (Eds.). [ Links ]
Kyne, P.M, R. Barreto, J. Carlson, D. Fernando, S. Fordham, M. P. Francis, K. Herman, R.W. Jabado, K.M. Liu, N. Pacoureau, E. Romanov and R.B Sherley. 2019. Carcharhinus galapagensis. The IUCN Red List of Threatened Species 2019: e.T41736A2954286. https://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T41736A2954286.en [ Links ]
Ladino, F., S. Bessudo, P. Salinas y M. Hoyos. 2016. Patrones de movimiento y residencia del tiburón aletiblanco (Triaenodon obesus) y el tiburón galápagos (Carcharhinus galapagensis) en el santuario de fauna y flora Malpelo. V Enc. Col. Condrictios, Bogotá. 49 p. [ Links ]
Ladino, F., Bessudo, S., P. Salinas y M. Hoyos. 2016. Patrones de movimiento y residencia del tiburón aletiblanco (Triaenodon obesus) y el tiburón galápagos (Carcharhinus galapagensis) en el santuario de fauna y flora Malpelo. V encuentro colombiano sobre Condrictios, Bogotá. [ Links ]
Lan, K. W., K. Evans and M.A. Lee. 2013. Effects of climate variability on the distribution and fishing conditions of yellowfin tuna (Thunnus albacares) in the western Indian Ocean. Clim. Change, 119(1): 63-77. [ Links ]
López-Victoria, M. 2006. Los lagartos de Malpelo (Colombia): aspectos sobre su ecología y amenazas. Caldasia, 28(1): 129-134. [ Links ]
Lucifora, L. O. 2003. Ecología y conservación de los grandes tiburones costeros de bahía Anegada, Provincia de Buenos Aires, Argentina. Unpublished Ph. D. Thesis, Univ. Nal. Mar del Plata, Mar del Plata. 406 p. [ Links ]
Mejía-Falla, P. A., A.F. Navia, R. Lozano, A. Tobón-López, K. Narváez, L.A. Muñoz-Osorio, L.M. Mejía-Ladino y J. López-García. 2014. Uso de hábitat deTriaenodon obesus(Carcharhiniformes: Carcharhinidae),Rhincodon typus(Orectolobiformes: Rhincodontidae) yManta birostris(Myliobatiformes: Myliobatidae) en el Parque Nacional Natural Gorgona, Pacífico colombiano. Rev. Biol. Trop., 62: 329-342. [ Links ]
Mejía-Falla, P.A and A.F Navia. 2011. Relationship between body size and geographic range size of elasmobranchs from the Tropical Eastern Pacific: An initial approximation for their conservation. Cienc. Mar., 37: 305-321. doi: 10.7773/cm.v37i3.1750 [ Links ]
Meyer, C. G., Y. P. Papastamatiou and K.N. Holland. 2010. A multiple instrument approach to quantifying the movement patterns and habitat use of tiger (Galeocerdo cuvier) and Galapagos sharks (Carcharhinus galapagensis) at French Frigate Shoals, Hawaii. Mar. Biol., 157(8): 1857-1868. [ Links ]
Migramar. 2016. Migramar: Ciencia para la conservación de especies marinas migratorias en el Pacífico Este, 20p. [ Links ]
Myers, R. and B. Worm. 2005. Extinction, survival or recovery of large predatory fishes. Phil. Transac. Royal Soc. B: Biol. Sci., 360(1453): 13-20. doi: 10.1098/rstb.2004.1573 [ Links ]
Nalesso, E. 2014. Distribución espacio-temporal de los tiburones martillo,Sphyrna lewini, alrededor de la isla del Coco (2005-2013 ), Pacífico Tropical Oriental. Tesis Ecol. Mar., CICESE, Baja California, 73 p. [ Links ]
Navia, A. F., P. A. Mejía-Falla and A. Giraldo. 2007. Feeding ecology of elasmobranch fishes in coastal waters of the Colombian Eastern Tropical Pacific. BMC Ecology 7. [ Links ]
Navia, A.F., E. Cortés, F. Jordán, V.H. Cruz-Escalona and P.A. Mejía-Falla. 2012. Changes to marine trophic networks caused by fishing. Div. Ecosyst.. doi: 10.5772/37787 [ Links ]
Navia, A.F., V.H Cruz-Escalona, A. Giraldo and A. Barausse. 2016. The structure of a marine tropical food web, and its implications for ecosystem-based fisheries management. Ecol. Modell., 32:23-33. [ Links ]
Navia, A. F., P. A. Mejía-Falla, J. López-García, A. Giraldo y V. H. Cruz-Escalona. 2017. How many trophic roles can elasmobranchs play in a marine tropical network? Mar. Freshw. Res., 68(7):1342-53. [ Links ]
Peñaherrera, C., A.R. Hearn and A. Kuhn. 2012. Diel use of a saltwater creek by white-tip reef sharksTriaenodon obesus(Carcharhiniformes: Carcharhinidae) in Academy Bay, Galapagos Islands. Rev. Biol. Trop., 60(2): 735-743. [ Links ]
Peñaherrera-Palma, C, E. Espinosa, A.R. Hearn, J. Ketchum, J.M. Semmens y P. Klimley. 2017. Reporte del estado poblacional de los tiburones martillo en la Reserva Marina de Galápagos: 127-131. En: Informe Galápagos 2015- 2016. DPNG, CGREG, FCD y GC. Puerto Ayora, Galápagos, Ecuador. 6 p. [ Links ]
Pomeroy, R. S. 2007. Cómo evaluar una AMP: Manual de indicadores naturales y sociales para evaluar la efectividad de la gestión de áreas marinas protegidas. UICN, Gland, Suiza y Cambridge, Reino Unido. 232 p. [ Links ]
Quimbayo J.P., F. A. Zapata, S. R. Floeter, S. Bessudo e I. Sazima. 2014. Asociaciones alimentarias en peces arrecifales en isla Malpelo, Colombia (Pacífico oriental tropical). Bol. Invest. Mar. Cost., 43(1). Disponible en:http://boletin.invemar.org.co:8085/ojs/index.php/boletin/article/view/40 [ Links ]
Quintanilla. S., A. Gómez, C. Mariño-Ramírez, C. Sorzano, S. Bessudo, G. Soler, J. E. Bernal and S. Caballero. 2015. Conservation genetics of the scalloped hammerhead shark in the Pacific coast of Colombia. J. Hered., 106(S1): 448-458. [ Links ]
Randall, J. E .1977. Contribution to the biology of the whitetip reef shark (Triaenodon obesus). Pac. Sci., 31: 144-164. [ Links ]
Rodríguez-Rubio, E y A. Giraldo. 2011. Características oceanográficas en isla Malpelo y su relación con la cuenca oceánica del Pacífico colombiano. Bol. Invest. Mar. Cost., 40: 19-32. [ Links ]
Salinas-de-León, P., E. M. Hoyos-Padilla y F. Pochet. 2017. First observation on the mating behaviour of the endangered scalloped hammerhead sharkSphyrna lewiniin the Tropical Eastern Pacific. Environ. Biol. Fishes, 100(12):1603-8. [ Links ]
Schluessel, V., M.B. Bennett and S.P. Collin. 2010. Diet and reproduction in the white-spotted eagle rayAetobatus narinarifrom Queensland, Australia and the Penghu Islands, Taiwan. Mar. Freshw. Res., 61: 1278-1289. doi: 10.1071/MF09261. [ Links ]
Schmitt, E, R. Sluka and K. Sullivan-Sealey. 2002. Evaluating the use of roving diver and transect surveys to assess the coral reef fish assemblage off southeastern Hispaniola. Coral Reefs 21: 216-223. [ Links ]
Sequeira, A. M., C. Mellin, M.G. Meekan, D.W. Sims and C.J. Bradshaw. 2013. Inferred global connectivity of whale sharkRhincodon typuspopulations. J. Fish Biol., 82(2): 367-389. [ Links ]
Soler, G. A., S. Bessudo and A. Guzmán. 2013. Long term monitoring of pelagic fishes at Malpelo Island, Colombia. Lat. Am. J. Cons., 3(2): 28-37. [ Links ]
Stevens, J. D., R. Bonfil, N.K. Dulvy and P.A. Walker. 2000. The effects of fishing on sharks, rays, and chimaeras (chondrichthyans), and the implications for marine ecosystems. ICES J. Mar. Sci., 57(3): 476-494. doi: 10.1006/jmsc.2000.0724 [ Links ]
Stuart-Smith, R. D., A. E. Bates, J. S. Lefcheck, J. E. Duffy, S. C. Baker, R. J. Thomson, J. F. Stuart-Smith, N. A. Hill, S. J. Kininmonth, L. Airoldi, M. A. Becerro, S. J. Campbell, T. P. Dawson, S. A. Navarrete, G. A. Soler, E. M. A. Strain, T. J. Willis and G. J. Edgar. 2013. Integrating abundance and functional traits reveals new global hotspots of fish diversity. Nature, 501(7468): 539-542. [ Links ]
United Nations. 2019. Special edition: progress towards the Sustainable Development Goals-Report of the Secretary-General. United Nations - Economic and Social Council.https://undocs.org/en/E/2019/68 [ Links ]
Usseglio, P., A.M Friedlander, H. Koike, J. Zimmerhackel, A. Schuhbauer, T. Eddy and P. Salinas-de-León. 2016. So long and thanks for all the fish: overexploitation of the regionally endemic Galapagos grouperMycteroperca olfax(Jenyns, 1840). PloS one, 11(10), e0165167. [ Links ]
White, E. R., M.C. Myers, J.M. Flemming and J.K. Baum. 2015. Shifting elasmobranch community assemblage at Cocos Island-an isolated marine protected area. Cons. Biol., 29(4): 1186-1197. [ Links ]
Wood, S., I. B. Baums, C. B. Paris, A. Ridgwell, W. S. Kessler and E. J. Hendy. 2016. El Niño and coral larval dispersal across the eastern Pacific marine barrier. Nat. Com., 7, 12571. doi:10.1038/ncomms12571 [ Links ]
Zanella, I., A. López-Garro and K. Cure. 2019. Golfo Dulce: critical habitat and nursery area for juvenile scalloped hammerhead sharksSphyrna lewiniin the Eastern Tropical Pacific Seascape. Environ. Biol. Fishes, 102(10): 1291-1300. [ Links ]
Recibido: 09 de Agosto de 2020; Aprobado: 30 de Enero de 2021











 text in
text in