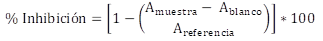INTRODUCCIÓN
La cadena bovina en el departamento de Córdoba participa con el 85,95 % de la cadena productiva agropecuaria del departamento (Gobernación de Córdoba, 2020). A pesar del valioso aporte socioeconómico que esta actividad tiene para la región, no se puede desconocer la problemática ambiental ante la falta de aprovechamiento de algunos subproductos que se generan del procesamiento de la carne (FAO & ADR, 2021). Dentro de estos, se encuentra la bilis, que se genera de los procesos metabólicos del hígado y contiene diferentes compuestos, como los ácidos biliares (Jaillier-Ramírez et al. 2021), con un potencial de uso farmacéutico e industrial (Sáyago-Ayerdi et al. 2008).
Los ácidos biliares son biomoléculas con un esqueleto esteroidal presentes en la bilis animal y humana, se sintetizan en el hígado, a partir de la descomposición del colesterol y luego son metabolizados por el microbiota intestinal. A estos compuestos se les atribuyen importantes propiedades biológicas y farmacológicas; asimismo, se han destacado por su actividad anticancerígena, antimicrobiana y por las propiedades terapéuticas de sus derivados, como agentes citotóxicos y neuroprotectores (Faustino et al. 2016; Mishra & Mishra, 2020; Navacchia et al. 2020). Estos compuestos exhiben efectos bacteriostáticos y bactericidas contra el microbiota al alterar sus membranas, afectando a géneros, como Staphylococcus, Balantidium, Pneumococcus y Enterococcus (Guzior & Quinn, 2021; An et al. 2022). Con relación a la actividad antioxidante, se reporta que los ácidos biliares conjugados con taurina presentan una actividad antioxidante apreciable y que los ácidos biliares al enlazarlos con otros tipos de compuestos adquieren potencial antioxidante (Singh & Bhattacharyya, 2016; Singh et al. 2017).
La finalidad que buscó este estudio fue abrir alternativas de impulso en la región y al país, a través del aprovechamiento de la bilis bovina proveniente del género Bos, mediante la extracción con solventes y separación de ácidos biliares, usando técnicas cromatográficas (cromatografía en capa fina) y la micro extracción en fase sólida (SPE); la identificación de los componentes mayoritarios, mediante cromatografía de gases acoplada a espectrometría de masas (CG-EM) y la evaluación de la actividad bactericida, por el método de microdilución frente a las bacterias Staphylococcus aureus (Gram positiva) y Pseudomona aeruginosa (Gram negativa) y de la actividad antioxidante frente al radical libre 2,2-difenil-1-picrilhidracilo (DPPH).
De esta manera, se busca presentar información preliminar sobre el análisis químico y el potencial bactericida y antioxidante de uno de los subproductos del sacrificio del ganado bovino generado en el departamento de Córdoba, con el propósito de motivar futuras investigaciones sobre el aprovechamiento de estos productos, considerados de desecho.
MATERIALES Y MÉTODOS
Recolección del material biológico. La muestra de bilis de ganado se recolectó durante el primer semestre del 2022, en Frigocer-Expocol S.A.S, frigorífico ubicado en el municipio de Cereté, localizado en el departamento de Córdoba. Se depositó en un galón plástico de polietileno de alta densidad, cerrado adecuadamente y se almacenó en una nevera con temperatura inferior a 5 ºC. El estudio de la muestra fue realizado en el laboratorio de Investigación, Evaluación y Desarrollo de Fármacos y Afines (IDEFARMA), adscrito al departamento de Farmacia de la Universidad de Córdoba.
Extracción por solvente. La extracción de los ácidos biliares se realizó de acuerdo con Bonaldi (1993), donde se mezclaron 312 mL de bilis bovina y 120 mL de solución acuosa de hidróxido de sodio (30 % p/p); la mezcla se sometió a reflujo durante 20 horas, a temperatura 115 y 125 ºC. Posteriormente, se enfrió y se extrajo con 200 mL de agua y acetato de etilo y se adicionó ácido sulfúrico al 35 % p/p, ajustando el pH a 4, aproximadamente, formándose dos fases: la acuosa, que se descartó, mientras que la fase orgánica se trató con 19 mL de una solución acuosa de cloruro de amonio al 10 % p/p, a una temperatura de 0 °C, formándose un precipitado que se filtró y se lavó con acetato de etilo; el producto húmedo se suspendió en 200 mL agua. Posteriormente, se adicionó 200 mL acetato de etilo, se calentó a 50 °C y se acidificó con ácido sulfúrico hasta pH 2, formando dos capas; la fase orgánica se trató con agua y se ajustó el pH en un rango de 8 a 9 con hidróxido de amonio; luego, se adicionaron 12 mL de solución acuosa de sulfato de magnesio al 17 % p/p; la mezcla se introdujo en un baño de hielo para alcanzar una temperatura de 0 °C, donde el producto se filtró y se lavó con acetato de etilo.
El producto húmedo del filtrado se suspendió en agua y acetato de etilo; posteriormente, se calentó y se acidificó con ácido sulfúrico formando dos capas, las cuales, se separaron. La fase acuosa se desechó, mientras que la fase orgánica se lavó con 100 mL de agua dos veces y se filtró, a través de carbón activado; la solución residual se dejó enfriar a 0°C. El sólido obtenido del paso anterior se filtró y se lavó con acetato de etilo y agua; por último, se realizó cromatografía de capa fina al sólido usando metanol como disolvente y un sistema de elución 70:20:10 Cloroformo: Acetona: MeOH y reactivo de Liebermann Bruchard como revelador.
Extracción por fase sólida (SPE). La extracción de ácidos biliares por SPE se realizó mediante columnas C18 HyperSep preactivada y acondicionada con metanol (MeOH) y agua y se cargó en la columna un volumen de 1 mL de la muestra de bilis; se usaron tres sistemas de elución H2O/MeOH (85:15), H2O/MeOH (25:75) y AcEt/MeOH (85:15). El producto obtenido se secó con Na2SO4 y, por último, se efectuó cromatografía de capa fina, usando el mismo sistema de elución del paso anterior (Persson et al. 2007).
Obtención de ésteres metílicos de ácidos biliares. Para la obtención de esteres metílicos de ácidos biliares se siguió el procedimiento descrito por Dayal et al. (1981), donde se tomaron 100 mg del producto obtenido por el método 1, para ser sometidos a la reacción de derivatización; mediante la adición de 3 mL de MeOH y 10 mg de ácido p-tolueno sulfónico, la solución fue colocada a reflujo durante dos horas y monitoreada por cromatografía de capa fina (TLC), usando un sistema 70:20:10 cloroformo: acetona: MeOH y reactivo de vainillina, como revelador. Se adicionó la mezcla de reacción gota a gota sobre hielo, manteniendo agitación; posteriormente, se evaporó el metanol y el residuo obtenido se lavó, con una solución diluida de bicarbonato sódico; se extrajo dos veces con 20 mL de acetato de etilo y se lavó con agua; después se evaporó hasta sequedad. El producto obtenido se adicionó a una mezcla acetona/acetato de etilo (90:10 v/v). El residuo tras la cristalización con acetona/acetato se monitoreo, mediante TLC.
Evaluación de la actividad antioxidante. Se preparó una solución madre de DPPH• disolviendo 18,8 mg DPPH•/ mL de MeOH y se dejó en oscuridad por 24 horas; posteriormente, se tomaron alícuotas de 1 mL, que se diluyeron con MeOH, hasta obtener una absorbancia ajustada de 0,30 ± 0,5 a λ=517 nanómetros (nm), usando MeOH como blanco. Para la evaluación de la actividad antioxidante se preparó una solución 100 ppm del extracto obtenido de ácidos biliares con dimetilsulfóxido (DMSO), de la cual, se tomaron 40 µL y se diluyeron en 1960 μL del radical DPPH• previamente preparado. El blanco de la muestra fue preparado adicionando 40 µL del tratamiento anterior y añadiendo 1960 µL de metanol. Como referencia se preparó una solución de 40 μl de DMSO y 1960 μL con la solución del radical (Pastrana et al. 2019).
Todos los tratamientos se hicieron por triplicado y todos los tubos se dejaron a oscuridad por 30 minutos; pasado este tiempo se procedió a medir la absorbancia. El promedio de los datos de absorbancia (A) se reemplazaron en la ecuación 1.
Evaluación de la actividad bactericida. El ensayo de la actividad bactericida del extracto de ácido biliar se realizó, a través del método de microdilución en caldo (Contreras Martínez et al. 2022). Se emplearon cajas de microtitulación de 96 pozos, así: los aislamientos clínicos bacterianos, una bacteria Gram positiva (Staphylococcus aureus) y una bacteria Gram negativa (Pseudomonas aeruginosa). Para el ensayo, se realizó a partir de cultivos puros en agar soya-tripticasa y se estandarizó el inóculo bacteriano (1-5x108 UFC/mL), empleando un espectrofotómetro SpectroquantMR Prove a 630 nm. Se realizaron diluciones seriadas en caldo Mueller-Hinton, hasta obtener concentraciones finales de 250, 500, 1000, 2000 y 4000 μg/mL de los extractos a evaluar, en cada pozo de reacción. Los ensayos se desarrollaron con un volumen final de 200 μl por pozo (100 μL del inoculo microbiano y 100 μL del extracto). Microorganismos sin tratamiento fueron empleados como control de crecimiento (control negativo) y la ciprofloxacina (2 mg/mL), con propiedades antimicrobianas como control positivo, fueron empleados como controles positivos; las cajas fueron incubadas a 37 ºC, durante 24 horas. Todos los experimentos fueron realizados por triplicado. Los resultados fueron expresados como porcentaje de reducción del crecimiento microbiano.
RESULTADOS Y DISCUSIÓN
Extracción de ácidos biliares. La mezcla de ácidos biliares se obtuvo con rendimientos del 0,8 % utilizando extracción con solvente y del 0,9%, mediante la técnica de extracción en fase sólida (SPE). Estos bajos rendimientos se podrían atribuir a la composición específica de la bilis, que se compone, aproximadamente, de 86 % en agua; los ácidos biliares representan el 11,34 % de todo el contenido biliar, por esta razón, las extracciones que se realicen con volúmenes no excesivos tendrán rendimientos bajos (Sheriha et al. 1968; Kandrac et al. 2006).
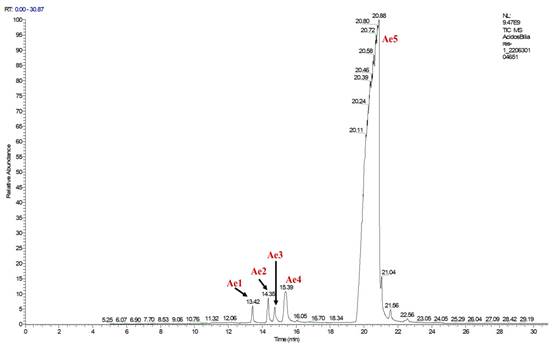
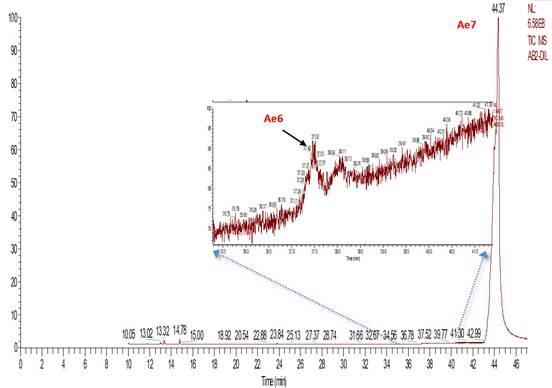
Identificación de compuestos. El análisis por CG-EM de los ácidos biliares derivatizados como ésteres metílicos, mostró un cromatograma con varios picos (Figura 1), con tiempos de retención, comprendidos entre 13 y 23 minutos; en el cromatograma se destacan los compuestos del Ae1 al Ae5, siendo este último, el que se encuentra en mayor proporción. El cromatograma obtenido de la mezcla de ácidos biliares por SPE (Figura 2), no tuvo una distribución similar al cromatograma obtenido por extracción por solvente, debido, en gran manera, a que las condiciones que se usaron fueron distintas; se destacó el compuesto Ae6.
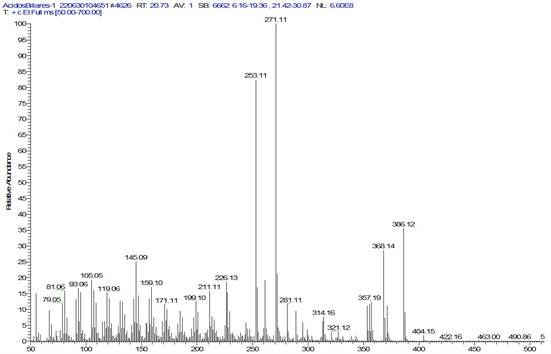
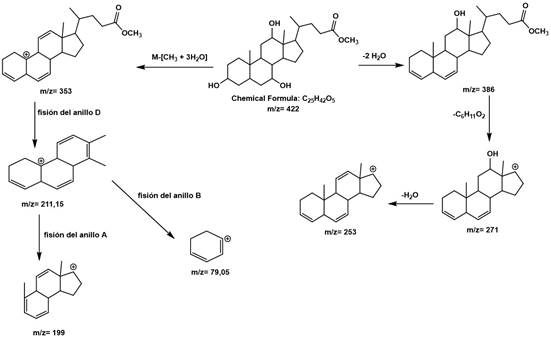
Elucidación del compuesto Ae5. En la figura 3 se muestra el espectro de masas del compuesto Ae5, donde se aprecia una señal en m/z (maza/carga) 422 generada por el ion molecular. Otros fragmentos generados que están en m/z: 404 (M+-H2O), 386 (M+-H2O) y 368 (M+-H2O) e indican que este compuesto contiene hidróxidos que se eliminan en forma de agua. También, se pueden observar los fragmentos con valores de m/z: 353 (368-CH3), m/z: 271 (pérdida de la cadena lateral) del anillo D, 253 (271-H2O), 211 (fisión del anillo D), 199 (fisión del anillo A), 79 (fisión el anillo B), que sustentan claramente la presencia del núcleo esteroidal. Este núcleo esteroidal tiene una cadena lateral oxigenada, previamente determinada por la diferencia entre el valor de m/z 386 y el valor de m/z 271. Por medio de comparación en los patrones de fragmentación hallados en literatura, se permite proponer la estructura del colato de metilo de fórmula molecular C25H42O5 (Tokes et al. 1968; Partridge & Djerassi, 1977; Valle Z. & Santafé P., 2009); para este compuesto, el patrón de fragmentación se muestra en la figura 4.
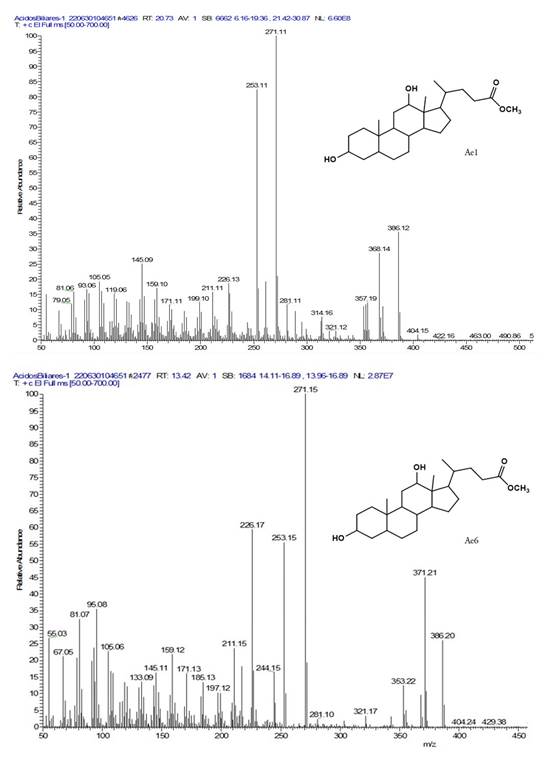
Elucidación del compuesto Ae1. En la figura 5 se muestra el espectro de masas del compuesto Ae1, con un ion de m/z de 404. Los fragmentos generados en m/z: 386 (M+-H2O), indican que este compuesto contiene hidróxido que se elimina en forma de agua. También, se pueden observar los fragmentos con valores de m/z: 371 (M+- CH3+H2O), m/z: 353 (M+- CH3+ 2H2O), 271 (pérdida de la cadena lateral 115 m/z + H2O), 253 (M+ 271-H2O), 211 (253-42), fragmentaciones que sustentan la presencia del núcleo esteroidal similar a los dihidroxicolanoatos con cadena lateral oxigenada, previamente determinada, por la diferencia entre el valor de m/z 386 y el valor de m/z 271. Por medio de consultas y comparaciones en la literatura, se propone la estructura del 7α-hidroxi-3-oxo-5β-colanoato de metilo, correspondiente con la fórmula molecular C25H40O4 (Eneroth et al. 1966; Lawson & Setchell, 1988).
Elucidación del compuesto Ae6. Observando el espectro del compuesto (Figura 5), aunque no hay evidencia del pico ion molecular m/z 406, se presentan fragmentaciones características de esteroides hidroxilados (Martínez Martínez, 2002), donde se muestran fragmentos, que incluyen las pérdidas de dos moléculas de agua, M-H2O, que corresponden a los picos m/z 388 y 370. El pico base m/z 255 se obtiene de la pérdida de la cadena lateral (C6H11O2) del carbono 17 del anillo D; el pico m/z 273, el cual, es el segundo pico más abundante, se obtiene, de igual forma, por la pérdida de la cadena lateral del carbono 17 del anillo D (C6H11O2) y la presencia de un grupo hidroxilo en el carbono doce. Este ácido biliar, perteneciente a la familia de los esteroides, presenta, además en el espectro de masas, los fragmentos: M-metilo, como es la señal 355, que se da por la pérdida del metilo del grupo éster; de igual forma, la señal en 147 se debe al rompimiento de los enlaces del carbono ocho y el carbono once del anillo C, respectivamente, seguido de la pérdida M-metilo, ubicado en el carbono diez, generando un carbocatión. El pico m/z 73 [C3H5O2]+ se forma por la ruptura heterolítica entre el carbono 22 y 23 de la cadena lateral unida al anillo D. Con base en las fragmentaciones encontradas y a los patrones de fragmentación hallados en literatura (Eneroth et al. 1966; Lawson & Setchell, 1988), se propone la estructura del desoxicolato de metilo, para este compuesto, en la figura 5.
Evaluación de la actividad antioxidante. Al determinar la capacidad antioxidante de la mezcla de ácidos, mediante el método de DPPH•, a una concentración de 100 μg/mL, se observó que el porcentaje de inhibición del radical fue inferior al 10 %, por lo que se decidió no seguir trabajando la evaluación de la actividad antioxidante y solo se reportó una lectura de absorbancia, siendo para la muestra, el blanco y la solución de referencia, 0,288, 0,019 y 0,295, respectivamente. Con este resultado, se podría considerar que la mezcla de ácidos biliares no se encuentran presentes compuestos donadores de H que puedan estabilizar al radical DPPH•, siendo el compuesto mayoritario, en esta mezcla, el ácido cólico, que no presenta una estructura con dobles enlaces conjugados o anillos fenólicos en la molécula, por lo que el electrón desapareado no se podría deslocalizar, produciéndose una baja estabilidad de la especie radicalaria (Dupont et al. 2021). Estudios han demostrado que el ácido cólico, así como también otros ácidos biliares, como el ácido desoxicólico y el ácido litocólico, presentan actividad antioxidante, cuando están enlazado con otro tipo de moléculas; tal es el caso de derivados de estilbenos (Dos Santos et al. 2015). Es importante mencionar que el ensayo de actividad antioxidante se realizó con la mezcla de ácidos biliares, obtenida por el método de extracción por solvente; por el método de SPE no se realizaron ensayos, porque al ser una microextracción, las cantidades obtenidas fueron muy bajas.
Evaluación de la actividad bactericida. Al evaluar la actividad antibacteriana por el método de microdilución en caldo, se observó una disminución en el crecimiento bacteriano de las dos cepas evaluadas, por parte de la mezcla de ácidos biliares. Los resultados obtenidos fueron expresados en porcentaje de reducción del crecimiento bacteriano del extracto de ácidos biliares frente a la bacteria Gram negativa (P. aeruginosa) y Gram positiva (S. aureus) y graficados, como se muestra en la figura 6.
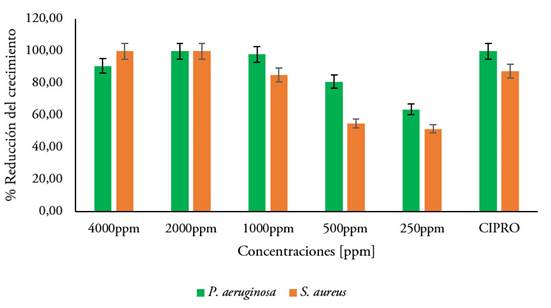
Figura 6 Porcentaje de inhibición del crecimiento bacteriano de Pseudomona aeruginosa y Staphylococcus aureus en función de la concentración de la mezcla de ácidos biliares. CIPRO: control positivo de ciprofloxacina
La mezcla de ácidos biliares mostró una prominente actividad antibacteriana contra los aislamientos clínicos probados en este estudio. Se pudo apreciar una inhibición del crecimiento de las bacterias tratadas con esta mezcla en comparación al control positivo de ciprofloxacina (CIPRO); respecto al control negativo, la reducción del crecimiento mostró diferencias significativas. Se observó una relación directamente proporcional entre el efecto inhibidor de crecimiento bacteriano y la concentración evaluada. Al realizar el análisis de varianza (ANOVA) y la prueba de Tukey a los datos de absorbancia registrados, se encontraron diferencias significativas entre los tratamientos (P>0,05), en cada una de las cepas utilizadas. Para P. aeruginosa, a partir de 1000 μg/mL, se consiguió una inhibición similar a la del antibiótico comercial ciprofloxacina, utilizado como control; incluso, con las concentraciones más bajas empleadas (250 y 500 μg/mL), la inhibición del crecimiento supera el 60 %, aunque no alcanzó a ser estadísticamente similar al alcanzado con control positivo. Para S. aureus se observó un comportamiento similar entre los tratamientos, a partir de 1000 μg/mL y no se observaron diferencias significativas con los resultados registrados en el control positivo. A las concentraciones más bajas, el porcentaje de inhibición del crecimiento bacteriano estuvo por encima del 50 %.
La actividad bactericida de los ácidos biliares se relaciona, principalmente, a las propiedades detergentes que poseen y su capacidad para penetrar y romper las membranas (Di Gregorio et al. 2021). Los ácidos biliares disuelven los lípidos de la membrana y provocan la disociación de las proteínas integrales de la membrana; esta solubilización da como resultado la fuga del contenido celular y la muerte celular (Begley et al. 2005).
Se pudo determinar que los ácidos biliares no conjugados y ácidos biliares conjugados en concentraciones sub-inhibitorias podían inhibir el crecimiento de S. aureus, así como también, demostraron que los ácidos biliares no conjugados poseen una acción antibacteriana más potente que los ácidos biliares conjugados (Sannasiddappa et al. 2017). Un estudio de actividad bactericida con dos patógenos, Escherichia coli y Enterococcus faecalis, demostró que los ácidos biliares tienen una inhibición significativa sobre el crecimiento de las bacterias evaluadas (Sung et al. 1993).
Se logró separar e identificar tres estructuras de esteres metílicos, siendo el colato de metilo el mayoritario, en el extracto de bilis estudiado. Las moléculas mostraron baja actividad antioxidante con un potencial de reducción inferior al 10 %; no obstante, los ácidos biliares esterificados presentaron alta actividad bactericida. La inhibición del crecimiento bacteriano se alcanzó en su totalidad con los microrganismos evaluados, aun a la concentración más baja utilizada (250 µg/mL). Esta investigación contribuye con el estudio de las actividades biológicas y químicas de los ácidos biliares y al aprovechamiento de los subproductos que se originan en el sacrificio bovino, en un frigorífico de Córdoba, Colombia.