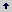Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.58 no.1 Medellín Jan./June 2005
POTENCIAL DE PROPAGACIÓN in vitro PARA EL TOMATE DE ÁRBOL PARTENOCÁRPICO Cyphomandra betacea Cav. (Sendt)
POTENTIAL OF in vitro PROPAGATION FOR THE TOMATO TREE PARTENOCARPIC Cyphomandra betacea Cav. (Sendt)
John Alexander Espinosa Orrego1; Ofelia Trillos González2; Rodrigo Alberto Hoyos Sánchez3; Lucía Afanador Kafuri4 y Guillermo Correa Londoño5
1 Ingeniero Agrónomo, Augura. Conjunto Residencial los Almendros. Carepa, Colombia. <jaespino@unalmed.edu.co>
2 Profesora Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <otrillos@unalmed.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <rhoyos@unalmed.edu.co>
4 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia<lafanado@unalmed.edu.co>
5 Profesor Asistente. Universidad Nacional de Colombia, Sede de Medellín. Facultad de Ciencias Agropecuarias. A. A. 1779. Medellín Colombia. <gcorrea@unalmed.edu.co>
Recibido: Enero 25 de 2005; aceptado: Abril 26 de 2005.
RESUMEN
Se evaluaron 10 medios de cultivo para el establecimiento y la multiplicación in vitro de tomate de árbol partenocárpico, los cuales contenían sales de MS, BAP de 0,17 a 5,82 mg/l, y AIA de 0,19 a 2,31 mg/l y una mezcla de tres sustancias antioxidantes: cisteína, ácido ascórbico y caseína hidrolizada (100 mg/l de cada una). Los explantes utilizados fueron esquejes de nudo de 1,5 a 2,0 cm de longitud. Para el análisis estadístico se empleó un diseño central compuesto triplicado con dos repeticiones del punto central. Los resultados fueron: en el material proveniente del altiplano Norte de Antioquia, Colombia, se determinó el punto óptimo para la variable longitud de brotes con reguladores de crecimiento (0,17 mg/l de BAP y 0,19 mg/l de AIA); en el material procedente del Oriente de Antioquia-Colombia, no se pudo determinar el punto óptimo. Las sustancias antioxidantes no fueron efectivas para evitar la oxidación fenólica, la cual fue mediana a alta. Las tasas de multiplicación fueron bajas (0 % y 20 % para los genotipos del Oriente y Norte de Antioquia, respectivamente) y el desarrollo de los brotes en el material del Norte fue muy lento (cuatro meses).
Palabras claves: Cultivo de tejidos vegetales, partenocarpia, oxidación fenólica.
ABSTRACT
Ten tissue culture medias were evaluated to establish and multiply in vitro the tomato tree partenocarpic, that contained MS salts, BAP from 0,17 to 5,82 mg/l, and IAA from 0,17 to 2,31 mg/l and a mix of three antiozidant substances : cistein, ascorbic acid, and hydrolized casein (100 mg/l each). The explants employed were nodal stems of from 1, 5 to 2,0 cm in length. For the statistical analyses, a triplicated central composite design was employed with two repetitions of the central point. The results were: in the material from the high plains of northern Antioquia, Colombia , the optimal point was determined for the variable shoot length with growth regulators (0,17 mg/l of BAP and 0,19 mg/l of IAA); for the material from eastern Antioquia-Colombia, it was not possible to determine the optimum point. The antioxidizing substances were not effective for preventing fenolic oxidation, which was intermediate to high. Multiplication rates were low (0 and 20 % for the eastern and northern genotypes, respectively) and shoot development in the material from the north was very slow (four months).
Key words: Vegetative tissue culture, partenocarpic, fenolic oxidation.
 INTRODUCCIÓN
INTRODUCCIÓN
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 CONCLUSIONES
CONCLUSIONES
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
El tomate de árbol es una fruta tropical de la zona andina, que se planta principalmente en Colombia, Ecuador y Perú. Entre la variabilidad existente de esta especie está el tomate de árbol partenocárpico, el cual es una rareza en los huertos comerciales y aún no se conoce su manejo agronómico. La propagación sexual de este tipo de tomate no es posible, debido a que los frutos presentan muy poca o ninguna semilla; por lo tanto, se debe recurrir a métodos de reproducción vegetativa como estacas, injerto, o mediante procedimientos de laboratorio como el cultivo de tejidos in vitro.
Guimarães et al. (1988), citados por Lopes et al. (2000), reportaron por primera vez éxito en la inducción de embriogénesis somática en tomate de árbol, mediante el cultivo de embriones zigóticos maduros e hipocótilos de plántulas. En un reporte posterior, el mismo grupo de investigadores describieron la regeneración de plantas de tomate de árbol mediante organogénesis y embriogénesis somática empleando diferentes clases de explantes (hypocótilos, cotiledones, raíces y embriones zigóticos maduros y a partir de protoplastos).
Hoyos (1996), logró obtener callos friables a partir de explantes de hojas crecidas in vitro, en un medio M & S (Murashige y Skoog, 1962) suplementado con 0,1 mg/l de 2,4-D (Ácido 2,4 Diclorofenoxiacético) y 0,05 mg/l de BAP (6 Benzilaminopurina), con el fin de producir las suspensiones embriogénicas necesarias, para la generación de material resistente a la acción de toxinas producidas por el hongo Colletotrichum acutatum Penz, causante de la antracnosis en el tomate de árbol.
Hoyos y Kafuri (1998), encontraron que para tomate de árbol, un medio de cultivo empleando sales M & S complementado con 0,1 mg/l de AIA (Ácido Indol Acético), es adecuado para la propagación de microesquejes de nudo (con una yema).
Obando y Jordan (2001), evaluaron el potencial de regeneración in vitro de varios explantes de tomate de árbol y su relación con los cambios de proteínas solubles y fenoles a lo largo de la morfogénesis, habiendo encontrado que los explantes de hoja, en presencia de TDZ (Tiabendazole), solo o combinado con AIA, inducían inicialmente callos y posteriormente brotes, los cuales se formaron en la superficie abaxial 4-5 semanas después de iniciado el cultivo. La mayor tasa de inducción de brotes se obtuvo utilizando TDZ solo (93,3 %) y el número de brotes adventicios formados por explante fue el más alto (2,1 a 16,3). Se observó pardeamiento en algunos de los explantes, los cuales se tornaron necróticos; este efecto ocurre en la lámina de la hoja, pero no en los brotes adventicios nuevos, los cuales permanecieron verdes.
Brotes de tomate de árbol subcultivados en presencia de 1,07 µM ANA (Ácido Naftalenacético), 0,88 µM BA y 0,58 µM GA3 (Ácido Giberélico) iniciaron la formación de raíces luego de otras cuatro semanas, obteniéndose plántulas que se desarrollaron rápidamente en un sustrato de suelo no estéril. La regeneración de plantas a partir de las yemas axilares fue del 67 %, éstas desarrollaron nuevos brotes en presencia de 0,11 µM de ANA y 11,41 µM de Zeatina (Z) y posteriormente se enraizaron en un medio y tiempo similar a los anteriores. Los pecíolos, cotiledones y ovarios formaron directamente embriones somáticos, después de un período de aproximadamente 45 días (Obando y Jordan, 2001).
Hoyos, Giraldo y Martínez (1998), encontraron que la presencia de BAP en el medio de cultivo, promovió la formación de brotes en los explantes foliares provenientes de hojas jóvenes de plántulas propagadas in vitro de las variedades de tomate de árbol común y tomate de árbol rojo o tomoro. La regeneración fue observada en la octava semana, y el mayor porcentaje de regeneración (37,5 %), se presentó con una concentración de BAP de 2,0 mg/l. Después de 12 semanas de cultivo en la misma concentración de BAP, se obtuvo el 53,83 % de regeneración, en tanto que el mayor promedio de brotes/explante fue 4,49.
Obando y Jordan (2001), indicaron que en tomate de árbol, el contenido fenólico de los tejidos intactos fue siempre mayor cuando se comparó con el de los explantes en cultivo. Un menor nivel de los fenoles endógenos en las secciones de hojas y en las yemas axilares parece estar asociado a la inducción de brotes y raíces, respectivamente. La adición de TDZ parece reducir la actividad de la enzima Fenilalanina Ammonia Liasa (PAL) reduciéndose los fenoles.Ramírez et al,. (1998), anotaron que además de la desinfestación superficial, en especies leñosas o semi-leñosas, como es el caso de Rubus, se requiere la evaluación de procedimientos para el control de la oxidación de los tejidos, como la utilización de segmentos nodales provenientes de plantas en estado de crecimiento activo, la inmersión de los mismos en solución de antioxidantes (una mezcla de ácido cítrico y ácido ascórbico en dosis de 0,125 g/l cada una) y su inclusión en un medio de cultivo utilizando la mitad de la concentración de sales M&S. Una vez controlada la oxidación en la fase de establecimiento, no se observaron problemas por oxidación durante el proceso de incremento, siempre y cuando se realizaran transferencias periódicas a medios de cultivo frescos.
González et al. (2003) evaluaron el comportamiento de segmentos nodales de guayaba Enana Roja Cubana var. EEA 18- 40 (Psidium guajava L.) con una longitud de 1,5 a 2,0 cm. Se emplearon un total de 34 explantes, de los cuales 28 presentaron contaminación visible en el medio de cultivo, alrededor de la base de los explantes y en ocasiones, colonizando los mismos. De todas las muestras analizadas se determinó que 26 (76,47 %) presentaban contaminación bacteriana, 2 (5,88 %) contaminación por levaduras y 6 (17,64 %) carecían de contaminantes detectables, pero presentaban un oscurecimiento o ennegrecimiento del medio de cultivo (fenolización). Se comprobó que los contaminantes más frecuentes pertenecen a las familias Pseudomonadaceae y Enterobacteriaceae, esto se explica, porque estas bacterias Gram negativas son abundantes en la superficie aérea de la planta y en el ambiente, ya que se han aislado como saprofíticas del agua, y del suelo. Tampoco se puede descartar la posibilidad de que las bacterias se encuentren en los espacios intercelulares, y por ello escapan a la desinfestación, expresándose en el medio de cultivo, cuando el explante está bajo condiciones de estrés (Leifert; Morris y Waites, 1994).
Obtención y multiplicación de plantas madres. Se trabajó con dos materiales de tomate de árbol partenocárpico: el primero de ellos a partir de la colección existente en el Banco de Germoplasma para Alimentación y Agricultura del Estado Colombiano, ubicado en Rionegro, Antioquia (Colombia), a cargo de la Corporación Colombiana de Investigaciones Agropecuarias (CORPOICA). El segundo material provino de una plantación de tomate de árbol comercial, ubicada en el municipio de Entrerríos, Norte del departamento de Antioquia (Colombia).
La propagación de las plantas madres del material proveniente del Oriente de Antioquia, se realizó empleando 25 estacas leñosas de unos 8 a 10 cm de longitud, que fueron sembradas en un sustrato (mezcla de suelo negro y cascarilla de arroz), previamente esterilizado en autoclave a 15 lb p-2 y 120 oC, durante una hora. A las estacas se les aplicó un enraizador (Hormonagro No 1), y se mantuvieron bajo una cámara húmeda, durante quince días, para promover el enraizamiento.
La propagación de las plantas madres del material proveniente del norte de Antioquia, se realizó empleando 12 plántulas, que se encontraban disponibles en el laboratorio de cultivo de tejidos vegetales y que fueron transplantadas a turba esterilizada, mantenidas en cámara húmeda durante quince días, y para lograr su endurecimiento, se les retiró la cubierta progresivamente. Posteriormente, las plantas sobrevivientes se trasplantaron a macetas, empleando el sustrato anteriormente descrito.
Preparación de explantes para el cultivo in vitro. Los explantes empleados fueron segmentos de nudos de 1,5 a 2,0 cm de longitud, provenientes de ramas de las plantas madre de ambos materiales de tomate de árbol partenocárpico, previamente propagadas. Se desinfestaron mediante la inmersión en una mezcla de los fungicidas Captan – Benlate en proporción 1:1 (1 g/l de cada uno) por 30 minutos, se lavaron tres veces con agua destilada estéril, luego se sumergieron en etanol al 70 % durante 40 segundos, se lavaron tres veces con agua destilada estéril, posteriormente se transfirieron a una solución de Hipoclorito de Sodio (NaOCl) al 0,6 % (v/v) durante 15 minutos y finalmente, fueron lavados tres veces con agua destilada estéril.
Medios de cultivo. Con el fin de definir el medio de cultivo óptimo, para el establecimiento y desarrollo de segmentos de nudos de tomate de árbol partenocárpico, se realizó un ensayo en el cual se evaluaron 10 tratamientos empleando sales M&S (Murashige y Skoog, 1962), que contenían 0,5 mg/l de Piridoxina, 0,5 mg/l de Ácido Nicotínico, 2 mg/l de Glicina, 20 % (w/v) de Sacarosa. Además, se adicionaron dos reguladores de crecimiento: BAP, en concentraciones de 0,17 a 5,82 mg/l, y AIA, en concentraciones de 0,19 a 2,31 mg/l. Se agregó una mezcla de tres sustancias antioxidantes: Cisteína, Ácido Ascórbico y Caseína Hidrolizada, en dosis de 100 mg/l cada una, y se ajustó el pH entre 5,6 y 5,7. Como agente solidificante se empleó Fitagel al 0,17 %. Las combinaciones de los niveles de reguladores de crecimiento empleados en cada uno de los tratamientos evaluados se indican en la Figura 1.
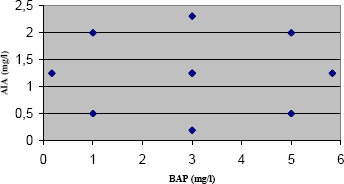
Figura 1. Medios de cultivo evaluados para propagar segmentos de nudo del tomate de árbol partenocárpico.
Las unidades experimentales fueron los recipientes de vidrio con una capacidad de 250 c.c., que contenían 20 mililitros de los medios a evaluar y un esqueje de nudo sembrado en cada uno. Los dos factores principales (niveles de BAP y AIA) se combinaron con base en un diseño central compuesto triplicado, con dos repeticiones del punto central, lo cual dio un total de 30 unidades experimentales para cada uno de los materiales en estudio.
Para todos los tratamientos se establecieron las siguientes variables: supervivencia (número de explantes vivos), desarrollo (longitud de los brotes diferenciados), presencia de contaminantes (número de unidades experimentales contaminadas), tipo de contaminación (hongos ó bacterias) y presencia de oxidación fenólica. La determinación de la oxidación fenólica se efectuó en forma visual, empleando una escala clasificatoria reportada por Zambrano, Demey y González (1995), donde: (0) no presenta oxidación fenólica, (1) muy baja oxidación fenólica, (2) baja oxidación fenólica, (3) moderada oxidación fenólica, (4) oxidación fenólica moderadamente alta, (5) oxidación fenólica alta y (6) oxidación fenólica muy alta. Los datos obtenidos se tabularon y se analizaron empleando el programa estadístico STAGRAPHICS versión 5.0.
Multiplicación de plantas madres. Únicamente enraizaron 5 de las 25 estacas sembradas del material tomado del Oriente de Antioquia (20 %), de las cuales, una vez transplantadas a macetas, únicamente sobrevivieron 2 plantas (8 %), que se transplantaron a campo para ser utilizadas como plantas madre. Por otra parte, del material proveniente del Norte de Antioquia, sobrevivieron 6 de las 12 plántulas obtenidas a partir de material in vitro (50 %), las cuales fueron transplantadas a macetas, para ser empleadas como plantas madre. El porcentaje de supervivencia de las plantas fue bajo, especialmente en el material originario del Oriente Antioqueño y que se propagó por estacas, y el crecimiento de las mismas fue lento (seis meses hasta iniciar la primera floración).
Medios de cultivo. En las Tabla 1 se indican los resultados obtenidos para el material de tomate de árbol partenocárpico proveniente del Norte de Antioquia.
Tabla 1. Respuesta del material de tomate de árbol partenocárpico proveniente del Norte del departamento de Antioquia (Colombia), a diversos niveles de reguladores de crecimiento, en medios de cultivo in vitro.
Del material de tomate de árbol partenocárpico traído del Norte de Antioquia, sobrevivieron 19 de los 30 nudos sembrados (63 %); en estos nudos se diferenciaron yemas, cuya longitud fluctuó entre 0,5 a 3,0 mm, cinco días después de la siembra. La contaminación debida a hongos (Cladosporium) fue baja (3 %), la presencia de bacterias contaminantes fue alta (93 %), y la oxidación fenólica fue media (3 en promedio). Seis (20 %) de los nudos que diferenciaron yemas, en las siguientes combinaciones de reguladores de crecimiento: 0,17 mg/l BAP y 1,25 mg/l AIA (2), 1,0 mg/l BAP y 2,0 mg/l AIA (1), 1,0 mg/l BAP y 0,5 mg/l AIA (1), 5,0 mg/l BAP y 0,5 mg/l AIA (1) y 5,0 mg/l BAP y 2,0 mg/l AIA (1). Estos sobrevivieron y diferenciaron brotes múltiples, a partir de los cuales se pudo continuar la propagación de este genotipo. Estos brotes se transfirieron a un medio fresco, donde se desarrollaron satisfactoriamente, con poca o ninguna oxidación fenólica y sin contaminación.
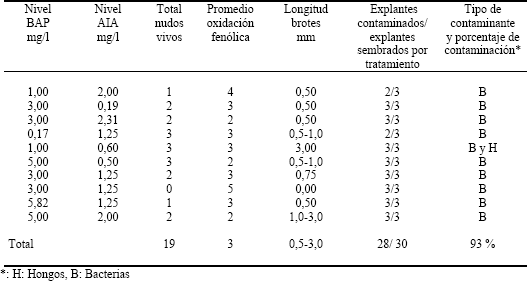
En la Tabla 2 se aprecia que para la variable longitud de brotes, no se encontró efecto significativo para el factor concentración de BAP (valor de P igual a 46,37 %), ni para el factor concentración de AIA (valor de P igual a 46,40 %) en forma independiente. Sin embargo, la interacción de ambos factores fue significativa (valor de P igual a 1,52 %).
Tabla 2. Análisis de varianza de la variable longitud de brotes (mm) para el material de tomate de árbol partenocárpico proveniente del Norte de Antioquia (Colombia), en medios de cultivo in vitro, con diversos niveles de reguladores de crecimiento. Valores de Y > 0.
Al analizar la superficie de respuesta resultante (Figura 2), se observó que cuando ambos reguladores de crecimiento, BAP y AIA, se encontraban en concentraciones bajas ó altas en forma simultánea, había respuesta cuadrática para la variable longitud de los brotes obtenidos, debido al efecto de los mismos.
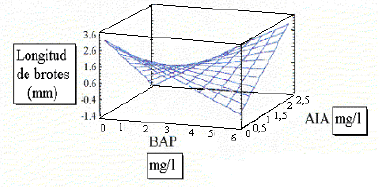
Figura 2. Superficie de respuesta para el material de tomate de árbol partenocárpico originado en el Norte de Antioquia, Colombia, en medios de cultivo in vitro, con diversos niveles de reguladores de crecimiento.
El modelo empleado señaló, como punto óptimo para el material proveniente del Norte de Antioquia, la combinación de concentraciones hormonales: 0,17 mg/l de BAP y 0,19 mg/l de AIA (Tabla 3).
Tabla 3. Combinación óptima de reguladores de crecimiento para el material de tomate de árbol partenocárpico obtenido en el Norte de Antioquia, Colombia. Variable longitud de brotes (mm). Valores de Y > 0.

En los cultivos in vitro, la inducción de órganos por efecto de las citoquininas (BAP), está encaminada a la formación de yemas, las cuales son obtenidas con base en una proporción de citoquinina alta con respecto a la auxina. De otro lado, el AIA es una auxina que interviene en el alargamiento y la división celular, estimulando la formación de brotes. En ausencia de citoquininas, la auxina provoca el alargamiento celular en los tejidos cultivados. Pero, en presencia de la BAP, el efecto que se obtiene por la presencia de la auxina, es una división celular mediada por la citoquinina. Sin embargo, un exceso de auxina puede suprimir la división celular y aún, el crecimiento celular. En este experimento, los reguladores de crecimiento utilizados estimularon tanto la división como la elongación celular, obteniéndose la formación de yemas y la diferenciación de brotes, a partir de algunos de los nudos cultivados.
En las Tabla 4 se indican los resultados obtenidos para el material de tomate de árbol partenocárpico traído del Oriente de Antioquia. Al analizar la variable longitud de brotes no se encontró efecto significativo para los factores BAP (P igual a 6,73 %), para el AIA (P igual a 12,90 %), ni para la interacción de ambos (Tabla 5).
Tabla 4. Respuesta del material de tomate de árbol partenocárpico proveniente del Oriente del departamento de Antioquia (Colombia), en medios de cultivo in vitro, con diversos niveles de reguladores de crecimiento.
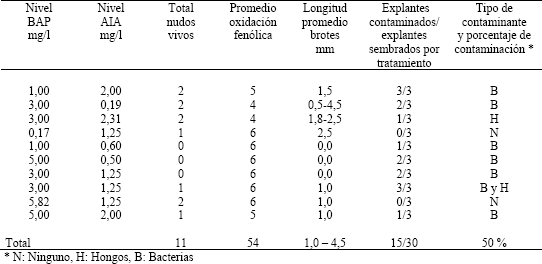
Tabla 5. Análisis de varianza de la variable longitud de brotes (mm) para el material de tomate de árbol partenocárpico proveniente del Oriente de Antioquia (Colombia), en medios de cultivo in vitro, con diversos niveles de reguladores de crecimiento. Valores de Y> 0

Del material de tomate de árbol partenocárpico proveniente del Oriente de Antioquia, únicamente sobrevivieron 11 de los 30 nudos sembrados (37 %), a partir de éstos se desarrollaron 16 yemas, cuya longitud fluctuó entre 0,5 a 4,5 mm, cinco días después de sembradas. La contaminación por hongos (Cladosporium) fue baja (6 %), la presencia de bacterias media (37 %), y dos de los nudos sembrados (7 %) no presentaron ningún tipo de contaminación (Tabla 4).
Los brotes diferenciados no sobrevivieron, debido a la alta oxidación fenólica de los nudos (5 en promedio), lo que condujo a la necrosis de los mismos. Por lo tanto, no se pudieron obtener brotes viables que permitieran continuar con la multiplicación de este genotipo, el cual es altamente recalcitrante al cultivo in vitro, al igual que las otras especies tropicales reportadas.
En este caso, no hubo confiabilidad para inferir la respuesta a los tratamientos, y por lo tanto, no se pudo deducir un punto óptimo de combinación de los reguladores de crecimiento (Figura 3).
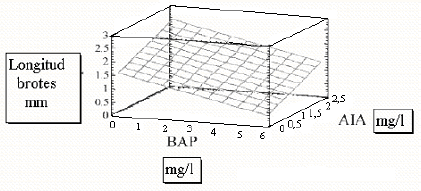
Figura 3. Superficie de respuesta para el material de tomate de árbol partenocárpico proveniente del Oriente de Antioquia, Colombia, en medios de cultivo in vitro, con diversos niveles de reguladores de crecimiento.
Para el genotipo originado en el Norte del departamento de Antioquia, se pudo determinar el punto óptimo para la combinación de los reguladores de crecimiento en el medio de cultivo (BAP y AIA), para el genotipo tomado del Oriente de Antioquia, este punto no fue determinado.
El tratamiento previo realizado a los explantes, aplicando los fungicidas Benlate y Captan, en proporción 1:1, fue efectivo para el control de los hongos, ya que se obtuvo un bajo porcentaje de explantes con contaminación por el hongo Cladosporium.
La Rifampicina aplicada al medio de cultivo, no fue efectiva para controlar la contaminación ocasionada por una bacteria Gram negativa endógena, proveniente de los esquejes de nudos; por lo tanto, se debe emplear otra sustancia bactericida adicional.
Únicamente se pudo multiplicar el material originario del Norte del departamento de Antioquia; sin embargo, la eficiencia del método empleado fue baja (20 %) y el tiempo para la diferenciación de brotes fue de cuatro meses.
GONZALEZ et al. Bacterias contaminantes en la fase de establecimiento in vitro del guayabo. s.l.: Instituto de Biotecnología de Plantas, 2003. 5 p. [ Links ]
GUIMARAES, M. L. S. et al.. Somatic embryogenesis and plant regeneration in Cyphomandra betacea (Cav.) Sendt. En: Plant Cell Tissue and Organ Culture. Vol 15. No 2. (1988); p. 161-168. Citados por: LOPES, M. L. et al. Somatic embryogenesis induction in tamarillo (Cyphomandra betacea). En: MOHAN JAIN, S.; GUPTA, P. K and NEWTON, R.J., eds. Somatic embryogenesis in woody plants. v. 6. New York: Agritech Publications, 2000. v. 6, 756 p. [ Links ]
HOYOS, R. Regeneración de plantas de tomate de árbol (Cyphomandra betacea (Cav.) Sendt in vitro vía organogénesis. En: SEMINARIO ORIENTACION ESTRATEGICA DE LA INVESTIGACION AGROPECUARIA EN LA UNIVERSIDAD NACIONAL DE COLOMBIA SEDE MEDELLIN (1996: Medellín). TRABAJOS PRESENTADOS. Medellín: Universidad Nacional de Colombia, 1997. p. 50. [ Links ]
________. y KAFURI, L. Sistemas biotecnológicos para la selección acelerada de tomate de árbol (Cyphomandra betacea) por su resistencia a antracnosis. En: SEMINARIO DE FRUTALES DE CLIMA FRÍO MODERADO. CENTRO DE DESARROLLO TECNOLÓGICO DE FRUTALES (2: 1998: Manizales). Memorias del 2º Seminario de Frutales de Clima Frío Moderado. Manizales: Centro de Desarrollo Tecnológico de Frutales, 1998. p. 40 – 45. [ Links ]
________; GIRALDO, A. y MARTINEZ, D. Establecimiento de estructuras callosas y suspensiones celulares de tomate de árbol (Cyphomandra betacea). En SEMINARIO DE FRUTALES DE CLIMA FRÍO MODERADO. CENTRO DE DESARROLLO TECNOLÓGICO DE FRUTALES (2: 1998: Manizales). Memorias del 2º Seminario de Frutales de Clima Frío Moderado. Manizales: Centro de Desarrollo Tecnológico de Frutales, 1998. 2003. p. 49 – 51. [ Links ]
LEIFERT, C.; MORRIS, C. E. and WAITES, W. M. Ecology of microbial saprophytes and patogens in tissue culture and field grown: reasons for contamination in vitro. En: Critical Review in Plant Sciences. Vol. 13 (1994); p. 139-183. [ Links ]
LOPES, M. L. et al. Somatic embryogenesis induction in tamarillo (Cyphomandra betacea). En: MOHAN JAIN, S.; GUPTA, P. K and NEWTON, R. J., eds. Somatic embryogenesis in woody plants. New York: Agritech Publications, 2000. v. 6, 756 p. [ Links ]
MURASHIGE, T. and SKOOG, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. En: Plant Physiology. Vol. 15 (1962); p. 473 – 479. [ Links ]
OBANDO, M. and JORDAN , M. Regenerative responses of Cyphomandra betacea (Cav.) Sendt. (Tamarillo) cultivated in vitro. En: Acta Horticulture. No. 560 (2001); p. 429 - 432. [ Links ]
RAMÍREZ, C. et al. Conservación de germoplasma de moras silvestres (Rubus spp.) de la cuenca del río El Palmar, municipio de Ubaqué (Cundinamarca, Colombia). Part II: Conservación y manejo ex situ. En: Plant Genetic Resources Newsletter. Vol. 115 (1998); p.13 – 22. [ Links ]
ZAMBRANO, A. Y., DEMEY, J. R. y GONZÁLEZ, V. Grupos homogéneos de crecimiento y manipulación in vitro de seis cultivares comerciales de caña de azúcar en Venezuela. En: Agronomía Tropical. Vol. 45, No.1 (1995); p. 51–72. [ Links ]