Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.29 no.87 Medellín July/Dec. 2007
ARTÍCULOS DE INVESTIGACIÓN
COMPOSICIÓN FLORÍSTICA Y DIVERSIDAD EN RODALES DE ELAEAGNUS ANGUSTIFOLIA L. (ELAEAGNACEAE)
FLORISTIC COMPOSITION AND DIVERSITY IN STANDS OF ELAEAGNUS ANGUSTIFOLIA L. (ELAEAGNACEAE)
Mercedes Girón–Vanderhuck1
1Universidad del Quindío. A. A. 460. Armenia (Quindío), Colombia. Dirección electrónica: <mercedesgiron@uniquindio.edu.co>.
Resumen
En Valdemoro (Madrid), España, se realizó un estudio para evaluar la composición florística y la diversidad de las herbáceas que crecen debajo y fuera del dosel de Elaeagnus angustifolia L., con el propósito de entender cómo está organizada la comunidad herbácea después del establecimiento de esta especie, en un lugar cuyo predominio en la primera mitad del siglo XX eran pastizales. Este estudio se efectuó en dos zonas que se diferenciaban en la perturbación antrópica y humedad del suelo. Se distribuyeron al azar 60 parcelas, cada una de un m2. En cada parcela se estimó el porcentaje de cobertura de todas las herbáceas y con base en este, se halló la diversidad. En las dos zonas, se encontró un total de 34 especies, clasificadas en 16 familias y 30 géneros, de las cuales ocho tenían una cobertura > 10%. La composición florística fue ligeramente similar entre las dos zonas, con 10 especies en común. El análisis factorial de componentes principales reflejó una separación entre las dos zonas, pero no mostró una ordenación de las unidades de muestreo con respecto al efecto dosel. Las dos zonas estudiadas presentaron una diversidad baja debido a la cobertura alta de unas pocas especies y, a pesar de que las zonas estaban contiguas, se diferenciaron en la composición florística y la diversidad (F = 22,726; p < 0,001). El establecimiento de E. angustifolia en Valdemoro afecto la composición florística, a través de un cambio en la comunidad herbácea.
Palabras clave: Composición florística, Dosel, Elaeagnus angustifolia, Herbáceas
Abstract
A study was carried out in Valdemoro (Madrid), Spain, in order to assess changes in floristic composition and diversity of plant community that develop under and outside of Elaeagnus angustifolia L. canopy, with the purpose of understanding how the herbaceous community is organized after the establishment of this species, in a place whose prevalence in the first half of the XX century was pastures. This study was conducted in two areas, which differed in anthropic disturbance and moisture soil. A total of 60 sampling plots, each one of a square meter, were laid out at random. In each quadrant, cover percentage was estimated for all herbaceous plant species. A total of 34 species in 16 families and 30 genera were found in two areas. Eight species were found with a covering > 10%. The floristic composition between the two areas was moderately similar with 10 species in common. The factorial analysis of main components reflected a separation among the two places, but it didn't show an ordination of the sampling units with regard to the canopy effect. Species diversity was low in the two areas because of the high covering of some species and, although the areas were contiguous, they differed in the floristic composition and diversity (F = 22.726; p < 0.001). The establishment of E. angustifolia in Valdemoro influenced floristic composition, through a change in the herbaceous community.
Key words: Canopy, Diversity, Elaeagnus angustifolia, Floristic composition, Herbaceous
INTRODUCCIÓN
La distribución de las especies en un hábitat local depende de la interacción que se establece entre ellas y el medio ambiente físico. Las especies arbóreas ejercen un efecto regulador de los factores climáticos, de tal manera que, diversifican ecológicamente el espacio alrededor de ellas. Por una parte, el dosel de los árboles reduce las temperaturas extremas en la superficie del suelo y desempeña un papel importante en el ciclo hidrológico afectando localmente la distribución de la lluvia por los procesos de intercepción, flujo de follaje, flujo caulinar y evapotranspiración. Esta alteración hidrológica reduce la magnitud de pérdida de nutrientes a través del lixiviado y escorrentía (Cavelier y Vargas, 2002). Por otra parte, los árboles con su sistema radical profundo, pueden tomar nutrientes del suelo a profundidades inalcanzables para otras especies del sotobosque. Además, los árboles suelen estar asociados con micorrizas en su inmensa mayoría, de tal manera que contribuyen notablemente al enriquecimiento del suelo con nutrientes (Montoya, 1982). Estos efectos modifican el microclima y las condiciones edáficas, afectando las comunidades herbáceas que pueden establecerse en cada lugar (Montoya y Meson, 1982). Por consiguiente, en una comunidad donde coexisten árboles y herbáceas, el efecto que tienen los primeros sobre el estrato herbáceo es múltiple e ineludible, cuando se trata de interpretar la estructura de la comunidad de herbáceas (Gómez–Gutiérrez, 1992; Tewksbury y Lloyd, 2001).
Las áreas localizadas fuera del dosel de los árboles están en condiciones ambientales más extremas que las ubicadas bajo la influencia del árbol. Esto condiciona el número y abundancia de las especies que se establecerán fuera y dentro del sotobosque (González–Bernáldez et al., 1969), debido a la heterogeneidad ambiental generada por la presencia de un estrato arbóreo (Fernández y Porras, 1998).
Cuando un sitio es colonizado por árboles actinorrícicos, estos tienen un efecto pronunciado sobre los procesos del ecosistema, ya que contribuyen al incremento de la materia orgánica y estructuración del suelo y crean un hábitat más favorable para el establecimiento de otras especies vegetales (Bermúdez de Castro, 1988). Es el caso de Elaeagnus angustifolia L. (Elaeagnaceae), conocida comúnmente como árbol del paraíso, una planta actinorrícica de origen eurasiático que se ha naturalizado y ha invadido zonas a lo largo de corrientes de agua en muchas regiones áridas y semiáridas del mundo (Klich, 2000) y que, por procesos de descomposición, contribuye de manera significativa al enriquecimiento de los suelos con nitrógeno (Girón, 2004; Katz y Shafroth, 2003; Simons y Seastedt, 1999).
En Valdemoro, a 26 km al sur de Madrid (España), E. angustifolia colonizó un terreno bajo, de humedad y salinidad altas, ocupado en la primera mitad del siglo XX sólo por herbáceas, y lo transformó en un área arbolada, considerada actualmente como un sitio de interés público, donde se llevan a cabo actividades educativas y de esparcimiento (Ayuntamiento de Valdemoro, 2001).
La comunidad de herbáceas en Valdemoro fue evaluada por Ron (1971), en el ámbito de la composición florística, pero no se tienen datos sobre la cobertura de las especies ni sobre la composición florística actual, que ayuden a entender cómo está organizada la comunidad vegetal. Por esta razón, se pretende conocer las características actuales de esta comunidad, mediante la riqueza y cobertura de las herbáceas que se desarrollan debajo y fuera del dosel de E. angustifolia. Se toma entonces como variable ecológica condicionante la presencia y efecto del dosel de los ejemplares de E. angustifolia sobre la comunidad herbácea.
MATERIALES Y MÉTODOS
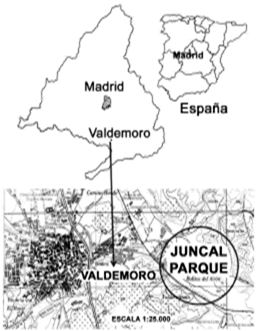
Área de estudio. El área de estudio está localizada en la Villa de Valdemoro, a 26 km al sur de Madrid (España), entre las coordenadas 40º 11' 04' N y 3º 41' 10' O., ubicada al este del casco urbano, junto a las instalaciones del Polideportivo Municipal (figura 1), entre los cerros del Espartal y el de los Yesares, ocupa una superficie de 35,34 ha (Ayuntamiento de Valdemoro, 2003). Esta área está colonizada por árboles de E. angustifolia que se desarrollaron sobre una pradera juncal salina mediterránea, de la clase Juncetea maritimi Br. Bl., donde los sedimentos yesíferos miocénicos constituyen un medio particular para la vida vegetal. En el sitio se observan dos zonas, una, ubicada entre el arroyo de la Cañada y el cerro de los Yesares con una superficie de 31,34 ha, fue declarada por el Ayuntamiento de Valdemoro como Parque Bolitas del Airón para uso recreativo y educativo, y, la otra, situada entre el cerro del Espartal y el arroyo antes mencionado con una superficie de 3 ha, está sin intervenir y los árboles se agrupan formando islas entre las cuales crecen juncales.
Figura 1. Ubicación geográfica del área de estudio en Valdemoro (Madrid), España (basada en el Mapa Topográfico Nacional de España, edición 1997)
El área de estudio se halla en la cuenca alta del Tajo, en la depresión terciaria miocénica de la región Castellano–Manchega y participa de las características geológicas y fisiográficas del borde occidental de la fosa del Tajo (Bourgón et al., 1975).
Los suelos de los cerros del Espartal y de los Yesares, que rodean la zona de estudio, son leptosoles rendsínicos asociados con cambisoles calcáricos. Normalmente el material originario está constituido por alternancia de yesos y margas yesíferas. En la zona del valle, donde están los árboles del paraíso, el suelo es un Solonchack yesoso, gley alcalino, con gran concentración de sales solubles en agua, debido al ascenso capilar y evaporación del agua subterránea rica en sales. En verano, las sales se concentran en la superficie, proporcionando al suelo un aspecto blanquecino, mientras que en la época húmeda se disuelven, de forma que su aspecto es muy diferente en verano y en invierno (Monturiol y Alcalá del Olmo, 1990).
El clima es mediterráneo árido del subtipo mesomediterráneo atenuado (Allue–Andrade, 1990). La temperatura promedio en el período estival es de 26 °C y en el invierno, de 6 °C. Las precipitaciones se producen principalmente en la época fría, entre 340 y 513 mm, siendo poco frecuentes las nevadas.
Diseño experimental. El muestreo de campo se realizó en mayo de 2002 en las dos zonas mencionadas en el área de estudio, y que de ahora en adelante se nombraran como zona del parque y zona del juncal. En cada zona se hicieron muestreos de las herbáceas que crecían fuera y debajo del dosel de E. angustifolia. Se utilizó la unidad de muestreo de un m2 sugerida por Kent y Coker (1996) para vegetación herbácea. En el parque, se obtuvieron 40 unidades de muestreo (20 fuera y 20 debajo del dosel) y en el juncal, se realizaron 20 (10 fuera y 10 debajo del dosel). Se utilizaron dos rutas para hacer el muestreo. Se tomó como punto de partida de las rutas el inicio del camino, donde se eligió un número al azar para contar pasos en dirección de los cerros (en la zona del parque, en dirección del cerro de los Yesares, y en la del juncal, en dirección del cerro del Espartal) y se hizo un recorrido en zigzag eligiendo las localizaciones de las unidades de muestreo al azar.
Cobertura. En las unidades de muestreo descritas arriba, se midió la altura de los individuos en el campo y se registró visualmente la cobertura de cada especie vegetal. Esto se hizo estimando el tanto por ciento de la superficie del suelo que está recubierto por la proyección vertical de las partes aéreas de la vegetación (Kent y Coker, 1996). Además, se obtuvo la frecuencia de cada especie.
Composición florística. Con los ejemplares recolectados en las unidades de muestreo, se hizo una lista de las especies que crecen en las dos zonas. Los ejemplares recogidos se identificaron con las claves de Tutin et al. (1964–1980) y Castroviejo et al. (1986–2001) y se encuentran depositados en el Herbario Madrid Ciencias Biológicas (MACB).
Diversidad. Se estimó la diversidad con el índice de Shannon–Wiener, H' = –Ópi log2 pi, donde pi corresponde a la probabilidad de encontrar un individuo de una especie dada entre el conjunto de individuos que aportan todas las especies presentes (Magurran, 1988). La equidad se calculó según la fórmula de Pielou, J' = H'/log2 S, siendo S = número de especies (Pielou, 1975). También se calculó el índice de diversidad de Simpson como D = Ópi2;. Este índice está influido por las especies más abundantes de la muestra, mientras que es menos sensible a la riqueza de especies (Magurran, 1988). La riqueza hace referencia al número de especies por m2, que es la medida más comúnmente utilizada para analizar comunidades vegetales (Bunce y Shaw, 1973).
Análisis estadístico. Antes de proceder con el análisis estadístico se comprobó la normalidad y homogeneidad de varianzas para cada índice de diversidad, equidad y riqueza. Se empleó un análisis de varianza (ANOVA) de dos factores para comprobar si habían diferencias significativas entre los sitios (Parque y Juncal) y debajo y fuera del dosel. Cuando las diferencias eran significativas se utilizó la prueba de Tukey para explicar las diferencias entre niveles del factor sitio y factor dosel.
Se elaboró un análisis factorial en componentes principales sobre la matriz formada por los valores de cobertura de las diferentes especies (variables) en cada uno de los cuadrantes (casos) de las dos zonas, fuera y debajo del dosel de los árboles. Esto se hizo con el fin de ordenar las observaciones en función de las variables y determinar si su tendencia de variación se identifica o no con el efecto dosel (debajo y fuera). Los análisis estadísticos se realizaron con el programa STATISTICA 5.1 (1997).
RESULTADOS
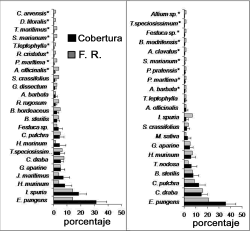
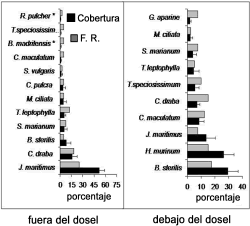
Cobertura. En la caracterización de la comunidad herbácea se encontró que en la zona del parque, fuera del dosel de E. angustifolia, sólo dos especies presentaron una cobertura superior al 10%: Elymus pungens (Pers.) Melderis (31,3%) e Iris spuria L. (18,4%); en las especies restantes fue inferior al 10%. En esta misma zona, debajo del dosel, se hallaron 3 especies con un porcentaje de cobertura mayor al 10%: E. pungens (35,65%), Cardaria draba (L.) Desv. (Brassicaceae) (14,85%) y Crepis pulchra (Asteraceae) (12,55%) (figura 2). En la zona del juncal, fuera del dosel, dos especies fueron las de más alta cobertura: Juncus maritimus Lam. (51,6%) y C. draba (16,2%); las demás no sobrepasaron el 9% de cobertura. Debajo del dosel, Bromus sterilis L., Hordeum murinum L. y J. maritimus presentaron la cobertura más alta con una media de 29,5, 26,3 y 13,5%, respectivamente (figura 3). Asimismo las especies con una cobertura superior al 10% fueron las más frecuentes.
Figura 2. Cobertura y frecuencia relativa (F. R.) de las especies encontradas en la zona del parque en Valdemoro (Madrid), España, fuera y debajo del dosel de Elaeagnus angustifolia L. (media ± error estándar; n = 20; el asterisco indica las especies con una cobertura inferior a 1%; el nombre completo de los géneros aparece en la tabla 1)
Figura 3. Cobertura y frecuencia relativa (F. R.) de las especies encontradas en la zona del juncal en Valdemoro (Madrid), España, fuera y debajo del dosel de Elaeagnus angustifolia L. (media ± error estándar; n = 20; el asterisco indica las especies con una cobertura inferior a 1%; l nombre completo de los géneros aparece en la tabla 1)
La gran mayoría de las plantas herbáceas que crecen en el sotobosque alcanzan alturas promedio de 95 cm, como S. marianum y T. speciosissimum y otras pueden llegar hasta el metro y medio como es el caso de C. maculatum. En general, las especies herbáceas que crecen en las dos zonas alcanzan alturas entre 50 y 100 cm.
Composición florística. La determinación taxonómica de las diferentes muestras vegetales recolectadas en las dos zonas, reveló la presencia de 34 especies agrupadas en 16 familias botánicas y 30 géneros. Las familias con mayor número de especies fueron: Poaceae con 11 especies y Asteraceae con 4 (tabla 1).
Tabla 1. Lista de familias y especies encontradas fuera y debajo del dosel de E. angustifolia en Valdemoro (Madrid), España (* = las especies reportadas por Ron (1971) y que en la actualidad se encuentran en Valdemoro)
De las 45 especies que Ron (1971) encontró, hace más de tres décadas, en el área tenida en cuenta en este trabajo, sólo 14 están presentes en la actualidad. Comparando estos resultados, se observa que E. pungens, actualmente muy abundante en el parque, no aparece en la lista florística presentada por Ron (1971), pero I. spuria y C. draba, que son las hierbas con mayor cobertura después de E. pungens, se encuentran dentro de las especies que forman parte de la subalianza Apio–Juncion maritimi Riv.–God. y Riv.–Mart. 1963, citada por Ron (1971).
Las dos zonas comparten 10 especies, las cuales se encontraron tanto fuera como debajo del dosel de los árboles: Torilis leptophylla (L.) Reichenb, C. pulchra, Sylibum marianum Gaertn., C. draba, J. maritimus, B. madritensis, B. sterilis, H. murinum, Thalictrum speciosissimum L. y Galium aparine L. En la zona del juncal aparecen 4 especies: Conium maculatum L., Melica ciliata L., Rumex pulcher L. y Silene vulgaris (Moench) Garcke, que no fueron registradas en las unidades de muestreo de la zona del parque. Mientras que, en ésta última zona, se hallaron 20 especies que no aparecieron en la zona del juncal (tabla 1).
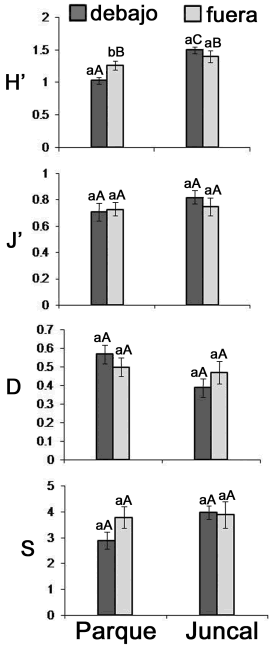
Diversidad. El índice de Shannon–Weiner mostró diferencias significativas para el factor sitio (F = 22,726; p << 0,001), pero no para el factor dosel (F = 0,076; p = 0,784). Sin embargo, hubo interacción significativa entre los factores sitio y dosel (F = 8,484; p = 0,005). En el parque este índice fue significativamente mayor fuera del dosel que debajo, mientras que en el juncal no se encontraron diferencias significativas fuera y debajo del dosel. Los demás índices no arrojaron diferencias significativas para los factores sitio y dosel, y su interacción (figura 4).
Figura 4. Medias de la diversidad de Shannon (H'), equidad (J'), dominancia (D) y riqueza de la comunidad herbácea de dos zonas (Parque y Juncal) fuera y debajo del dosel de los árboles de E. angustifolia en Valdemoro (Madrid), España [media ± error estándar; parque, n = 20; juncal, n = 10; las letras diferentes dentro de cada muestreo son significativamente distintas al 5%; las minúsculas comparan el efecto dosel (fuera y debajo) y las mayúsculas, las dos zonas]
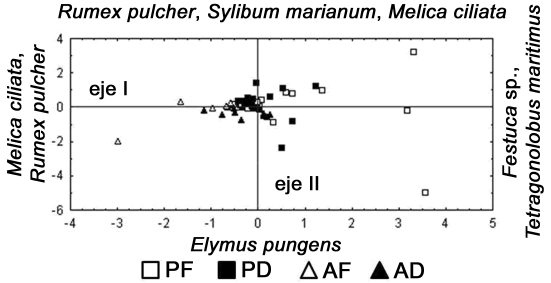
La absorción de varianzas, arrojada por el análisis factorial de componentes principales, no es muy alta pero permite identificar alguna tendencia de ordenación. La figura 5 muestra como están ordenadas las unidades de muestreo considerando su clasificación previa, según la zona a que pertenecen, fuera y debajo del dosel, en el plano factorial definido por los dos primeros ejes del análisis de componentes principales. El eje 1 absorbe sólo el 8,7% de la varianza total. En la parte positiva del eje se sitúan la mayoría de unidades de muestreo de la zona del parque, siendo los factores de carga más importantes Tetragonolobus maritimus (Fabaceae) (0,637), Festuca sp. (Poaceae) (0,595), Rapistrum rugosum (Brassicaceae) (0,474), Geranium dissectum (Geraniaceae) (0,464) y Rumex cristatus (Polygonaceae) (0,441); las unidades de muestreo de la zona del juncal se disponen en la parte negativa del eje, siendo los factores de carga principales las especies M. ciliata (–0,471), R. pulcher (–0,394) y J. maritimus (–0,378). El primer componente refleja una separación entre las dos zonas, al oponer los factores de carga de especies propias de cada zona. No existe una ordenación de las unidades de muestreo con respecto al efecto de dosel.
Figura 5. Situación de las unidades de muestreo en el plano factorial definido por los dos primeros ejes del análisis de componentes principales (PF = zona del parque fuera del dosel; PD = zona del parque debajo del dosel; AF = zona del juncal fuera del dosel; AD = zona del juncal debajo del dosel)
El eje 2 absorbe el 8 % de la varianza total. Este segundo componente principal tiene como factores de carga más destacados a Melica ciliata (Poaceae) (0,626), Rumex pulcher (Polygonaceae) (0,596), Silybum marianum (Asteraceae) (0,579) y Festuca sp. (Poaceae) (0,504). Con respecto a este eje, las unidades de muestreo ubicadas fuera del dosel son más heterogéneas porque se disponen dispersas; mientras que las situadas debajo del dosel son más homogéneas debido a que están agrupadas hacia el centro del eje.
En resumen, el estudio multivariante muestra una separación entre las unidades de muestreo de las dos zonas, pero no entre las situadas fuera y debajo del dosel. La mayoría de los puntos en la gráfica se agrupan alrededor del centro de unión entre los ejes de los dos componentes y las observaciones no se ordenan con respecto a estos componentes según una tendencia interpretable.
DISCUSIÓN
Las especies dominantes fueron E. pungens e I. spuria en la zona del parque y J. maritimus y H. murinum en el juncal, debido a su cobertura alta tanto debajo como fuera del dosel de E. angustifolia. Posiblemente estas especies se comporten como invasoras o generalistas, y se ubiquen en los espacios donde la disponibilidad de luz y nutrientes sean las más adecuadas para su establecimiento. Las especies generalistas aprovechan la variedad de condiciones físicas generadas por la presencia arbórea para establecerse de manera exitosa (Damascos y Rapoport, 2002). A su vez, el éxito en el establecimiento y crecimiento de las especies en un determinado ambiente está estrechamente relacionado con los caracteres morfológicos y fisiológicos asociados a la captura de recursos como luz y nutrientes (Canham et al., 1994).
El cambio observado en la composición florística después del establecimiento de E. angustifolia, se evidenció en el bajo porcentaje de especies que permanecieron en la zona de estudio, desde que Ron (1971) hiciera el inventario florístico en Valdemoro, y en la aparición de un porcentaje alto de nuevas especies distribuidas debajo y fuera del dosel de los árboles. Esto se puede explicar por la heterogeneidad ambiental generada por la presencia de los árboles y la respuesta de las herbáceas a las nuevas condiciones ambientales creadas por E. angustifolia. Se sabe que los árboles pueden modificar el hábitat y generar variación espacial en la disponibilidad de recursos (Catovsky y Bazzaz, 2000). Este hecho, asociado a las diferencias interespecíficas en los requerimientos de luz y nutrientes de cada especie, conduce a cambios en la composición de especies (Finzi y Canham, 2000).
El hecho de que E. angustifolia sea una especie actinorrícica y que aporte al suelo de Valdemoro cantidades suficientes de nitrógeno por procesos de descomposición (Girón, 2004), es un aspecto que pudo influir en la composición florística y diversidad actual. Posiblemente, algunas de las especies, además de tolerar la sombra, son exigentes con respecto a la fertilidad del suelo y necesitan un suministro alto de nitrógeno para su crecimiento y desarrollo. Por ejemplo, Bromus hordeaceus L., B. madritensis L., B. sterilis, H. murinum, G. aparine y T. nodosa, que se encontraron creciendo debajo del dosel, son consideradas por González–Bernáldez (1986) y, Montoya y Meson (1982) como nitrófilas. Así que su presencia indicaría las condiciones de fertilidad del suelo en el sotobosque de E. angustifolia. Esta fertilidad podría incidir en la productividad de la comunidad. Varios autores han comprobado que el aumento en la productividad, vía adición de nitrógeno, generalmente conduce a una disminución en la riqueza que, a su vez, está acompañada por el incremento en la dominancia de unas pocas especies que monopolizan la radiación incidente (Gough et al., 2000; Hector et al., 1999; Huenneke et al., 1990; Rajaniemi, 2003; Schade et al., 2003; Shaltout et al., 1995; Tilman 1982, 1987, 1993). Esto es lo que posiblemente sucede en el área de estudio, donde unas cuantas especies dominan sobre las demás, al presentar valores de cobertura y altura altos. Varios autores sugieren que los hábitats productivos tienen menor diversidad, debido a la dominancia de unas pocas especies altamente competitivas (Grime, 1979; Loreau et al., 2001; Rajaniemi, 2002).
No se registró un efecto del dosel sobre la composición florística debido a que la mayoría de las especies se encontraron tanto debajo como fuera del dosel de los árboles. Pero, si se observó diferencia en la composición florística y diversidad de las dos zonas. Esto posiblemente se debe a que en la zona del juncal, el nivel freático es más alto, lo que influye en el establecimiento y permanencia de las especies mejor adaptadas a estas condiciones. La capacidad competitiva de algunas de las especies herbáceas, tolerantes a las condiciones de encharcamiento del suelo, puede conducir a la exclusión de otras menos competitivas, reduciendo así la diversidad de la comunidad herbácea. Pineda et al. (1991) plantean que una diversidad baja puede darse cuando las condiciones físicas del lugar o las relaciones de competencia interespecífica sólo ofrecen ciertas ventajas selectivas para la vida de unas pocas especies. En muchos tipos de vegetación herbácea la dominancia competitiva es uno de los mecanismos que controlan la densidad o cobertura de las especies (Grime, 1979; Rajaniemi, 2003).
La riqueza y diversidad hallada en la comunidad de herbáceas, que crece debajo y fuera del dosel de los árboles del paraíso, es muy baja comparada con la de otras comunidades de pastizales mediterráneos. Marañón (1985) registró 37,1 y 34,8 especies m–2 en pasto abierto y sombra de copa respectivamente. En pastizales mediterráneos, bajo presión de pastoreo, se ha encontrado una diversidad alta, con valores para el índice de Shannon entre 3,5 y 5 (Montalvo et al., 1993; Pineda et al., 1981).
Un factor que puede influir en la diversidad baja es la perturbación producida por la afluencia de visitantes al área de estudio, que ejercen un efecto negativo sobre la vegetación debido al pisoteo. Andersen (1995) e Ikeda (2003) demostraron que el pisoteo reduce la riqueza y diversidad de especies herbáceas. Además, Grime (1979) plantea que la dominancia de algunas especies en la comunidad de herbáceas está asociada no sólo a la fertilidad del suelo, sino a circunstancias en que la comunidad vegetal está sometida a perturbación. Marañón (1997) trata este aspecto citando a varios autores que lo interpretan como el efecto de la acción combinada de dos procesos: en condiciones adversas o con perturbación intensa sólo sobreviven una pocas especies tolerantes, lo que conduce a una biomasa y diversidad bajas y en el extremo opuesto, con gran disponibilidad de agua y nutrientes, la exclusión competitiva provocada por las especies dominantes también produce una reducción en la diversidad.
La salinidad es otro factor que puede influir en la distribución y abundancia de las especies en la zona de estudio. El suelo de las dos zonas estudiadas tiene una salinidad que varía entre 1,562 y 3,688 mS cm–1 (Girón, 2004). Esta característica, asociada a la adaptación de las plantas para sobrevivir en este medio y su capacidad para tolerar las condiciones edáficas locales, pueden estar ejerciendo un efecto sobre la diversidad. La salinidad es un factor que se convierte en limitante para muchas especies (Barbour, 1970, 1978). Un hábitat salino con frecuencia tiene diversidad baja, algunas veces sólo una especie dominante, debido a que son pocas las plantas capaces de resistir el daño causado por la sal (Perry y Atkinson, 1997). Shaltout et al. (1995) hallaron una diversidad baja, entre 0,9 y 0,8 para el índice de Shannon, en la vegetación herbácea que crecía sobre un Solonchak con una concentración salina de 2,0 y 3,4 mS cm–1 en la región mediterránea del Delta del Nilo. Resultados semejantes se han encontrado en comunidades vegetales de algunos humedales salinos mediterráneos (Shaltout y El–Ghareeb, 1992; García et al., 1993). García y sus colaboradores señalaron también que las condiciones de salinidad elevada y encharcamiento excluían numerosas especies vegetales, pero las pocas capaces de tolerar estas limitaciones podían alcanzar valores muy altos de biomasa. Establecieron que la reducción en la diversidad está asociada con una biomasa elevada y un efecto de exclusión competitiva. Aunque estos aspectos no se tuvieron en cuenta, se puede plantear que, debido a la cobertura y porte altos alcanzados por las herbáceas en las dos zonas, se esperaría encontrar una biomasa alta que afectara la disponibilidad de luz y nutrientes para el establecimiento de otras especies de menor porte.
La aparición de E. angustifolia en Valdemoro determinó un cambio en la composición florística de la comunidad herbácea. Las dos zonas estudiadas presentaron una diversidad baja debido a la cobertura alta de unas pocas especies y, a pesar de que la zona del parque estaba contigua a la del juncal, se diferenciaron en la composición florística y la diversidad.
AGRADECIMIENTOS
A los doctores Francisco Bermúdez de Castro y Naya y María Esther Pérez Corona del Departamento de Ecología de la Universidad Complutense de Madrid por sus comentarios y discusiones sobre este trabajo. A la doctora María Eugenia Ron Álvarez del departamento de Biología Vegetal I de la Universidad Complutense de Madrid por la determinación de las plantas. A Pedro Frontelo, Técnico de Medio Ambiente del Ayuntamiento de Valdemoro, por las facilidades dadas para trabajar en el Parque Natural Bolitas del Airón. A Jaina Corona por la ayuda en los trabajos de campo.
REFERENCIAS
1. Allue–Andrade JL. 1990. Atlas fitoclimático de España: Taxonomías. Ministerio de Agricultura Pesca y Alimentación. Instituto Nacional de Investigaciones Agrarias. Madrid, España. [ Links ]
2. Ayuntamiento de Valdemoro. 2001. Parajes de Valdemoro (VI): Parque Bolitas del Airón. Informativo Municipal Valdemoro, 113:22–25. [ Links ]
3. Ayuntamiento de Valdemoro. 2003. Informe de Gestión 1999–2003. Publicaciones Ayuntamiento de Valdemoro. Madrid, España. [ Links ]
4. Andersen UV. 1995. Resistance of Danish coastal vegetation types to human trampling. Biological Conservation, 71:223–230. [ Links ]
5. Barbour MG. 1970. Is any angiosperm an obligate halophyte? American Midland Naturalist, 84:105–120. [ Links ]
6. Barbour MG. 1978. The effect of competition and salinity on the growth of a salt marsh plant species. Oecologia, 37:93–99. [ Links ]
7. Bermúdez de Castro F. 1988. Las plantas actinorrizas y la sucesión. Pp. 435–439. En: L. Villar (ed.). Homenaje a Pedro Montserrat. Monografía del Instituto Pirenaico de Ecología 4, Jaca. Publicaciones CSIC. Zaragoza, España. [ Links ]
8. Bourgón PM, Campos JC, Vegas MR, Pérez GA, Míquez MF. 1975. Hoja de Getafe. Mapa Geológico de España, escala 1:50.000. Servicio de Publicaciones Ministerio de Industria. Madrid, España. [ Links ]
9. Bunce RGH, Shaw MW. 1973. A standarized procedure for ecological survey. Journal Environmental and Management, 1:239–285. [ Links ]
10. Canham C, Finzi A, Pacala S, Burbank D. 1994. Causes and consequences of resource heterogeneity in forests: interspecific variation in light transmission by canopy trees. Canadian Journal of Forest Research, 24:337–349. [ Links ]
11. Castroviejo S, Laínz M, López–González G, Montserrat P, Muñoz–Garmendia F, Paiva J, Villar L (eds.). 1986–2001. Flora Ibérica. Ediciones Real Jardín Botánico, CSIC. Madrid, España. [ Links ]
12. Catovsky S, Bazzaz F. 2000. The role of resource interactions and seedling regeneration in maintaining a positive feedback in hemlock stand. Journal of Ecology, 88:100–112. [ Links ]
13. Cavelier J, Vargas G. 2002. Procesos hidrológicos. Pp 145–165. En: Guariguata MR, Kattan GH (eds.). Ecología y conservación de bosques neotropicales. Ediciones Libro Universitario Regional (LUR). Cartago, Costa Rica. [ Links ]
14. Damascos MA, Rapoport EH. 2002. Diferencias en la flora herbácea y arbustiva entre claros y áreas bajo dosel en un bosque de Nothofagus pumilio en Argentina. Revista Chilena de Historia Natural, 75:465–472. [ Links ]
15. FAO. 1989. Mapa mundial de suelos. FAO. Roma, Italia. [ Links ]
16. Fernández RP, Porras TCJ. 1998. La Dehesa. Algunos aspectos para la regeneración del arbolado. Informaciones técnicas 58/98. Dirección General de Investigación y Formación Agraria, Servicio de Publicaciones y Divulgación. Sevilla, España. [ Links ]
17. Finzi A, Canham C. 2000. Sapling growth in response to light and availability in a southern New England Forest. Forest Ecology and Management, 131:153–165. [ Links ]
18. García LV, Marañón T, Moreno A, Clemente L. 1993. Above–ground biomass and species richness in a mediterranean salt marsh. Journal Vegetation of Science, 4:417–424. [ Links ]
19. Girón VMM. 2004. Evolución del bosquete de Elaeagnus angustifolia L. en Valdemoro (Madrid). Tesis doctoral. Departamento de Ecología, Facultad de Ciencias Biológicas, Universidad Complutense de Madrid. Madrid, España. [ Links ]
20. Gómez Gutiérrez JM. 1992. Orígenes del monte adehesado y situación actual. Pp. 19–32. En: Gómez–Gutiérrez JM (ed.). El libro de las dehesas salmantinas. Junta de Castilla y León, Consejería del Medio Ambiente y O. T., Secretaría General, Servicio de Educación Ambiental. Salamanca, España. [ Links ]
21. González–Bernáldez F. 1986. Gramíneas pratenses de Madrid. Comunidad de Madrid. Madrid, España. [ Links ]
22. González–Bernáldez F, Morey M, Velasco F. 1969. Influences of Quercus ilex rotundifolia on the herb layer at the El Pardo forest (Madrid). Boletín de la Real Sociedad Española de Historia Natural, Sección Biológica, 67:265–284. [ Links ]
23. Gough L, Osenberg CW, Gross KL, Collins SL. 2000. Fertilization effects on species density and primary production in herbaceous plant communities. Oikos, 89:428–439. [ Links ]
24. Grime JP. 1979. Plant strategies and vegetation processes. John Wiley & Sons. New York, United States. [ Links ]
25. Hector A, Schmid B, Beierkuhnlein C, Caldeira MC, Diemer M, Dimitrakopoulus PG, Finn JA, Freitas H, Giller PS, Good J, Harris R, Högberg P, Huss–Danell K, Joshi J, Jumpponen A, Körner C, Leadley PW, Loreau M, Minns A, Mulder CPH, O'Donovan G, Otway SJ, Pereira JS, Prinz A, Read DJ, Scherer–Lorenzen M, Schulze ED, Siamantziouras ASD, Spehn E, Terry AC, Troumbis AY, Woodward FA, Yachi S, Lawton JH. 1999. Plant diversity and productivity experiments in European grasslands. Science, 286:1123–1127. [ Links ]
26. Huenneke LF, Hamburg SP, Koide R, Mooney HA, Vitousek PM. 1990. Effects of soil resources on plant invasion and community structure in Californian Serpentine Grassland. Ecology, 71(2):478–491. [ Links ]
27. Ikeda H. 2003. Testing the intermediate disturbance hypothesis on species diversity in herbaceous plant communities along a human trampling gradient using a 4–year experiment in an old–field. Ecological Research, 18:185–197. [ Links ]
28. Katz GL, Shafroth PB. 2003. Biology, ecology and management of Elaeagnus angustifolia L. (Russian olive) in Western North America. Wetlands, 23(4):763–777. [ Links ]
29. Kent M, Coker P. 1996. Vegetation description and analysis: A practical approach. John Wiley & Sons. New York, USA. [ Links ]
30. Klich MG. 2000. Leaf variations in Elaeagnus angustifolia related to environmental heterogeneity. Environmental and Experimental Botany, 44(3):171–183. [ Links ]
31. Loreau M, Naeem S, Inchausti P, Bengtsson J, Grime JP, Hector A. 2001. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 294:804–808. [ Links ]
32. Magurran AE. 1988. Ecological diversity and its measurement. Princeton University Press. New Jersey, U. S. A. [ Links ]
33. Marañón T. 1985. Diversidad florística y heterogeneidad ambiental en una dehesa de Sierra Morena. Anales de Edafología y Agrobiología, 44:1183–1197. [ Links ]
34. Marañón T. 1997. Ponencia: Biodiversidad de las comunidades vegetales: Escalas y componentes. Pp. 15–24. En: S. E. P. P. (eds.). Los pastos extensivos: Producir conservando. XXXVII Reunión Científica de la Sociedad Española para el Estudio de los Pastos. Junta de Andalucía, Conserjería de Agricultura y Pesca. Sevilla–Huelva, España. [ Links ]
35. Montalvo J, Casado MA, Levassor C, Pineda FD. 1993. Species diversity patterns in Mediterranean grasslands. Journal of Vegetation Science, 4:213–222. [ Links ]
36. Montoya OJM. 1982. Efectos del arbolado de las dehesas sobre los factores ecológicos que actúan al nivel del sotobosque. Anales del INIA (Serie Forestal), 5:61–85. [ Links ]
37. Montoya OJM, Meson GML. 1982. Intensidad y efectos de la influencia del arbolado de las dehesas sobre la fenología y composición específica del sotobosque. Anales del INIA (Serie Forestal), 5:43–59. [ Links ]
38. Monturiol RF, Alcalá del Olmo BL. 1990. Mapa de asociaciones de suelos de la comunidad de Madrid. Ediciones CSIC. Madrid, España. [ Links ]
39. Perry JE, Atkinson RB. 1997. Plant diversity along a salinity gradient of four marshes on the York and Pamunkey rivers in Virginia. Castanea, 62(2):112–118. [ Links ]
40. Pielou EC. 1975. Ecological diversity. John Wiley & Sons. New York, U. S. A. [ Links ]
41. Pineda FD, Nicolás JP, Ruiz M, Peco B, Bernáldez FG. 1981. Succession, diversité et amplitude de niche dans les pâturages du centre de la péninsule ibérique. Vegetatio, 47:267–277. [ Links ]
42. Pineda FD, Di Castri F, Orcoyen CG, Villanueva JR. 1991. Estudio y conservación de la diversidad biológica. Pp. 15–19. En: Pineda FD, Casado MA, De Miguel JM, Montalvo J (eds.). Diversidad biológica/Biological diversity. Ediciones Areces–Adena/WWF–SCOPE. Madrid, España. [ Links ]
43. Poole RW. 1974. An introduction to quantitative ecology. McGraw–Hill. New York, U. S. A. [ Links ]
44. Rajaniemi TK. 2002. Why does fertilization reduce plant species diversity? Testing three competition–based hypotheses. Journal of Ecology, 90:316–324. [ Links ]
45. Rajaniemi TK. 2003. Explaining productivity–diversity relationships in plants. Oikos, 101:449–457. [ Links ]
46. Ron ME. 1971. Sobre el carácter subespontáneo de Elaeagnus angustifolia L. Anales de la Real Academia de Farmacia, 37:229–240. [ Links ]
47. Schade JD, Sponseller R, Collins SL, Stiles A. 2003.The influence of Prosopis canopies on understorey vegetation: Effects of landscape position. Journal of Vegetation Science, 14:743–750. [ Links ]
48. Shaltout KH, El–Ghareeb R. 1992. Diversity of the salt marsh plant communities in the Western Mediterranean region of Egypt. Journal of University Kuwait (Sciences), 19:75–84. [ Links ]
49. Shaltout KH, El–Kady HF, Al–Soday YM. 1995. Vegetation analysis of the Mediterranean region of Nile Delta. Vegetatio, 116:73–8. [ Links ]
50. Simons SB, Seastedt TR. 1999. Decomposition and nitrogen release form foliage of cottonwood (Populus deltoides) and Russian–olive (Elaeagnus angustifolia) in a riparian ecosystem. The Southwestern Naturalist, 44(3):256–260. [ Links ]
51. Tewksbury JJ, Lloyd JD. 2001. Positive interactions under nurse–plants: spatial scale, stress gradients and benefactor size. Oecologia, 127:425–434. [ Links ]
52. Tilman D. 1982. Nutrient limitations to plant growth in California serpentine grassland. American Midland Naturalist, 107:95–99. [ Links ]
53. Tilman D. 1987. Secondary succession and the pattern of plant dominance along experimental nitrogen gradients. Ecological Monographs, 57:189–214. [ Links ]
54. Tilman D. 1993. Species richness of experimental productivity gradients: how important is colonization limitation? Ecology, 74:2179–2191. [ Links ]
55. Tutin TG, Heywood VH, Burges NA, Moore DM, Valentine DH, Walters SM, Webb DA (eds.). 1964–1980. Flora Europea. Cambridge University Press. Cambridge, England. [ Links ]
Recibido: agosto 2007
Aceptado: noviembre 2007