Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.37 no.102 Medellín Jan./June 2015
ARTÍCULOS DE INVESTIGACIÓN
Hábitos alimenticios y aspectos del uso del hábitat por el chivo cabezón Ariopsis sp. (aff. assimilis) (Siluriformes: Ariidae), en una laguna costera neotropical (Ecorregión Darién, Colombia)
Food habits and aspects of habitat use by the catfish Ariopsis sp. (aff. assimilis) (Siluriformes: Ariidae) in a Neotropical coastal lagoon (Darien Ecoregion, Colombia)
Luis Sandoval-Londoño1,2,3, Jenny Leal-Flórez1,2,4, Juan F. Blanco-Libreros2,5, Alexander Taborda-Marín2,6
1 Grupo de Investigación en Sistemas Marinos y Costeros (GISMAC), Corporación Académica Ambiental, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
2 Grupo de Ecología Lótica: Islas, Costas y Estuarios (ELICE), Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
Correos electrónicos: 3 sandovalejo@gmail.com; 4 jeleal@quimbaya.udea.edu.co; 5 blanco@exactas.udea.edu.co; 6 alextaborda@gmail.com.
Recibido: marzo 2014; aceptado: octubre 2014
Resumen
El ''chivo cabezón'' Ariopsis sp. (aff. assimilis), es una especie estuarina endémica de la costa Caribe colombiana y del Oeste venezolano, pero está en peligro de extinción debido a la presión por pesca artesanal. Se estudió su alimentación y aspectos del uso del hábitat mediante su distribución espacial y estacional (densidad y biomasa) en la Bahía El Uno, golfo de Urabá (departamento de Antioquia), Colombia, a lo largo del gradiente ambiental definido por la pluma turbia del río Turbo (Ecorregión Darién). Los peces de tallas grandes se alimentaron principalmente de peces, crustáceos anomuros y camarones, presentando una tendencia a una dieta generalista, mientras que los pequeños lo hicieron principalmente de copépodos, siendo consumidores especialistas, evidenciando cambios ontogénicos en la alimentación de la población. Se plantea la hipótesis que esta especie puede presentar patrones de distribución y utilización del hábitat de forma secuencial en tiempo y espacio o programación estacional. La parte baja del estuario podría jugar un papel importante en la reproducción como hábitat de peces grandes, los cuales pueden incubar huevos principalmente durante la época seca, mientras que las zonas de la parte media y alta, que se encuentran bordeadas por bosque de manglar, se podrían considerar como zonas importantes de crianza, presentando mayor abundancia de peces pequeños en la época de lluvia.
Palabras clave: bagres marinos, alimentación, distribución, gradiente ambiental, especie vulnerable, Bahía El Uno Turbo
Abstract
The New Granada sea catfish, Ariopsis sp. (aff. assimilis) is a species endemic to the Colombian Caribbean coast and the western coast of Venezuela, but it is endangered due to pressures from artisanal fishing. Diet and aspects of habitat use were studied through its spatial and temporal distribution patterns (density and biomass) in a coastal estuary along an environmental gradient defined by the turbid plume of the Turbo River (Darien Ecorregion). The largest sized fish fed mainly on fish, anomuran crustaceans and shrimps, exhibiting a tendency for a generalist diet, while the smaller fish fed mainly on copepods, being specialist feeders, indicating an ontogenic change in the diet of this population. We hypothesize that this species may present patterns of distribution and habitat use in a sequential form in time and space, or seasonal programming. The southern part of the of the estuary may play an important role in reproduction as habitat for the larger fish, which brood eggs mainly during the dry season, while the middle and northern zones, bordered by mangroves, may be important nursery areas, with larger peaks in abundance of smaller fish mainly during the rainy season.
Key words: catfish, feeding habits, distribution, coastal estuary, environmental gradient, Darien Ecorregion
INTRODUCCIÓN
Los bagres marinos son importantes modelos de estudio, debido a que habitan en todos los mares tropicales y subtropicales del mundo, en aguas costeras continentales y en las cuencas bajas de ríos costeros y estuarios, y debido a que muchos son endémicos, algunos de ellos amenazados por ser considerados recursos pesqueros de alto valor económico (Acero 2002, Betancur-R 2003, Marceniuk y Menezes 2007). El ''chivo cabezón'' o ''New Granada sea catfish'', Ariopsis sp. (aff. assimilis) es una especie estuariana que por falta de información molecular, que permita la comparación de las especies del género Ariopsis en el Caribe, no tiene nombre aceptado taxonómicamente y ha sido confundido con el ''bagre cazón'' Notarius bonillai (Miles, 1965) que es dulceacuícola (Acero y Betancur-R. 2006). El chivo cabezón es endémico de la costa Caribe colombiana y del Oeste venezolano, y está en peligro de extinción debido a la presión por pesca artesanal [referenciado como Ariopsis bonillai (Miles, 1945)] (Mejía y Acero 2002, International Union for Conservation of Nature 2012), pero a pesar de su importancia y su inclusión en la lista roja de peces marinos colombianos, poco se sabe de su biología y ecología.
En la Ciénaga Grande de Santa Marta (CGSM), la talla aproximada de madurez sexual es de 250 mm de longitud estándar (LT) (Moreno et al. 2001) y el desove ocurre durante todo el año, siendo mayor entre abril y julio. Las hembras tienen baja fecundidad (24-36 huevos por hembra madura) y los machos progenitores exhiben cuidado parental, mediante la incubación bucal durante 50-70 días (Galvis 1983). La dieta cambia de acuerdo con la talla y se basa principalmente en invertebrados bentónicos como crustáceos y poliquetos, aunque también incluye insectos, peces, algas y detritos (Santos- Martínez 1998, Pardo-Rodríguez et al. 2003). En el golfo de Urabá (Ecorregión Darién, Caribe colombiano sur occidental), Ariopsis sp. es también un recurso de importante valor comercial pero no se cuenta con estudios sobre su biología (Sandoval 2012).
La abundancia y distribución espacial de peces en ecosistemas costeros y estuarios tropicales, están sujetos a fluctuaciones estacionales de variables ambientales (Barletta et al. 2008, Dantas et al. 2010). A nivel global, se cuenta con diferentes estudios sobre movimientos y uso del hábitat en estuarios y otros ecosistemas costeros por parte de peces juveniles y adultos, basados en su distribución, trabajos desarrollados principalmente en Florida (Faunce y Serafy 2007, Jones et al. 2010), Australia (Blaber et al. 1989, Gillanders 1997), Rhode Island (Dorf y Powell 1997), Portugal (Henriques y Almada 1998), y Curazao y Antillas Holandesas (Verweij et al. 2007). En México, particularmente, se ha observado que la distribución de peces en lagunas costeras responde principalmente a los gradientes de salinidad, temperaturas y materia orgánica (Sánchez-Gil et al. 2008, Yáñez- Arancibia y Pauly 1986, Yáñez-Arancibia et al. 1988, 1994,), mientras que en Brasil se observó que la salinidad y el oxígeno disuelto fueron los factores determinantes para la distribución de algunos bagres marinos (Dantas et al. 2012). Sin embargo, en el Atlántico tropical son escasos estos estudios y las investigaciones se han enfocado en ecosistemas de arrecife de coral (Barletta et al. 2010, Dantas et al. 2012, Nagelkerken y Van der Velde 2002). En consecuencia, los objetivos del presente estudio fueron: a) evidenciar los cambios ontogénicos de la amplitud del nicho trófico y de la composición de la dieta; y b) las tendencias de la distribución espacial y temporal del chivo cabezón, Arius sp. (aff. assimilis) en términos de densidad y biomasa en la Bahía El Uno, laguna costera en el delta del río Turbo.
MATERIALES Y MÉTODOS
Área de estudio. La Ecorregión Darién en el Caribe comprende el sur de Panamá y el extremo sur occidental de Colombia en el océano Atlántico. Allí se encuentra el golfo de Urabá (7º 50' - 8º 56' N; 77º 22' - 76º 25' O), Antioquia (Colombia), el cual es un cuerpo de agua semicerrado que tiene un área de 4.291 km2, y es la entrada más grande del mar Caribe en tierra continental colombiana. A su vez, el golfo es el estuario de mayor tamaño en el Caribe colombiano, ya que en la parte media de su costa occidental desemboca el río Atrato (4155 m3/s), el de segundo mayor caudal del Caribe colombiano, después del río Magdalena, (García 2007).
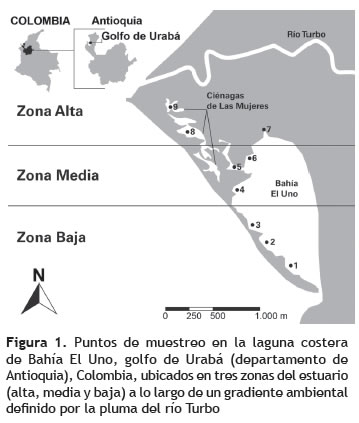
El río Turbo es uno de los afluentes de menor caudal que desembocan en el costado suroriental del golfo de Urabá (Blanco y Castaño 2012, García 2007) y presenta un delta acuminado que forma una espiga hacia el sur, y confina la laguna costera denominada Bahía El Uno y otras pequeñas lagunas interiores llamadas ''ciénagas de Las Mujeres'', las cuales se encuentran conectadas (figura 1). La espiga formada por la progradación se comporta como un espolón natural que retiene los sedimentos transportados por el río y el material que arrastra la deriva litoral desde el norte (Correa y Vernette 2004, Costero y Gómez 1996).
La Bahía El Uno tiene una extensión aproximada de 1,2 km2, la parte noroccidental (donde se encuentran también las tres pequeñas ciénagas) y la parte media de la Bahía se caracterizan por estar bordeadas de manglares constituidos por Rhizophora mangle (Linnaeus, 1753), Avicennia germinans (L.) L. y Laguncularia racemosa (L.) C. F. Gaertn. (Blanco y Castaño 2012, Corporación para el Desarrollo Sostenible de Urabá (CORPOURABÁ) 2003). Al sur, donde la Bahía se conecta con el mar, a través de una estrecha boca, los manglares son menos abundantes. De acuerdo a la precipitación media anual (2.500 mm/anual) se presenta un periodo seco desde finales de diciembre hasta abril (100 mm/mes), cuando predominan los vientos alisios del norte y el noreste; la época lluviosa comienza en mayo y presenta vientos de direcciones variables y velocidades bajas con predominio de los componentes del sur (250 mm/ mes) (García 2007).
Diseño de muestreo. Entre noviembre de 2009 y octubre de 2010 se hicieron seis salidas de campo (bimensuales) para la colecta de peces en la Bahía El Uno y las pequeñas ciénagas conectadas. Las capturas se realizaron teniendo como referencia nueve puntos ordenados a lo largo de un gradiente ambiental, definido por la distancia a la zona de desborde del caudal del río Turbo sobre el abanico deltáico (figura 1).
En cada uno de los puntos de muestreo se realizaron jornadas de pesca diurna y nocturna con pescadores artesanales de la región, empleando dos tipos de atarrayas para capturar peces de tallas pequeñas y grandes (ojo de malla de 2,54 y 5,08 cm, respectivamente). Este arte de pesca fue seleccionado por sus ventajas respecto a otros en cuanto a la reducción del grado de digestión de presas y por ende, el aumento de la probabilidad de identificación (Guerra y Sánchez 1998). En cada uno de los nueve puntos se hicieron 24 lances de atarraya (12 de cada tipo) por faena bimensual. Los individuos fueron sacrificados con una sobredosis de Eugenol (Rubio y Silveira 2009), y posteriormente, su contenido estomacal fue fijado vía anal con formaldehído al 4% y los individuos conservados en formaldehído al 10% para su análisis en laboratorio.
Para definir y describir el gradiente ambiental en el delta del río Turbo, se empleó información proporcionada por Taborda y Blanco (2012) durante el mismo periodo de tiempo que se efectuaron las faenas de pesca (2009 a 2010). En dicho trabajo se estudió la sedimentación, utilizando 36 trampas de fondo (65 cm de diámetro cada una) a lo largo del delta y analizando los sedimentos colectados mensualmente en el laboratorio del grupo de investigación Elice de la Universidad de Antioquia. Del mismo modo, se estudiaron algunas propiedades físicas y químicas del agua (salinidad, conductividad, sulfatos, sólidos suspendidos totales, turbiedad, oxígeno disuelto, nitritos, DBO5), con muestras de aguas someras tomadas in situ una vez al mes, desde octubre de 2009 hasta septiembre de 2010, en siete estaciones de muestreo distribuidas a lo largo de la zona de estudio, siguiendo los protocolos de toma de muestras y almacenamiento sugeridos por Strickland y Parsons (1972) y APHA-AWWA-WEF (1992), y analizadas en el laboratorio de aguas de de la Corporación para el Desarrollo Sostenible de Urabá (CORPOURABÁ). A partir de datos físicos y químicos del agua se definieron tres zonas en el estuario (alta, media y baja) (figura 1), las cuales se emplearon para evidenciar tendencias de la distribución espacial y temporal de las capturas del chivo cabezón.
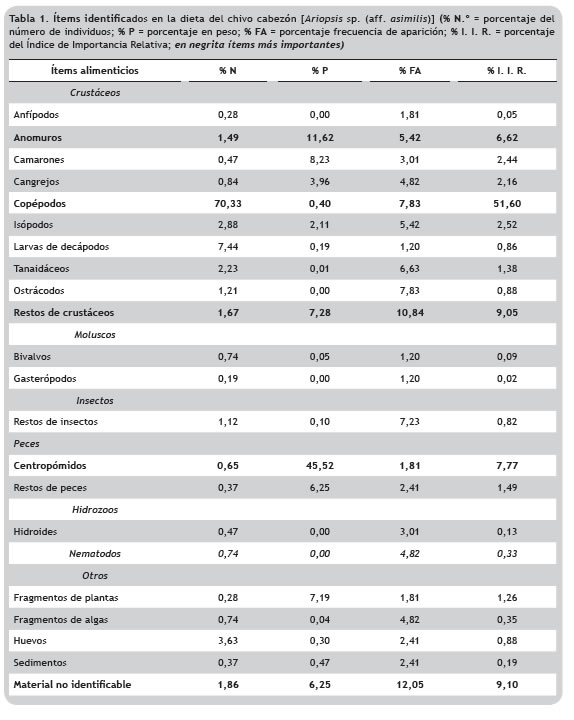
Procedimientos de laboratorio. Los individuos de ''Chivo cabezón'' se identificaron siguiendo las claves taxonómicas de Acero (2002). Posteriormente fueron pesados con una balanza electrónica Shimadzu ELB600 de 0,05 g de precisión y medidos con ictiómetro de 1 mm de precisión. Ejemplares del taxón en estudio fueron depositados en la Colección de Ictiología de la Universidad de Antioquia. Se analizaron 71 estómagos, 46 correspondientes a peces de talla pequeña [longitud total (LT) = 65-192 mm) y 24 a peces de talla grande (LT = 193-320 mm). Las diferentes especies presas presentes en los contenidos estomacales se identificaron utilizando las claves de Brusca y Brusca (2005), Carpenter (2002) y Ruppert y Barnes (1996), siguiendo las técnicas estandarizadas para estudios de dietas de peces propuestas por Hyslop (1980) y Marrero (1994), y empleando un microscopio estereoscopio de magnificaciones de 20 a 40X. Las presas identificadas se incluyeron dentro de las categorías crustáceos, moluscos, insectos, peces, hidrozoos, nematodos y otros. Las presas fueron registradas por conteo numérico (N), peso (P) y frecuencia de aparición (FA).
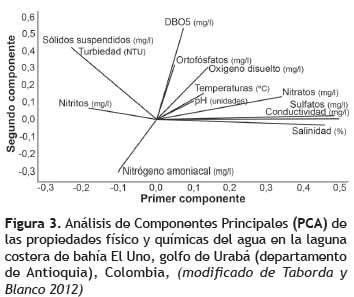
Análisis de datos. Inicialmente, para definir y describir el gradiente ambiental en el delta del río Turbo, se utilizaron los resultados aportados por Taborda y Blanco (2012) sobre la dinámica intra-anual de los sedimentos (tasas de sedimentación en kg/m2/mes), estudiados durante 12 meses en cuatro estaciones a lo largo de la zona de estudio, utilizando en cada estación nueve trampas de fondo de 65 cm2 de diámetro, las cuales se dispusieron y reemplazaron mensualmente. Además, para explicar dicho gradiente se realizó un análisis de componentes principales (ACP) de las propiedades físicas y químicas del agua (valores promedios mensuales), empleando el programa estadístico MINITAB.
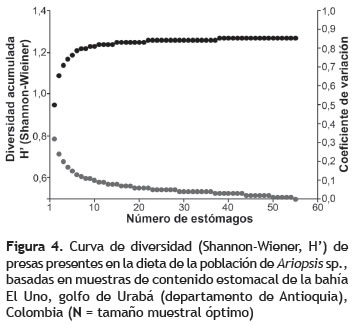
Para estimar la representatividad del tamaño de muestra en el estudio de la dieta, se aplicó la rutina propuesta por Ferry et al. (1997). Este método consiste en calcular la media acumulada y la desviación estándar de un grupo de curvas de diversidad generadas con los datos de abundancia de las presas, mediante el Índice de Shannon-Wiener 'H' (Krebs 1989). Las curvas de diversidad se derivan de una rutina diseñada en el programa MATLAB, que computa 500 permutaciones al azar con todos los datos originales, manteniendo un margen de error de 0,05. Este error se obtiene mediante el coeficiente de variación de los datos y evidencia cuándo la media acumulada llega a una asíntota que permite determinar el tamaño de muestra apropiado para caracterizar la dieta del depredador. Se estimó el porcentaje de repleción como del número de estómagos vacíos con respecto al total de estómagos (Guerra y Sánchez 1998).
Para corroborar la importancia relativa (IIR) de cada ítem alimenticio se empleó el índice propuesto por Pinkas et al. (1971):
IIR = (% P + % N) * % FA
Donde:
IIR, es el índice de importancia relativa para una presa o ítem, % P, es el porcentaje en peso (peso de una presa/peso de todas las presas x 100),
% N, es el porcentaje en número (número de una presa/ número de todas las presas x 100),
% FA, es el porcentaje de frecuencia de aparición (FA de una presa/Σ FA de todas las presas x 100).
Para conocer la amplitud del nicho trófico se utilizó el índice de Levins 1968 estandarizado por Hurlbert (1978) (Krebs 1989):
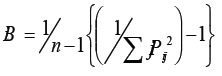
Donde:
Bi, es el índice de Levin para el pez i,
Pij, es la proporción en la dieta del pez i de la presa j,
n, corresponde al número de categorías de presas.
Los valores de este índice están comprendidos entre 0 y 1. Valores de Bi cercanos a cero indican que la especie utiliza un número bajo de recursos y presenta preferencia por ciertas presas, por lo tanto sería especialista; cuando los valores son cercanos a uno, su espectro es generalista, es decir, utiliza todos los recursos en igual proporción, sin ninguna selección (Labropoulou y Eleftheriou 1997).
Para evidenciar tendencia con respecto a cambios ontogénicos en la dieta, se separaron los peces en dos intervalos de tallas con rangos idénticos de longitud total (LT); peces pequeños (LT: 65-192 mm) y grandes (LT: 193-320 mm). No se tuvo en cuenta información de la talla de madurez sexual debido a que no se cuenta con esta información para la zona, de esta manera se utilizó el índice de solapamiento trófico de Morisita 1956 modificado por Horn 1966 (Smith y Zaret 1982):
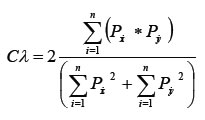
Donde:
Cl, es el índice de Morisita-Horn entre tallas,
Pxi, es la proporción de presa i del total de presas o ítems usados en la zona x,
Pyi, es la proporción de presa i del total de presas o ítems usados en la zona y,
n = número total de presas.
Este índice varía entre 0 y 1 y se considera como un traslapo biológicamente significativo cuando el valor excede a 0,60 (Langton 1982).
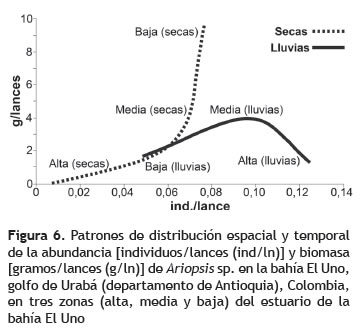
Para evidenciar tendencia de la distribución de Ariopsis sp. entre las partes alta, media y baja del estuario, durante las épocas secas y de lluvias, se estimó y analizó gráficamente la captura por unidad de esfuerzo (CPUE) expresada en términos de abundancia y de biomasa [individuos/número de lances (ind/ln) y gramos/número de lances (g/ln), respectivamente].
RESULTADOS
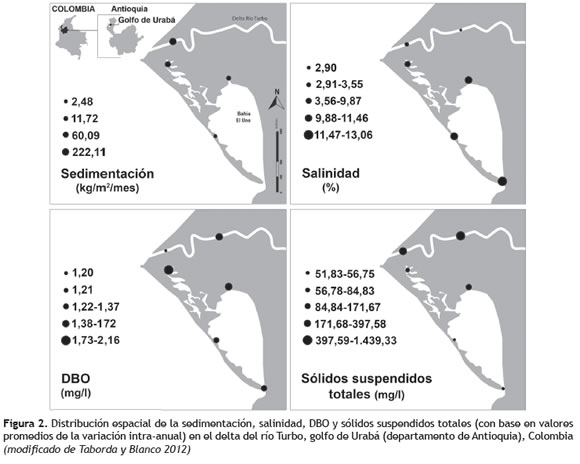
Gradientes ambientales en el delta del río Turbo. La dinámica intra-anual de la sedimentación evidencia el gradiente ambiental. La zona alta del estuario (comprendiendo las ciénagas pequeñas de la parte norte), cercana a la desembocadura del río, presentó mayor carga de sedimentos (222,11-68,89 kg/m2/mes), la zona media del estuario, ubicada en la parte norte del espejo de agua principal de la Bahía, presentó sedimentación intermedia (68,89-11,72 kg/m2/mes), y la zona baja al sur de la Bahía, la cual se comunica directamente con el golfo de Urabá, presentó menor sedimentación (11,72-3,84 kg/m2/mes) (figuras 1 y 2).
El análisis de componentes principales estableció que la salinidad, la conductividad y los sulfatos presentaban correlación positiva con el PC1 y correlación negativa con los sólidos suspendidos totales, la turbiedad y los nitritos (figura 3). La DBO5, y parcialmente el oxígeno disuelto, los sólidos suspendidos y la turbiedad se correlacionaron positivamente con el PC2 (figura 3). Por lo tanto, existe gradiente estuarino principal y gradiente de actividad metabólica secundario. También se observó gradiente de turbiedad dentro de la laguna principal. El gradiente estuarino mostró incremento de la salinidad en dirección norte-sur, producto de la entrada del caudal del río al área de las ciénagas internas, durante la época de lluvias y de la entrada del prisma mareal por la boca de la laguna costera (bahía El Uno) (figura 2). Sobre el gradiente estuarino también se observó gradiente de sulfatos, nitratos (inversamente correlacionado con los nitritos y amonio), pH, temperatura y oxígeno disuelto. El gradiente secundario estuvo relacionado con la DBO5, la cual tuvo mayores valores en las aguas semiconfinadas de las ciénagas internas y menores valores en las aguas con mayor recambio a través de la boca de la laguna costera (figura 3). Dentro de la laguna costera, la turbidez y los sólidos suspendidos aumentó desde la boca hacia la parte interna. Sin embargo, disminuyó nuevamente en las ciénagas interiores (figura 3).
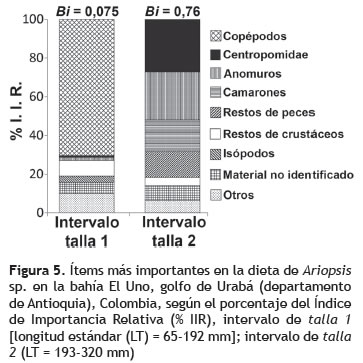
Análisis de las dietas. La curva de diversidad de presas alcanzó la asíntota en 35 estómagos, lo cual refleja que el tamaño de muestra utilizado (71 estómagos) fue adecuado para describir la composición de la dieta de Ariopsis sp. en la zona de estudio (figura 4). 67 estómagos contenían alimento (94,4% de repleción). Se identificaron 22 ítems alimenticios (tabla 1), de los cuales los principales componentes, según el índice de IIR, fueron los copépodos, restos de crustáceos, peces de la familia Centropomidae y crustáceos anomuros, también se presentaron isópodos, camarones y cangrejos (figura 5).
El análisis de solapamiento trófico entre individuos de tallas pequeñas (46 estómagos) y grandes (24 estómagos) indicó que existen diferencias significativas (Cl = 0,02). Según el IIR los copépodos fueron las principales presas de peces pequeños, mientras que los peces grandes consumieron preferiblemente peces de la familia Centropomidae, crustáceos anomuros y camarones (figura 5). Según el índice de Levins, la amplitud de la dieta indicó que los peces de tallas pequeñas son consumidores especialistas (Bi = 0,075), mientras que los de tallas grandes son generalistas (Bi = 0,76).
Tendencias en la distribución espacio-temporal. Los 71 individuos de Ariopsis sp. capturados presentaron tallas entre 65 y 320 mm de LT y media de 150 mm, con peso total de los 71 individuos de 3,32 kg. La CPUE en términos de biomasa obtuvo su valor mayor en el periodo seco, mientras que en abundancia fue para el de lluvias (figura 6). Durante el periodo seco, la parte alta presenta menor densidad de individuos con respecto a la parte media y baja del estuario. De acuerdo a la biomasa se puede establecer que estos peces de la parte alta, corresponden a individuos de gran tamaño (figura 6), al parecer adultos, debido a que algunos de los ejemplares se encontraban incubando sus huevos en la boca. Durante la época de lluvias, se tiende a disminuir y homogenizar la biomasa, es decir, tienden a haber peces más pequeños y del mismo tamaño, encontrando baja biomasa en todo el estuario pero presentando mayor densidad de individuos pequeños en la parte alta (ciénagas) y medianos en la parte media del estuario (figura 6).
DISCUSIÓN
Los crustáceos fueron las principales presas en el espectro trófico de Ariopsis sp. en el delta del río Turbo, acorde con lo descrito para el Caribe colombiano (Acero 2002), y particularmente con los resultados de Santos-Martínez (1998) en la CGSM y Pardo-Rodríguez et al. (2003) en la bahía de Cartagena y aguas adyacentes. Los cambios ontogénicos en la dieta y en amplitud del nicho trófico también son acordes con Acero (2002) y Santos-Martínez (1998), quienes encontraron que los adultos de esta especie se alimentan principalmente de crustáceos y peces, mientras que los juveniles lo hacen de copépodos. Cabe destacar específicamente para este estudio la importancia del anomuro (Callianassa atlántica Rathbun, 1926) y de peces de la familia Centropomidae en la dieta de los individuos de tallas grandes.
Aunque no hay estudios para el Caribe colombiano, se ha planteado que las adaptaciones que presentan algunas especies de peces estuarinos a variaciones estacionales de parámetros abióticos, oferta de alimento y competencia, resulta en el fenómeno llamado programación estacional, esto se refiere a la secuencia temporal y espacial de la utilización del hábitat de una laguna costera como refugio por peces juveniles y pre-adultos (Pauly y Yáñez-Arancibia 1994, Yáñez-Arancibia et al. 1988, 1994), y que han sido ampliamente discutidos en la Laguna de Términos en México (Sánchez-Gil et al. 2008, Yáñez-Arancibia et al. 1986, 1994, Yáñez-Arancibia y Lara-Domínguez 1988). Estos estudios indicaron que para una especie determinada, la programación estacional implica que sus individuos (en su mayoría inmaduros) se alimentan, en el curso de su ontogenia, en una sucesión de diferentes tipos de presas, a menudo congregados en diferentes sub-zonas dentro de una laguna dada. Dicho fenómeno puede estar dando explicación a lo encontrado para Ariopsis sp. en la bahía El Uno, no obstante, es necesario profundizar y corroborar esta información, incluyendo estudios de la biología reproductiva y uso del hábitat, en lo posible incluyendo otras especies de peces estuarinos.
Del mismo modo, las tendencias de la distribución espacial de la abundancia y la biomasa del ''Chivo cabezón'', durante los dos periodos climáticos, también pueden respaldar la hipótesis anterior. En este sentido, se sugiere que esta especie a parte de sus cambios ontogénicos en la dieta, puede presentar patrones de distribución y utilización del hábitat de forma secuencial en tiempo y espacio dentro de la bahía y a lo largo del gradiente ambiental que se ha expuesto. De esta forma, la parte baja del estuario podría jugar un papel importante en la reproducción como hábitat de peces de tallas grandes (193-320 mm LT) que pueden incubar huevos principalmente en algunos momentos durante el periodo seco, mientras que la zonas de la parte media y alta, que se encuentran bordeadas por bosque de manglar, podrían ser zonas importantes de crianza, con mayores abundancias de peces de tallas pequeñas (65-192 mm LT) en el periodo de lluvia. Es importante señalar que la incubación bucal es un proceso relacionado con el desove y que lo observado en la bahía El Uno tiende a coincidir con lo señalado en la CGSM, donde Galvis (1983) encontró que el ''Chivo cabezón'' puede desovar durante todo el año, sin embargo, presentó un desove masivo en los meses de abril a julio, meses que hacen parte de los periodos secos y de menor lluvia en dicha zona (Blanco 1988, Rueda y Defeo 2003).
Sin embargo, para entender los patrones de distribución de peces estuarinos y su migración según sus fases ontogénicas, se debe tener en cuenta que estos están sujetos a diferentes factores bióticos (ej., depredación, disponibilidad de alimento, reclutamiento), abióticos (ej., salinidad, temperatura, oxígeno disuelto) y del paisaje (ej., tamaño del hábitat y conectividad del hábitat) (Barletta et al. 2005, Beck et al. 2003, 2008, Dantas et al. 2012). Algunos estudios han demostrado que las fluctuaciones del gradiente de salinidad son el principal factor que determina los ensambles de peces en estuarios (Barletta-B et al. 2002, Barletta et al. 2005, 2008, Barletta y Blaber 2007, Cyrus y Blaber 1992, Lugendo et al. 2007). Igualmente, Dantas et al. (2012), en el estuario de tipo fluvial de Goiana en Brasil, encontraron relación de salinidad y oxígeno disuelto con la distribución estacional en diferentes fases ontogénicas de dos especies de peces de la familia Ariidae (Cathorops spixii (Agassiz, 1829) y Cathorops agassizii (Eigenmann y Eigenmann, 1888).
No obstante, aunque en el delta del río Turbo es evidente un gradiente ambiental estuarino, donde la salinidad mostró un incremento en dirección norte-sur, como producto de la entrada del caudal del río al área de las ciénagas internas durante la época de lluvias y de la entrada del prisma mareal, por la boca que comunica directamente con el Golfo, en la laguna costera la variación de dicho parámetro fue leve (salinidad promedio por zonas: alta = 10,4 ups, media = 11,2 ups y baja= 12,3 ups) (figura 2), esto debido posiblemente a su reducida área (1,2 km2), por lo cual se sugiere que los patrones de distribución y el uso del hábitat por el ''Chivo cabezón'' en el estuario, podrían estar más determinados por otros procesos fisico, químicos y biológicos, como la disponibilidad de alimento y áreas de protección a lo largo del gradiente ambiental, principalmente la proliferación de copépodos, la turbiedad y la oferta de raíces de manglar que pueden proporcionar refugio a los peces de tallas pequeñas ante depredadores. Aunque estos procesos no fueron medidos en esta investigación, la importante función de los ecosistemas de manglar como hábitats de refugio y disponibilidad de recursos alimenticios para peces juveniles ha sido ampliamente documentada (Blaber y Blaber 1980, Blaber 2000, Laegdsgaard y Johnson 2001, Lara-Domínguez y Yáñez-Arancibia 1999, Nagelkerken et al. 2000, Nagelkerken et al. 2008, Winemiller y Leslie 1992, Yáñez-Arancibia et al. 1994,).
En conclusión, se evidenciaron tendencias en cuanto a cambios ontogénicos en la dieta de Ariopsis sp., los peces de tallas grades se alimentaron principalmente de peces y crustáceos (anomuros y camarones), presentando tendencia a ser consumidores generalistas, mientras que los de tallas pequeñas fueron consumidores especialistas, principalmente de copépodos. Se plantea la hipótesis que esta especie también puede presentar patrones de distribución y utilización del hábitat de forma secuencial en tiempo y espacio en el estuario o programación estacional, determinados al parecer, principalmente, por la disponibilidad de alimento y oferta de zonas de protección a lo largo de un gradiente ambiental.
AGRADECIMIENTOS
El presente estudio se realizó en el marco del programa de Maestría en Ciencias Ambientales, de la Universidad de Antioquia. Agradecemos a la Corporación Académica Ambiental, al Instituto de Biología, al grupo de investigación GIUA, y al Comité para el Desarrollo de la Investigación de la Universidad de Antioquia (Proyecto ''Impactos de las tasas de sedimentación sobre la estructura trófica macrobentónica e íctica y el procesamiento de la hojarasca del manglar en el delta del río Turbo, Golfo de Urabá, Caribe colombiano''). Asimismo, a la Corporación para el Desarrollo Sostenible de Urabá (CORPOURABÁ), al Fondo de Becas Colombia Biodiversa de la Fundación Alejandro Ángel Escobar y la comunidad de El Uno del municipio de Turbo. Este trabajo fue financiado parcialmente por CORPOURABÁ, pero las opiniones expresadas no comprometen a dicha institución. Contribución ELICE N.° 11.
REFERENCIAS
Acero A. 2002. Order Siluriformes Ariidae sea catfishes. En: Carpenter K, editores. The living marine resources of the western central Atlantic. Volumen 2. Roma: Food and Agriculture Organization of the United Nations (FAO). p. 831-852. [ Links ]
Acero A, Betancur-R R. 2006. Real identity of the northern Colombian endemic sea catfish Galeichthys bonillai Miles, 1945 (Siluriformes: Ariidae). Cybium, 30 (3): 215-219. [ Links ]
APHA, AWWA, WEF. 1992. Standard methods for the examination of water and wastewater. American Public Health Association. Baltimore, U. S. A. p. xx-xx. [ Links ]
Barletta-B A, Barletta M, Saint-Paul U. 2002. Structure and seasonal dynamics of larval fish in the Caeté River Estuary in North Brazil. Estuarine, Coastal and Shelf Science, 54 (2): 193-206. [ Links ]
Barletta M, Barletta-B A, Saint-Paul U, Hubold G. 2005. The role of salinity in structuring the fishing assemblages in a tropical estuary. Journal of Fish Biology, 66 (1): 45-72. [ Links ]
Barletta M, Blaber SJM. 2007. Comparision of fish assemblage and guilds in tropical habitats of the Emblay (Indo-West Pacific) and Caeté (Western Atlantic) estuaries. Bulletin of Marine Science, 80 (3): 647-680. [ Links ]
Barletta M, Amaral CS, Correa MFM, Guebert F, Dantas DV, Lorenzi L, Saint-Paul U. 2008. Factors affecting seasonal variations in demersal fish assemblages at an ecocline in a tropical\subtropical estuary. Journal of Fish Biology, 73: 1314-1336. [ Links ]
Barletta M, Jaureguizar AJ, Baigun C, Fontoura NF, Agostinho AA, Almeida-Val V, Val A, Torres RA, Jimenes LF, Giarrizzo T, Fabré NN, Batista V, Lasso C, Taphorn DC, Costa MF, Chaves PT, Vieira JP, Corrêa MFM. 2010. Fish and aquatic habitat conservation in South America: a continental overview with emphasis on neotropical systems. Journal of Fish Biology, 76 (9): 2118-2176. [ Links ]
Beck MW, Heck Jr. KL, Able KW, Childers DL, Eggleston DB, Gillanders BM, Halpem BS, Hays CG, Hoshino K, Minello TJ, Orth RJ, Sheridan PF, Weinstein MP. 2003. The role of near shore ecosystems as fish and shell fish nurseries. Issues in Ecology, 11: 1-12. [ Links ]
Betancur-R R. 2003. Filogenia de los bagres marinos (Siluriformes: Ariidae) del nuevo mundo. [Tesis de maestría]. [Bogotá D. C. y Santa Marta D. T. C. H (Colombia)]: Sección Biología Marina, Universidad Nacional de Colombia. p. 123. [ Links ]
Blaber SJM. 2000. Tropical estuarine fishes: ecology, exploitation and conservation. Oxford: Blackwell Science Ltd. p. 372. [ Links ]
Blaber SJM, Blaber TG. 1980. Factors affecting the distribution of juvenile estuarine and inshore fish. Journal of Fish Biology, 17 (2): 143-162. [ Links ]
Blaber SJM, Brewer DT, Salini JP. 1989. Species composition and biomasses of fishes in different habitats of a tropical northern Australian estuary: their occurrence in the adjoining sea and estuarine dependence. Estuarine, Coastal and Shelf Science, 29 (6): 509-531. [ Links ]
Blanco JA. 1988. Las variaciones ambientales estacionales en las aguas costeras y su importancia para la pesca en la región de Santa Marta, Caribe colombiano. [Tesis de maestría] [Bogotá D. C. (Colombia)]: Sección Biología Marina, Universidad Nacional de Colombia. p. 50 [ Links ]
Blanco JF, Castaño MC. 2012. Efecto de la conversión del manglar a potrero sobre la densidad y tallas de dos gasterópodos en el delta del río Turbo (golfo de Urabá, Caribe colombiano). Revista Biología Tropical, 60 (4): 1707-1719. [ Links ]
Brusca RC, Brusca GJ. 2005. Invertebrates. 2nd edition. Sunderland, Massachusetts: Sinauer Associates, Inc. p. 936. [ Links ]
Carpenter KE, editor. 2002. The living marine resources of the Western Central Atlantic. Volumen 3. Bony fishes part 2 (Opistognathidae to Molidae), sea turtles and marine mammals. Rome: Food and Agriculture Organization of the United Nations (FAO) y American Society of Ichthyologists and Herpetologists. p. 1375-2127. [ Links ]
Corporación para el Desarrollo Sostenible de Urabá. 2003. Caracterización y zonificación de los manglares del golfo de Urabá. Apartadó, Colombia: Informe técnico del Convenio 201671 FONAM-CORPOURABÁ (Corporación para el Desarrollo Sostenible de Urabá), Alcaldía de Turbo, Universidad de Antioquia y Capitanía de Puerto de Turbo. [ Links ]
Correa D, Vernette G. 2004. Introducción al problema de la erosión litoral en Urabá (Sector Arboletes-Turbo) Costa Caribe colombiana. Boletín de Investigaciones Marinas y Costeras, 33: 7-28. [ Links ]
Costero EF, Gómez VJ. 1996. Evolución de la línea de costa del litoral antioqueño. Aspectos geomorfológicos, sector río Necoclí-Turbo. Corpourabá, Apartadó, Colombia. [ Links ]
Cyrus DP, Blaber SJM. 1992. Turbidity and salinity in a tropical Northern Australian Estuary and their influence on fish distribution. Estuarine, Coastal and Shelf Sciences, 35 (6): 545-563. [ Links ]
Dantas DV, Barletta M, Costas MF, Barbosa SCT, Possatto FE, Ramos JAA, Lima ARA, Saint-Paul U. 2010. Movement patters os catfishes (Ariidae) in a tropical semi-arid estuary. Journal of Fish Biology, 76: 2540-2557. [ Links ]
Dantas DV, Barletta M, Araújo-Lima A, Almeida-Ramos J, Ferreirada Costa M, Saint-Paul U. 2012. Nursery Habitat Shifts in an Estuarine Ecosystem: Patterns of Use by Sympatric Catfish Species. Estuarine and Coastal, 35 (2): 587-602. [ Links ]
Dorf BA, Powell JC. 1997. Distribution, abundance, and habitat characteristics of juvenile tautog (Tautogaonitis, Family Labridae) in Narragansett Bay, Rhode Island, 1988-1992. Estuaries, 20 (3): 589-600. [ Links ]
Faunce C, Serafy JE. 2007. Near shore habitat use by gray snapper (Lutjanus griseus) and blue striped grunt (Haemulon sciurus): environmental gradients and ontogenetic shifts. Bulletin of Marine Science, 80 (3): 473-495. [ Links ]
Ferry L, Clark S, Cailliet G. 1997. Food habits of spotted sandbass (Paralabrax maculatofasciatus), (Serranidae) from Bahia de Los Angeles, Baja California. Bulletin of the Southern California Academy of Sciences, 96: 1-21. [ Links ]
Galvis OD. 1983. Los Áridos de la Ciénaga Grande de Santa Marta. [Tesis de maestría] [Bogotá D.C. (Colombia)]: Universidad Nacional de Colombia. p. 163. [ Links ]
García C, editor. 2007. Atlas del golfo de Urabá: una mirada al Caribe de Antioquia y Chocó. Instituto de Investigaciones Marinas y Costeras (Invemar) y Gobernación de Antioquia. Santa Marta: Serie de Publicaciones Especiales de Invemar N.º 12. p. 180. [ Links ]
Gillanders BM. 1997. Patterns of abundance and size structure in the blue grouper Achoerodus viridis (Pisces: Labridae): evidence of links between estuaries and coastal reefs. Environmental Biology of Fishes, 49: 153-173. [ Links ]
Guerra A, Sánchez J. 1998. Fundamentos de explotación de recursos vivos marinos. Zaragoza, España: Acribia S. A. p. 249. [ Links ]
Henriques M, Almada VC. 1998. Juveniles of non-resident fish found in sheltered rocky subtidal areas. Journal of Fish Biology, 52: 1301-1304. [ Links ]
Hyslop EJ. 1980. Stomach contents analysis, a review of methods and their application. Journal Fish Biology, 17 (4): 411-429. [ Links ]
International Union for Conservation of Nature (IUCN). 2012. The IUCN Red List of Threatened Species. Version 2012. [ Links ]
Jones DL, Walter JF, Brooks EN, Serafy JE. 2010. Connectivity through ontogeny: fish population linkages among mangrove and coral reef habitats. Marine Ecology Progress Series, 401: 245-258. [ Links ]
Krebs CJ. 1989. Ecological Methodology. New York, U. S. A.: Harper and Row Publishers. p. 654. [ Links ]
Labropoulou M, Eleftheriou A. 1997. The foraging ecology of two pairs of congeneric demersal fish species: importance of morphological characteristics in prey selection. Journal of Fish Biology, 50 (2): 324-340. [ Links ]
Laegdsgaard P, Johnson C. 2001. Why do juvenile fish utilize mangrove habitats? Journal Experimental Marine Biology, 257 (2): 229-253. [ Links ]
Langton RW. 1982. Diet overlap between the Atlantic cod Gadus morhua, silver hake Merluccius bilinearis and fifteen other northwest Atlantic finfish. Fishery Bulletin, 80 (4): 745-759. [ Links ]
Lara-Domínguez AL, Yáñez-Arancibia A. 1999. Productividad secundaria, utilización del hábitat y estructura trófica. En: Yáñez- Arancibia A, Lara-Domínguez LA, editores. Ecosistemas de Manglar en América Tropical. Instituto de Ecología A. C. México, UICN/ORMA, Costa Rica, NOAA/NMFS Silver Spring MD, U. S. A. p. 153-166. [ Links ]
Lugendo BR, Nagelkerken I, Jiddawi N, Mgaya YD, van der Velde G. 2007. Fish community composition of a tropical non estuarine embayment in Zanzibar, Tanzania. Fisheries Science, 73: 1213-1223. [ Links ]
Marceniuk AP, Menezes MA. 2007. Systematics of the family Ariidae (Ostariophysi, Siluriformes), with a redefinition of thegenera. Zootaxa, 1416: 1-126. [ Links ]
Marrero C. 1994. Métodos para cuantificar contenidos estomacales en peces. Caracas: Universidad Nacional Experimental de los Llanos Occidentales ''Ezequiel Zamora''. p. 37. [ Links ]
Mejía LS, Acero A, editores. 2002. Libro rojo de peces marinos de Colombia. INVEMAR, Instituto de Ciencias Naturales - Universidad Nacional de Colombia, Ministerio del Medio Ambiente. Bogotá: La serie Libros Rojos de Especies Amenazadas de Colombia. p. 37. [ Links ]
Moreno PA, García DX, Vargas Y, Yie T. 2001. Biología reproductiva del ''chivo cabezón'' Notarius bonillai miles, 1945 (Pisces: Ariidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano. IX Congreso Latinoamericano sobre Ciencias del Mar, San Andrés Isla, Colombia. [ Links ]
Nagelkerken I, Van der Velde, Gorissen G, Meijer MW, Van't Hof J, Den Hartog C. 2000. Importance of mangroves, seagrass beds and the shallow coral reef as a nursery for important coral reef fishes, using a visual census technique. Estuarine, Coastal and Shelf Science, 51: 31-44. [ Links ]
Nagelkerken I, Van der Velde G. 2002. Do non-estuarine mangroves harbour higher densities of juveniles fish tan adjacent shallowwater and coral reef habitats in Curacao (Netherlands Antilles)? Marine Ecology Progress Series, 245: 191-204. [ Links ]
Nagelkerken I, Blaber SJM, Bouillon S, Green P, Haywood M, Kirton LJ, Meynecke J, Pawlik J, Penrose HM, Sasekumar A, Somerfield PJ. 2008. The habitat function of mangroves for terrestrial and marine fauna: A review. Aquatic Botany, 89:155-185. [ Links ]
Pardo-Rodríguez F, Ospina-Arango J, Álvarez-León R. 2003. Hábitos alimenticios de algunas especies ícticas de la bahía de Cartagena y aguas adyacentes, Colombia. Dahlia - Revista Asociación Colombiana lctiólogos, 6: 69-78. [ Links ]
Pauly D, Yañez-Arancibia A. 1994. Fisheries in coastal lagoons. En: Kjerfve B, editor. Coastal Lagoon Processes (Amsterdam): Elsevier Science Publication. p. 377-399. [ Links ]
Pinkas L, Oliphant S, Iverson I. 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. Fishery Bulletin, 152: 1-105. [ Links ]
Rubio M, Silveira R. 2009. Bienestar de los animales acuáticos, con fines de control sanitario. Revista Electrónica de Veterinaria [Internet], 10: 1-12. Fecha de acceso: 1 de febrero de 2011. Disponible en: http://www.redalyc.org/articulo.oa?id=63617143009. [ Links ]
Rueda M, Defeo O. 2003. Spatial structure of fish assemblages in a tropical estuarine lagoon: combining multivariate and geostatistical techniques. Journal Experimental Marine Biology and Ecology, 296: 93-112. [ Links ]
Ruppert EE, Barnes RD. 1996. Zoología de los invertebrados. México: Mc Graw -Hill. p. 1114. [ Links ]
Sánchez-Gil P, Yáñez Arancibia A, Tapia M, Day JW, Wilson CA, Cowan JH. 2008. Ecological and biological strategies of Etropus crossotus and Citharichthys spilopterus (Pleuronectiformes: Paralichthyidae) related to the estuarine plume, Southern Gulf of Mexico. Journal of Sea Research, 59 (3): 173-185. [ Links ]
Sandoval LA. 2012. Efecto de la sedimentación sobre la ictiofauna en el delta del río Turbo (Golfo de Urabá, Caribe colombiano). [Tesis de Maestría] [Medellín (Colombia)]: Corporación Académica Ambiental. Universidad de Antioquia. p. 121. [ Links ]
Santos-Martínez A. 1998. Informe Proyecto Evaluación de los Principales Recursos Pesqueros de la Ciénaga Grande de Santa Marta, Costa Caribe colombiana. INVEMAR-COLCIENCIAS, Santa Marta, Colombia. [ Links ]
Smith PE, Zaret MT. 1982. Bias in estimating niche overlap. Ecology, 63: 1248-1253. [ Links ]
Strickland D, Parsons P. 1972. A practical Handbook of Seawater Analysis. Ottawa: Bulletin Fisheries Research Board of Canada, N.°167. p. 310. [ Links ]
Taborda A, Blanco JF. 2012. Exportación y depósito de sedimentos en la franja costera del delta del río Turbo. En: Blanco JF, Taborda A, Vásquez JG, editores. Sedimentación en manglares: relación de la deforestación de la cuenca e impactos en la fauna estuarina. El caso del delta del río Turbo y la costa sur-oriental del Golfo de Urabá. Medellín, Colombia: Universidad de Antioquia- Corpourabá. p. 131-182. [ Links ]
Verweij MC, Nagelkerken I, Hol KE, Van den Beld AH, Van der Velde G. 2007. Space use of Lutjanus apodus including movement between a putative nursery and a coral reef. Bulletin of Marine Science, 81: 127-138. [ Links ]
Winemiller KO, Leslie MA. 1992. Fish assemblages across a complex, tropical freshwater/marine ecotone. Envioronmental Biology of Fish, 34: 29-50. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL, Aguirre-León A, Díaz-Ruiz S. 1986. Feeding ecology of tropical estuarine fishes in relation to recruitment processes. En: Yáñez-Arancibia A, Pauly D, editores, IOC-FAO Workshop on Recruitment in Tropical Coastal Demersal Communities (Ciudad del Carmen): UNESCO. Workshop Report 44, Supplement. p. 73-94. [ Links ]
Yáñez-Arancibia A, Pauly D, editores. 1986. IOC-FAO Workshop on Recruitment in Tropical Coastal Demersal Communities. Ciudad del Carmen: Workshop Report 44-Supplement. UNESCO. p. 323. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL, Rojas-Galavíz JL, Sánchez- Gil P, Day Jr. DW, Madden C. 1988. Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogeneity (Southern Gulf of Mexico). Journal of Fish Biology, 33: 191-200. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL. 1988. Ecology of three sea catfishes (Ariidae) in a tropical coastal ecosystem-southern Gulf of Mexico. Marie Ecology Progress Series, 49: 215-230. [ Links ]
Yáñez-Arancibia A, Sánchez-Gil P, Lara-Domínguez LA. 1991. Interacciones ecológicas estuario-mar: Estructura funcional de bocas estuarinas y su efecto en la productividad del ecosistema. Academia de Ciencias de Sao Paulo, 71: 49-83. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL, Pauly D. 1994. Coastal lagoons as fish habitats. En: Kjerfve B., editor. Coastal Lagoon Processes. (Amsterdam): Elsevier Science Publisher. p. 363-399. [ Links ]