Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.7 no.1 Popayán Jan./June 2009
APLICACIÓN DEL MÉTODO DE COÁGULO DE PLASMA PARA ESTUDIOS DE ULTRAESTRUCTURA CELULAR
APPLICATION OF PLASMA COAGULATE METHOD FOR CELULAR ULTRASTRUCTURE STUDIES
GERARDO ANDRÉS TORRES RODRÍGUEZ1
1 Profesor Departamento de Biología - Unidad de Microscopía Electrónica - Universidad del Cauca.
Correspondencia: Gerardo Andrés Torres Rodríguez: email: gator@unicauca.edu.co
Recibido para evaluación: Febrero 6 de 2009. Aprobado para publicación: Mayo 5 de 2009
RESUMEN
Los estudios de ultraestructura celular en material particulado como bacterias, virus y células en suspensión requieren de un manejo especial, es por esto que se han desarrollado técnicas como la de coágulo de plasma, la cual se aplicó en un modelo experimental de fagocitosis. Se realizaron análisis de Microscopia Electrónica de Transmisión y de Barrido observándose claramente cuatro etapas de la fagocitosis. Se consideró una relación de 10 partículas de levadura por PMN como la proporción más eficiente para la observación del proceso fagocítico, igualmente se determinó muy corto el periodo de incubación de 20 minutos para alcanzar la fagocitosis en su totalidad. La técnica del coágulo de plasma mostró muy buenos resultados en preparaciones para TEM conservando la integridad de las células, no obstante, esta técnica presentó inconvenientes al observarse en MEB debido a los componentes fibrosos del coágulo que impiden una observación de la muestra, adhiriéndose a las superficies produciendo artefactos y deterioro en éstas.
PALABRAS CLAVE:
Microscopía electrónica, fagocitosis, coágulo de plasma, linfocitos
ABSTRACT
Studying ultrastructure cell in particle material such as bacteria, virus and cells suspension require special handling. For that reason, it has been developed techniques like plasma coagulate with phagocytosis as experimental model and analyzed by transmission electronic microscopy (TEM) and scanning electronic microscopy (SEM). Four stages of phagocytosis were observed. The efficient proportion to observe the phagocytosis process was 10 particles per NPM (Nuclear Polymorphic), although 20 min as a incubation period was very short to reaching the total process. Applying this technique, cells conserved their integrity to obtain good quality preparation for TEM. In contrast for SEM samples which kept coagulate fiber components adhered to the surface, producing devices and cell deterioration was observed.
KEYWORDS:
Electronic microscopy, phagocytosis, plasma coagulate, lymphocite
INTRODUCCIÓN
Los estudios de la ultraestructura celular en microscopía electrónica requieren de la aplicación de unas técnicas semejantes a la microscopia óptica, sin embargo, puesto que se van a observar las estructuras con mayor detalle, estas técnicas son más delicadas y sus protocolos son más exigentes y costosos. Esto ha llevado a que los investigadores constantemente estén explorando, desarrollando y estandarizando metodologías y técnicas de aplicación rutinaria en el laboratorio como en este caso para estudios de material particulado.
Los especímenes biológicos tales como bacterias, virus, células en suspensión como las sanguíneas, los cultivos y fracciones celulares, deben tener un tratamiento especial en su manejo para los estudios de ultraestructura celular. Para el manejo de estos se han desarrollado varias técnicas [1,2] con diferentes aplicaciones en estudios de enfermedades parasitarias y ultraestructurales [3], sin embargo la aplicación de esta técnica ha sido poco explorada en estudios de procesos celulares como la fagocitosis en los cuales se hacen análisis comparativos por microscopia electrónica de transmisión y de barrido. De otra parte, la aplicación de un modelo experimental de la fagocitosis [4,5] ha representado un potencial de investigación con diferentes aplicaciones entre ellas los fenómenos de la respuesta inmune humoral y celular así como el desarrollo de técnicas de estudio más detalladas como la inmunolocalización de moléculas en las células y tejidos como la inmunocitoquímica [6,7,8]. Por este motivo el desarrollo y aplicación de estas técnicas así como la utilización de estos modelos experimentales por medio de microscopía electrónica son una herramienta de gran aplicación para diversos estudios en la biología celular y Molecular. [9,10]
El presente artículo tiene como objetivos: aplicar metodologías y protocolos para análisis de la ultraestructura celular en Microscopía Electrónica de Transmisión y de Barrido, igualmente pretende estandarizar la técnica de coágulo de plasma para estudios de material particulado en un modelo experimental de fagocitosis, por tal motivo representa un documento de referencia para estudios de Microscopía electrónica.
METODOLOGÍA
Montaje del modelo experimental de la fagocitosis
Se obtuvo 5 ml de sangre humana de un adulto sano del cual se separó linfocitos polimorfonucleados (PMN) por gradientes de densidad con Mono-Poly Resolvin Medium, igualmente se recogieron 10 ml de sangre con heparina para a partir de este obtener suero autólogo que se incorporó a los tubos donde se llevó a cabo la reacción.
posteriormente, se procedió a preparar las suspensiones celulares de PMN y levaduras Saccharomyces cerevisiae de la siguiente forma:
Para los PMN se realizó un conteo del total de células con un hemocitómetro en tampón de fosfatos a pH de 7.4 [11,12]. De las levaduras se prepararon suspensiones de partículas en tres proporciones a ensayar así: 5 partículas por PMN, 10 partículas por PMN, y 27 partículas por PMN [13] las cuales se prepararon a partir de una suspensión patrón estéril. Se hicieron pruebas de viabilidad celular con azul de tripan [11] para establecer el buen estado de los linfocitos.
La reacción se montó en tubos de ensayo y se llevó a cabo al mezclar la suspensión de 2.5x 106 PMN en un volumen de 400ul y la suspensión de partículas de levadura en las diluciones anteriormente mencionadas en un volumen de 100 ul. Todos los tubos se llevaron a un volumen final de 1 ml con suero autólogo. Se prepararon controles con PMN solamente y se procedió a incubar a 37°C en baño de agitación durante 5 y 20 minutos. La reacción se terminó al agregar 900 ul de tampón de fosfatos de sodio pH 7.4 en baño de hielo.
Montaje del material en Coágulo de plasma
Después de detener la reacción las células se centrifugaron a 2000 r.p.m. durante 5 minutos y se resuspendieron con fijador de Karnovsky durante media hora, se lavaron tres veces con tampón de fosfatos 0,1 M pH 7,4. se toma una muestra y se realiza montaje en placas para su observación en microscopía de luz con azul de toluidina. Seguidamente se postfijaron con tetróxido de osmio al 1% durante media hora, con tres lavados posteriores en tampón a 2000 RPM hasta formar un botón celular.
El coágulo de plasma se preparó obteniendo 5 ml de sangre empleando citrato de sodio al 3.8% en solución salina al 0.9% como anticoagulante. La sangre se homogeniza lentamente y se procede a separar los eritrocitos a 2500 r.p.m. durante 5 minutos. Se transfiere el plasma a otro tubo de ensayo colectando también la capa de células blancas aunque arrastre eritrocitos, se homogeniza y posteriormente rompa las plaquetas congelando y descongelando las muestras dos veces. Se centrifuga a 5000 r.p.m. durante 30 minutos se emplea el sobrenadante y descarta el botón de células blancas y residuos de plaquetas. El plasma que se obtiene se emplea para formar los coágulos que van a dar soporte la muestra particulada según la modificación de Hernández y colaboradores 1991.
A partir de las muestras en coágulos se procede a deshidratar con gradientes ascendentes de etanol e incluidas en resina spurr, posteriormente cortadas en grosores de 90 nm, recogidas en rejillas y se observan en Microscopio electrónico de transmisión (TEM) H7100 Hitachi [14]. Las Muestras procesadas para Microscopia electrónica de Barrido (MEB) se deshidrataron en gradientes ascendentes de etanol, se secaron con secado de punto crítico, recubiertas en cobertor iónico con una capa de 20 nm Oro-Platino para posteriormente ser observadas en MEB S-570 Hitachi [14].
RESULTADOS
Los análisis de Microscopía Electrónica de Transmisión y Barrido muestran diferentes etapas del proceso de la fagocitosis lográndose establecer cuatro etapas. [15, 16,17]
Aproximación. En esta etapa se observan como los linfocitos PMN se aproximan produciéndose la emisión de seudópodos por parte de la membrana y el citoplasma desprovisto de gránulos. En esta etapa la célula fagocítica entra en contacto con numeroso material e identifica la partícula para ser fagocitada. (Figura 1. A y Figura 2. A y B)
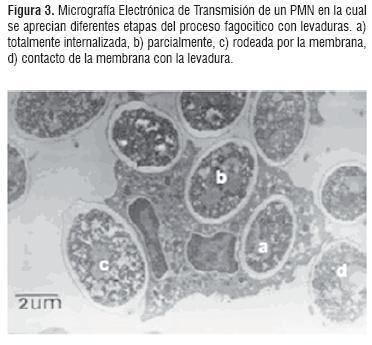
Englobamiento. Una vez la señal fagocítica ha sido generada y transmitida la célula responde con la extensión de seudópodos alrededor de la partícula y eventualmente la encierra dentro de la vacuola fagocítica. La Figura 3 muestra un PMN el cual está rodeado de partículas de levadura y en su interior muestra diferentes etapas del proceso de englobamiento en un tiempo de 20 minutos de incubación y en una proporción de 1 PMN por 20 partículas de levadura demostrándonos que al cabo de este tiempo ya se ha experimentado el proceso.
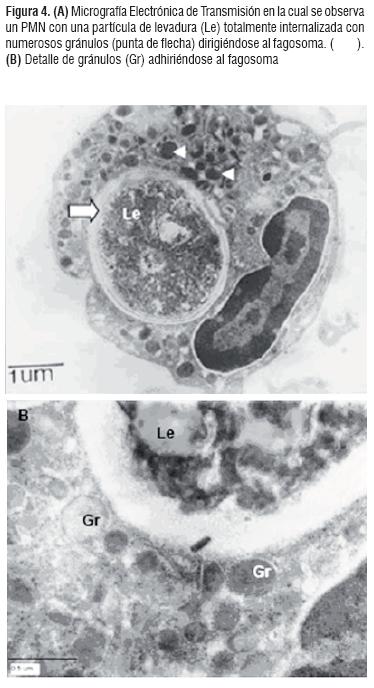
Destrucción intracitoplasmática o lisis. Esta etapa requiere que la célula haya extendido seudópodos alrededor de la partícula hasta que los bordes de la membrana se fundan y encierren la misma para formar una vacuola fagocítica o fagosoma. Los análisis en TEM muestran que hay una migración de los gránulos hacia la vacuola fagocítica, igualmente se aprecia la presencia de un número considerable de gránulos los cuales han ocasionado un deterioro en la pared celular de la levadura. (Figura 4. A y B).
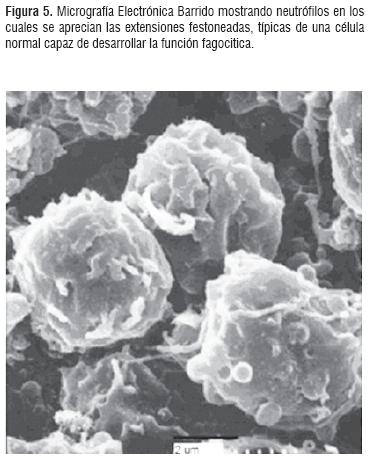
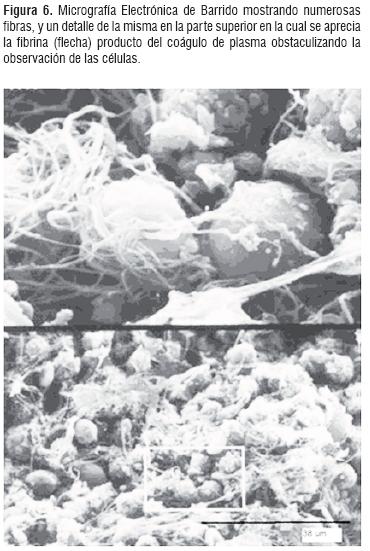
La observación de las diferentes etapas de la fagocitosis a través de Microscopía Electrónica confirma la integridad de las células apreciada en la prueba de viabilidad con azul de tripán realizada en el momento de llevarse acabo la reacción. Es importante destacar que el modelo experimental de fagocitosis mostró muy buenos resultados, determinándose que la proporción de 10 partículas de levadura por PMN permitieron mejores resultados para los análisis de las etapas de la fagocitosis. Igualmente se observó que los linfocitos conservaron la integridad y ultraestructura analizada en el grupo control. (Figura 5). De otra parte, se aprecia que la metodología de coágulo de plasma dio muy buenos resultados para MET pero presentó problemas en los análisis de MEB pues los componentes fibrosos del coágulo contaminan la muestra dificultando la observación. (Figura 6).
CONCLUSIONES
El desarrollo de los protocolos y la metodología para análisis ultraestructural en MET y MEB para muestras biológicas dio buenos resultados. La aplicación del modelo experimental de fagocitosis y el procesamiento de las muestras para MET y MEB fueron correctamente aplicados al observarse que no se presentó daño celular, manteniéndose la integridad de la ultraestructura celular. Se consideró una relación de 10 partículas de levadura por PMN como la proporción más eficiente para la observación del proceso fagocítico, igualmente se determinó muy corto el periodo de incubación de 20 minutos para alcanzar la fagocitosis en su totalidad, al observarse la migración de gránulos hacia el fagosoma pero no la fusión y descarga de estos en la vacuola con posterior destrucción intracitoplasmática, por lo que se consideraría extender el tiempo de reacción a dos horas con muestreos a intervalos regulares.
La técnica del coágulo de plasma mostró muy buenos resultados en preparaciones para TEM pudiéndose observar la ultraestructura celular sin daño, no obstante, esta técnica presentó inconvenientes al observarse en MEB debido a los componentes fibrosos del coágulo que impiden una observación de la muestra, adhiriéndose a las superficies produciendo artefactos y deterioro de las muestras.
Se propone hacer una aplicación de la técnica de coágulo para estudios de TEM y para estudios de MEB hacer uso de técnicas como Bloque de Agar base o poli-L-lisina las cuales permiten obtener imágenes más limpias.
Agradecimientos
Este trabajo se realizó en su mayor parte en la Unidad de Microscopía Electrónica de la Universidad de Costa Rica bajo el auspicio de la Agencia de Cooperación Internacional del Gobierno del Japón (JICA) a través del XII Curso Regional de Microscopía Electrónica 1994.
Se agradece el apoyo prestado por la doctora Olga Arroyo Coordinadora de la Unidad de Microscopía Electrónica Universidad de Costa Rica.
BIBLIOGRAFÍA
[1] HERNÁNDEZ, F.; COTO, E.; COLMENARES, A.; MOREIRA, M. Aplicación del método de coagulación de plasma al estudio ultraestructural de especímenes biológicos. Rev. Biol. Trop 39 (1). 1991. 177-180. [ Links ]
[2] DE GIROLAMI E. Plasma thrombin technique for cell block. Cancer cytol.12. 1972. 25-30. [ Links ]
[3] DE GIROLAMI E. y DE GIROLAMI R. Aplicación del método de plasma trombina al diagnóstico de enfermedades parasitarias. Rev. Biol. Trop. 36. 1988. 485-498. [ Links ]
[4] GRIFFIN, F.M.; and BIANCO, J.R. Characterization of the macrophage receptor for complement and demostration of its functional Independence from the receptor for the fc portion of inmunolobulin. G.J. Exp. Med. 141. 1975. 1269-1277. [ Links ]
[5] GRIFFIN, F.M., Jr.; GRIFFIN, J.A. and SILVERSTEIN, S.C. Studies of mechanism of phagocytosis. I. Requeriments for circumferential attachment of particle-boun ligands to specific receptor of the macrophage plasma membrane. J. Exp. Med. 142. 1988. 1263-1282. [ Links ]
[6] HERMAN E. M. Immunocytochemical Localization of Macromolecules with the Electron Microscope. Annual Review of Plant Physiology and Plant Molecular Biology, June 1988, Vol. 39, 139-155. [ Links ]
[7] MORAGA, D., et al. Stress response in Cu2+ and Cd2+ exposed oysters (Crassostrea gigas): An immunohistochemical approach Comparative Biochemistry and Physiology, Part C 141. 2005. 151-156 [ Links ]
[8] GARNEROT, F. , et al., Immunohistochemical localization of serotonin (5-hydroxytryptamine) in the gonad and digestive gland of Mya arenaria (Mollusca: Bivalvia). General and Comparative Endocrinology 149. 2006. 278-284 [ Links ]
[9] RABITTO, I.S., et al. Effects of dietary Pb(II) and tributyltin on neotropical fish, Hoplias malabaricus: histopathological and biochemical findings. Ecotoxicology and Environmental Safety 60 2005. 147-156 [ Links ]
[10] MARIGOMEZ, I. et al. Cell and tissue biomarkers in mussel, and histopathology in hake and anchovy from Bay of Biscay after the Prestige oil spill (Monitoring Campaign 2003) Marine Pollution Bulletin 53 2006. 287-304 [ Links ]
[11] GADERBERG, O., and BLOM, J. Morphological studie of the in vitro citotoxic effect of alpha hemolitic E. coli bacterium and cultures supernatants on human blood granulocytes and monocytes. Acta Path. Microbil. Inmunol. Scand Sect. B. 94. 1982. 75-83. [ Links ]
[12] GADERBERG, L.V. In vitro citotoxic effect of alphahemolitic and monhemolytic Escherichia coli on human blood granulocytes and monocytes. Acta path. Microbil. Inmunol. Scand Sect. B. 95. 2007. 214-225. [ Links ]
[13] LICOIS, D., et al. Scanning and Transmission electron Microscopic study of adherence of Escherichia coli 0103. Enteropathogenic and/or Enterohemorragic strain gv in enterie infection in rabbits. Infections and immunity. 59. 1991. 3796-3800. [ Links ]
[14] BOZZOLA, J.J and RUSELL, L. Electron Microscopy: Principles and techniques for biologists. Jones & Bartlett publishers. 1991. [ Links ]
[15] ZUCKER-FRANKLIN, D. et al., Atlas of blood cells: functions and pathology. Lea and Febiger, Philadelphia. 1988. 159-188 [ Links ]
[16] GALLIN, J. and FAUCI, A. Advances Phayocitic cells in host differences mechanisms. Raven, press. New York. 1982. 31-51. [ Links ]
[17] ALBERTS B. et al. Molecular Biology of the Cell. Third Edition. Garland Publishing Inc. 1994. 356-410. [ Links ]














