Introducción
El tumor fibroso solitario de pleura (TFSP) es una patología poco frecuente, corresponde a menos del 5 % de los tumores primarios de pleura 1,2. Se reportaron más de 900 casos en la literatura hasta el 2005, aproximadamente 500 nuevos casos hasta la fecha actual (tabla 1) y solo un caso reportado en Colombia 2-5.
Tabla 1 Características demográficas, clínicas y paraclínicas de los pacientes con tumores fibrosos de la pleura.
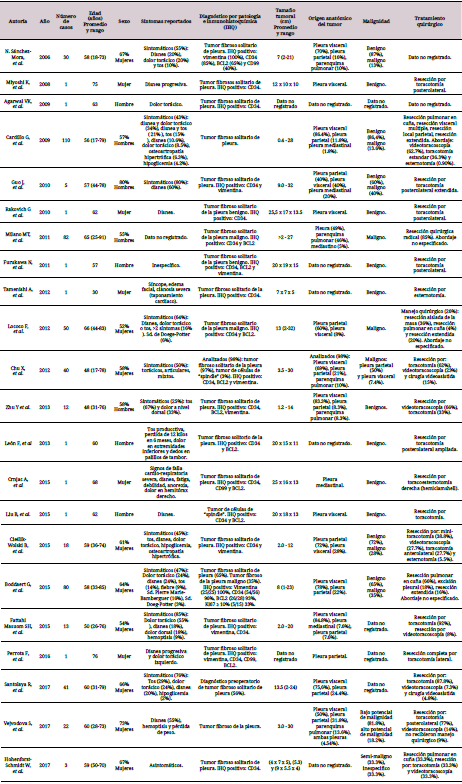
Son más inusuales los tumores mayores de 15 centímetros y aquellos en pacientes menores de 35 años, con un pico de incidencia entre los 60 a 70 años. La distribución es similar entre hombres y mujeres 2,6. Estos tumores son de predominio benigno. Sin embargo, entre el 10 % al 20 % son malignos, caracterizados patológicamente según la actividad mitótica, atipia, hipercelularidad y necrosis 7-9.
En 1870, Wagner reportó el primer caso de un tumor pleural primario localizado. Posteriormente, Klemperer y Rabin publicaron en 1931 la descripción patológica y clasificaron estos tumores en localizados y difusos. Con el avance de la tecnología y las nuevas técnicas de inmunohistoquímica, se considera que este tumor es de origen mesenquimal (tumor localizado), y actualmente se denomina tumor fibroso solitario de pleura 10. Los TFSP varían en tamaño, siendo reportados pocos casos de tumores gigantes 9,11-13.
Estos tumores pueden surgir de órganos viscerales y tejido mesotelial, de localización extratorácica en un 10 % de los casos, en órganos como meninges, glándulas salivales, boca, hígado, páncreas, vejiga y riñones, entre otros 8,10,14. Su localización más frecuente es la pleura: 80 % en la pleura visceral y el 20 % a la pleura parietal 1.
Aparentemente, no hay predisposición genética y no hay relación con exposición a asbesto, tabaco u otro factor ambiental 15.
La clínica del tumor fibroso solitario de pleura (TFSP) gigante suele seguir un curso silente, cuyo hallazgo suele ser incidental en la radiografía o tomografía axial computarizada (TAC) de tórax 1,2,9,14.
Presentación del caso
Paciente femenina de 33 años de edad, de bajo nivel educativo y socioeconómico, manejada en un hospital de tercer nivel público perteneciente al Estado. Antecedente de dos gestaciones, como producto dos mortinatos. El primero lo tuvo a los 32 años de edad, presentó una corioamnionitis aguda severa. Era de sexo masculino, de 29 semanas de gestación, con malformaciones congénitas asociadas (Dolicocefalia, orejas de implantación baja y micrognatia). El segundo mortinato lo tuvo a los 33 años de edad, era de sexo femenino, de 24 semanas de gestación, sin malformaciones reportadas, la placenta evidenció numerosos infartos antiguos, deciduitis aguda y subcorionitis aguda. Ningún otro antecedente de importancia, ni exposición a asbesto o cigarrillo.
Consultó por cuadro de 5 meses de evolución, de disnea de moderados esfuerzos y dolor de intensidad variable en dorso derecho manejado con acetaminofén a necesidad. Adicionalmente, refirió pérdida no cuantificada de peso. No presentó síntomas B asociados.
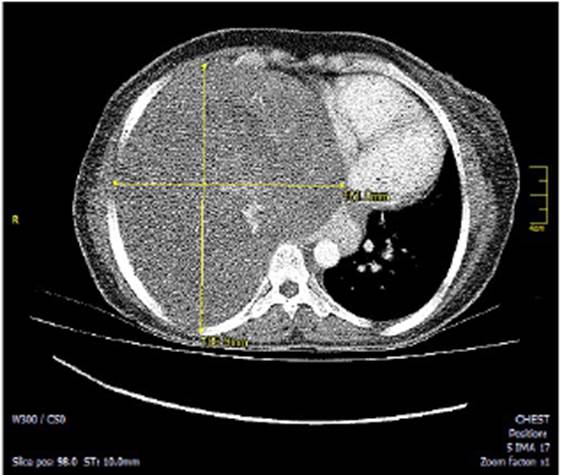
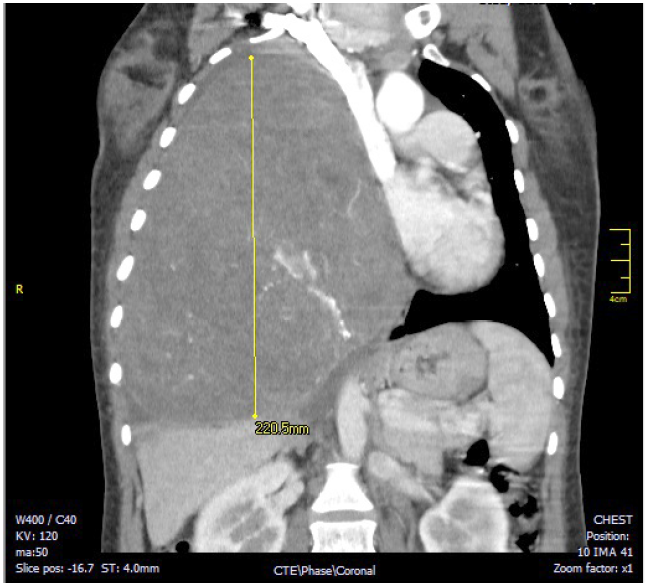
La radiografía de tórax inicial evidenció una opacidad que ocupaba el 70 % del hemitórax derecho, la TAC contrastada de tórax evidenció una gran masa sólida de contornos lobulados que comprometía el 70 % del hemitórax derecho de origen extrapulmonar, heterogénea y con densidad de tejidos blandos, que desplazaba el mediastino y comprimía el corazón (figuras 1 y 2). Las dimensiones de la masa eran 16 x 18 x 22cm. Los diagnósticos planteados por el radiólogo fueron teratoma, tumor fibroso pleural o secuestro pulmonar. La histopatología de la muestra, obtenida por biopsia percutánea con aguja cortante de la lesión, reportó un tumor fusocelular de aspecto benigno que pudiera tratarse de un tumor fibroso de la pleura; posteriormente, la inmunohistoquímica confirmó el diagnóstico por inmunoreactividad de las células tumorales para BCL2, CD34, CD99 y STAT6 compatible con un tumor fibroso solitario.
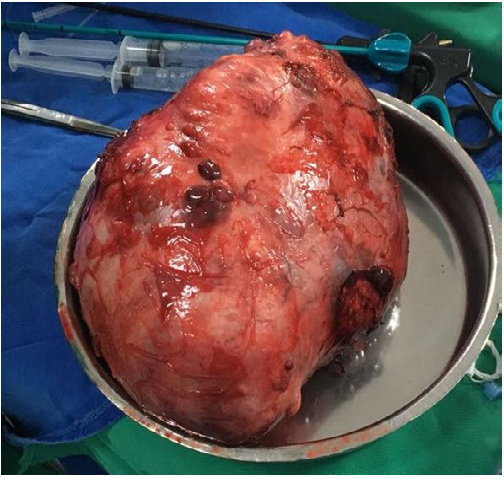
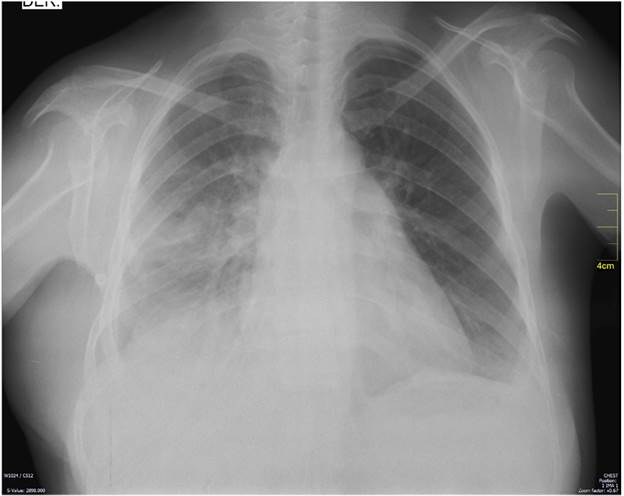
En estudios preoperatorios: el ecocardiograma transtorácico reportó una masa extra cardiaca que comprimía la aurícula derecha, FEVI 63 %, insuficiencia mitral leve, no trombos intracavitarios. Se consideró candidata para manejo quirúrgico y fue llevada a resección por toracotomía posterolateral derecha extendida asistida por video (cirugía de tórax oncológica), encontrándose un tumor dependiente de la pleura parietal derecha de aproximadamente 30 x 25 x 20cm (figura 3), con adherencias laxas y firmes a pleura parietal, lóbulo inferior del pulmón derecho y hemidiafragma derecho. Vasos de irrigación provenientes de la pleura parietal y del lóbulo inferior derecho del pulmón y escaso líquido serohemático libre en la cavidad. Presento un sangrado intraoperatorio estimado de 1000cc, la cirugía se completo sin otras complicaciones. Fue trasladada a la unidad de cuidados intensivos sin soporte vasopresor y con ventilación mecánica invasiva con parámetros bajos. La evolución clínica y radiológica (Figura 4) fue satisfactoria y su egreso hospitalario se registró al sexto día postoperatorio.
La citología del líquido pleural reportó hiperplasia mesotelial reactiva. Histopatología de la pieza quirúrgica (30 x 23 x 16cm) fue compatible con un tumor fibroso solitario, con menos de 1 mitosis por campo, ausencia de necrosis y márgenes de sección libres de tumor. La inmunohistoquímica reportó inmunoreactividad de las células tumorales para BCL2, CD34, CD99, STAT6, CD99 asociado con negatividad para los marcadores CD31, CK y desmina. El índice de proliferación medido con Ki-67 fue menor al 5 %, sin evidencia de mitosis ni pleomorfismo celular, confirmando el diagnóstico de TFSP gigante benigno. De acuerdo con los hallazgos de la patología, se consideró que la paciente no requería manejo oncológico sistémico.
A la fecha, completa 4 meses de seguimiento clínico; sin signos de recidiva local y con una adecuada evolución postoperatoria (figura 4).
Discusión
Entre el 50 % al 60 % de los pacientes con TFSP debutan con múltiples signos y síntomas descritos en la tabla 1 1-3,6-9,11-25. Disnea, dolor torácico y tos son los más frecuentes 5,26. Algunos son secundarios a la localización y tamaño del tumor. Y más frecuentes por lesiones malignas hasta en el 75 % de los casos, incluyendo síntomas sistémicos como la pérdida de peso, fiebre y astenia 2,5,10,14.
Un TFSP gigante se define por un tamaño superior a 15cm de diámetro mayor o que ocupe más del 40 % del hemitórax afectado 13. Por esta razón, en los tumores intratorácicos se han descrito síntomas asociados al efecto compresivo de la masa sobre el corazón, incluyendo taponamiento cardiaco o en el pulmón como derrame pleural y compresión bronquial, lo que genera hemoptisis, atelectasias y neumonitis obstructiva 2,8,10,19. Otros menos frecuentes, como edema de miembros inferiores y dolor de huesos largos, se presentan en el síndrome de Pierre-Marie-Bamberg -posiblemente por producción excesiva de ácido hialurónico por el tumor- siendo este el síndrome más frecuentemente asociado a los TFSP gigantes, entre el 10 % al 20 % de los casos. Entre el 3% al 5 % de los casos de TFSG presentan episodios intermitentes de hipoglicemia refractaria como manifestación del síndrome paraneoplásico denominado Doeg-Potter, causado por la producción del factor similar a la insulina tipo II 1,2,8-10,14,26.
El enfoque diagnóstico inicia con una radiografía de tórax que evidencia una lesión solitaria, redondeada, bien definida y homogénea 8. Los tumores pequeños originados en la pleura parietal forman ángulos obtusos con la pared torácica, más comúnmente localizados en las porciones medias e inferiores del hemitórax, pudiendo estar asociados con derrame pleural entre el 6 %-17 % de los casos 2,10,26.
La tomografía axial computarizada de tórax es la imagen de elección para el diagnóstico de los TFSP. Caracterizándolos por su tamaño, morfología y relación con estructuras adyacentes, además de ser una herramienta para el planeamiento quirúrgico 8,18. Generalmente, demuestra una masa única, con atenuación de tejidos blandos, bien definida, ocasionalmente lobuladas y homogéneas 8,10,26. Puede presentarse heterogeneidad secundaria a degeneración mixoide, hemorragia o necrosis del tumor 26. En el caso de tumores de mayor volumen, las lesiones pueden presentar características atípicas, incluyendo la formación de ángulos agudos con la pleura adyacente, imitando tumores pulmonares periféricos 6,10.
La diferenciación imagenológica de los TFSP benignos frente a los malignos continua siendo limitada, a pesar del uso de la TAC, resonancia magnética nuclear y la tomografía por emisión de positrones FGD 3,8,13,15. Incluso, la evaluación citológica prequirúrgica de estos tumores reporta una exactitud menor del 50 % con el uso de la biopsia con aguja fina guiada por TAC, por lo cual su uso se limita a casos específicos, incluyendo resecciones quirúrgicas extensas, alto riesgo quirúrgico y tumores irresecables 3,15.
Los tumores de 10 cm de diámetro o mayores, no pedunculados, con adherencias fibrosas, derrame pleural asociado, originados de la pleura parietal o con un índice de proliferación medido con Ki-67 del 10 % o mayor, son signos sugestivos de malignidad en este tipo de lesiones 3,8,15,17. La angioembolización es una opción prequirúrgica para reducir el tamaño de los TFSP gigantes, con el fin de disminuir el riesgo de sangrado y facilitar la resección 11.
La resección quirúrgica en bloque, mediante toracotomía, es el patrón de oro para el tratamiento de los TFSP gigantes. El abordaje depende de la localización del tumor y tamaño, manteniendo la resección del parénquima pulmonar al mínimo. Se deben garantizar márgenes de seguridad entre 1-2 centímetros. El sangrado intraoperatorio es una de las mayores complicaciones, con tasas de mortalidad entre 0 %-1.5 % 8,13. La toracoscopía es un abordaje complementario, útil para disminuir el tamaño de la incisión de la toracotomía y así su morbilidad 27. En este caso, se utilizó la toracoscopía para asistir por video la resección en los puntos posteriores donde la masa no permitía una disección y sección segura.
El diagnóstico confirmatorio se realiza mediante las pruebas de inmunohistoquímica para los TFSP, siendo los marcadores positivos más comunes el CD34, CD99, BCL-2, STAT6 y vimentina 16.
En este paciente, a pesar de tener signos sugestivos de malignidad como el tamaño tumoral y su origen en la pleura parietal, el diagnóstico definitivo por patología e inmunohistoquímica fue benigno.
El seguimiento es imprescindible; con TAC de tórax cada 6 meses por 2 años y después, anualmente por la posibilidad de recurrencia reportada entre el 9 % hasta el 30 % de los casos y una sobrevida libre de enfermedad a 10 años del 95.7 % para los TFSP benignos 2,8,11,18,28.
La paciente autorizó y firmo consentimiento informado para la publicación de este caso.
En una paciente joven, es poco frecuente esta patología. Posterior a su diagnóstico, y a pesar de tener algunas características que sugerían malignidad como su tamaño y origen en la pleura parietal, la resección quirúrgica fue el tratamiento indicado para este tumor. La patología e inmunohistoquímica confirmaron el diagnóstico de TFSP gigante benigno, ofreciendo un manejo curativo y egreso hospitalario temprano