Introducción
La salmonelosis es una infección de especial relevancia en salud pública debido al impacto socioeconómico que ocasiona tanto en los países en desarrollo como en los desarrollados. Es una enfermedad bacteriana frecuente que afecta al tracto digestivo generalmente viviendo en los intestinos de animales y humanos y liberada por medio de las heces en el proceso de excreción de los mismos (Gutiérrez et al., 2000). En este sentido, representa una intoxicación dentro de la zoonosis de mayor prevalencia dentro de los países en el mundo y una de las principales razones de enfermedades gastrointestinales severas en los seres humanos (Mora, 2018). El número estimado de infecciones humanas por Salmonella es superior a los 93.800.000 de casos anuales, con 155.000 muertes al año en el mundo, esto esclarecido por El Centro para el Control y la Prevención de Enfermedades (CCPE, 2019). En América latina, Asia y África, la incidencia reportada de salmonelosis es de 200 a 500 casos por cada 100.000 habitantes al año. Consecuentemente, resulta interesante aclarar, que la transmisión de esta infección de persona a persona es poco frecuente, por lo que se considera que los alimentos son la principal fuente de exposición humana, como por ejemplo los huevos de consumo alimenticio, según la Organización Mundial de la Salud (OMS, 2018).
Salmonella es un género de bacilos gramnegativos que pertenece a la familia Enterobacteriaceae (González et al., 2014). Hasta el presente se han identificado más de 2500 serotipos o serovares diferentes en dos tipos de especies, Salmonella bongori y Salmonella enterica. Siendo una bacteria ubicua y resistente que puede sobrevivir durante varias semanas en un ambiente seco y varios meses en agua (Barreto et al., 2016). Si bien, todos los serotipos pueden causar la enfermedad en el ser humano, unos pocos son específicos de algunos huéspedes y pueden alojarse solo en una o en unas pocas especies animales, por ejemplo, Salmonella enterica serotipo Dublín en vacunos, y Salmonella enterica serotipo Choleraesuis en aves y porcinos (Alfaro, 2018). Cuando estos serotipos particulares provocan la enfermedad en la persona suelen ser invasivos y pueden ser mortales.
Así mismo, la nomenclatura de Salmonella ha sido objeto de sucesivas revisiones a través de los años por los diferentes grupos de investigación, debido a la confusión que creaban los criterios adoptados para su designación. En la actualidad se reconoce que el género Salmonella está constituido por una única especie, compuesta de siete taxones, que tienen el nivel de subespecies (subsp), los que pueden dividirse en serovariedades (serotipos) que están descritas en el esquema de Kauffmann-White Le Minor. El nombre para la especie tipo es Salmonella enterica sp. nov., nom. rev. Las serovares del taxón I se designan, por ejemplo, Salmonella subsp. I ser. Typhimurium. Para los restantes taxones, menos frecuentes en patología humana o animal, se emplea el nombre de la subespecie seguida de la fórmula antigénica, por ejemplo, Salmonella subespecie IV 50 b. Este criterio ha sido aceptado como válido por el Comité Internacional de Taxonomía Microbiana y los nombres de las serovares se van incluyendo en las Listas Aprobadas de los Nombres Bacterianos (Eiguet & Caffer, 1988).
Sin embargo, la mayoría de los serotipos se encuentran en una gran diversidad de huéspedes. Generalmente, estos serotipos causan gastroenteritis, que suele ser un trastorno sin complicaciones y no requiere un tratamiento invasivo, aunque puede ser grave en los infantes, longevos y pacientes con sistemas inmunológicos deficientes. A este grupo pertenecen Salmonella enterica serotipo Enteritidis y Salmonella enterica serotipo Typhimurium, los dos serotipos más relevantes de esta bacteria transmitido de animales a humanos en el mundo.
Es de relevancia destacar que los serogrupos de Salmonella entérica pueden llegar a infectar diferentes alimentos, siendo los huevos uno de los más vulnerables en cuanto a la contaminación por microorganismos de este género y teniendo en consideración la importancia de su distribución y agresividad establecidas en los diferentes niveles de este alimento como la cáscara, la cutícula, membrana externa y yema, zonas más propensas a poseer serogrupos C1 y B de esta bacteria (Meza & Morales, 2020).
Así mismo, la envergadura radica en que los serogrupos C1 y B son considerados como responsables de enfermedades gastrointestinales, que causan inflamación severa, daños de las paredes de la mucosa intestinal; y, además, deja al huésped en estado de portador de este ejemplar ampliando la transmisión entre los manipuladores de alimentos entre ellos los huevos reflejando condiciones sanitarias inseguras en el expendio de alimentos y consumo, lo que representa un riesgo para la salud social (Nayarit et al., 2016). Es por ello que, el presente abordaje tuvo por objetivo determinar las variaciones de serogrupos de Salmonella enterica en huevos de uso comercial.
Materiales y métodos
El abordaje investigativo se ampara bajo un enfoque cuantitativo (Ruiz & Estrada, 2021), correspondiente a una tipología descriptiva con la cual se buscó identificar la existencia de Salmonella enteritis en huevos de uso comercial; además, el estudio respondió a un diseño experimental de corte transversal, ya que el proceder analítico y de laboratorio se realizó en un intervalo de tiempo determinado y finito (García & Sánchez, 2020). Así mismo, el trabajo se realizó en la ciudad de Puno, Perú, geopolíticamente esta región se ubica en el departamento y provincia de Puno, a una altitud de 3810 m.s.n.m, dentro de los márgenes de coordenadas 13°00'00" y 17°17'30" de latitud sur y los 71°06'57'' y 68°48'46'' de latitud oeste del meridiano de Greenwich; con una extensión territorial de 71.999, 00 Km2(Cayo & Apaza, 2017).
A su vez, la toma de muestra se llevó a cabo en cuatro mercados pertenecientes a la región; y, el procesamiento de las muestras y análisis serológico se realizó en las instalaciones del Laboratorio de Microbiología de la Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano, que se encuentra ubicada de la ciudad de Puno.
Muestra biológica
Se trabajó con huevos que se expenden en los principales mercados de la ciudad de Puno. El tamaño muestral se obtuvo por medio de un muestreo probabilístico aleatorio para establecimientos poblacionales infinitos, en este tipo de análisis de muestreo, todos los individuos pertenecientes a la población pueden formar parte de la muestra (Zambrana et al., 2020). Consecuentemente, se realizó una corrección a la muestra (Otzen & Manterola, 2017), esta corrección se abordó porque se conoció el tamaño poblacional, este es de 10.100 de los huevos comercializados en la ciudad de Puno; así, la muestra corregida se estableció en 370 huevos distribuidos de la siguiente manera: 125 procedentes del establecimiento comercial I, 100 del establecimiento II, 91 del mercado III y 54 del recinto IV.
Medios de cultivo
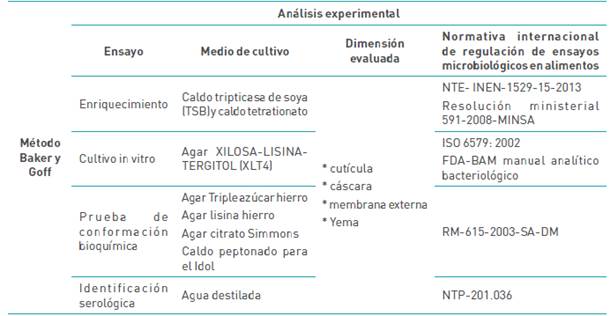
Los medios se seleccionaron de tal forma de esclarecer los parámetros a evaluar para el contraste de resultados. En primera instancia se presentó el cultivo in vitro, este buscó consolidar el enriquecimiento por medio de caldo tripticasa de soya (Tripticasa de soya Broth) (TSB); y, medio selectivo por medio de agar XILOSA-LISINA-TEGITOL (XLT4). Por su parte, para la identificación bioquímica se utilizaron medios diferenciales, estos son; Agar Triple azúcar hierro (TSI), Agar lisina hierro (LIA), Agar citrato Simmons (CIT) y caldo peptonado (IDOL). Consecuentemente, para la identificación serológica se empleó antisuero polivalente para el análisis de Salmonella enterica subespecie enterica y antisuero monovalente para los serogrupos A, B, C1, C2m D y E. También, como complemento se empleó agua destilada y alcohol etílico a 95 % de pureza.
Métodos de análisis microbiológico para la detección de Salmonella
Para la detección serológica de Salmonella enterica en huevos de uso comercial de la ciudad de Puno, se estableció la metodología fundamentada en Baker y Goff (Gómez et al., 2012). La misma constó de 4 etapas de análisis: 1) enriquecimiento, 2) cultivo in vitro, 3) prueba de conformación bioquímica y 4) identificación serológica. Esta estructuración metodológica se puede evidenciar en la tabla 1.
Procedimiento experimental
Caldo tripticasa de soya (Tripticasa de soya Broth)
Cutícula
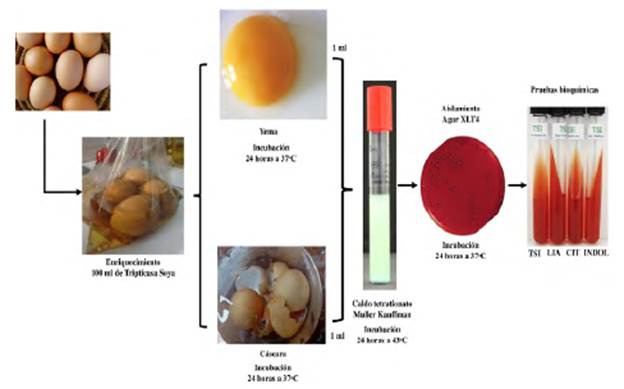
Una vez recabadas las muestras de los mercados establecidos en Puno se realizó un hisopado en la superficie del huevo intacto (sin pasar por lavado). Se introdujo el hisopo en un frasco con 100 ml de medio tripticasa soya Broth (TSB) para proceder a la incubación de los frascos a 37 °C por 24 horas.
Cáscara
En esta etapa se introdujeron los huevos en una bolsa de polietileno estéril. Se cubrió en su totalidad con 100 ml de Tripticasa soya Broth (TSB), consecuentemente, se lavaron las cáscaras por 2 minutos, se trasvasan a un frasco para incubar a 37 °C por 24 horas.
Membrana externa
Se abrió una grieta en las muestras de forma aséptica y se introdujo el asa de kolle en la superficie interna de la cáscara del huevo. Se introdujo el asa en un frasco con 100 ml de TSB y se incubó por 24 horas a 37 °C.
Yema
Se sumergió los huevos en alcohol etílico a 35% de pureza y se flamearon para eliminar el exceso de alcohol, se fracturó de forma aséptica la cáscara y se trasvasa el contenido de 4 huevos a un frasco estéril, consecuentemente, se extrajo el contenido en un frasco con 100 ml de TSB y se incubó por 24 horas a 37 °C.
Caldo tetrationato
Se retiró de la estufa el material incubado en el procedimiento anterior para las distintas partes de los huevos, acto seguido se tomó una alícuota de 1 ml y se transfirió al caldo de enriquecimiento tetrationato Muller Kauffman, para luego ser incubado a 43 °C por 24 horas. Consecuentemente, se procedió a la siempre por medio del Cultivo in vitro: siembra en medio selectivo: Agar XILOSA-LSINA-TERGITOL (XLT4), incubando por 24 horas a 37 °C (Freije et al., 2019).
Prueba de confirmación bioquímica
Se inoculó en agar TSI y agar LIA con un asa en punta introduciendo el inóculo por el centro del medio hasta tocar el fondo del tubo, se retiró por el mismo trazo y se sembró por estría en la parte inclinada del tubo. Con el mismo inóculo, se sembró en el agar citrato Simmons (CIT) por estría en la parte inclinada del tubo, luego en el tubo del caldo peptonado para la prueba del indol, se agitó ligeramente el asa para luego ser incubada en tubos a 37 °C por 24 horas (Bustamante et al., 2009).
Identificación serológica
Se transfirió una cepa del medio TSI al medio TSA a partir de las cuales se realizaron las pruebas serológicas. En primera instancia se procedió a la identificación con antisuero polivalente, este consistió en la colocación de una gota de agua destilada estéril en un portaobjetos de vidrio limpio, se emulsiona una ufc de la cepa aislada de Salmonella a partir del cultivo del medio TSA, se añadió además una gota de antisuero polivalente en el portaobjetos a fin de confirmar la existencia de Salmonella enterica. También, se procedió a la identificación con antisuero monovalente, esto consistió en la adición de seis gotas de agua destilada estéril en el portaobjetos, depositando un pequeño inóculo de la cepa de Salmonella en ellas, se añadió una gota de antisuero monovalente por cada una de las seis gotas de agua destilada, se movió de forma cuidadosa y se verificó el aglutinamiento con el fin de confirmar los serogrupos A, B, C1, C2, D y E.
Para el entendimiento de este abordaje experimental, se expresa el presente diagrama de flujo (figura 1) donde se identifica presencia de Salmonella según el método la Baker y Goff.
Análisis estadístico
Para la comparación de los porcentajes de presencia de Salmonella de las muestras objetos de estudio se aplicó la prueba de Chi-cuadrado, debido a que los resultados se expresaron en frecuencias (absolutas y porcentuales), esto se logró con un nivel de confianza del 95 % (a=0.05), la hipótesis que se buscó validar fue la existencia de diferencias significativas de la presencia de Salmonella según los factores de estudio (establecimientos comerciales y partes del individuo). Estos análisis estadísticos descriptivos se realizaron empleando el software o plataforma Jamovi 1 7.1.2.
Resultados
Presencia de Salmonella sp. en cáscaras, cutícula y membrana externa de los huevos comercializados mediante cultivos in vitro y confirmación bioquímica
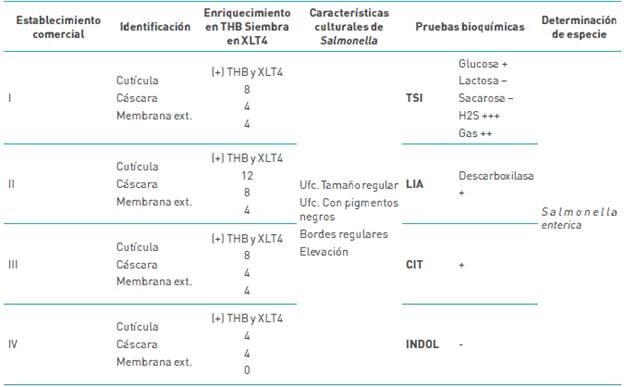
En la tabla 2, se reporta la identificación de especies de Salmonella en cáscara, cutícula y membrana externa en el enriquecimiento y siembra en medio selectivo XLT4; también se esboza el número de muestras positivas en el ámbito de las tres estructuras en la ciudad de Puno, consecuentemente, se reporta las características culturales de las ufc positivas a Salmonella en el medio selectivo y las reacciones bioquímicas abordadas para la identificación del género en medios de cultivo diferenciales para la especie que se diagnosticó como Salmonella enterica
Tabla 2 Identificación de Salmonella enterica. Por medio de cultivos in vitro y pruebas bioquímicas en cáscaras, cutícula y membrana externa.
Fuente: elaboración propia de los autores, 2022.
En la Tabla 3, se esclarece la presencia de microorganismos del género Salmonella en un 8,64 % con respecto a cutícula, incumbiendo el 6,4 %, 12 %, 8,7 % y 7,4 % a los establecimientos comerciales I, II, III y IV respectivamente. Por su parte, se revela la presencia de la bacteria en un 5,41 % en la cáscara, atenuando el 3,20 %, 8 %, 4,40 % y 7,4% a los mercados I, II, III y IV respectivamente. En cuanto a membrana externa del huevo, se visualizó un 3,24 % del ejemplar Salmonella, del cual el 3,2 %, 4 %, 4,3 % y 0 % corresponden a I, II, III y IV.
Tabla 3 Presencia de Salmonella enterica en cutícula, cáscara y membrana externa de huevo
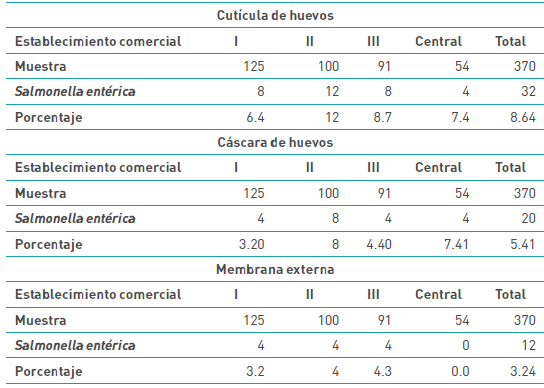
Fuente: elaboración propia de los autores, 2022.
Consecuentemente, se reportan las comparaciones estadísticas luego de la aplicación de la prueba estadística Chi cuadrado, se tiene que para 3 grados de libertad y alfa de 0,05, la presencia de Salmonella enterica en la cutícula de huevo esboza un valor crítico de 7,815 con un p-valor de 0,507; por su parte, en cáscara se evidenció un valor crítico de 7,815 con un p-valor de 0,375; para la membrana externa, se obtuvo un valor crítico de 7,815 y p-valor de 0,498. Finalmente, para la yema un valor crítico de 7,815 y un p-valor de 0,498. Lo anterior bajo la interpretación de H0: todas las proporciones son iguales, Ha: al menos una proporción es distinta de otra. Estos resultados señalan que no se evidencia diferencia significativa (P>0.05) entre los mismos, lo que establece que la presencia de Salmonella enterica es análoga en los cuatro establecimientos comerciales.
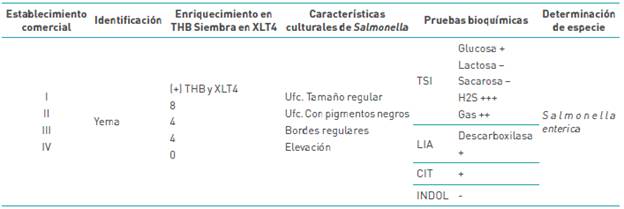
En la tabla 4 se identifica la especie de Salmonella en yema, bajo condiciones de enriquecimiento y siembra en medio selectivo XLT4; dando el número de muestra positiva en este nivel en los establecimientos comerciales, asimismo, se reporta las características culturales de las ufc positivas de Salmonella en el medio selectivo y las reacciones químicas llevadas a cabo para la identificación del género en medios de cultivos diferenciales para la especie que se identificó como Salmonella enterica.
Tabla 4 Presencia de Salmonella sp. en la yema de los huevos por medio de cultivo in vitro y confirmación bioquímica.
Fuente: elaboración propia de los autores, 2022.
En cuanto a la presencia de Salmonella enterica en yema, en la entidad comercial I se concilió 4 para una muestra de 125 se representó un 3,2 %, por su parte para el mercado II se concilia 4 para una muestra de 100, representó el 4 %, para el mercado III, 4 para una muestra de 91, representó el 4,4 % en cuanto al establecimiento IV, no se encontró salmonella en yemas, concibiendo un total de 3,24 %.
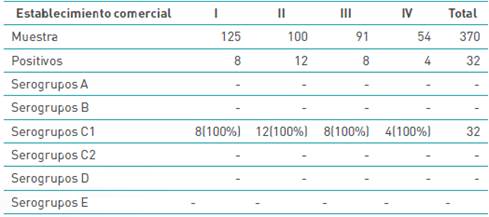
En la tabla 5 se evidencia la presencia de microorganismos del género Salmonella en la cutícula del huevo, donde el 100 % de los aislamientos positivos corresponden al serogrupo C1 en los establecimientos comerciales I y 100 °% del serogrupo C1 en los establecimientos II, III y IV.
Tabla 5 Determinación de serogrupos A, B, C1, C2, D y E de Salmonella enterica de las cepas identificadas en los huevos de uso comercial.
Fuente: elaboración propia de los autores, 2022.
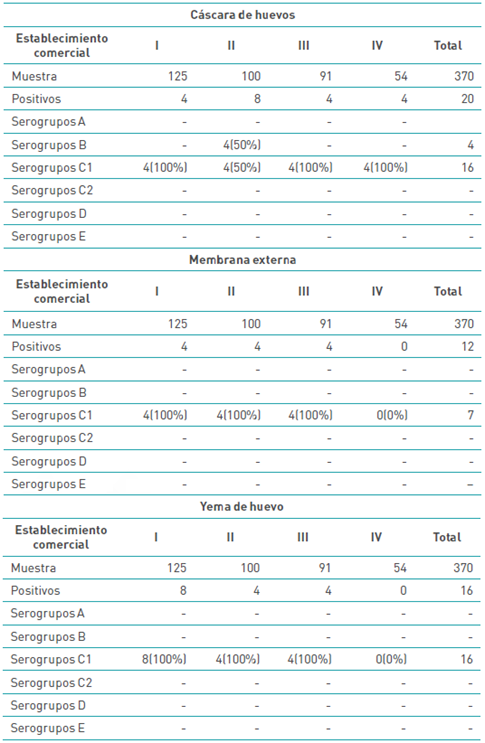
Se evidencia en la Tabla 6 la presencia de microorganismos del género Salmonella en la cáscara de huevo, donde 100 % de los aislamientos positivos corresponden al serogrupo C1 en el establecimiento I, 50 % al serogrupo C1 y 50 % al serogrupo B en el II, C1 en III y C1 en IV. En cuanto a la membrana externa del huevo, el 100 % de los aislamientos corresponden al serogrupo
Tabla 6 Serogrupos de Salmonella enterica en cáscara, membrana externa y yema de huevos
Fuente: elaboración propia de los autores, 2022.
C1 en I, 100 % al C1 en II, 100 % al C1 en III, en cuanto al establecimiento IV no se reportan muestras positivas. Finalmente, en cuanto a la yema de huevo, el 100 % de los aislamientos positivos corresponden al serogrupo C1 en el establecimiento I, II y III, en cuanto al establecimiento IV no se obtuvieron muestras positivas.
Discusiones
Los resultados recabados en cuanto a cutícula en un 8,64 % no esclarecen homogeneidad o concordancia con los reportados por Ramírez et al. (2014) y Mogollón et al. (2016), quienes identificaron la presencia de Salmonella enterica en la cutícula de huevos de granja donde su evidencia representó un 5,37 % y 4,93 % respectivamente en este nivel. Sin embargo, si presentan semejanza con lo reportado por Freije et al. (2019). Estos hallazgos se explican y fundamentan en el hecho que Salmonella tiene una capacidad de adherirse con firmeza a la cutícula por medio de estructuras de tipo lectina, que son proteínas con afinidad a ciertos azúcares que se proyectan a la zona más superficial del huevo, esto esclarecido también en los abordajes realizados por Figueroa y Verdugo (2005).
Así mismo, la presencia de Salmonella enterica en la cutícula del huevo se debe además que el magnum, que es el lugar del tracto reproductivo de la gallina donde se forma la cutícula del huevo, puede ser colonizada por Salmonella y de esta manera incorporarse a esta zona del huevo, asimismo, esta estructura es fácilmente infectada minutos después de la oviposición, ya que en ese momento es inmadura y esta situación la hace vulnerable a factores antrópicos como este, esta aseveración se ampara con lo establecido por Castañeda et al. (2017).
Contreras et al. (2019), en suma, de conocimiento para esta investigación, establece que los humanos representan también una fuente considerable de contaminación de huevos por Salmonella y también los utensilios que se manejan para su comercialización. Cuando la contaminación ocurre, no se consigue mucho con mantener los alimentos refrigerados, ya que a la temperatura de congelación esta bacteria puede sobrevivir por meses, tal y como lo establece Nayarit et al. (2016).
Consecuentemente, para el nivel de la cáscara en un 5,41 % presenta similitud por lo esclarecido por Quesada et al. (2016), quienes establecieron un estudio sobre presencia de Salmonella en huevos frescos en mercados comerciales, evidenciando un 4,40 % de presencia en este nivel. Estos se fundamentan en el hecho de que si bien la cáscara del huevo posee gran cantidad de poros por los cuales se lleva a cabo el intercambio gaseoso con el medio, estos a su vez constituyen una vía de entrada a varios microorganismos, asimismo, la cantidad de microorganismos del género Salmonella en esta estructura del huevo puede variar, ya que depende cerradamente de las condiciones de higiene de la zona, así los huevos procedentes de granja no industriales suelen estar más contaminados que los de las industrias, esto afirmado de forma consolidada por Gutiérrez et al. (2000).
De igual forma, la contaminación de la cáscara del huevo se realiza inmediatamente después de la oviposición, ya que cualquier ambiente contaminado en la zona de este alimento, así como las camas de los animales, cajas, el polvo suspendido, nidos, criaderos, heces, medio ambiente o medios de transporte pueden conducir el microorganismo infeccioso (Gómez et al., 2012). Consecuentemente, la presencia de heces de pollo facilita la supervivencia de Salmonella en la cáscara, puesto que sirven como un depósito nutricional necesario que proporciona a la bacteria un grado de protección física, aun así puede vivir y crecer en los huevos en ausencia de contaminación fecal y sobrevivir por un tiempo largo debido a su metabolismo lento que está inducido por las condiciones secas de la superficie, propiciando la expansión de los microorganismos en la cáscara, esto en concordancia con lo descrito por Freije et al. (2019).
Así, la membrana externa con un 3,24 % presenta semejanza con lo esclarecido por Freije et al. (2019) quienes identificaron la presencia de Salmonella entérica de la membrana externa de huevos de granja, estableciendo un 3,36 %, también guardando estrecha relación con los reportados por González et al. (2014); sin embargo, estos se abordaron por medio de presencia industrial.
Este discernimiento se debe a que si bien la membrana externa cuenta con tres capas de fibrina y mucina, que se encuentran firmemente adheridas a la superficie interior de la cáscara y a pesar de que esta membrana sirve como un filtro mecánico que evita la penetración de microorganismos al interior del huevo, se considera que esta contiene alrededor de 8000 poros existiendo un escaso porcentaje de poros grandes malformados con diámetros varios y superiores al de la bacteria, por donde logra penetrar hasta la membrana externa, aun minutos después de la oviposición los poros pequeños se abren dando mayor oportunidad al ingreso de bacteria explicando con ello la penetración de estas bacterias por lo que la variabilidad de penetración de Salmonella enterica a las diferentes estructuras del huevo se ve favorecida por la porosidad del cascarón tal y como se esclarece en los estudios de Arzálluz et al. (2007) y Castañeda et al. (2017).
Por medio de la prueba Chi-cuadrado se reportan las comparaciones estadísticas de la presencia de Salmonella enterica en la yema de huevo, respecto a los establecimientos comerciales, los resultados indican que no se encontró diferencia significativa (p>0,05) entre los mercados I, II, III y IV con una presencia de este ejemplar en 3,2 % y 0 % respectivamente, esto guarda concordancia con lo descrito por Castañeda et al. (2017). Estos resultados además presentan homogeneidad por lo descrito en el abordaje de Mogollón et al. (2016), quien identificó Salmonella Enteritidis en la yema de huevos de gallina ponedora.
Estos resultados se entablan en el hecho de que la yema de huevo puede contaminarse durante su formación y que la Salmonella es capaz de colonizar el ovario, este tipo de infección se denomina contaminación transovárica, asimismo, la contaminación puede ser oviductal por colonización de la membrana vitelina durante el paso por el oviducto tal y como lo refieren los estudios de Ramírez et al. (2014) y Mora (2018).
Los hallazgos sobre la presencia de Salmonella enterica subespecie enterica serogrupo C1 y Salmonella serogrupo B, presentan concordancia con lo esclarecido por Ramírez et al. (2014), quienes identificaron los serogrupos de Salmonella en cerdos de granja comercial donde hubo un total de los aislamientos 85 % correspondieron al serogrupo C1 y 10 % al serogrupo B pertenecientes a Salmonella enterica, serogrupos que también se conciben en otros estudios realizados por Gómez et al. (2012) en camarones de cultivo crudo y Nayarit et al. (2016) en aislamientos de carnes de res molida.
Estos resultados se encuentran enmarcados en lo suscitado que explica que la diversidad estructural del antígeno O se desarrolló durante la evolución con el fin de escapar al sistema inmune del hospedador mediante la presencia de novedosas especificaciones, razón por la cual la Organización Mundial de la Salud formuló una clasificación de Salmonella y de esta manera se puede esconder las unidades más profundad (lípido A y núcleo) los cuales son esenciales para la multiplicación bacteriana, de este modo el antígeno O protege a Salmonella contra la acción antibacteriana de ciertos productos que pueden aplicarse a la estructura del huevo. Así, el antígeno O de la bacteria de este género no solo protege sino además de que, al tener variabilidad en su estructura, da lugar a serogrupos más agresivo, dado que el grado de invasión, virulencia y supervivencia es distinto entre serogrupos tal y como se establecen en las investigaciones realizadas por (Parra et al., 2019).
Por su parte, la relevancia de los resultados del serogrupo B se debe a que la especie al producir infección altera la expresión genética de un gran número de genes de quimioquinas, receptores de superficie celular, así como genes que no se habían implicado en la respuesta del hospedero, así esta bacteria perteneciente a este grupo capitaliza la fagocitosis de los macrófagos para residir intracelularmente en estos donde se replica en vacuolas especializadas (Castañeda et al., 2017; Nayarit et al., 2016).
De los hallazgos reportados sobre la presencia se serogrupos A, B, C1, C2, D y E de Salmonella enterica de las cepas identificadas en los huevos, se acepta la hipótesis de que existen los serogrupos C1 y B de Salmonella enterica en las cepas de los huevos de uso comercial.
Conclusiones
La Salmonella entérica es uno de los patógenos más trascendentales transmitidos por los animales en el mundo, siendo la primera causa de brotes de intoxicación alimentaria en Latinoamérica. A pesar de todos los bríos de inspección y prevención desarrollados, los acontecimientos en las personas se han sostenido alta, por lo que diversos factores podrían estar influenciando el comportamiento epidemiológico de esta infección como el establecimiento de los serogrupos de este ejemplar. El objetivo de este abordaje fue determinar las variaciones de serogrupos de Salmonella enterica en huevos de uso comercial, de esta manera se refirió a ámbitos significativos dentro de esta investigación, el cual permitió entender su dispersión en las diferentes áreas del huevo (cáscara, membrana exterior, cutícula y yema) y su éxito como patógeno de un amplio rango de hospedadores de los serogrupos. A futuro, el mayor conocimiento de estos serogrupos y sus comportamientos facilitará la implementación de estrategias de bioseguridad, saneamiento y manejo de los alimentos de origen no solo de gallinas ponedoras, sino de toda la variedad de animales que se encuentran portantes o propensos a portar este patógeno severo para la prevención de la enfermedad y disminuir la vulnerabilidad en las personas y otros animales.