Introducción
La garrapata común del ganado (Rhipicephalus. (Boophilus) microplus) posee una amplia distribución geográfica, siendo predominante en casi todos los países tropicales y subtropicales del globo (Álvarez et al., 2006; Muro et al., 2004). Como ectoparásito obligado, R. (B.) microplus se encuentra principalmente en el ganado bovino, no siendo ajena su presencia en equinos, ovinos y perros. Adicionalmente, es considerado el ectoparásito de mayor importancia en este sector pecuario debido a los daños y grandes pérdidas económicas ocasionadas(López-Valencia, 2013). Consecuencias directas como la pérdida de peso en el animal debido a la ingurgitación de sangre por parte del ectoparásito, e indirectas como la transmisión de diferentes organismos patógenos como la bacteria Anaplasma marginale y dos protozoos del género Babesia: B. bigemina y B. bovis, han sido bien estudiadas y caracterizadas. Tales organismos patógenos revisten gran atención debido a que causan la llamada “fiebre de las garrapatas”, siendo la anemia el principal causante, inclusive ocasionando la muerte del bovino cuando éste se encuentra totalmente infestado por el parásito (López-Valencia, 2013).
Por estas razones, diversos mecanismos han sido propuestos y usados para contrarrestar tales daños, entre los cuales se encuentra como principal medida el uso del método químico convencional, siendo los organofosforados, piretroides y amidinas los compuestos de mayor uso a nivel mundial (Álvarez et al., 2006; Cabrera, Rodríguez y Rosado, 2008; Castro-Janer, Martins et al., 2010; Castro-Janer, Rifran et al., 2010). Si bien se ha logrado controlar este ácaro a través de estos compuestos, su uso repetitivo, seguido de su mala utilización, ha llevado a la generación de resistencia en diversos lugares del mundo por parte de esta garrapata (Cabrera, Rodríguez y Rosado, 2008; Castro-Janer, Rifran et al., 2010; Castro-Janer, Martins et al., 2010; Kumar et al., 2011), al igual que repercusiones en el ambiente y problemas a la salud humana debido al hallazgo de residuos de algunos de estos derivados en la carne y leche de los animales (Rossini, 2013).
Dicha problemática ha obligado a la búsqueda constante de mecanismos diferentes de control que permitan contrarrestar tales problemáticas, siendo el control biológico como por ejemplo el uso de microorganismos entomopatógenos (López, López y Orduz 2009; Ren et al. 2012) y el uso de extractos vegetales una alternativa promisoria (Bisen, S.C, and P.K 2011; Kaaya 1992; Borges, Sousa, and Barbosa 2011).
Jatropha curcas (Euphorbiaceae), se encuentra ampliamente distribuida en los trópicos y subtrópicos, siendo nativa principalmente de centro y sur América(Achten et al., 2008). J. curcas es considerada en términos generales como planta tóxica, principalmente debido a los ésteres de forbol presentes en la semilla. Si bien su uso principal está enfocado a la extracción de aceite a partir de su semilla y posterior producción de biocombustible, la presencia de estos compuestos tóxicos ha motivado la exploración y utilización como posibles biopesticidas (Djamin and A.B, 2012; Devappa, Makkar and Becker, 2010a; Devappa, Rajesh et al., 2012; Devappa, Angulo-Escalante et al., 2012; Bevilaqua et al., 2011).
Por su parte, Annona muricata (Annonaceae), comúnmente llamada guanábana y nativa de Centro América, posee una amplia distribución geográfica, siendo igualmente las regiones tropicales y subtropicales las de mejores condiciones para su establecimiento (Badrie y Schauss, 2009). Como fruta ampliamente consumida, en las últimas décadas diversos estudios se han enfocado en buscar las moléculas principales que se encuentran en las diferentes partes de la planta con la finalidad de aislar y posteriormente evaluar su actividad biológica (Rupprecht, Hui, y McLaughlin, 1990; Ragasa et al., 2012; Cavé et al., 1997), siendo las acetogeninas el grupo de compuestos principales con mayor capacidad tóxica. De esta manera, su aislamiento ha permitido emplearlas como fungicidas, antihelmínticos, bactericidas e insecticidas en general (de Sousa et al., 2010; Komansilan et al., 2012; Ferreira et al., 2013).
En este contexto, el objetivo de este trabajo fue evaluar el efecto de los extractos vegetales de J. curcas y A. muricata sobre la capacidad reproductiva de la garrapata común del ganado R (B.) microplus bajo condiciones de laboratorio.
Materiales y Métodos
Obtención material vegetal
La obtención de las semillas de J. curcas se llevó a cabo gracias a la empresa “Colombiana de Biocombustibles S.A”, ubicada en el municipio de Santa Fe de Antioquia - Antioquia, Colombia. Se utilizaron 2 kg aproximadamente para la realización del experimento, las cuáles fueron escarificadas y la almendra resultante fue pulverizada a través de un pulverizador mecánico. Por otra parte, las semillas de A. muricata, fueron obtenidas en el mercado local. Estas semillas no fueron sometidas a procesos de escarificación, sólo trituradas mecánicamente; todo el material fue lavado con agua y secado previo a la extracción de sus metabolitos totales.
Obtención de extractos vegetales
Mezcla de solvente + semilla. El material obtenido de cada especie vegetal se mezcló con el solvente etanol en una proporción 1:2 y almacenado durante 48 horas a temperatura ambiente en un recipiente. Posteriormente esta mezcla fue filtrada a través de papel filtro, y la solución obtenida se almacenó en un nuevo recipiente. Esta percolación fue repetida tres veces cada 24 horas sobre la porción restante del primer recipiente, utilizando cada vez un solvente nuevo. La solución final (solvente + metabolitos) se llevó a temperatura de 4 °C hasta el momento de la extracción de sus metabolitos. El solvente fue grado analítico.
Obtención extractos totales. La solución contenida en el recipiente se sometió a rotaevaporación mediante un rotaevaporador marca YAMATO (Vacumm Controller VR 600) a una presión de 550 HPa y a una temperatura entre 35-40 °C en el baño maría hasta obtener los extractos totales. Los extractos fueron almacenados en frascos ámbar durante 15 días a 4 °C hasta la realización de cada experimento. Este procedimiento se llevó a cabo en el laboratorio de química de la Escuela de Ingeniería de Antioquia (IEA), Medellín-Antioquia.
Muestreo garrapatas
Siguiendo la metodología de Drummond et al. (1973), los extractos se evaluaron sobre las teleoginas, que corresponde al estado en el cual las garrapatas están completamente ingurgitadas. La obtención de las teleoginas se llevó a cabo en la finca San Rafael, ubicada en el municipio de San Pedro de Los Milagros - Antioquia, Colombia. De cada una de 16 vacas raza Holstein se tomó al azar una muestra de 15 a 30 teleoginas. Las teleoginas colectadas fueron almacenadas en recipientes plásticos mientras fueron llevadas al laboratorio hasta el momento de las pruebas in vitro.
Pruebas in vitro
Los extractos vegetales fueron preparados de acuerdo a cinco concentraciones diferentes, medidas como el porcentaje de metabolitos totales: 0,1%, 0,5%, 1%, 3% y 5%. Las teleoginas fueron lavadas con agua estéril por un minuto y luego secadas con papel absorbente para eliminar impurezas. Siguiendo a Drummond et al. (1973), 36 grupos de 10 garrapatas fueron previamente pesadas y dispuestas en cajas de petri; se usaron tres réplicas por cada combinación de planta (J. curcas y A. muricata) y concentración del extracto (0,1; 0,5; 1, 3 y 5%) más un control negativo (solo agua) y un control positivo. El control positivo fue un acaricida convencional (Ganabaño®) preparado de acuerdo a las indicaciones propuestas por el productor (0.015 %).
Adicionalmente, se procedió a realizar la Prueba de Inmersión de Adulto (AIT) (“Adult Inmersion Test” por sus siglas en inglés) la cual consiste en tomar los grupos de 10 garrapatas y sumergirlas durante 3 minutos en cada uno de los tratamientos previamente mencionados (López, López y Orduz, 2009; Santillán-Velazquez et al., 2013); suavemente se agitan las soluciones con las garrapatas allí sumergidas. Las garrapatas fueron extraídas y secadas con papel absorbente, retornando cada grupo a la caja de Petri correspondiente. Las cajas de Petri (previamente cubiertas para evitar la salida de los individuos) fueron incubadas a una temperatura entre 27 - 28 °C y humedad relativa entre el 70 - 80 % durante 24 días (Drummond et al., 1973). Posteriormente, se retiraron las teleoginas y los huevos resultantes se pesaron. En seguida, los mismos huevos fueron dispuestos en tubos de ensayo de 12 cm, cerrados con tapón de gasa evitando la salida de las larvas emergentes; dicho procedimiento se dejó por 24 días más bajo las mismas condiciones de temperatura y humedad relativa previamente mencionadas.
La tasa (%) de eclosión larvaria se determinó de forma cualitativa, generando un valor numérico para este porcentaje al observar cada tubo de ensayo, aprovechando el hecho de que la larva eclosionada se ve de color blanco y los huevos no eclosionados de color café oscuro. Esta evaluación siempre fue realizada por la misma persona.
Usando el peso inicial de las garrapatas, el peso de los huevos y la tasa de eclosión larvaria, se calculó el índice de producción de huevos (IPH) y la eficiencia reproductiva (ER) con las siguientes fórmulas:
Análisis estadístico
Como indicadores del desempeño del extracto sobre la capacidad reproductiva de la garrapata, se usaron el índice de producción de huevos (IPH) y la eficiencia reproductiva (ER). Estos dos índices fueron modelados en función de la concentración (% de metabolitos totales) del extracto y la especie de planta (A. muricata y J. curcas) usando un análisis de covarianza (Ancova). Dado que se observó un patrón no lineal en ambas respuestas, la concentración del extracto fue incluida en el modelo Ancova de forma lineal y cuadrática. Desde el modelo Ancova, se realizaron contrastes entre la respuesta media de los controles y la curva de respuesta obtenida para cada combinación de tipo de planta y concentración del extracto. Los residuales del modelo cumplieron los supuestos de normalidad y homogeneidad de varianzas. Todos los análisis fueron realizados con el software R (CoreTeam Development, 2015).
Resultados
La eficiencia reproductiva (ER) se encontró directamente proporcional al índice de producción de huevos (IPH) dado que el porcentaje de eclosión se comportó aproximadamente constante (alrededor del 98%) para el conjunto de réplicas. La correlación lineal entre el ER y el IPH fue 0,96. La media y desviación estándar para cada variable fue: IPH: 0,335 (0,191); ER: 30,66 (19,97). Debido a esto, los resultados del modelo Ancova fueron muy similares para ambas variables (ER e IPH) y por esto solo se muestran aquí los resultados de dicho modelo para el IPH.
El índice de producción de huevos (IPH) disminuye de forma no lineal con la concentración del extracto en ambas especies de planta (Figura 1). El IPH mostró una reducción significativa cuando cualquiera de las combinaciones de planta/concentración del extracto fue comparada con el control negativo (Ancova, valor p < 0,050). La comparación con el control positivo tuvo resultados variables dependiendo de los dos factores evaluados. El extracto de J. curcas solo supera de forma significativa (Ancova, valor p = 0,008) al control positivo cuando su concentración es mayor a 3.5% aproximadamente (Figura 1A). Por otro lado, A. muricata supera de forma significativa (Ancova, valor p < 0,001) al control positivo a partir de un 1% de concentración (Figura 1B).
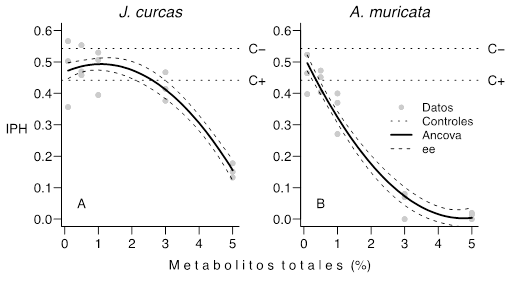
Figura 1 Desempeño de J. curcas (panel A) y A. muricata (panel B) expresado a través del índice de producción de huevos (IPH), en función de la concentración del extracto (metabolitos totales). Se indican los datos de cada réplica, el promedio de IPH de los controles negativo (C-: 0,542) y positivo (C+: 0,442) y la predicción realizada por el modelo Ancova (R 2 = 0,924, valor p < 0,0001) (ee = error estándar de la predicción obtenido desde el modelo Ancova). Las curvas mostradas aquí para el IPH son iguales a las de la eficiencia reproductiva (ER).
El Ancova mostró una interacción significativa entre la concentración (lineal y cuadrática) del extracto y el tipo de planta (Prueba para interacción con la concentración cuadrática, F 1,24 = 22,82, valor p < 0,001; con la concentración lineal: F 1,24 = 29,18, valor p < 0,001). Estas interacciones se observan en la diferencia en el patrón de descenso de las dos curvas de la Figura 1. La A. muricata tuvo un descenso más fuerte del IPH que la J. curcas. Por ejemplo, si el extracto de A. muricata se usa a un 3% de metabolitos totales, se espera que el IPH caiga de 0,5 a 0,2 (un 85%) mientras que a la misma concentración para la J. curcas, se espera que el IPH caiga de 0,5 a 0,41 (un 18%) (Figura 1).
Discusión
La reducción observada en el IPH y la ER con el uso de los extractos vegetales de la guanábana y de la jatropha demuestra su capacidad biocontroladora sobre teleoginas de la garrapata del ganado.
Históricamente, J. curcas ha sido ampliamente usada con diferentes fines, entre los cuales se encuentra su uso a nivel medicinal, etnobotánico y base de alimento para animales (Devappa, Makkar Becker, 2010a; Aiyelaagbe et al., 2011). Sin embargo, debido al alto contenido de aceite en sus semillas, en las últimas décadas ha incrementado su interés por su extracción y posterior producción de biodiesel (Pandey et al., 2012).
Adicionalmente, la presencia en sus semillas, tallo y hojas de ciertos compuestos tóxicos y anti nutricionales tales como taninos, diterpenos, saponinas, inhibidores de tripsina, lectinas y curcinas ha motivado a la búsqueda de usos alternos tales como el Biocontrol. Por ejemplo, Devappa y col. recientemente demostraron que los ésteres de forbol (diterpenos), considerados como los compuestos más tóxicos de la jatropha y presentes en buena cantidad en la semilla, poseen un alto potencial bioinsecticida contra diferentes organismos de interés comercial (Devappa, Rajesh, et al., 2012). Por otra parte Juliet et al. 2012 han obtenido una reducción en el porcentaje de postura de Rhipicephalus (Boophilus) annulatus de hasta el 90% cuando son tratadas con extracto etanólico a partir de las hojas de Jatropha. De igual manera, y consistente con la actividad biocontroladora del extracto etanólico de semilla de J. curcas, varios estudios han sido conducidos a soportar la idea de que esta planta posee un amplio espectro de acción con actividad insecticida, entre los cuales se ha encontrado efectivo contra Spodoptera frugiperda, Sitophilus zeamais y haemonchus contortus (Devappa, Angulo-Escalante et al., 2012; Bevilaqua et al., 2011; Djamin and A.B, 2012).
Hasta la fecha, no se han encontrado reportes que soporten la actividad bioinsecticida de extractos de J. curcas sobe teleoginas de R (B) microplus. En los resultados obtenidos, el IPH mostró diferencias estadísticamente significativas cuando la concentración de metabolitos totales era igual o superior al 3.5%. Dichos resultados pueden están relacionados con la presencia de terpenoides y taninos presentes en la semilla, compuestos que se creen están involucrados en la actividad antinutricional de esta planta (Devappa, Makkar and Becker, 2010a). Sin embargo, determinar si ambos tipos de compuestos causaron dichos resultados, no es apropiado, ya que, aunque J. curcas tenga la posibilidad de sintetizar muchos diterpenos diferentes, la información acerca de su actividad biológica resulta todavía escasa (Devappa, Makkar, and Becker, 2010a). Adicionalmente, es importante aclarar que la separación de compuestos específicos no se llevó a cabo en este estudio, sino la extracción de metabolitos totales.
Por su parte, los resultados encontrados con respecto a A. muricata en el presente trabajo, indican que el extracto etanólico mostró los mejores resultados en comparación con los extractos de J. curcas. En la figura 1 se puede observar como a partir del 1% de concentración de metabolitos hubo un efecto estadísticamente significativo sobre el IPH (lo mismo para el ER; datos no mostrados), indicando ser un buen candidato para la extracción de metabolitos secundarios y continuar estudiando su actividad bioinsecticida.
Los efectos de esta planta se cree que están atribuidos a la presencia de acetogeninas (principalmente anonacinas y muricatacinas) en la semilla de guanábana, compuestos que han sido asociados con la inhibición de la respiración a nivel celular al bloquear el complejo 1 mitocondrial, y por consiguiente la muerte del ectoparásito (Rupprecht, Hui and McLaughlin, 1990).
Estudios similares respaldan la capacidad bioinsecticida de este extracto: por ejemplo, Robledo-Reyes et al., 2008, encontraron que los extractos etanólicos de semilla de guanábana tienen un efecto sobre el último estadio de ninfas de Periplaneta americana, obteniendo una mortalidad entre el 40 y 60% diez días después de ser tratadas con dicho extracto. De igual manera, Amariles, et al. (2013) encontraron que el mayor efecto biocontrolador a partir de 3 especies vegetales diferentes sobre ninfas de tercer estadio de Aedes aegypti, proviene de la extracción de metabolitos totales de semillas de A. muricata. Adicionalmente, Parra-Henao, et al.2007 muestran la capacidad de esta planta para generar una mortalidad mayor en comparación con los demás extractos evaluados, indicando ser una planta promisoria para estudios de actividad biológica.
J. curcas mostró menor actividad biológica comparado con A. Muricata (Figura 1). Si bien en este estudio no se realizó una obtención de metabolitos específicos, se propone que esto puede ser debido a la presencia de muchos metabolitos primarios (carbohidratos, proteínas, lípidos, etcétera) presentes en el extracto de Jatropha, los cuales podrían opacar la acción de los componentes activos más relevantes en la planta tales como los ésteres de forbol que han mostrado una actividad importante en otros estudios (Rakshit et al., 2008; Goel et al., 2007). Posiblemente los compuestos con actividad biológica en A. Muricata se encuentren en una mayor concentración y esto se deba su mayor efecto. Por ejemplo, se ha reportado que la semilla de guanábana posee alrededor de un 23% en aceites, lo cual sería un indicador de que tales acetogeninas (policétidos similares a los ácidos grasos) presenten una buena concentración (Badrie and Schauss, 2009; Solís-Fuentes, Hernández-Medel y Durán-de-Bazúa, 2011). Por tal razón, se recomendaría extraer y posteriormente evaluar tales componentes activos (tanto en J. curcas como en A. muricata) con la finalidad de ver su efecto (Devappa, Makkar and Becker, 2010b; Devappa, Makkar and Becker, 2010a), ya que los resultados arriba reportados han mostrado ser alentadores para el control de este ectoparásito. Adicionalmente, el protocolo usado en este estudio bajo condiciones In vitro (Drummond et al., 1973), ha mostrado ser efectivo en la evaluación de extractos vegetales.
Conclusiones
En conclusión, se encontró que los extractos de J. curcas y A. muricata son prometedores para el control de R (B) microplus bajo condiciones in vitro. Los extractos de A. muricata tuvieron un mayor efecto biológico y por ende pueden ser una mejor opción para futuras investigaciones, no solamente en esta garrapata (de Sousa et al., 2010; Komansilan et al., 2012; Ferreira et al., 2013). El aislamiento de sus componentes activos y posterior evaluación en este ectoparásito es requerido. Sin embargo, por tratarse precisamente de evaluaciones a nivel de laboratorio, su reproducibilidad y evaluación en estudios de campo también son necesarias.















