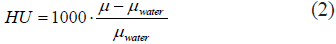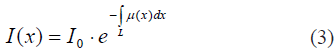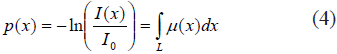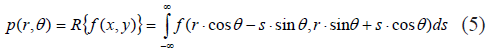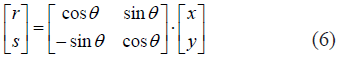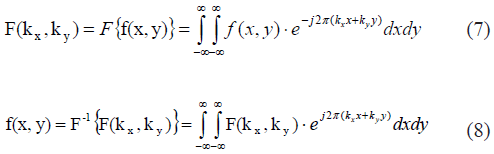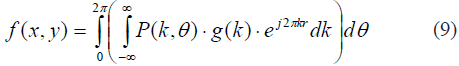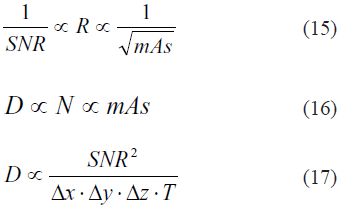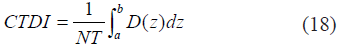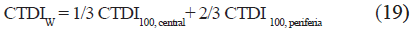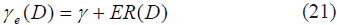Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ingeniería Biomédica
Print version ISSN 1909-9762
Rev. ing. biomed. vol.2 no.4 Medellín July/Dec. 2008
TOMOGRAFÍA COMPUTARIZADA POR RAYOS X: FUNDAMENTOS Y ACTUALIDAD
Juan Carlos Ramírez Giraldo1, Carolina Arboleda Clavijo2, Cynthia H. McCollough3
1 Department of Physiology and Biomedical Engineering, Mayo Graduate School, Mayo Clinic, Rochester-MN, EE. UU. ramirezgiraldo.juancarlos@mayo.edu.
2 Programa de Ingeniería Biomédica. Escuela de Ingeniería de Antioquia-Universidad CES, Colombia.
3 CT Clinical Innovation Center, Department of Radiology, Mayo Clinic, Rochester-MN, EE. UU.
Recibido 12 de septiembre de 2008. Aceptado 5 de noviembre de 2008
RESUMEN
Este artículo presenta una revisión de los fundamentos de la tomografía computarizada, empezando por un recuento de los inicios y progresos de esta técnica a través del tiempo, y continuando con una descripción de los principios físicos que rigen la producción de los rayos X. El artículo también discute las bases matemáticas para la reconstrucción de las imágenes a partir de proyecciones utilizando métodos analíticos o iterativos. En una sección independiente, se revisan los conceptos más importantes relacionados con los riesgos de la radiación ionizante y se discuten investigaciones recientes, algunas polémicas, acerca de los beneficios y riesgos asociados con la tomografía computarizada y cómo estos afectan los protocolos de adquisición de las imágenes. Finalmente, con base en los avances científicos y tendencias más recientes, el artículo propone las áreas que, presumiblemente, continuarán siendo el centro de atención de la tomografía computarizada de rayos X en los próximos años.
PALABRAS CLAVE: Dosimetría, Rayos X, Reconstrucción de imágenes, Tomografía computarizada.
ABSTRACT
This paper reviews the fundamentals of x-ray computed tomography. It starts by summarizing the early days of the technique and its evolution through time, as well as the physical principles of x-ray production. Subsequently, the mathematical principles of image reconstruction are discussed with emphasis in both analytical and iterative reconstruction methods. A complete section is dedicated to review the main concepts related with the risks of ionizing radiation, and discuss some of the most recent controversies about CT radiation and how those risks affect scanning protocols. Finally, based on the most recent advances and trends in CT, the paper discuss about those areas, which, presumably, will be the research focus of CT in the near future.
KEY WORDS: Dosimetry, X Rays, Image reconstruction, Computed tomography.
I. EVOLUCIÓN DE LA TOMOGRAFÍA COMPUTARIZADA POR RAYOS X
En julio de 1972, el ingeniero eléctrico Sir Godfrey Newbold Hounsfield publicó un artículo en la Revista British Journal of Radiology, donde describía una técnica basada en rayos X, llamada tomografía computarizada [1-2], que utilizaba métodos matemáticos que A.M. Cormack había desarrollado una década antes [3]. El método de Hounsfield dividía la cabeza en varias tajadas, cada una de las cuales era irradiada por sus bordes. De esta manera, la radiación podía ser confinada dentro de la misma porción. A diferencia de la técnica convencional de rayos X, la información obtenida no se veía afectada por variaciones del material, que se presentaran a ambos lados de la tajada en cuestión [2].
La técnica tomográfica buscaba superar tres limitaciones que Hounsfield consideraba evidentes en la radiología convencional. Primero, la imposibilidad de mostrar en una imagen radiológica bidimensional toda la información contenida en una escena tridimensional, debido a la superposición de los objetos en la imagen que se obtenía; segundo, la limitada capacidad para distinguir tejidos blandos; y finalmente, la imposibilidad de cuantificar las densidades de los tejidos [4].
La primeras imágenes de tomografía reconstruidas con el primer escáner desarrollado en los Laboratorios EMI contaban con una muy baja resolución espacial, una matriz de 80x80 pixeles, y tardaba nueve horas en total para cubrir un cerebro humano [5-6]. El primer escáner comercializado en 1973 fue el EMI Mark I, y a pesar que tomaba imágenes con una muy baja resolución espacial, comparadas con los estándares actuales, representó una revolución en el campo de la radiología (Fig. 1).
En los tomógrafos de primera generación, se producían rayos paralelos gracias a un movimiento de traslación a largo del objeto, y este proceso se repetía con pequeños incrementos rotacionales hasta barrer 180 grados (Fig. 2a). Los equipos de segunda generación funcionaban bajo un principio de traslación-rotación similar; sin embargo, podían realizar el proceso un poco más rápido, gracias al uso de un mayor número de detectores, y una fuente que emitía rayos en forma de abanico , además, aprovechaban mejor la potencia de los rayos X emitidos [7].
La búsqueda de una mayor velocidad de adquisición de las imágenes hizo que se eliminara el movimiento de traslación; así, aparecieron los equipos de tercera generación, en 1975 (Fig. 2b). En este tipo de escáneres, el tubo de rayos X y el detector rotan simultáneamente, cubriendo el paciente con un haz de rayos X en forma de abanico. Los primeros prototipos de tercera generación contaban con arreglos (unidimensionales) de hasta 250 detectores y permitían tiempos de adquisición de sólo 5 segundos [5,7-8]. A pesar de una ganancia considerable en los tiempos de adquisición, esta geometría presenta un problema: dado que los tubos de rayos X están firmemente unidos a los detectores, cada detector sólo puede medir los rayos que pasan a una distancia específica del centro de rotación, dependiendo de la ubicación del detector en el arreglo. Cualquier error en la calibración de cada detector con respecto a los demás, se retro-proyecta a lo largo de estos rayos, y resulta en la formación de un artefacto en forma de anillo en las imágenes reconstruidas. Otro problema adicional es la dispersión de rayos X, que se produce a causa de las proyecciones en forma de abanico del sistema [8].
En 1976, aparecieron los tomógrafos de cuarta generación, que consistían en un arreglo estacionario de detectores en forma de anillo, que rodeaban completamente al paciente, de modo que la rotación se limita al tubo de rayos X (Fig. 2c). En este caso, cada detector podía medir rayos que se encontraran a cualquier distancia del centro de rotación y podía ser calibrado dinámicamente, lo que evitaba la presencia de artefactos en forma de anillo. No obstante, el tamaño del anillo necesario para mantener una distancia adecuada entre la piel del paciente y la fuente de rayos X, y la cantidad de detectores requerida para alcanzar una resolución espacial aceptable, hicieron que este diseño resultara particularmente costoso [8].
En 1980 se introdujo la tomografía por rayo de electrones EBCT (del inglés Electron Beam CT), que constituye la quinta generación. El EBCT utiliza una arquitectura estacionaria (sin rotación), donde un rayo de electrones hace un barrido a lo largo de cuatro placas semicirculares que rodean al paciente. La mayor innovación de este escáner fue su alta resolución temporal (33 ms a 100 ms), suficiente para tomar imágenes del corazón [9]. Sin embargo, el uso de la EBCT ha sido limitado por dos desventajas: la trayectoria está limitada a un arco de 220°, y a un plano que no coincide con aquel de los detectores; y, por otro lado, no pueden introducirse colimadores anti-dispersión (del inglés anti-scatter), debido a que el detector es estacionario [7]. Persiguiendo una alta resolución temporal y espacial, investigadores de la Clínica Mayo construyeron el DSR (del inglés Dynamic Spatial Reconstructor), que contaba con una alta resolución temporal adquiriendo hasta 60 tajadas volumétricas por segundo; así como una resolución isotrópica de hasta 1 mm3, y generando datos de hasta 3 Gb en solo 20 segundos en 1979. Este escáner, muy delante de las posibilidades técnicas de la época, contaba con 14 fuentes de rayos X y nunca se hizo comercial, entre otras porque pesaba más de 15 toneladas y un costo de varios millones de dólares [10].
Durante la mayor parte de los años ochenta, aparecieron pocas innovaciones en la tomografía computarizada, lo que, incluso, llevó a especular que esta área de investigación estaba acabada, especialmente con el florecimiento de la resonancia magnética [7]. No obstante, 1989 resultó ser un año crucial, con la aparición de la sexta generación, cuando Kalender y sus colaboradores inventaron la tomografía en espiral [11].
La tomografía en espiral (o helicoidal) utiliza la arquitectura de tercera generación, pero se caracteriza porque hay un movimiento continuo de la camilla a través del gantry (parte del tomógrafo en continua rotación que contiene el tubo de rayos X y el arreglo de detectores). Estos tomógrafos efectúan las mediciones en los bordes de la tajada y, como es necesario estimar el valor correspondiente al interior de la misma, requieren de la interpolación de tajadas en el eje z. Este concepto permite un registro rápido de regiones de interés a lo largo del eje z, en algunos casos, durante una sola respiración sostenida del paciente (15 a 25 segundos), lo que permite tomar imágenes de órganos en movimiento [7,11]. Una de las variables más importantes en la tomografía helicoidal (o de espiral) es el pitch (1), que relaciona la distancia d (en mm) que se desplaza la camilla en una rotación del gantry, y el espesor e (en mm) determinado por el colimador. Usualmente, el pitch se encuentra entre 1 y 1,5, para garantizar una cobertura aceptable del paciente y, al mismo tiempo, evitar que las tajadas sean interpoladas entre puntos muy lejanos [7].
La posibilidad de escanear órganos y regiones anatómicas continuamente, en un período muy corto de tiempo, demostró las ventajas de esta innovación. Sin embargo, en la tomografía en espiral, los tubos de rayos X se podían sobrecalentar, especialmente cuando se deseaba una mayor resolución espacial con tajadas más delgadas [12]. Este hecho impulsó el desarrollo de las arquitecturas con múltiples detectores y, en 1998, llevó a la introducción de modelos de séptima generación: tomógrafos multi-tajadas (MSCT, del inglés Multi-Slice Computed Tomography), también llamados multi-detectores (MDCT, del inglés Multi-Detector Computed Tomography). Estos equipos se caracterizan, principalmente, por tener arreglos multidimensionales (varias líneas de detectores) y se basan en la geometría de tercera generación, aunque, en este caso, en lugar de un rayo en forma de abanico, el rayo tiene forma de cono (del inglés cone-beam). Así, permiten recoger datos correspondientes a varias tajadas simultáneamente y, por consiguiente, reducen el número de rotaciones del tubo de rayos X necesaria para cubrir una región anatómica específica [12]. La Tabla 1 resume las especificaciones técnicas de los equipos disponibles en el mercado de las principales casas fabricantes. La sección V (ver más adelante), discute con mejor detalle las tendencias actuales del campo, así como avances muy recientes que incluyen la tomografía de doble fuente de rayos X y la tomografía de dos energías.
II. PRINCIPIOS FÍSICOS
Producción de los rayos X
Un tubo de rayos X está compuesto por un cátodo, un ánodo y una fuente de poder. El cátodo es, generalmente, un filamento de tungsteno, que se calienta y eleva la energía de los electrones lo suficiente para que se liberen del átomo. Los electrones libres se aceleran hacia el ánodo, gracias a la diferencia de potencial que existe entre este y el cátodo, y, por consiguiente, adquieren una significativa cantidad de energía cinética (del orden de keV y MeV). Cuando estos electrones chocan con la placa de tungsteno que hay en el ánodo, pierden su energía cinética, bien sea mediante excitación (la energía es empleada para mover electrones a capas más exteriores del átomo), ionización (la energía es suficiente para remover un electrón de un átomo) o radiación (la energía se utiliza para crear un fotón directamente). Los rayos X característicos, se generan cuando se produce la emisión de un fotón, luego de que se llenan las vacancias producidas mediante los dos primeros mecanismos. Por el contrario, los rayos X de Bremsstrahlung se producen mediante radiación y en un espectro continuo, a diferencia de los característicos, que se generan en bandas específicas de energía [13].
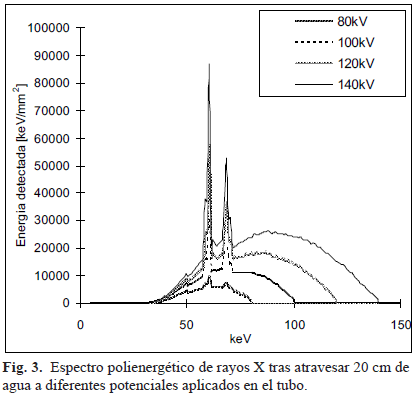
La energía de los rayos X de Bremsstrahlung es directamente proporcional a la proximidad del electrón al núcleo, y está determinada por el potencial del tubo de rayos X [13]. La probabilidad de que un electrón impacte directamente el núcleo, decrece linealmente con el aumento de la energía. Por esa razón, el espectro de Bremsstrahlung tiene una forma triangular. Sin embargo, los rayos X de muy baja energía son absorbidos (filtrados) por el material del ánodo y tienen una alta probabilidad de no abandonar el tubo [13]. En la Fig. 3. se muestra un espectro de rayos X, tal como se registra en el detector tras atravesar un objeto de 30 cm de diámetro y aplicando 100 kV.
El coeficiente de atenuación lineal
El coeficiente de atenuación lineal µ refleja la habilidad de un material para detener fotones, y es directamente proporcional al número atómico del material (Z) y su densidad, mientras que se relaciona inversamente con la energía. Esta variable µ depende de dos mecanismos básicos de interacción de los rayos X con la materia: Compton y el efecto fotoeléctrico [14]. El primero predomina en los tejidos blandos (como el pulmón), y se caracteriza porque se absorbe parte de la energía del fotón incidente, y el resto se invierte en la expulsión de un electrón de alta energía y la dispersión de un fotón de menor energía. El segundo prevalece en los materiales de alto número atómico, y, aunque también se caracteriza porque el fotón incidente causa la expulsión de un electrón y la producción de un fotón de baja energía, la diferencia, con respecto al anterior fenómeno, radica en que este fotón se dispersa, debido a que un electrón de las capas exteriores se desplaza hacia una capa más interior, y en que no se presenta absorción de energía. La probabilidad de estas interacciones, decrece a medida que la energía del fotón se aleja de la energía de unión de la capa K (denominada, en inglés, k-edge), que es la capa de electrones más cercana al núcleo.
A medida que el coeficiente de atenuación lineal de un material aumenta, más blanco aparecerá este en la imagen, y viceversa (los materiales con bajo µ dejan pasar más rayos X a través de ellos, y por eso se ven más negros en la imagen). En la Fig. 4, se observa el coeficiente de atenuación lineal de varios materiales. Por otro lado, es importante tener en cuenta que los fotones dispersados (fenómeno conocido como scattering) contribuyen negativamente al contraste de la imagen, puesto que no aportan información, y cambian la energía y dirección de los rayos incidentes [15].
Sin embargo, existen varios métodos para reducir la cantidad de dispersión: usar colimadores para hacer el rayo más estrecho, utilizar una película antidispersión que sólo deje pasar los rayos paralelos a los colimadores, y, finalmente, reducir el campo de visión FOV (del inglés Field Of View), es decir, el tamaño de la región que se está registrando [15].
Otro fenómeno que es importante considerar es el endurecimiento del rayo, que se refiere a un incremento gradual en la energía efectiva de los espectros policromáticos (Fig. 3), a medida que penetran más profundamente en el material. Esto ocurre a causa de que los fotones de baja energía son más fácilmente atenuados, y hace que el mismo tejido, a una profundidad mayor, tenga un coeficiente de atenuación menor. Por consiguiente, un objeto hecho del mismo material aparecerá más oscuro en el centro (menor µ), y más claro en la periferia de la imagen (mayor µ). Con el fin de corregir este artefacto, Hounsfield, en su primer prototipo, propuso el uso de una caja llena de agua para realizar una corrección al fenómeno de endurecimiento del rayo. Lo que hacía era medir el µ resultante del paso del rayo a través de agua exclusivamente, y compararlo con el obtenido con el rayo que pasaba tanto a través de la caja de agua, como del paciente. Posteriormente, calculaba un µ equivalente igual a la diferencia entre ambas medidas y aplicaba un factor de corrección [8]. Debido a esto, y al hecho de que las diferencias entre los coeficientes de atenuación lineales de distintos materiales son muy pequeñas (alrededor del 0,5 %), surgieron las unidades Hounsfield (HU), o números CT, que se definen como:
En la Fig. 5 se observan los números HU correspondientes a varios tipos de materiales.
III. RECONSTRUCCÓN DE IMÁGENES
Obtención de las proyecciones
Considérese una rebanada axial que se divide en vóxels con resolución espacial Δx, Δy, Δz, donde a cada vóxel puede asignarse una atenuación efectiva µ (Fig. 6). Considérese también un rayo de intensidad Io, que penetra un objeto a lo largo de una trayectoria L, en línea recta, pasando por cada vóxel (o región discretizada del objeto) con una distribución no homogénea de atenuaciones µ(x). La intensidad del rayo que alcanza el detector I(x) depende no sólo de la distancia atravesada x sino también de la atenuación µ(x) de cada punto en su trayectoria, obedeciendo la ley de Beer-Lambert:
Dado que es posible medir tanto Io como la intensidad I(x) en el detector del tomógrafo, resulta conveniente reescribir (3), así:
El resultado en (4) provee la proyección p(x), y tiene implicaciones importantes. La primera, que el detector registra la integral de línea y esta depende de las atenuaciones en cada región del objeto en la trayectoria del rayo (regiones que fueron divididas en vóxels). La segunda, que aunque se usa información volumétrica (vóxels), el detector registra la proyección p(x), que es una señal unidimensional para cada ángulo θ (Fig. 7a y 7b). Dichas proyecciones usualmente se guardan en una matriz p(x, θ), que constituye el sinograma (Fig. 7c). Tras la reconstrucción (ver más adelante), se obtiene una imagen bidimensional, donde cada píxel tiene por intensidad el valor estimado de su atenuación µ. Finalmente, nótese que se asume que cada vóxel contiene una atenuación uniforme (que corresponde a un tejido específico), lo cual no es necesariamente cierto, ya que es muy probable que algunos vóxels contengan dos, o incluso más, materiales simultáneamente, especialmente en los bordes o interfaces entre tejidos. Este fenómeno es llamado el efecto del volumen parcial, que en algunas aplicaciones específicas (que no se discutirán aquí), debe ser corregido [16].
El problema de la reconstrucción de la imagen, consiste en asignar la atenuación µ adecuada para cada vóxel que se utilizó para discretizar el objeto, dadas las proyecciones p(x,θ). Para realizar dicha asignación, pueden utilizarse métodos analíticos o iterativos. Los métodos analíticos comprenden la solución directa del sistema de ecuaciones lineales, la retroproyección y la retroproyección filtrada FBP (del inglés Filtered Back Projection) [17]. Los métodos iterativos incluyen el método iterativo algebraico ART (del inglés Algebraic Reconstruction Tecnhnique) [18] y el método iterativo estadístico [19]. Como es evidente, la solución de un sistema de M ecuaciones con N variables, aunque en principio es posible resolver si se cuenta con suficientes ecuaciones linealmente independientes, resulta computacionalmente muy costoso a medida que M y N aumentan, y, además, es susceptible al ruido, que generaría inexactitudes en el sistema de ecuaciones. Una solución para aumentar la robustez al ruido, consiste en utilizar métodos iterativos estadísticos de máxima verosimilitud (ver más adelante), si bien estos no solucionan el problema del alto costo computacional.
Reconstrucción por métodos analíticos
Tras la pronta inclusión de la tomografía en la práctica clínica, no sólo se propusieron diferentes geometrías (sección I), sino que también se buscaron métodos que ofrecieran aproximaciones que permitieran reconstruir la imagen con el menor costo computacional posible. Esto llevó a que la retro-proyección y la retro-proyección filtrada [17], originalmente propuestas en astronomía [20], fueran rápidamente adoptadas. Antes de explicarlas, resulta conveniente definir la transformada de Radon y el teorema de la proyección (en inglés conocido como central slice o Fourier slice theorem).
La transformada de Radon [21] R{} de una función f(x,y) se define como:
donde r,s hacen parte de un nuevo sistema coordenado que es rotado un ángulo θ, así:
Comparando (4) y (5), es posible identificar que ambas ecuaciones deben estar relacionadas, notando que, en lugar de µ(x), en (5) se hace referencia a f(x,y). El problema de la reconstrucción consiste, entonces, en calcular la distribución de atenuaciones en el objeto f(x,y) (o lo que se llamó antes µ), dadas las proyecciones (es decir, la transformada de Radon), matemáticamente expresadas en (5).
Aunque es posible retro-proyectar el sinograma al espacio de la imagen, esto conduce a una imagen borrosa. Para brindar una mejor aproximación a la solución de este problema, se propuso el teorema de la proyección. Se definen primero las ecuaciones (7) y (8) que describen la transformada de Fourier y la transformada inversa de Fourier bidimensional, respectivamente, y permiten pasar del domino espacial f(x,y) al dominio de la frecuencia espacial F(kx,ky), llamado espacio-k.
El teorema de la proyección establece que la transformada de Fourier unidimensional P(k,θ) de la proyección p(r,θ), corresponde a una línea que cruza el origen del espacio-k (Fig. 8). Como consecuencia, si dichas proyecciones son interpoladas para obtener una representación cartesiana de F(kx,ky), es posible tomar la transformada inversa de Fourier y obtener la imagen f(x,y) del objeto utilizando (8).
El proceso descrito permite reconstruir una imagen idéntica a la Fig. 9a. Ahora, si el problema de la reconstrucción se interpreta como una convolución y, entonces, se multiplica F(kx,ky) con un filtro o kernel, en el dominio de la frecuencia, podría obtenerse una imagen filtrada. Este procedimiento, precisamente, corresponde a la retroproyección filtrada o FBP.
El método de FBP comienza calculando la transformada de Fourier de p(r,θ) para obtener P(k,θ). A continuación, P(k,θ) se convoluciona con un filtro. Finalmente, al aplicar la transformada inversa de Fourier bidimensional (como en (8)), se obtiene una aproximación al objeto f(x,y).
donde g(k) corresponde al kernel seleccionado. Algunos filtros comúnmente utilizados incluyen la función rampa y la función Shepp-Logan, así como la ventana de convolución Hamming. La FBP provee mejoras significativas con respecto a la retroproyección simple (compárense las Fig. 9a y 9c). Algunos filtros suavizan las imágenes, disminuyendo el ruido y reduciendo un poco los detalles finos (altas frecuencias), mientras otros conservan mejor esos detalles al costo de no eliminar tanto el ruido. La selección última del filtro adecuado resulta, en ocasiones, subjetiva y es seleccionada por el radiólogo, dadas las opciones que le proporcione el fabricante.
Si se regresa a la descripción del proceso, esquematizado en la Fig. 8a, se observa que el muestreo del espacio-k depende directamente del número de proyecciones, ya que es necesario contener información espectral suficiente para reconstruir la imagen. En otras palabras, debe respetarse el teorema del muestreo. Un número insuficiente de proyecciones conlleva a la distorsión de la imagen, como puede observarse en la Fig. 9b. La reconstrucción de la imagen por el método FBP depende, entonces, no sólo del filtro empleado sino del número de proyecciones utilizadas.
Por facilidad, se han descrito hasta aquí reconstrucciones, asumiendo que la adquisición se obtuvo con rayos paralelos (Fig. 2a). Cuando se considera la adquisición en forma de abanico (Fig. 2b), es necesario modificar algunas de las ecuaciones aquí expuestas para compensar por este tipo de geometría [22]. Las modificaciones de los algoritmos son aún más complejas cuando la adquisición es en forma de cono como la requerida cuando se emplean múltiples detectores donde el rayo también se extiende en z [23]. La explicación específica de dichos algoritmos está fuera del alcance de este artículo.
Reconstrucción por métodos iterativos
Los algoritmos iterativos comienzan por proponer un objeto fi, por ejemplo, con distribución homogénea de atenuaciones. A continuación, se calculan las proyecciones pi, correspondientes al objeto propuesto y se comparan con las proyecciones originales medidas en el detector po. El objeto propuesto fi+1 se actualiza, con base en la diferencia de las proyecciones. Matemáticamente, este proceso se podría expresar así:
donde A corresponde a una matriz que depende de la geometría del sistema, la respuesta del detector y otros parámetros físicos del tomógrafo en cuestión; y e corresponde al error inducido por el ruido (p.ej. en el detector). Con este proceso iterativo, se produce una secuencia de distribuciones de atenuación f1, f2,..., fn; hasta que se converge a un valor óptimo fopt , basado en una regla de optimización comparando pi con po.
En el método ART, se supone una distribución homogénea de atenuaciones f para inicializar el proceso de iteración y se ignora la naturaleza estadística del problema. El proceso iterativo respectivo se ejemplifica en la Fig. 10.
En este punto, resulta conveniente concientizar al lector sobre la importancia de explorar nuevos métodos. El motivo es que los métodos iterativos convencionales o de retro-proyección son aproximaciones. A medida que los métodos son más complejos y toman en cuenta factores físicos como el ruido, endurecimiento del rayo o la dispersión, se pueden obtener mejores aproximaciones. Algunas de las ventajas de contar con métodos iterativos estadísticos, incluyen la posibilidad de disminuir dosis de radiación y un mejor manejo de otros problemas, como los artefactos debidos a metales [24-25], si bien estrategias para reducir artefactos metálicos usando FBP también han sido propuestas [26].
Uno de los métodos estadísticos empleados para resolver el problema de la reconstrucción de imágenes por procedimientos iterativos, como en (10), es el de Máxima Verosimilitud (MV). Este comienza expresando el Máximo a posteriori (MAP) que se basa en la regla de Bayes:
donde, dado el conjunto de proyecciones p, debe encontrarse la distribución de atenuaciones f que maximice la probabilidad P(f/p). Cuando no se tiene información a priori acerca de la imagen (lo que elimina el termino P(f)) y se omite el termino P(p) asumiendo que es independiente de f, el problema se reduce a optimizar P(p/f), y se obtiene precisamente el método MV.
Ahora, si se asume que las variaciones estadísticas son mutuamente independientes, la probabilidad P puede ser escrita de la siguiente manera:
Es conocido que la mayor fuente de incertidumbre (ruido) en la tomografía proviene de la naturaleza cuántica de los fotones de rayos X, y su conteo se modela con una distribución de Poisson [27]. Una distribución de Poisson para p, donde 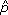 es el valor esperado de ocurrencias en el intervalo de observación, puede expresarse como:
es el valor esperado de ocurrencias en el intervalo de observación, puede expresarse como:
Como la probabilidad de pi dependerá sólo de la estimacsón de 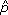 i, con base en la imanen f, se puede reescribir (12) de la siguiente manera:
i, con base en la imanen f, se puede reescribir (12) de la siguiente manera:
Nótese que, en lugar de maximizar la función P, se está maximizando su logaritmo, que es una función monotónica. Para resolver (14) se utilizan diversos métodos numéricos (p. ej. gradiente ascendente), y su elección depende la velocidad con que se puede converger a una imagen [25,28].
La reconstrucción iterativa es utilizada en medicina nuclear (PET y SPECT), donde la cantidad de datos a procesar es significativamente menor a la requerida por la tomografía computarizada de rayos X [28-29]. Actualmente, existe un gran interés en poder utilizar la reconstrucción iterativa en tomografía y, consecuentemente, numerosos grupos de investigación y empresas emplean diversas estrategias para implementarla de una manera más rápida. En general, pueden identificarse tres enfoques: mejora en los algoritmos, la utilización de hardware dedicado (FPGAs o tarjetas gráficas), o procesamiento en paralelo [30].
IV. DOSIMETRÍA
Definición
La dosis de radiación D está relacionada con el número total de fotones N, y sus energías individuales Ei. La distribución de estos fotones depende del voltaje aplicado (en kV), así como de los filtros espectrales utilizados para absorber la región de bajas energías del espectro (filtro plano), así como el filtro bowtie utilizado para atenuar la exposición en regiones periféricas. En la práctica, obtener imágenes de calidad, con buena resolución y bajo ruido, viene con el costo de una mayor dosis de radiación; esto implica que hay un compromiso entre la calidad de la imagen que obtendrá el radiólogo y la dosis de radiación a la que el paciente es expuesto. Las relaciones más importantes para entender el compromiso entre la dosis de radiación D, el ruido R (medido con la desviación estándar), la relación señal ruido SNR, la resolución (en x, y, z), el grosor T de la rebanada, y el proceso de adquisición, son las siguientes:
donde mAs significa miliAmperios por segundos. Los mAs relacionan la corriente aplicada (en mA) con el tiempo (en s), y constituyen el término que el operador encontrará en el escáner (y en la literatura especializada).
En las ecuaciones (15) a (17), puede notarse, además, que el número de fotones que alcanza al detector es directamente proporcional al número de mAs aplicado; así, mientras más fotones se tengan, menor será la desviación estándar y, por ende, menor el ruido. De acuerdo con estas relaciones, es claro que el ruido R disminuye a medida que se aumenta la corriente o el tiempo (que a su vez aumentan N), pero el costo que se paga es incrementar la dosis de radiación. De igual forma, mejorar la resolución espacial también implica una mayor dosis, pues para obtener la misma calidad de imagen (una SNR equivalente), se necesitará compensar aumentando la cantidad de mAs, para obtener fotones suficientes para contrarrestar el ruido.
Unidades
Las unidades más utilizadas para medir las dosis de radiación son el Gray (Gy), que cuantifica la dosis absorbida, y el Sievert (Sv), que mide la dosis equivalente. La unidad de dosis absorbida, se define como la cantidad de energía absorbida por una masa (1 Gy= 1 J/kg). La radiación medida en Gy no toma en cuenta los efectos biológicos de la radiación, y por esto se propuso utilizar la dosis equivalente (en Sv), que indica la cantidad de energía absorbida por una masa multiplicada por un factor F (entre 0 y 1), que refleja cómo esta energía produce daño a los tejidos biológicos, de acuerdo con el tipo de radiación utilizada (1 Sv=1 Gy x F). Para la radiación por rayos-X, F=1.
El índice CTDI
El índice CTDI (del inglés Computed Tomography Dose Index) es usado para medir las dosis de radiación en tomografía computarizada por rayos X [31]. El CTDI representa el promedio de la dosis absorbida, a lo largo del eje z, de una serie de exposiciones contiguas. Se calcula dividiendo la integral de la dosis absorbida por el grosor de la sección estudiada.
Donde D(z) es el perfil de la dosis a lo largo del eje z entre dos puntos a y b, T se refiere al grosor de la sección (determinado por el colimador) y N es el número de rebanadas tomográficas escaneadas durante una rotación del gantry; así, para los tomógrafos convencionales (de una sola rebanada), N=1.
En un esfuerzo por estandarizar los diferentes equipos, usualmente se utiliza el CTDI100, que corresponde a un segmento de 100 mm, que emplea una cámara de ionización y fantomas de acrílico estandarizados. Similarmente, existe el CTDIFDA, donde la Food and Drug Administration (FDA) exige que los límites de integración sean ±7T [32-33]. Como, además, el CTDI, cuando se utiliza para tomografía del cuerpo, varía dependiendo del FOV (región central o periferia) se define el CTDIw, así [34]:
A pesar de que el CTDI es un índice estándar para medir las dosis de radiación, este usualmente brinda un valor ponderado. En los últimos años, numerosas publicaciones se han propuesto mejorarlo y, así, estimar las dosis de radiación con mayor exactitud; por ejemplo, calculando dosis efectivas y específicas para cada órgano o región del cuerpo [32]. Similarmente, algunos autores han identificado que la eficiencia de las herramientas usadas en el cálculo del CTDI100 es menor al 90%, así que al optimizarle es posible aumentar su exactitud [35-36]. Nótese que aunque estas propuestas, y otras no citadas aquí, son apenas lógicas, es difícil establecer un estándar que todos sigan, y que a la vez sea fácil de implementar tanto por fabricantes como centros prestadores del servicio. La implementación efectiva de dichas medidas, habitualmente se desprende de la aplicación de leyes que obligan el cumplimiento de estándares, como sucede en EE. UU. o Europa [34,36].
El producto dosis-longitud DLP
Para representar mejor la dosis de radiación total de un protocolo en particular, el CTDI (en mGy) es multiplicado por la longitud de la región total a escanear SL, para calcular el producto dosis-longitud DLP (del inglés Dose-Length Product)
El DLP (en mGy-cm) refleja la energía total absorbida de una adquisición en específico y, en principio, permite cuantificar mejor el potencial efecto biológico de la radiación ionizante. (20) establece que a medida que se toman imágenes que cubren una mayor porción anatómica, se obtienen valores DLP mayores [34].
Modelación del riesgo por radiación de rayos X
Diferentes modelos han sido utilizados para estudiar el daño que la radiación ionizante produce en los tejidos. El modelo LNT (del inglés Linear No-Threshold) asume que los daños siempre son proporcionales a las dosis, contrario a otros modelos que asumen que, en efecto, hay un umbral específico, que mientras no es sobrepasado, se considera seguro. Un tercer modelo es el modelo de hormesis, que propone que la radiación es beneficiosa en bajas dosis y dañina cuando sobrepasa ciertos límites [37].
Para modelar el exceso de riesgo γe luego de una exposición a una dosis de radiación D, dado un riesgo base γ de sufrir cáncer, se utiliza la siguiente ecuación:
donde ER(D) se refiere al exceso del riesgo absoluto tras la exposición a una dosis de radiación D. En general, el riesgo base y, depende de la edad y el género de un individuo, así como otros factores (p. ej. tabaquismo).
El riesgo atribuible durante la vida de un individuo LAR (del inglés Lifetime Attributable Risk), estima la probabilidad de que un individuo muera, o desarrolle un cáncer asociado con la exposición, y se calcula como la sumatoria del exceso relativo del riesgo (ERR) para cada edad, desde la edad de la exposición, multiplicado por la probabilidad de supervivencia en cada edad. Esto implica que el LAR es mayor en aquellos pacientes que son expuestos a edades tempranas, y este es uno de los motivos por los cuales es crítico optimizar los protocolos en la adquisición de imágenes tomográficas de rayos X, en pacientes pediátricos [38].
Efectos de la radiación por tomografía de rayos X: la controversia
Las dosis de radiación asociadas con la tomografía de rayos X son, tal vez, la principal limitante de esta técnica. Sin embargo, es muy importante resaltar que los riesgos de desarrollar cáncer debidos a la radiación de rayos X, aún siguen siendo discutidos, rebatidos y redefinidos. Primero, porque constantemente es necesario hacer un compromiso entre la calidad de las imágenes obtenidas y la dosis de radiación, buscando la mejor calidad diagnóstica para el radiólogo, que desemboca en el mejor resultado para el paciente, y, aunque discutible, es un hecho que el beneficio puede ser significativamente mayor al riesgo implicado. Segundo, porque aun hoy día es investigado cómo medir las dosis de radiación de la manera más exacta; y no es claro, por ejemplo, cuáles son los umbrales para determinar cuándo la radiación genera un riesgo significativo. Finalmente, diferentes estudios han mostrado ser contradictorios. Por un lado, el estudio más citado para evaluar los riesgos de la radiación se basa en datos de más de 25.000 sobrevivientes de las bombas atómicas en Japón, y que fueron expuestos a radiación menor a 50 mSv, comparable, entonces, con las que se obtienen por tomografía de rayos [39]. Pero, de otro lado, un estudio que por 100 años (1897-1997) evaluó a los radiólogos británicos, un grupo que evidentemente acumula exposición a dosis de radiación importante, encontró que no había ninguna diferencia estadística significativa entre muertes por cáncer y muertes por otro tipo de enfermedades [40]. Es más, en un controversial artículo, un prestigioso físico médico, el Dr. James R. Cameron, propuso que la longevidad es la medida mas apropiada para medir los efectos de la radiación en la salud; y que, de hecho, el estudio británico y otro realizado en EE. UU., sugerían que bajas dosis de radiación, incluso podrían ser beneficiosas para la salud [41]. No obstante, una limitante en las conclusiones del Dr. Cameron fue que dichos estudios no contenían datos consolidados de los efectos de las dosis de radiación por tomografía por rayos X, dosis que son significativamente mayores a las de la radiografía convencional.
El reconocimiento de los riesgos asociados a la tomografía de rayos X ha generado gran controversia, y dos buenos ejemplos son los estudios publicados en dos de las más influyentes revistas médicas a nivel mundial, señalando las altas dosis de radiación a las que pueden ser expuestos los pacientes cuando se realizan estudios utilizando el escáner multi-detector u otras generaciones de la tomografía por rayos X [42-43]. Dichos estudios no desconocen la utilidad de la técnica, sino que resaltan que hay que realizarla de manera responsable, evitando tomografías innecesarias, así como modificando apropiadamente los protocolos en la población infantil, que es la más sensible a estos tipos de radiación. De otro lado, hay que señalar que la mayoría de estudios en este tema, se realizan con simulaciones que usan métodos de Monte Carlo, y ajustando métodos de regresión basados en modelos cuantitativos [42]. Si se tiene en cuenta que el riesgo de desarrollar cáncer por la radiación de rayos X es bajo, y además es difícil diferenciarlo del riesgo implícito de desarrollarlo por otros motivos (modelo LAR), sería necesario hacer estudios poblacionales con muestras muy elevadas, que en la práctica son muy complicados de realizar, lo que hace complejo dtrar efectos adversos, especialmente con las más bajas dosis de radiación (p.ej. 10 mSv) [37]. Aun así, se han emprendido proyectos retrospectivos y prospectivos en este campo, y probablemente serán fundamentales para entender mejor los efectos de las bajas dosis de radiación por tomografía de rayos X [44].
Estrategias para disminuir las dosis de radiación
Las estrategias para reducir las dosis de radiación dependen de la parte del proceso de adquisición y procesamiento de los datos que se seleccione, tal como se especifica en la Tabla 2. El primer punto donde puede optimizarse la dosis de radiación es en el hardware del equipo, con detectores más eficientes como los que se basan en estado sólido [45], u otras estrategias como el empleo de detectores contadores de fotones [46], que prometen incrementar considerablemente la eficiencia en la detección de los rayos X. Una segunda estrategia, está relacionada con la reconstrucción de las imágenes de tomografía, bien sea utilizando el método convencional (proyección hacia atrás filtrada FBP) y encontrando mejores filtros, dependiendo de la aplicación, o implementando métodos de reconstrucción iterativos (sección III). Otra posibilidad para reducir las dosis durante la reconstrucción de la imagen es el uso de algoritmos como HYPR (del inglés HighlY constrained backPRojection), recientemente propuesto por Mistretta y colaboradores en la Universidad de Wisconsin [47]; o PICCS (del ingles Prior Image Constrained Compressed Sensing). Ambos algoritmos pueden considerarse bajo la denominación de Compressed Sensing (CS), cuya teoría ha sido recientemente propuesta por Candes et al. (2006) [48] y Donoho (2006) [49]. La teoría del CS demuestra que es posible "violar" el criterio de Nyquist y reconstruir la imagen con un número menor de proyecciones siempre y cuando la información pueda expresarse en un dominio de baja densidad, utilizando una matriz incoherente que cumpla las propiedades de la isometría restringida y finalmente resolviendo un sistema de optimización con una función objetivo que usa una norma l1 [48-49]. La utilización de los métodos de CS en tomografía aun esta en una etapa muy temprana y básicamente por explorar, si bien potencialmente podría implicar disminuciones muy considerables en la exposición de los rayos X, aumentar la resolución temporal y alcanzar muy buenos niveles de SNR.
Diferentes fabricantes han incluido novedosos avances tecnológicos en sus equipos, para reducir las dosis de radiación. Un ejemplo representativo es la modulación de la corriente del tubo de rayos X en los ejes x, y, z. En estos, la calidad de la imagen se optimiza de acuerdo con el tamaño y peso del paciente (p. ej. adultos normales, personas obesas o niños), dependiendo de la región anatómica y, además, del objetivo diagnóstico [50].
Es importante concientizar al lector, de que algunas estrategias, no necesariamente técnicas, pueden disminuir considerablemente las dosis de radiación. Entre otras, estas incluyen: educar a los pacientes para que sostengan la respiración durante el procedimiento (usualmente 5 a 15 segundos) y, de este modo, se eviten artefactos de movimiento que pudiesen requerir repetir la adquisición de las imágenes. Asimismo, es aconsejable utilizar técnicas alternativas a la tomografía de rayos X cuando estas se encuentran disponibles (p. ej. ultrasonido o resonancia magnética) siempre y cuando estas puedan brindar un diagnóstico equivalente. Finalmente, es deseable que en cada institución de salud se generen tablas técnicas que especifiquen parámetros como la relación corriente-tiempo (mAs) de acuerdo con el peso, sexo y edad de los pacientes, buscando un buen balance entre la calidad de la imagen y el mínimo de radiación alcanzable razonablemente.
V. PRESENTE Y FUTURO DE LA TOMOGRAFÍA COMPUTARIZADA POR RAYOS X
Tomografía de múltiples fuentes de rayos La tomografía de doble fuente de rayos X, DSCT (por sus siglas en inglés, Dual Source CT), fue recientemente introducida comercialmente por Siemens (Somaton Definition DS) [51]. Este escáner cuenta con dos fuentes de rayos X y sus respectivos arreglos multi-detectores. Ambas fuentes se encuentran desfasadas 90 grados, una con respecto a la otra, como se aprecia en la Fig. 11. El FOV de la primera fuente es 50 cm, mientras el FOV de la segunda es 26 cm. Como es evidente, al utilizar ambos tubos de rayos X simultáneamente, no se tienen problemas de registro de las imágenes y, más importante aún, las proyecciones sobre un objeto pueden tomarse de manera más rápida, lo que beneficia aplicaciones cardíacas y otras donde se requiere alta resolución temporal. Adicionalmente, dos fuentes de rayos X, han permitido tener potencia suficiente para tomar imágenes adecuadas de pacientes obesos, que, de otra manera, no podrían beneficiarse del diagnóstico por tomografía [52].
El DSCT alcanza tiempos de adquisición de hasta 83 ms, con lo cual hace posible tomar imágenes del corazón sin necesidad de utilizar beta bloqueadores, en pacientes con ritmos cardíacos elevados (p.ej. 100 latidos por minuto o más), logrando altos niveles de detalle de las arterias coronarias, las válvulas cardíacas y el miocardio, de gran valor clínico [53]. La resolución temporal se logra, porque cada rotación del gantry toma 333 ms. Es conocido, además, que con sólo barrer 180 grados es posible adquirir la información necesaria para la reconstrucción, lo que reduce el tiempo hasta 166 ms. Y finalmente, dado que se cuenta con dos fuentes de rayos X, el tiempo se reduce hasta 83 ms.
McCollough et al. (2007) recientemente demostraron que las dosis de radiación utilizando el DSCT (Somaton Definition, 64 canales) pueden llegar a ser equivalentes a las que se obtienen por tomografía multi-detector de única fuente, para estudios de angiografía por CT [54]. Esto es posible gracias a la aplicación de estrategias para la reducción de la dosis, que incluyen: el filtro bowtie (que atenúa severamente los rayos X que recaen sobre zonas fuera del FOV), técnicas de reducción de ruido adaptativas, pitch variable de acuerdo con la frecuencia cardíaca, y modulación de la corriente en el tubo de rayos X. El estudio mostró que en condiciones idealizadas (donde no hay movimiento del paciente y se asume periodicidad del ritmo cardíaco), se alcanzan reducciones hasta del 50%. La principal limitación de dicho estudio, no obstante, fue el hecho de que no consideró variabilidad en la frecuencia cardíaca, común en los pacientes, lo que haría difícil alcanzar menores dosis de radiación, cuando se le compara con la tomografía convencional, si bien el estudio indicó que es posible alcanzar dosis equivalentes, y, en algunos casos, ligeramente menores.
Investigaciones recientes han mostrado la factibilidad de implementar una arquitectura de tres fuentes (y tres arreglos de detectores), que posiblemente podría aportar ventajas adicionales en la resolución temporal sobre el DSCT [55]. Sin embargo, su costo podría resultar prohibitivo y con aplicaciones muy específicas, lo que llevaría a limitar su uso. Una propuesta diferente para utilizar múltiples fuentes de rayos X es a través de una geometría inversa IGCT (del inglés Inverse Geometry Computed Tomography) [56]. Pelc y sus colaboradores en Stanford, idearon una geometría en la cual se emplea un solo detector y múltiples fuentes de rayos X organizadas en un arreglo lineal. Tras el trabajo continuo con esta geometría, recientemente se propuso una mejora llamada multieye IGCT, donde se emplean tres detectores para alcanzar un FOV de 45 cm [57]. En general, con el sistema IGCT se obtienen ventajas como adquisición con mayor cobertura volumétrica con una sola rotación del gantry; se eliminan artefactos como el producido por el rayo en forma de cono; y, dado que es posible modular la corriente (reflejado en la unidad mAs), es factible optimizar la calidad de la imagen, al tiempo que se minimiza la dosis, dependiendo de la región anatómica estudiada.
Tomografía de dos energías: discriminación de materiales
La tomografía de dos energías DECT (por sus siglas en inglés, Dual-Energy CT), consiste en obtener imágenes aplicando dos voltajes distintos (energías) a cada tubo de rayos X; usualmente, una energía alta de 140 kV y otra baja de 80 kV (o 100 kV), comparables con 120 kV, que es la energía más empleada en tomografía convencional. Cuando se emplea una misma energía, se obtienen valores reproducibles de atenuación para diferentes tejidos, mientras que cuando diferentes energías son empleadas, se encuentran diferencias notables en atenuación, especialmente en materiales con alto número atómico, porque su proporción de cambio de atenuación respecto a las dos energías evaluadas no es necesariamente el mismo [58].
Es importante mencionar que la técnica de DECT no es nueva. De hecho, Hounsfield (1973) propuso el uso de dos energías distintas para discriminar Yodo (I) y Calcio (Ca) [2]. Dado su potencial de aplicaciones, la DECT fue ampliamente estudiada en los setenta, donde alcanzó un importante desarrollo [59]. En particular, de la experimentación se pasó a la utilización clínica para estudios de densitometría ósea [60]. Sin embargo, limitaciones tecnológicas de la época [61], hicieron que no fuera usada extensivamente en la práctica clínica, en especial debido a problemas para registrar (fusionar) adecuadamente las imágenes, así como, en algunos casos, a la necesidad explícita de incrementar la dosis de radiación tras escanear a los pacientes dos veces. No obstante algunas técnicas donde el voltaje era cambiado durante una misma adquisición fueron propuestas, este proceso, aunque prometedor, era lento (aproximadamente 60 Hz) e insuficiente para brindar calidad diagnóstica [62].
Para obtener las dos energías en DECT, se tienen varias posibilidades: (1) cambios rápidos del voltaje, (2) múltiples capas de detectores o (3) doble fuente de rayos X (DSCT) (Fig. 12). En los años setenta, se escaneaba el objeto dos veces, con dos voltajes distintos. Evidentemente, esto crea problemas de registro (alineamiento) de las imágenes, que son más complicados si se realizan con pacientes, ya que la técnica resulta muy sensible al movimiento y, por consiguiente, poco ideal para el uso clínico. No obstante, más recientemente, se ha propuesto una técnica llamada cambio rápido del kilovoltaje donde una misma fuente de rayos X, puede cambiar rápidamente (a una frecuencia de 1 KHz) entre las energías altas y bajas, lo cual constituye un reto ingenieril significativo que, al parecer, GE Healthcare ha sido capaz de sobrepasar con la introducción de la línea de tomógrafos CT750 HD [63-64]. Como ventajas, se obtienen imágenes sin problemas de registro con el mismo FOV, se utiliza una sola fuente de rayos X, y, se ha mostrado que posibilita corregir mejor el fenómeno de endurecimiento del rayo. Una segunda metodología, originalmente propuesta en los setenta [61], consiste en utilizar varias capas de detectores que absorben preferentemente ciertos rangos del espectro de energías. Esta última metodología fue recientemente implementada (en inglés usualmente referida como sandwich-detectors) y consiste en el uso de dos capas de detectores de diferentes materiales; la primera absorbe la parte baja del espectro de energías y la segunda capa la parte alta del mismo (haciendo uso del fenómeno de endurecimiento del rayo). Cada detector funciona como un filtro del espectro de energías, si bien la eficiencia y calidad del espectro obtenido es menor cuando se le compara con la técnica de cambios rápidos del voltaje [65]. Finalmente, la tercera opción para implementar DECT, es utilizando DSCT, y aplicando un voltaje distinto a cada tubo de rayos X. La DSCT presenta importantes ventajas, como la posibilidad de filtrar los espectros de energías independientemente para cada tubo de rayos X, lo cual podría incrementar considerablemente el poder de discriminación de la DECT y podría aumentar la sensibilidad de los protocolos diagnósticos utilizados, así como permitir nuevas aplicaciones que antes no tenían sensibilidad suficiente, por ejemplo, la discriminación del hierro (Fe) como marcador de vulnerabilidad en placas ateroscleróticas [66].
Dado que DE-DSCT fue la primera modalidad comercialmente disponible (Somaton Definition, Siemens Healthcare, Forchheim, Alemania), ha existido una explosión de investigaciones utilizando esta metodología, con aplicaciones que prometen ser trasladadas a la práctica clínica en muy corto plazo. Algunos ejemplos representativos incluyen la substracción de yodo (medio de contraste), que implica que el paciente sólo sea escaneado una vez con medio de contraste, y utilizando la información adicional que provee la DECT, es posible obtener una representación virtual de la imagen sin contraste, lo que implicaría menor radiación para el paciente, aunque esto último aún no está del todo comprobado [67]. Similarmente, DECT ha demostrado ser capaz de diferenciar cálculos renales que contienen ácido úrico, lo cual resulta de alta utilidad clínica, ya que dichos cálculos pueden ser tratados con medicamentos, en lugar de procedimientos de litotricia [68]. Otras aplicaciones incluyen la visualización de la gota [69] y de ligamentos de la rodilla [70]. La modalidad de los cambios rápidos del kilovoltaje (LightSpeed CT750 HD, GE Healthcare, Milwaukee, EE. UU.) sin duda contribuirá con importantes avances en esta área [63].
Tomografía computarizada de múltiples detectores: llegando a los límites
La adquisición de imágenes a mayor velocidad, y por ende con mejor resolución temporal, ha sido una de las motivaciones más significativas que ha guiado el progreso de la tomografía computarizada. Esto se refleja no sólo con el desarrollo de la tomografía helicoidal y la rápida aceptación que esta técnica tuvo [11], sino también con la tomografía de múltiples detectores MDCT. En muy pocos años, el número de detectores ha aumentado considerablemente, y en este aspecto, Toshiba ha tomado la delantera implementando el escáner de 256 detectores [71] y, más recientemente, el tomógrafo de 320 detectores (Aquilion ONE, Toshiba Medical Systems, Otawara, Japón) [72].
La MDCT, ha permitido un avance muy significativo en la resolución temporal de la adquisición de las imágenes, que se refleja en una mejor fidelidad de las mismas, especialmente cuando se visualizan órganos, como el corazón, que se encuentran en constante movimiento, o para seguir el flujo del medio de contraste en aplicaciones de angiografía por tomografía computarizada [73]. El escáner MDCT de 320 detectores, por ejemplo, cubre una longitud en el eje z de 16 cm (320 x 0,5 mm), que es suficiente para tomar una imagen del corazón en una sola rotación del gantry. Esto, evidentemente, minimiza errores producto del artefacto de movimiento y facilita el alcance de alta resolución espacial (de hasta 0,5 mm), en los tres ejes; e incluso elimina la necesidad del movimiento de la camilla, como es usualmente realizado en tomografía espiral [72].
El aumento de la resolución temporal, incluso, puede resultar suficiente para tomar imágenes de otros órganos o estructuras en movimiento. Tay et al. (2008), explicaron la factibilidad de tomar imágenes de alta calidad en objetos con movimientos periódicos de hasta 20 mm/s, usando un pitch de 0,1 y con movimientos de 30 ciclos por minuto, que podrían ser de utilidad en caracterización de los movimientos de las articulaciones [74]. Una mejor resolución temporal permite la realización de estudios funcionales, particularmente cuando se utilizan medios de contraste, tales como análisis de la filtración glomerular de los riñones (que son el medio mas utilizado usualmente para la eliminación del medio de contraste), así como la perfusión de diferentes órganos [73]. No obstante, es importante recordar que aunque la MDCT permite reconstruir los datos con mejor resolución espacial, esto viene con el costo de una mayor dosis de radiación en el paciente, en especial cuando se desea alta resolución en z (<3 mm).
Otras tendencias en CT
Los detectores contadores de fotones, podrían ser uno de los avances más significativos en la tomografía computarizada de rayos X en los próximos años [46,75]. Esta aplicación implica el conteo de cada uno de los fotones de rayos X, así como la medición de su energía. Este tipo de detectores puede mejorar la relación señal ruido (SNR), por ser mucho más robustos al ruido, ya que se podrían definir umbrales de energía óptimos. Al mismo tiempo, la posibilidad de medir individualmente la energía de cada fotón y procesar estos datos, permitiría optimizar la asignación de la proporción de energía que normalmente se hace con los detectores convencionales, cuando se usa un número de kVp específico. El espectro policromático de energías, además, se podría separar y, por consiguiente, usarse para analizar la composición de elementos del objeto en estudio, equivalente a la tomografía de dos energías [76]. Otras ventajas incluyen la disminución de la dispersión de rayos X, así como la reducción en las dosis de radiación por rayos X [77].
La tomografía computarizada con detectores planos FD-CT (del inglés, flat panel detector CT), utiliza detectores que convierten fotones de rayos X en fotones de luz, a través de un escintilador. Los fotones de luz luego son convertidos a corriente por fotodiodos. Esta tecnología de detectores es idéntica a la utilizada en radiografía digital, y la adquisición tridimensional es implementada a través de un sistema de brazo en C que gira alrededor del paciente y barre al menos 180 grados. Aunque la FD-CT permite obtener alta resolución espacial, la resolución temporal es muy baja (~5 s) y, por consiguiente, se hacen necesarias técnicas de compensación de artefactos de movimiento [78]. Una ventaja con la FD-CT es la mayor eficiencia en las dosis de radiación. Usando una tecnología similar, Boone y otros investigadores en la Universidad de California-Davis, han desarrollado un tomógrafo basado en detectores planos especializado en el seno, el cual tiene alta resolución espacial, realiza adquisiciones tridimensionales, y elimina la necesidad del aplastamiento del seno (una de las mayores barreras prácticas de la mamografía). Este escáner se beneficia de un mejor rango de contrastes (especialmente los bajos para tejidos blandos), todo esto con dosis de radiación, al parecer, comparables con la mamografía convencional [79].
Una pregunta que el lector podría hacerse, es por qué no es posible tener una mejor resolución espacial y temporal. Por ejemplo, qué limita que la adquisición tome 1 ns y la resolución espacial sea en micrómetros, o mejor aún, en nanómetros. La respuesta no es fácil, porque depende de múltiples factores, como límites físicos: por ejemplo, los rayos X no pueden viajar más rápido que la luz. De otro lado, la mayor velocidad de rotación del gantry que los fabricantes han logrado alcanzar es de 3 vueltas por segundo, y el problema es que aumentar esta velocidad implica fuerzas de gravedad muy altas que inestabilizan mecánicamente al sistema. Otro hecho que siempre debe recordarse es que una mayor resolución implica mayores dosis de radiación. Así mismo, si se mantiene el FOVOV para poder estudiar a un paciente (típicamente 30 cm a 50 cm), y se quiere procesar a una muy alta resolución espacial, la cantidad de información a procesar sería muy exuberante y haría el proceso mucho más lento, con la capacidad computacional actual. Por estos (y varios otros) motivos, la investigación en micro-tomografía (microCT) se limita al estudio de pequeños animales, con el empleo de tomógrafos especializados [80]. O más en el extremo, la empresa Xradia, recientemente desarrolló el nanoXCT, capaz de tomar imágenes por tomografía computarizada de rayos X con una resolución por debajo de 100 nm, si bien este equipo solo podría ser aplicado para estudios in vitro [81].
VI. CONCLUSIÓN
La tomografía computarizada de rayos X ha tenido un reflorecimiento en los últimos años, evidenciado en múltiples avances científicos y tecnológicos. Resulta interesante notar que los avances de esta técnica, han estado marcados por cuatro parámetros comunes: la constante búsqueda de una mayor velocidad de adquisición (resolución temporal), aumentar la resolución espacial, mejorar la calidad de la imagen, y minimizar las dosis de radiación ionizante. Como fue expuesto en esta revisión, mejoras en cada uno de los componentes del escáner (p. ej. detectores o fuentes de rayos X), cambios novedosos en su geometría, o la utilización de elaboradas técnicas de reconstrucción de la imagen, aportan significativamente a la mejora de cada uno de los parámetros expuestos, si bien estos siempre guardan un compromiso con las dosis de radiación.
La radiación ionizante es el parámetro clave que limita el uso de la tomografía computarizada; y, dado el riesgo que genera, es de suma importancia un uso responsable de la misma. Especial cuidado debe tenerse en pacientes pediátricos, para evitar sobre-exposiciones innecesarias, lo que implica que las instituciones prestadoras de servicios de salud están obligadas a implementar protocolos de adquisición específicos para estos pacientes. Es deseable utilizar técnicas complementarias (p. ej. ultrasonido o resonancia magnética) cuando éstas estén disponibles y puedan brindar un diagnostico idéntico.
AGRADECIMIENTO
Los autores agradecen al CT Clinical Innovation Center, Department of Radiology, Mayo Clinic por el material suministrado para la preparación del manuscrito.
REFERENCIAS
[1] Bosch E. Sir Godfrey Newbold Hounsfield y la tomografía computada, su contribución a la medicina moderna. Revista Chilena de Radiología, 10, 183-185, 2004. [ Links ]
[2] Hounsfield G.N. Computarized transverse axial scanning (tomography): Part I. Description of system. British Journal of Radiology, 1016-1022, 1973. [ Links ]
[3] Cormack A.M. Representation of a function by its line integrals, with some radiological applications. Journal of Applied Physics, 34, 2722-2727, 1963. [ Links ]
[4] Hounsfield G.N. Computed medical imaging. Science, 210, 22-28, 1980. [ Links ]
[5] Beckman E.C. CT scanning the early days. The British Journal of Radiology, 5-8, 2006. [ Links ]
[6] Kalender W. CT: the unexpected evolution of an imaging modality. European Radiology Supplements, 15, 21-24, 2005. [ Links ]
[7] Kalender W. X-ray computed tomography. Physics in Medicine and Biology, 29-43, 2006. [ Links ]
[8] Goldman L.W. Principles of CT and CT technology. Journal of Nuclear Medicine and Technology, 115-128, 2007. [ Links ]
[9] Boyd D.P., Gould R.G., Quinn J.R., Sparks R., Stanley J.H., Herrmannsfeldt W.B. A proposed dynamic cardiac 3D densitometer for early detection and evaluation of heart disease. IEEE Trans Nucl Sci, 26, 2724-2727, 1979. [ Links ]
[10] Ritman E.L., Kinsey J.H., Robb R.A, Gilbert B.K., Harris L.D., Wood E.H. Three-dimensional imaging of heart, lungs, and circulation. Science %R 10.1126/science.7423187, 210, 273-280, 1980. [ Links ]
[11] Kalender W.A., Seissler W., Klotz E., Vock P. Spiral volumetric CT with single-breath-hold technique, continuous transport, and continuous scanner rotation. Radiology, 176, 181-3, 1990. [ Links ]
[12] Goldman L.W. Principles of CT: multislice CT. Journal of Nuclear Medicine and Technology, 57-68, 2008. [ Links ]
[13] McCollough C. The AAPM/RSNA Physics Tutorial for Residents: X-ray production. RadioGraphics, 967-984, 1997. [ Links ]
[14] Lehmann L.A., Alvarez R.E., Macovski A., Brody W.R., Pelc N.J., Riederer S.J., Hall A.L. Generalized image combinations in dual kVp digital radiography. Medical Physics, 659-667, 1981. [ Links ]
[15] Bushberg J.T. The essential physics of medical imaging. Second Edition ed: Lippincot Williams & Wilkins, 2002. [ Links ]
[16] Zou Y., Sidky E.Y., Pan X. Partial volume and aliasing artefacts in helical cone-beam CT. Phys Med Biol, 49, 2365-75, 2004. [ Links ]
[17] Shepp L., Logan B. The Fourier reconstruction of a head section. IEEE Trans-actions on Nuclear Science, 21, 21-43, 1974. [ Links ]
[18] Gordon R., Bender R., Herman G. Algebraic reconstruction techniques (ART) forthree dimensional electron microscopy and X-ray photography. Journal of Theoritical Biology, 36, 105-117, 1970. [ Links ]
[19] Rockmore A.J., Macovski A. A maximum likelihood approach to emission image reconstruction from projections. IEEE Trans. Nucl. Sci., 23, 1428-1432, 1976. [ Links ]
[20] Bracewell R.H., Riddle A.C. Inversion of fan beam scans in radio astronomy. Astrophysics Journal. 150, 427-434, 1967. [ Links ]
[21] Radon J. Uber due bestimmung von funktionen durch ihre intergralwerte langsgewisser mannigfaltigkeiten (on the determination of functions from their integrals along certain manifolds. Berichte Saechsische Akademie der Wissenschaften. 29, 262-277, 1917. [ Links ]
[22] Wang L. Cross section reconstruction with fan beam scanning geometry. IEEE Transactions on Computing. 26, 264-268, 1977. [ Links ]
[23] Katsevich A. Theoretically exact filtered backprojection-type inversion algorithm for spiral CT SIAM. Journal on Applied Mathematics, 62, 2012-2026, 2002. [ Links ]
[24] Liu X., Shaw C.C., Altunbas M.C., Wang T. An alternate line erasure and readout (ALER) method for implementing slot-scan imaging technique with a flat-panel detector-initial experiences. IEEE Trans Med Imaging, 25, 496-502, 2006. [ Links ]
[25] DeMan B. Iterative Reconstruction for Reduction of Metal Artifacts in Computed Tomography. Tesis de Doctorado (2001). Consultada el 25 de julio de 2008, disponible en: ftp://134.58.179.7/pub-/nuyts/publications/thesis_BrunoDeMan.pdf. [ Links ]
[26] Rinkel J., Dillon W.P., Funk T., Gould R., Prevrhal S. Computed tomographic metal artifact reduction for the detection and quantitation of small features near large metallic implants: a comparison of published methods. J Comput Assist Tomogr, 32, 621-9, 2008. [ Links ]
[27] Hsieh J. Adaptive streak artifact reduction in computed tomography resulting from excessive x-ray photon noise. Medical Physics, 25, 2139-47, 1998. [ Links ]
[28] Matej S., Fessler J.A., Kazantsev I.G. Iterative tomographic image reconstruction using Fourier-based forward and back-projectors. IEEE Trans Med Imaging, 23, 401-12, 2004. [ Links ]
[29] Kontaxakis G., Vaquero J.J., Santos A. Reconstrucción de imagen en tomografía por emisión de positrones. Rev. R. Acad. Cienc. Exact. Fis. Nat., 96, 45-57, 2002. [ Links ]
[30] Ni J., Li X., He T., Wang G. Review of parallel computing techniques for computed tomography image reconstruction. Current Medical Imaging Reviews, 2, 405-414, 2006. [ Links ]
[31] Shope T.B., Gagne R.M., Johnson G.C. A method for describing the doses delivered by transmission x-ray computed tomography. Medical Physics, 8, 488-95, 1981. [ Links ]
[32] Bauhs J.A., Vrieze T.J., Primak A.N., Bruesewitz M.R., McCollough C.H. CT dosimetry: comparison of measurement techniques and devices. Radiographics, 28, 245-53, 2008. [ Links ]
[33] McNitt-Gray M.F. AAPM/RSNA Physics Tutorial for Residents: topics in CT. Radiation dose in CT, Radiographics, 22, 1541-53, 2002. [ Links ]
[34] International Electrotechnical Commission. Medical Electrical Equipment. Part 2-44: Particular requirements for the safety of x-ray equipment for computed tomography. IEC publication No. 60601-2-44. Ed. 2.1. International Electrotechnical Commission (IEC) Central Office: Geneva, Switzerland, 2002. [ Links ]
[35] Boone J.M. The trouble with CTD100. Medical Physics, 34, 1364-71, 2007. [ Links ]
[36] AAPM Report. The Measurement, Reporting, and Management of Radiation Dose in CT. Task Group 23: CT Dosimetry Diagnostic Imaging Council CT Committee. Consultado el 5 de agosto 2008 en: http://www.aapm.org/pubs/reports/RPT_96.pdf, 2008. [ Links ]
[37] Prokop M. Cancer screening with CT: dose controversy. European Radiology, 15, 4, D55-61, 2005. [ Links ]
[38] Alliance for radiation safety in pediatric imaging. The image gently campaign. Consultado el 31 de Julio de 2008 en: http://www.pedrad.org/associations/5364/ig/, 2008. [ Links ]
[39] Preston D.L., Pierce D.A., Shimizu Y., Cullings H.M., Fujita S., Funamoto S., Kodama K. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates. Radiat Res, 162, 377-89, 2004. [ Links ]
[40] Berrington A., Darby S.C., Weiss H.A., Doll R. 100 years of observation on British radiologists: mortality from cancer and other causes 1897-1997. The British Journal of Radiology, 74, 507-19, 2001. [ Links ]
[41] Cameron J.R. Longevity Is the Most Appropriate Measure of Health Effects of Radiation. Radiology, 229, 14-15, 2003. [ Links ]
[42] Brenner D.J., Hall E.J. CT: an increasing source of radiation exposure. N. Engl. J. Med., 357, 2277-2284, 2007. [ Links ]
[43] Einstein A.J., Henzlova M.J., Rajagopalan S. Estimating risk of cancer associated with radiation exposure from 64-slice computed tomography coronary angiography. JAMA, 298, 317-23, 2007. [ Links ]
[44] Giles J. Study warns of 'avoidable' risks of CT scans. Nature, 431, 391, 2004. [ Links ]
[45] Fuchs T., Kachelriess M., Kalender W.A. Direct comparison of a xenon and a solid-state CT detector system: measurements under working conditions. IEEE Trans Med Imaging, 19, 941-8, 2000. [ Links ]
[46] Shikhaliev P.M., Xu T., Molloi S. Photon counting computed tomography: concept and initial results. Medical Physics, 32, 427-36, 2005. [ Links ]
[47] Speidel M.A., Lysel M.S.V., Reeder S.B., Supanich M., Nett B.E., Zambelli J., Chang S.M., Hsieh J., Chen G.H., Mistretta C.A. ECG-gated HYPR reconstruction for undersampled CT myocardial perfusion imaging. Proceedings of SPIE, 2007. [ Links ]
[48] Candes E.J., Romberg J., Tao T. Robust uncertainty principles: exact signal reconstruction from highly incomplete frequency information. IEEE Transactions on Information Theory, 52, 489-509, 2006. [ Links ]
[49] Donoho D.L. Compressed Sensing. IEEE Transactions on Information Theory, 52, 2006. [ Links ]
[50] McCollough C.H., Bruesewitz M.R., Kofler J.M. CT dose reduction and dose management tools: overview of available options. Radiographics, 26, 503-12, 2006. [ Links ]
[51] Flohr T.G., McCollough C.H., Bruder H., Petersilka M., Gruber K., Suss C., Grasruck M., Stierstorfer K., Krauss B., Raupach R., Primak A.N., Kuttner A., Achenbach S., Becker C., Kopp A., Ohnesorge B.M. First performance evaluation of a dual-source CT (DSCT) system. European Radiology, 16, 256-68, 2006. [ Links ]
[52] Bruder H., Stierstorfer K., Petersilka M., Wiegand C., Suess C., Flohr T. Correction of cross-scatter in next generation dual source CT (DSCT) scanners. Progress in Biomedical Optics and Imaging-Proceedings of SPIE 6913, art. 69131W, 2008. [ Links ]
[53] Johnson T.R., Nikolaou K., Busch S., Leber A.W., Becker A., Wintersperger B.J., Rist C., Knez A., Reiser M.F., Becker C.R.. Diagnostic accuracy of dual-source computed tomography in the diagnosis of coronary artery disease. Investigative Radiology, 42, 684-91, 2007. [ Links ]
[54] McCollough C.H., Primak A.N., Saba O., Bruder H., Stierstorfer K., Raupach R., Suess C., Schmidt B., Ohnesorge B.M., Flohr T.G. Dose performance of a 64-channel dual-source CT scanner. Radiology, 775-784, 2007. [ Links ]
[55] Zhao J., Jin Y.N., Lu Y., Wang G. A reconstruction algorithm for triple-source helical cone-beam CT via filtered backprojection, 9th International Meeting on Fully Three-Dimensional Image Reconstruction in Radiology and Nuclear Medicine, 205-208, 2007. [ Links ]
[56] Schmidt T.G., Fahrig R., Pelc N.J., Solomon E.G. An inverse-geometry volumetric CT system with a large-area scanned source: A feasibility study, Medical Physics, 31, 2623-2627, 2004. [ Links ]
[57] Mazin S.R., Star-lack J., Bennett N.R., Pelc N.J. Inverse-geometry volumetric CT system with multiple detector arrays for wide field-of-view imaging, Medical Physics, 34, 2133-2142, 2007. [ Links ]
[58] Johnson T.R., Krauss B., Sedlmair M., Grasruck M., Bruder H., Morhard D., Fink C., Weckbach S., Lenhard M., Schmidt B., Flohr T., Reiser M.F., Becker C.R. Material differentiation by dual energy CT: initial experience. European Radiology Supplements, 1510-1517, 2007. [ Links ]
[59] Millner M.R., McDavid M.D., Waggener R.G., Dennis M.J., Payne V, Sank V.J. Extraction of information from CT scans at different energies, Medical Physics, 6, 70-71, 1979. [ Links ]
[60] Kalender W.A., Klotz E., Suess C. Vertebral bone mineral analysis: an integrated approach with CT, Radiology, 164, 419-423, 1987. [ Links ]
[61] Kelcz F., Joseph P.M., Hilal S.K. Noise considerations in dual energy CT scanning, Medical Physics, 6, 418-425, 1979. [ Links ]
[62] Kalender W.A., Perman W.H., Vetter J.R., Klotz E. Evaluation of a prototype dual-energy computed tomographic apparatus. I. Phantom studies, Medical Physics, 13, 334-339, 1986. [ Links ]
[63] GE Healthcare website. GE LightSpeed CT750 HD. Consultado el 30 de Julio 2008 en http://www.gehealthcare.com/usen/ct/products/lspeed_750hd_index.html, 2008. [ Links ]
[64] Zou Y., Silver M. Analysis of fast kV-switching in dual energy CT using a pre-reconstruction decomposition technique. Proceedings of SPIE, 1-12, 2008. [ Links ]
[65] Carmi R., Naveh G., Altman A. Material separation with Dual-Layer CT. IEEE Nuclear Science Symposium Conference Record, 1876-1878, 2005. [ Links ]
[66] Ramirez J.C., Primak A.N., Liu X., and McCollough C.H. X-ray spectra optimization for dual-energy imaging using dual-source CT. Proceedings of the 50th AAPM annual meeting, Houston, TX, 2008. [ Links ]
[67] Takahashi N., Hartman R.P., Vrtiska T.J., Kawashima A., Primak A.N., Dzyubak O.P., Mandrekar J.N., Fletcher J.G., McCollough C.H. Dual-energy CT iodine-subtraction virtual unenhanced technique to detect urinary stones in an iodine-filled collecting system: a phantom study. AJR Am J Roentgenol, 190, 1169-1173, 2008. [ Links ]
[68] Primak A.N., Fletcher J.G., Vrtiska T.J., Dzyubak O.P., Lieske J.C., Jackson M.E., Williams J.J.C., McCollough C.H. Noninvasive differentiation of uric acid versus non-uric acid kidney stones using dual-energy CT. Academic Radiology, 14, 1441-1447, 2007. [ Links ]
[69] Johnson T.R., Weckbach S., Kellner H., Reiser M.F., Becker C.R. Clinical image: Dual-energy computed tomographic molecular imaging of gout. Arthritis Rheum, 56, 2809, 2007. [ Links ]
[70] Sun C., Miao F., Wang X.M., Wang T., Ma R., Wang D.P., Liu C. An initial qualitative study of dual-energy CT in the knee ligaments. Surg Radiol Anat, 2008. [ Links ]
[71] Mori S., Endo M., Obata T., Murase K., Fujiwara H., Susumu K., Tanada S. Clinical potentials of the prototype 256-detector row CT-scanner. Academic Radiolology, 12, 148-54, 2005. [ Links ]
[72] Boedeker K., Mather R. Dynamic volume CT: technical aspects and image quality of the Aquilion ONE. Proceedings of the 50th AAPM annual meeting, Houston, TX, 2008. [ Links ]
[73] Boone J.M. Multidetector CT: opportunities, challenges, and concerns associated with scanners with 64 or more detector rows. Radiology, 241, 334-7, 2006. [ Links ]
[74] Tay S.C., Primak A.N., Fletcher J., Schmidt B., An K.N., McCollough C.H. Understanding the relationship between image quality and motion velocity in gated computed tomography: preliminary work for 4-dimensional musculoskeletal imaging. J Comput Assist Tomogr, 32, 634-639, 2008. [ Links ]
[75] Shikhaliev P.M. Computed tomography with energy-resolved detection: a feasibility study. Physics in Medicine and Biology, 53, 1475-1495, 2008. [ Links ]
[76] Roessl E., Proksa R. K-edge imaging in x-ray computed tomography using multi-bin photon counting detectors. Physics in Medicine and Biology, 52, 4679-4696, 2007. [ Links ]
[77] Taguchi K. Photon counting X-ray detectors and DR and CT imaging methods. Proceedings of the 50th AAPM annual meeting, Houston, TX, 2008. [ Links ]
[78] Kalender W.A., Kyriakou Y. Flat-detector computed tomography (FD-CT). European Radiology, 17, 2767-79, 2007. [ Links ]
[79] Lindfors K.K., Boone J.M., Nelson T.R., Yang K., Kwan A.L., Miller D.F. Dedicated breast CT: initial clinical experience. Radiology, 246, 725-33, 2008. [ Links ]
[80] Ritman E.L. Micro-computed tomography-Current status and developments. Annual Review of Biomedical Engineering, 6, 185-208, 2004. [ Links ]
[81] Lau S.H., Wen F., Yu H., Duewer F., Chang H., Cui H., Feser M., Yun W. Virtual non invasive 3D imaging of biomaterials and soft tissue with a novel high contrast CT, with Resolution from mm to sub 30 nm. ICMAT Symposium on Adv Functional Biomaterials, Singapore, 2007. [ Links ]