Servicios Personalizados
Revista
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO  Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google  Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804
Resumen
MENDOZA, Johanna; RODRIGUEZ, Oscar y AGREDA, Jesús A. ESTUDIO TERMOCINÉTICO DE LAS REACCIONES DE ORDEN CERO, UNO Y DOS EN UN CALORÍMETRO PSEUDO-ADIABÁTICO: Aproximación numérica y datos experimentales. Rev.Colomb.Quim. [online]. 2012, vol.41, n.1, pp.111-122. ISSN 0120-2804.
La señal producida por un calorímetro pseudo-adiabático se simuló mediante la solución numérica de las ecuaciones diferenciales que modelan la cinética química [1], las propiedades térmicas de la celda calorimétrica [2] y la respuesta del termistor que se usó como sensor termométrico [3]. 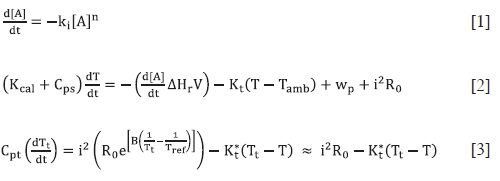 Los resultados obtenidos de las simulaciones se usaron para hacer una comparación entre las señales de las tres cinéticas básicas (orden cero, uno y dos). Esto sirvió para establecer un protocolo de estudio de la cinética de una reacción a partir de medidas calorimétricas, lo cual resulta fundamental, ya que, como se ve en las ecuaciones anteriores, la relación entre el orden de reacción y la señal calorimétrica no es sencilla. Para esclarecer este punto, se realizó el estudio de las señales calorimétricas simuladas, empleando el método de las velocidades iniciales, y se compararon los resultados así obtenidos (orden de reacción y constante cinética) con los valores usados para las simulaciones. Como era de esperarse, los "órdenes de reacción calorimétricos" no coincidieron con los órdenes cinéticos usados en las simulaciones, como sí sucede, por ejemplo, en el caso de datos espectrofotométricos. Sin embargo, se pudo establecer una relación lineal entre el "orden calorimétrico" y el orden cinético que permite obtener el orden de reacción de un proceso que se estudia con un calorímetro. Finalmente, el procedimiento desarrollado se aplicó a los resultados calorimétricos experimentales de la descomposición del H2O2 catalizada en fase homogénea con Fe3+ y en fase heterogénea con carbón activado, encontrando los órdenes de reacción y las constantes cinéticas respectivas de cada proceso global, los cuales presentaron buena coincidencia con los valores reportados en la literatura.
Los resultados obtenidos de las simulaciones se usaron para hacer una comparación entre las señales de las tres cinéticas básicas (orden cero, uno y dos). Esto sirvió para establecer un protocolo de estudio de la cinética de una reacción a partir de medidas calorimétricas, lo cual resulta fundamental, ya que, como se ve en las ecuaciones anteriores, la relación entre el orden de reacción y la señal calorimétrica no es sencilla. Para esclarecer este punto, se realizó el estudio de las señales calorimétricas simuladas, empleando el método de las velocidades iniciales, y se compararon los resultados así obtenidos (orden de reacción y constante cinética) con los valores usados para las simulaciones. Como era de esperarse, los "órdenes de reacción calorimétricos" no coincidieron con los órdenes cinéticos usados en las simulaciones, como sí sucede, por ejemplo, en el caso de datos espectrofotométricos. Sin embargo, se pudo establecer una relación lineal entre el "orden calorimétrico" y el orden cinético que permite obtener el orden de reacción de un proceso que se estudia con un calorímetro. Finalmente, el procedimiento desarrollado se aplicó a los resultados calorimétricos experimentales de la descomposición del H2O2 catalizada en fase homogénea con Fe3+ y en fase heterogénea con carbón activado, encontrando los órdenes de reacción y las constantes cinéticas respectivas de cada proceso global, los cuales presentaron buena coincidencia con los valores reportados en la literatura.
Palabras clave : termocinética; calorímetro pseudo-adiabático; cinéticas de orden cero; uno y dos; simulaciones; descomposición de H2O2.













