Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.73 no.150 Medellín Nov. 2006
PRODUCCIÓN DE ÁCIDO CÍTRICO CON Aspergillus niger NRRL 2270 A PARTIR DE SUERO DE LECHE
PRODUCTION OF CITRIC ACID WITH Aspergillus niger NRRL 2270 FROM MILK WHEY
CARLOS ANDRÉS LÓPEZ RÍOS
Facultad de Minas, Universidad Nacional de Colombia, Medellín
ALEJANDRO ZULUAGA MENESES
Facultad de Minas, Universidad Nacional de Colombia, Medellín
SARA NATALIA HERRERA PENAGOS
Facultad de Minas, Universidad Nacional de Colombia, Medellín
ANGELA ADRIANA RUIZ COLORADO
Escuela de Procesos y Energía, Facultad de Minas, Universidad Nacional de Colombia, Medellín
VICTORIA ISABEL MEDINA DE PÉREZ
Escuela de Procesos y Energía, Facultad de Minas, Universidad Nacional de Colombia, Medellín vimedina@unal.edu.co
Recibido para revisar 14 de Mayo de 2005, aceptado 1 de Noviembre de 2005, versión final 16 de Marzo de 2006
RESUMEN: Con el fin de aprovechar el subproducto de la fabricación de queso blanco, se evaluó el suero de leche como sustrato para la producción de ácido cítrico utilizando Aspergillus niger NRRL 2270. Para este sustrato se comparó la hidrólisis ácida y enzimática de la lactosa con el fin de proporcionar al microorganismo una fuente de carbono más asimilable. En el suero entero (SE) y desproteinizado e hidrolizado (SDH), se estudió el efecto del pH y la adición de nitrógeno, además en el suero hidrolizado (SH) la complementación con sacarosa; posteriormente se estudió la adición de nitrógeno y fósforo en el SE y SDH; se determinó la producción de ácido cítrico al agregar magnesio, carboximetil celulosa (CMC), gelatina y metanol al SE. El proceso fermentativo se realizó en cultivo sumergido discontinuo agitado y a las mejores condiciones nutricionales se hizo un seguimiento de las variables del proceso en el tiempo.
PALABRAS CLAVE: Ácido cítrico, Suero de leche, Aspergillus niger, Hidrólisis, Carboximetil celulosa, Gelatina, Metanol.
ABSTRACS: In order to take advantage of byproduct of white cheese production, the whey was evaluated as a substrate for the production of citric acid utilizing Aspergillus niger NRRL 2270. For this substrate the acid and enzymatic hydrolysis of the lactose are compared in order to provide the microorganism with an easily assimilated source of carbon. In the entire whey (EW) and unprotein hydrolyzed whey (UHW) was studied the effect of the pH, and the addition of nitrogen and phosphorus; besides, in the hydrolyzed whey (HW) the complementation with sucrose afterwards it was studied the addition of nitrogen and phosphorus in the (EW) and (UHW) the production of citric acid was evaluated by adding magnesium, carboxymethyl cellulose (CMC), gelatin and methanol to the whey. The fermentation process was carried out in a submerged, agitated batch cultivation. After determining the better nutritional conditions a were monitoring in the time of the process.
KEY WORDS: Citric acid, Whey, Aspergillus niger, Hydrolysis, Carboxymethylcellulose, Gelatin, Methanol.
1. INTRODUCCIÓN
En la actualidad los altos índices de contaminación han llevado a los gobiernos de todo el mundo a exigir a las industrias una producción limpia, lo cual hace que las empresas planteen soluciones para disminuir sus cargas contaminantes. La industria alimenticia genera una gran cantidad de residuos orgánicos e inorgánicos, de características contaminantes; la biotecnología es una excelente alternativa en la biodegradación de estos desechos, convirtiéndolos en materias primas para la obtención de importantes productos de consumo. Además de ser una alternativa de producción, la biotecnología es una herramienta para el control de residuos contaminantes. El suero de leche es un medio de cultivo con la lactosa como fuente de carbono, y por ello se utiliza en un gran número de procesos fermentativos para la producción de etanol, ácido acético, ácido láctico, ácido propiónico, ácido glucónico, ácido succínico, ácido cítrico, glicerol, proteína unicelular, enzimas (b-galactosidasa o lactasa), grasas y aceites, butanol y acetona, polisacáridos extracelulares y vitaminas, entre otros. (Betancourt, 2003, Sánchez et al., 2005).
El ácido cítrico es un producto con una demanda mundial creciente, debido a sus aplicaciones en la industria de alimentos (bebidas, embutidos), farmacéutica, cosmética, plásticos y detergentes (Saniez, 1999, Betancourt, 2003); por este motivo se ha estudiado su producción a partir de diferentes sustratos como la melaza de caña (Mayilvahanan et al., 1996, Adham, 2002, Haq et al, 2002a, Haq et al, 2002b, Alí et al., 2002a, Alí et al., 2002b), melaza de remolacha (Berovic, 1999, Berovic and Papovic, 2001), desechos de cervecería (Roukas and Kotzekidou, 1986), almidón (Suzuki et al., 1996, Saniez, 1999, Haq et al., 2003b), desechos de piñas (Muñoz et al., 2000), sacarosa (Kim et al., 1995, Jernejc y Legisa, 2002, Peksel and Kubicek, 2003), glucosa (Rugsaseel et al., 1995), tuzas de maíz (Hang, 2001) y suero de leche (Hossain et al., 1983, Hossain and Ahmed, 1992, El- Samragy et al., 1993, El- Samragy et al., 1996, El-Holi and Al-Delaymy, 2003, Betancourt, 2003, Sánchez et al., 2005), entre otros. Se ha reportado que la sacarosa es la fuente de carbono más favorable seguida por glucosa, fructosa y lactosa (Grewal and Kalra, 1995).
Para la utilización del suero de leche se han realizado investigaciones acerca de la hidrólisis ácida y enzimática de la lactosa como pretratamiento para los procesos fermentativos (Amiot, 1991, Arias y Osorio, 1994, González, 1996, Szczodrak, 2000, Douglas et al., 2001, Di Serio et al., 2003, Betancourt, 2003, Jurado et al., 2004).
Entre los microorganismos capaces de producir y acumular ácido cítrico se encuentran las especies de los géneros Aspergillus, Citromyces, Penicillium, Monilia, Candida y Pichia. Las especies de Aspergillus negros y especialmente Aspergillus niger, son las más empleadas en este tipo de producción; las más efectivas son las que presentan baja actividad de las enzimas isocitrato deshidrogenasa y aconitasa hidratasa y una alta actividad de la citrato sintetasa (Grewal and Kalra, 1995, Saniez, 1999, Anastassiadis et al., 2002, Betancourt, 2003). La producción de metabolitos con hongos filamentosos se ve favorecida cuando se presenta un crecimiento en forma de pellets; en los pellets grandes la región central sufre de autolisis debido a la limitación de nutrientes como el oxígeno; por el contrario los pellets pequeños son deseables en el desarrollo de las fermentaciones (Papagianni, 2004).
En la producción de ácido cítrico con Aspergillus niger los niveles de los nutrientes y las condiciones ambientales, como pH, agitación, temperatura, iones metálicos, concentración de fosfato, fuente de nitrógeno y carbono, alcoholes y aditivos, son factores importantes que regulan la morfología del microorganismo y el proceso fermentativo (Hossain et al., 1983, Hossain and Ahmed, 1992, Rugsaseel et al., 1995, Mayilvahanan et al., 1996, El-Samragy et al., 1996, Netik et al., 1997, Pera and Callieri 1997, Papagianni et al., 1998, Jianlong and Ping, 1998, Papagianni, et al., 1999, Adham, 2000, Jianlong, 2000, Ali et al., 2002b, Haq et al., 2002a, Haq et al., 2002a, Ali et al., 2002b, Jernejc and Legisa, 2002, Ates et al., 2002, El-Holi and Al-Delaimy, 2003, Haq et al., 2003a, Peksel and Kubicek, 2003, Papagianni, 2004). El Aspergillus niger es utilizado para la obtención de enzimas a nivel industrial, como la b-Amilasa, amiloglucosidasa, catalasa, celulasa, b-galactosidasa, b-galactosidasa, b-gluconasa, glucoamilasa, glucosa aerodeshidrogenasa, glucosa oxidasa, a-glucosidasa, a-D-Glucosidasa, b-glucosidasa, hemicelulasa, hesperidinasa, invertasa, lipasa, pectinasa, pitasa, proteasa y tanasa (Papagianni, 2004).
Los procesos de producción de ácido cítrico se han llevado a cabo por fermentación en estado sólido (FES) (Rugsaseel et al., 1995, Muñoz et al., 2000), fermentación sumergida (Hossain et al., 1983, Hossain and Ahmed, 1992, Rugsaseel et al., 1995, Mayilvahanan et al., 1996, Netik et al., 1997, Paul et al., 1999, Berovic, 1999, Ates et al., 2000, Jianlong, 2000, Berovic and Papovic, 2001, Jernejc and Legisa, 2002, Ali et al., 2002a, Alí et al., 2002b, Haq et al., 2002a, Haq et al., 2003a, Papagianni, 2004) y fermentación en superficie (Roukas and Kotzekidou, 1986). Además, se ha estudiado la producción de ácido cítrico por Aspergillus niger inmovilizado en un reactor de lecho fluidizado (Sanromán, 1996).
Este trabajo tuvo como objetivo encontrar las condiciones nutricionales adecuadas para la mejor producción de ácido cítrico a partir del suero de leche con Aspergillus niger. Se seleccionaron los tratamientos previos, como el método de la hidrólisis ácida y enzimática de la lactosa y la reducción, de ser necesaria, de metales pesados en el suero. Se evaluó el mejor medio de cultivo al complementar con nitrógeno, fósforo, magnesio, metanol, gelatina y CMC.
2. MATERIALES Y MÉTODOS
2.1 Suero de leche
El suero de leche que se utilizó en la fermentación proviene de la Planta de Leches de la Universidad Nacional de Colombia, Sede Medellín; es subproducto de la elaboración del queso blanco. Adicional a la caracterización realizada por Peña y Flòrez, 2002, a éste se le determinó en el laboratorio de Bromatología de la Universidad Nacional de Colombia, Sede Medellín, el contenido de azufre, cobre, fósforo, hierro, magnesio, manganeso, potasio y zinc. Para cada suero de leche utilizado, se realizó el análisis del contenido de lactosa, con el fin de verificar en cada corrida experimental la concentración de ésta. Para desproteinizar el suero de leche se llevó a cabo el procedimiento propuesto por Gallego y Cuenca, 1988, para la precipitación térmica de las proteínas.
2.2 Pretratamiento del suero
Con el fin de aumentar la disponibilidad de sustratos fermentables e incrementar la producción de ácido cítrico se procedió a estudiar las mejores condiciones de la hidrólisis ácida y enzimática del suero de leche entero.
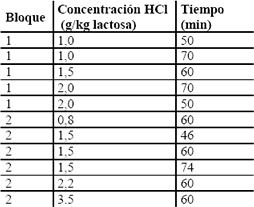
Hidrólisis ácida. Se tomó como base las condiciones de hidrólisis de la sacarosa, teniendo en cuenta la similitud estructural de los dos disacáridos (1 g de HCl concentrado/ kg de sacarosa, 15 minutos y 85 °C). La hidrólisis se llevó a cabo en erlenmeyers de 50 ml con un volumen de trabajo de 25 ml., sumergidos en un baño termostatado que se mantuvo a una temperatura de 80 ºC. Cuando el suero alcanzó la temperatura deseada se adicionó el ácido clorhídrico concentrado y se empezó a registrar el tiempo. El suero se agitó de forma intermitente con el fin de garantizar una mezcla completa. Para la determinación de las mejores condiciones se trabajó con un diseño central compuesto realizado en dos bloques, el cual se presenta en la Tabla 1. Para el análisis de los resultados se utilizó el programa Statgraphics Plus.
Tabla 1. Diseño central compuesto para la hidrólisis ácida del suero de leche.
Table 1. Central composed design for acid hydrolysis of the milk whey.
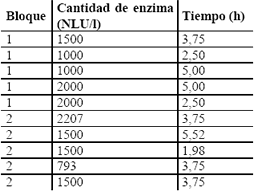
Hidrólisis enzimática. La hidrólisis enzimática se llevó a cabo a las condiciones reportadas en la ficha técnica de la enzima Maxilact L2000, donada por Interenzimas S.A. (1NLU es la masa de enzima comercial que produce 1 mmol de ONP [o-nitrofenol] desde una solución de ONPG [o-nitrofenil b-D-galactopiranoside] bajo condiciones estándar) (Jurado et al., 2004). La hidrólisis se llevó a cabo en erlenmeyers de 250 ml con un volumen de trabajo de 100 ml, en un shaker orbital a 150 rpm, a la temperatura y pH óptimos de la enzima (37 °C y 6,6 respectivamente) (Szczodrak, 2000, Di Serio et al., 2003). Con base en la ficha técnica el pH del suero de leche se ajustó con ácido fosfórico concentrado, ya que la actividad enzimática se ve favorecida con la presencia de PO4-3. Para determinar las mejores condiciones de la hidrólisis enzimática se trabajó con un diseño central compuesto realizado en dos bloques, el cual se presenta en la Tabla 2. Para el análisis de los resultados se utilizó el programa Statgraphics Plus
Tabla 2. Diseño central compuesto para la hidrólisis enzimática del suero de leche.
Table 2. Central composite design for enzimatic hydrolysis of the milk whey.
2.3 Microorganismo
Se seleccionaron varias cepas de A. niger (GCB-47, GCMC-7 y NRRL 2270) con base en sus rendimientos (Haq et al., 2002a, 2003. Jernejc and Legisa, 2002. Netik et al., 1997). En este trabajo el microorganismo que se utilizó fue el Aspergillus niger NRRL 2270 suministrado por Microbial Genomics and Bioprocessing National Center for Agricultural Utilization Research, Agricultural Research Service, USDA. Este microorganismo (A. niger NRRL 2270) se encuentra en otras colecciones como: ATCC 11414; ATCC 26550; CECT 2806; IMI 075353; Martin A-1-233; Perlman Wisconsin 72-4; strain A60; VTT D-77050; VTT D-77053; Wold NRC A-1-233. Esta cepa es de fácil manejo, tiene habilidad para fermentar una amplia variedad de fuentes de carbono económicas y presenta altos rendimientos (Grewal and Kalra, 1995).
Para la activación de la cepa se seleccionó un caldo de papa y dextrosa (PD). Se sembró una cantidad de microorganismo liofilizado en 50 ml de PD contenidos en un erlenmeyer de 150 ml. El medio sembrado se incubó por 5 días a una temperatura de 30 ºC en un shaker orbital a 150 rpm. Después de activada la cepa, se sembró nuevamente el microorganismo en medio sólido (PDA) en caja de petri, manteniendo la temperatura en 30 ºC y un tiempo de 5 días hasta que germinaran las esporas. Al cabo del tiempo de incubación y habiendo esporulado el microorganismo, se guardó para su conservación en el refrigerador a 4 ºC. De las cajas de petri refrigeradas se prepararon suspensiones de esporas con una concentración aproximada de 2 x 107 esporas/ml. con el fin de favorecer la formación de pellets (Berovic, 1999, Papagianni, 2004).
2.4 Fermentación
La fermentación se dividió en cuatro procesos secuenciales: ensayos previos, para encontrar el mejor pH y el tipo de tratamiento que se realizaría al sustrato; estudio de las mejores condiciones nutricionales; adicionando al medio nitrógeno como (NH4)2SO4 y fósforo como KH2PO4; el seguimiento de las variables en el tiempo y el estudio del efecto del magnesio, el metanol y las sustancias viscosas. Para los ensayos previos, el estudio de las condiciones nutricionales y el efecto de magnesio, metanol y las sustancias viscosas, se realizaron mediciones de biomasa, ácido cítrico y azúcares reductores totales (TRS) al inicio y al final de la fermentación después de 6 días. Para el seguimiento de las variables en el tiempo (biomasa, ácido cítrico y TRS), se tomaron muestras por duplicado cada 24 horas durante 10 días.
Durante todas las etapas del proceso se utilizaron erlenmeyers de 250 ml en los cuales se vertieron 47 ml del medio de cultivo y se taparon con un tapón de gasa y algodón que permite el paso de gases y evita la contaminación del medio. Los medios se esterilizaron en autoclave por 15 minutos a 125 ºC. A los erlenmeyers con los medios ya estériles se les acondicionó el pH en la cámara de flujo laminar con HCl concentrado o con NaOH 3 N según el caso. Luego se inoculó con 3 ml (6% v/v) de una suspensión de esporas con una concentración de 2,8 x 107 esporas/ml y se taparon los erlenmeyers. Todos los erlenmeyers fueron llevados a un shaker orbital a 160 rpm y 30°C, durante 6 días (Haq et al., 2002a,b,c).
El diseño experimental para el estudio de las mejores condiciones nutricionales se planteó en dos etapas; una inicial con un intervalo amplio para las concentraciones de amonio y fosfato donde se usó un diseño central compuesto con 4 repeticiones del punto central; la segunda etapa se basaba en los mejores resultados obtenidos de la etapa anterior y se redujo el intervalo de estudio. En la segunda etapa el intervalo de estudio era diferente para cada uno de los medios sugeridos como posibles medios aptos para la producción de ácido cítrico y fue evaluada con un diseño factorial con 6 repeticiones del punto central.
2.4.1. Ensayos previos.
Con el fin de evaluar el suero de leche como medio de cultivo para el Aspergillus niger en la producción de ácido cítrico, se llevaron a cabo, por duplicado, los ensayos previos que se presentan en la Tabla 3 (Hossain and Ahmed, 1992, El-Samragy et al., 1996, Betancourt, 2003, Sánchez et al., 2005). Los medios se complementaron con (NH4)2SO4 (3,5 g/l) teniendo en cuenta que éste incrementa la producción de ácido cítrico sin la formación de ácido oxálico y tiene un bajo costo comparado con el NH4NO3, a pesar de que éste último favorece un período corto de crecimiento (Grewal and Kalra, 1995).
Tabla 3. Condiciones de los medios en los ensayos previos.
Table 3. Conditions of medium in the previous tests
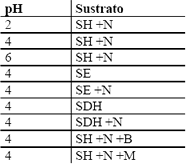
SE: suero de leche entero.
SH: suero de leche hidrolizado.
SDH: suero desproteinizado e hidrolizado.
+N: complemento de nitrógeno, 3,5 g/l (NH4)2SO4.
+B: complemento de azúcar blanca, 90 g/l.
+M: complemento de azúcar morena, 90 g/l.
2.4.2. Condiciones nutricionales.
En la Tabla 4 se presenta el primer bloque que se aplicó a ambos sustratos (SE y SDH), con un intervalo amplio para los factores de NH4+ y PO4-3, como etapa preliminar para disminuir el intervalo de estudio. Después de obtener los resultados del primer bloque para los 2 sustratos, se definió una nueva región de exploración en busca de las mejores condiciones nutricionales, cuyos diseños se presentan en las Tablas 5 y 6.
Tabla 4. Diseño central compuesto modificado para bloque 1.
Table 4. Central composite modified design for block 1.
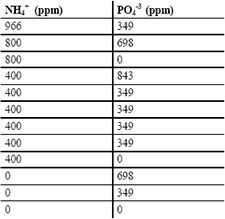
Tabla 5. Diseño factorial del segundo bloque para SE
Table 5. Factorial design of the second block for EW
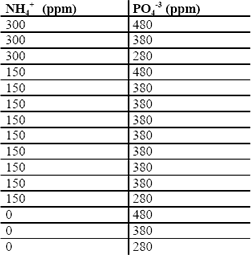
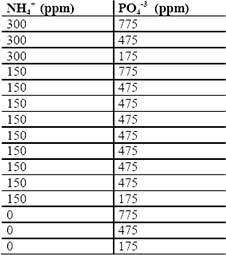
Tabla 6. Diseño factorial del segundo bloque para SDH
Table 6. Factorial design of the second block for UHW
2.4.3. Estudio cinético.
Con las mejores condiciones obtenidas para SE y SDH, en el segundo bloque experimental para los factores concentración de NH4+ y concentración de PO4-3, se llevó a cabo el seguimiento en el tiempo de las variables ácido cítrico, biomasa y TRS.
2.4.4 Efecto del magnesio, metanol y sustancias viscosas.
Usando las mejores condiciones nutricionales obtenidas previamente para el SE, se estimó el efecto del magnesio en 2 niveles (1000 ppm y 500 ppm) realizando las pruebas por duplicado; además, se evaluó por triplicado el efecto del metanol con una concentración del 1% (v/v) como aditivo para el SE con las mejores condiciones nutricionales obtenidas y un ensayo con metanol al 2% (v/v) (Grewal and Kalra, 1995). Posterior a este análisis, se evaluó por duplicado la adición de metanol a concentraciones del 0,75 y 0,5% v/v, de CMC entre 1,5 y 3,5 g/l y gelatina entre 2 y 6 g/l (Rugsaseel et al., 1995).
3. MÉTODOS DE ANÁLISIS
El conteo de esporas por mililitro de solución se llevó a cabo en la cámara de Neubauer. Se determinó el contenido de lactosa por el método de Teles (Teles et al., 1978). Para evaluar el porcentaje de hidrólisis se determinó la glucosa por el método enzimático GOD/POD (Werner et al., 1970). Los azúcares reductores se evaluaron por el método DNS (Miller, 1959). El ácido cítrico se estimó por el método espectrofotométrico de la piridina – anhídrido acético reportado por Marrier and Boulet, 1958. Los minerales se evaluaron por absorción atómica en un equipo Perkin Elmer A-Analyst 100, excepto el potasio el cual se determinó por U.V. visible en un espectófotometro Genesys 2 y el azufre se analizó por el método gravimétrico (sulfato de bario).
4. RESULTADOS Y ANÁLISIS DE RESULTADOS4.1 Caracterización del suero
En la Tabla 7, se presentan los valores de los parámetros evaluados en el Laboratorio de Bromatología de la Universidad Nacional de Colombia, Sede Medellín.
Tabla 7. Análisis de suero de leche.
Table 7. Milk whey analysis
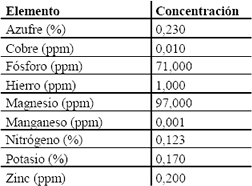
Para la fermentación cítrica utilizando Aspergillus niger es de gran importancia el control de los metales; los cationes divalentes deben estar en concentraciones muy bajas, sin llegar al punto de su ausencia. Con los valores obtenidos para los metales se descarta un tratamiento de remoción de los mismos, previo a la fermentación. El Aspergillus niger consume el ácido cítrico en medios con presencia del ión Mn+2 (5 x10-5 M), mientras que en medios con ausencia de éste la secreción aumenta significativamente (Netik et al., 1997). Los niveles bajos de Mn+2 reprimen las enzimas del ciclo de Krebs a excepción de la citrato–sintetasa; se ha reportado que niveles de 1 ppm de Mn+2 reduce el rendimiento del ácido cítrico en un 10 % (Grewal and Kalra, 1995). Además, el Mn+2 tiene efectos sobre la morfología del microorganismo favoreciendo la formación de pequeños pellets esponjosos y redondeados, que son los deseados para una máxima productividad de ácido cítrico (Alí et al., 2002b). Altos niveles de zinc en cultivos de hongos mantienen el microorganismo en fase de crecimiento y el ácido cítrico no se acumula (Hossain and Ahmed, 1992, Grewal and Kalra, 1995). Papagianni (2004) cita para la producción de ácido cítrico con A. niger, como valores óptimos 0,3 ppm de Zn+2 y 1,3 ppm de Fe+2; Yigitoglu (1992) menciona que niveles de Fe+2 superiores a 1 ppm son necesarios para la producción de ácido cítrico, pero otros autores afirman que las concentraciones de hierro deben ser muy bajas, alrededor de 0,2 ppm. Sin embargo, se ha reportado que la adición de 2 x 10-5 M de CuSO4 a melazas de caña, reduce la concentración de Fe+2, debido a la formación de compuestos tales como el FeS y FeSO4, los cuales precipitan durante el curso de la fermentación, incrementándose la productividad de ácido cítrico; además, reduce el crecimiento e induce una pérdida de la morfología del micelio tipo pellets (Grewal and Kalra, 1995, Haq, et. al., 2002a, Papagianni, 2004). También se ha reportado que la adición de Mg+2 y Cu+2, en pequeñas cantidades, aumenta significativamente la producción de ácido cítrico (Jemejc and Legisa, 2002).
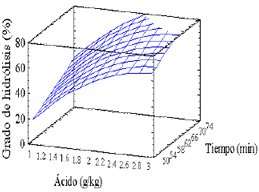
4.2 Hidrólisis ácidaDel análisis estadístico se tiene que ninguno de los puntos presenta un valor de residual que justifique su eliminación. Como era de esperarse los efectos significativos en el proceso son la concentración de ácido y el tiempo con un nivel de confianza del 95% (Pvalue de 0,0028 y 0,0289 respectivamente). No resultaron significativos el efecto cuadrático del tiempo y el efecto de la interacción entre la concentración de ácido y el tiempo. La ecuación que correlaciona las variables en la región estudiada y permite estimar una superficie de respuesta y el óptimo es:
Y = - 86,9511 + 69,069 X1 + 0,956672 X2 – 11,401 X12
Y = Grado de hidrólisis, %.
X1 = Concentración de ácido, g HCl/kg. lactosa.
X2 = Tiempo, minutos.
R2 = 82,8967 %
Las condiciones óptimas para la hidrólisis ácida del suero de leche con una conversión de 88,59 %, son: 3,02899 g de ácido/kg. de lactosa y un tiempo de 74,1421 minutos. Sin embargo, una mayor cantidad de ácido podría llegar a degradar sustancias que mejoran la producción de ácido cítrico en la etapa fermentativa, como es el caso de la riboflavina y la tiamina (Yigitoglu, 1992).
Figura 1. Superficie de respuesta para la hidrólisis ácida.
Figure 1. Response surface for acid hydrolysis.
4.3 Hidrólisis enzimática
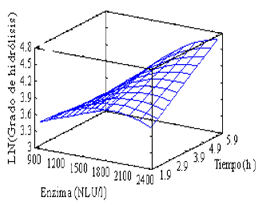
Los cálculos realizados se efectuaron usando el logaritmo natural de la variable de respuesta (grado de hidrólisis). Este operador hace que el modelo ajuste mejor y que algunas suposiciones que realiza el programa sean más cercanas a la realidad. Del análisis de varianza se tiene que el efecto lineal de la concentración de enzima (Pvalue = 0,0000), el efecto cuadrático de la concentración de enzima (Pvalue = 0,0009), el efecto lineal del tiempo (Pvalue = 0,0014) y la interacción entre el tiempo y la concentración de enzima (Pvalue = 0,0046) son significativos en el proceso de hidrólisis enzimática a un nivel de significancia del 95 %. La ecuación que correlaciona las variables en la región estudiada permite estimar una superficie de respuesta y el óptimo es:
Ln Y = 2,7559 + 0,00146067 X1 – 0,306965 X2 – 5,2078 x 10-7 X12 + 0,00022958 X1 X2
Y = Grado de hidrólisis, %.
X1 = Concentración de enzima, NLU/l de suero de leche.
X2 = Tiempo, horas.
R2 = 96,6046 %
La superficie de respuesta estimada se presenta en la Figura 2. Las condiciones óptimas para la hidrólisis enzimática del suero de leche para una conversión del 100 %, son una concentración de enzima 2392 NLU/l y un tiempo de 5,52 horas. Con la superficie de respuesta estimada, se puede ver que existen unas condiciones para las cuales una cantidad adicional de enzima no favorecerá el grado de hidrólisis. Esto se ve claramente en lapsos cortos en los que se observa un máximo para el grado de hidrólisis con una concentración de enzima intermedia en el intervalo evaluado. Este comportamiento no es tan evidente en tiempos largos, pero se puede ver una ligera tendencia a la disminución del grado de hidrólisis para concentraciones altas de enzima. Este comportamiento en la hidrólisis enzimática se puede explicar, porque aunque la enzima es específica para los enlaces glucosídicos entre la glucosa y la galactosa, después de que estos dos se encuentren libres en el medio, se pueden presentar reacciones donde se forman oligosacáridos (Douglas et al., 2001).
Figura 2. Superficie de respuesta para la hidrólisis enzimática.
Figure 2. Response surface for enzymatic hydrolysis.
4.4 Fermentación
4.4.1. Ensayos previos.
Los resultados de los ensayos previos se presentan en la Tabla 8 a,b,c. Para la fermentación con un pH inicial de 2 se obtienen bajas producciones de ácido cítrico y bajo consumo TRS; en éstas la morfología de los microorganismos no fue muy definida tendiendo a ser de forma filamentosa, más aún, no se observan a simple vista, como si se notaba en los otros tratamientos donde se veía claramente una morfología de pellets. Con los resultados obtenidos en los diferentes montajes, se probó que el pH inicial de 4 en comparación con los demás pHs evaluados, favorece la producción de ácido cítrico para el suero de leche hidrolizado complementado con nitrógeno, valor un poco mayor al reportado por El-Samragy et al., 1996 y Betancourt, 2003 de 3,5 y 3,0, respectivamente.
Tabla 8.a. Resultados de los ensayos previos para TRS
Table 8.a. Results of previous tests for TRS
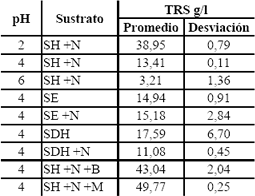
SE: suero de leche entero.
SH: suero de leche hidrolizado.
SDH: suero de leche desproteinizado hidrolizado.
+N: complemento de nitrógeno.
+B: complemento de azúcar blanca.
+M: complemento de azúcar morena.
Tabla 8.b. Resultados de los ensayos previos para àcido cìtrico
Table 8.b. Results of previous tests for citric acid
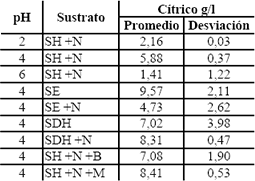
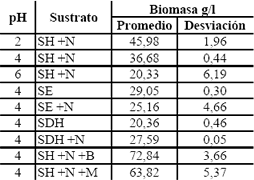
Tabla 8.c. Resultados de los ensayos previos para biomasa
Table 8.c. Results of previous tests for biomass
El pH inicial requerido depende de la fuente de carbono usada. En el medio con pH 6 no se produjeron cantidades apreciables de ácido cítrico porque la ruta metabólica se desvía a ácido oxálico en medios con pH altos, para algunas fuentes de carbono (Grewal and Kalra, 1995, Scragg, 1996). La adición de nitrógeno en el SDH, incrementó la producción de ácido cítrico, la biomasa y el consumo de azúcares reductores. Esto debido a que este tipo de sustrato contiene una baja cantidad de fuente de nitrógeno, ya que gran parte de las proteínas fueron retiradas en la desproteinización.
Los medios suplementados con azúcar, tanto morena como blanca, presentaron un alto crecimiento de biomasa debido a las condiciones favorables del medio en cuanto a la fuente de carbono y nitrógeno fácilmente asimilable por el microorganismo y en concentraciones altas. Aunque las cantidades de ácido cítrico producidas en este par de medios (8,405 y 7,08 g/l para azúcar morena y blanca, en promedio, respectivamente) son comparables con las más altas (9,565 y 8,31 g/l para suero de leche entero y suero de leche desproteinizado e hidrolizado mas nitrógeno, en promedio, respectivamente) no se consideraron para la siguiente etapa de fermentación porque la adición de azúcares trae consigo la adición de metales que inhiben la producción de ácido cítrico y la complementación traería un costo adicional para el proceso y se podría esperar que el consumo de azúcares sea preferencial a la sacarosa, con lo que se dejaría la lactosa del suero de leche sin utilizar como sustrato para seguir siendo una carga contaminante al final del proceso. De estos ensayos previos, se estudió las mejores condiciones nutricionales para el SE y para el SDH; fueron estos dos los que mayores cantidades de ácido cítrico produjeron (9,565 y 8,31 g/l en promedio, respectivamente)
4.4.2. Condiciones nutricionales
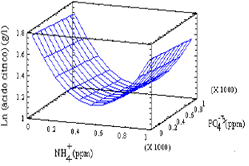
Suero de leche entero Los resultados del primer bloque de estudio de las mejores condiciones nutricionales en el SE se presentan en la Figura 3. La ecuación que correlaciona las variables en la región estudiada y permite estimar la superficie de respuesta y el óptimo es:
Y = 1.84394 - 0.00292477* X1 + 0.0081757* X2 + 0.00000204156* X1 - 0.000011713* X2 2
Y = Concentración de ácido cítrico. g/l
X1 = Concentración de amonio, NH4+ ppm.
X2 = Concentración de ión fosfato, PO4-3, ppm
Figura 3. Superficie de respuesta para el primer bloque con SE.
Figure 3. Response surface for the first block with EW.
La máxima concentración que se alcanzó en estos experimentos fue de 3,27 g/l de ácido cítrico (para una combinación de 0 ppm de NH4+ y 349 ppm de PO4-3) que comparada con los 9,565 g/l alcanzados en los ensayos previos es muy baja; esto se atribuye al cambio del sustrato ya que aunque provienen de la misma planta pueden variar algunas condiciones del proceso que cambian las propiedades del medio. Sin embargo, del análisis de varianza de este primer bloque se evaluaron las mejores condiciones en las cuales se basó el segundo bloque experimental. De este primer bloque se puede decir que concentraciones intermedias (349 ppm) de PO4-3 favorecen la producción de ácido cítrico. Se nota un efecto no tan marcado de la concentración de NH4+, pero bajos niveles de este ión mejoran la producción. Además, se nota una variabilidad baja del proceso dado que las 4 repeticiones del punto central muestran poca desviación (0,3673). De los resultados obtenidos en el primer bloque se propuso una nueva región con niveles bajos de NH4+ (0 a 300 ppm) y valores intermedios de PO4-3 (280 a 480 ppm).
Los resultados del segundo bloque de estudio de las mejores condiciones nutricionales en el SE se presentan en la Figura 4. La ecuación que correlaciona las variables en la región estudiada y permite estimar la superficie de respuesta y el óptimo es:
Ln Y = -2.32935 + 0.0094737*X1 + 0.017464*X2 - 0.0000249308*X1*X2 - 0.0000161817*X22
Y = Concentración de ácido cítrico, g/l
X1 = Concentración de amonio, NH4+ ppm.
X2 = Concentración de ión fosfato, PO4-3, ppm
Figura 4. Superficie de respuesta para el segundo bloque con SE.
Figure 4. Response surface for the second block with EW.
Las condiciones óptimas para el segundo bloque de la fermentación del suero de leche entero corresponden a 10,22 g/l de ácido cítrico para una concentración de NH4+ de 0 ppm y de PO4-3 de 480 ppm. En el segundo bloque evaluado, se alcanzaron mayores concentraciones finales de ácido cítrico lo que probó la predicción de un valor óptimo en el primer bloque. Sin embargo, el aumento en la cantidad máxima de ácido cítrico (de 3,27 g/l en el primer bloque a 10,89 g/l en el segundo bloque) se puede justificar ya que los valores alcanzados en la concentración de ácido cítrico son muy similares a los obtenidos en los ensayos previos, con lo que se afirma la teoría de la variación de las cualidades del suero de leche como sustrato. Este bloque comparado con el primer bloque corrido presentó una variabilidad mayor entre las repeticiones realizadas del punto central (con una desviación de 3,1575). El análisis de varianza arrojó como resultados que en esta región evaluada no existe un factor significativo en un nivel de significancia del 0,05.
Se puede apreciar un comportamiento similar en los dos bloques estudiados para el SE. Para concentraciones altas de NH4+ en el segundo bloque, se ve un máximo en la concentración de ácido cítrico para valores intermedios de PO4-3. Sin embargo, en concentraciones bajas de NH4+ se observó un aumento en la producción de ácido cítrico con la variación de PO4-3, sin que se presente una tendencia que sugiera un máximo cercano a la región evaluada. En la búsqueda de las mejores condiciones nutricionales el microorganismo no presentó formación de pellets definida y si una morfología que tiende a ser filamentosa.
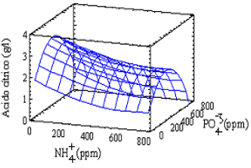
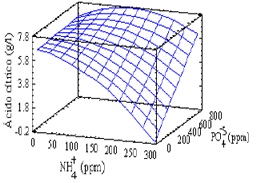
Suero de leche desproteinizado hidrolizado Los resultados del primer bloque evaluado en el estudio de las mejores condiciones nutricionales en el suero de leche desproteinizado hidrolizado se presentan en la Figura 5. De los resultados puede verse que las concentraciones bajas de NH4+ favorecen la producción de ácido cítrico sin importar la concentración de PO4-3. Del análisis de varianza no se encontró algún factor significativo, el más importante fue el efecto cuadrático del ión amonio (Pvalue = 0,0557). En este análisis, el efecto lineal del PO4-3 y la interacción entre el NH4+ y el PO4-3 no fueron significativos. Se decidió en lugar de reducir la región en estudio, utilizar un diseño que cubra la región no evaluada de este primer bloque teniendo solo en cuenta que la concentración de NH4+ debe ser baja. La ecuación que correlaciona las variables en la región estudiada y permite estimar la superficie de respuesta es:
Ln Y = 1.7733 -0.00228059*X1 -0.0000747775*X2 + 0.00000214842*X12
Y = Concentración de ácido cítrico. g/l
X1 = Concentración de amonio, NH4+ ppm.
X2 = Concentración de ión fosfato, PO4-3, ppm
Figura 5. Superficie de respuesta para el primer bloque con SDH
Figure 5. Response surface for the first block with EW
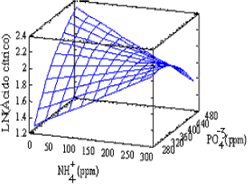
Los resultados obtenidos para el segundo bloque evaluado presentaron concentraciones finales un poco superiores para el ácido cítrico que los obtenidos en el primer bloque, alcanzando una máxima concentración de 7,37 g/l comparada con una máxima del primer bloque de 6,36 g/l de ácido cítrico. Sin embargo, al contrario del primer bloque, la desviación estándar de las repeticiones del punto central es baja (0,737). El análisis de varianza de los resultados mostró como factores significativos el efecto lineal de NH4+ (Pvalue = 0,0004), el efecto lineal del PO4-3 (Pvalue = 0,0018), el efecto cuadrático del NH4+ (Pvalue = 0,0040) y el efecto de la interacción entre el NH4+ y el PO4-3 (Pvalue = 0,0117). El análisis se realizó excluyendo dos puntos (150 ppm NH4+, 475 ppm PO4-3 y 4,99 g/l ácido cítrico; 300 ppm NH4+, 175 ppm PO4-3 y 6,45 g/l ácido cítrico) debido al valor de sus residuales. De los resultados obtenidos, se observa que a concentraciones altas de PO4-3 se deben utilizar niveles intermedios de NH4+ y que para niveles bajos de PO4-3 se debe usar niveles bajos de NH4+. Sin embargo, los mejores resultados se encontraron utilizando la primera condición mencionada (niveles altos de PO4-3 y niveles intermedios de NH4+), esto se puede ver más claramente en la superficie de respuesta estimada y con el valor óptimo para la producción de ácido cítrico en los valores de los niveles de los iones calculados por el análisis de varianza. La ecuación que correlaciona las variables en la región estudiada y permite estimar la superficie de respuesta y el óptimo es:
Y = 6.63185 - 0.0054413*X1+ 0.000192593*X2 - 5,71216 x 10-5 *X12 + 2.59259 x 10-5 *X1*X2
Y = Concentración de ácido cítrico, g/l
X1 = Concentración de amonio, NH4+, ppm.
X2 = Concentración de ión fosfato, PO4-3, ppm
La superficie de respuesta estimada se presenta en la Figura 6. Se determinó que las concentraciones óptimas para una concentración de ácido cítrico de 7,85 g/l de ácido cítrico corresponden a una concentración de NH4+ de 133,74 ppm y de PO4-3 de 775,00 ppm.
Figura 6. Superficie de respuesta para el segundo bloque con SDH
Figure 6. Response surface for the second block with UHW
En casi todos los ensayos, menos en un par de erlenmeyers, en esta etapa fermentativa A. niger presentó formación definida de pellets de tamaño apreciable; en algunos casos se observó pellets sueltos y pequeños, mientras que en otros los pellets se aglomeraban formando una masa de gran tamaño.
4.4.3 Efecto del magnesio, metanol y sustancias viscosas
Efecto del magnesio. Se nota que existe una clara inhibición en la producción de ácido cítrico en los dos niveles evaluados, si se compara la producción con el control (suero de leche entero con 480 ppm PO4-3 y sin adición de NH4+) donde se alcanzó una concentración de 23,798 g/l.
En la Tabla 9 se presentan los resultados después de 7 días de proceso.
Tabla 9. Evaluación del efecto de la adición de magnesio
Table 9. Evaluation of the magnesium addition effect.

Efecto del metanol y sustancias viscosas. Los resultados de la fermentación utilizando como aditivo metanol se presentan en la Tabla 10.
Tabla 10. Evaluación del efecto de la adición de metanol.
Table 10. Evaluation of the methanol addition effect.
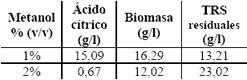
El metanol al 2 % (v/v) puede llegar a ser tóxico para el microorganismo. Estos resultados no están de acuerdo con lo reportado por Haq et al. (2003ª) y El-Samragy et al. (1996), quienes muestran que a la concentración del 4% v/v, se incrementa la producción de ácido cítrico. En un segundo estudio se evaluaron concentraciones inferiores al 1% v/v de metanol y el efecto de la adición de otras sustancias viscosas como la CMC y la gelatina.
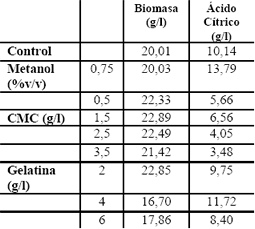
De los resultados mostrados en la Tabla 11, se observa que la adición del metanol al 0,75% mejoró la producción de ácido cítrico (13,79 g/l) al compararla con el control (10,14 g/l); con la CMC a las concentraciones evaluadas de 1,5, 2,5 y 3,5 g/l se encontró que no se incrementaba la producción de ácido cítrico, contrario a lo reportado por Rugsaseel et al. (1995); la adición de gelatina a la concentración de 4 g/l, aumentó ligeramente la concentración de ácido cítrico, pasando de 10,14 g/l (control) a 11,723 g/l. Rugsaseel et al. (1995), reportan un incremento en la concentración de ácido cítrico de 3,4 veces el valor del control cuando se adiciona gelatina a una concentración de 2 a 6 g/l a un medio con glucosa como fuente de carbono. Se observó para la CMC que, a mayor concentración, disminuye la concentración de ácido cítrico, debido probablemente a que el aumento en la viscosidad disminuye la transferencia de los nutrientes.
Tabla 11. Evaluación del efecto de la adición de metanol, carboximetil celulosa y gelatina.
Table 11. Evaluation addition effect of methanol, carboxymethylcellulose and gelatin.
4.4.4 Seguimiento de las variables en el tiempo.
Debido a que en los preensayos se obtuvo resultados muy cercanos para el SE y para el SDH, se decidió realizar el estudio cinético para la producción de ácido cítrico a partir de los dos sustratos, utilizando para cada uno las condiciones nutricionales calculadas como óptimas en el segundo bloque.
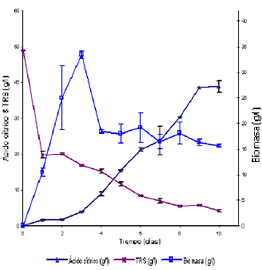
Suero de leche entero Para el suero de leche entero con 480 ppm de PO4-3 y sin adición de NH4+, se encontró un alto crecimiento de la biomasa en los primeros tres días con un alto consumo de azúcares en el primer día, mientras que el ácido cítrico no alcanza concentraciones significativas. Se nota una desviación estándar alta para la mayoría de los datos de biomasa, mientras que para los azúcares residuales y el ácido cítrico esta desviación es mucho menor en la mayoría de los puntos. Al contrario de la morfología presentada en la búsqueda de las mejores condiciones nutricionales, en esta etapa del trabajo se presentó a partir del segundo día un crecimiento en forma de pellets pequeños y bien definidos que no se apelmazaban y que no hacían variar la viscosidad del medio manteniendo una buena agitación del cultivo sumergido. Se ha encontrado que una morfología en forma de pellets pequeños y bien definidos esta asociada a una alta producción de ácido cítrico; una aglomeración de éstos no permite una buena transferencia de nutrientes hacia el microorganismo (Papagianni, 2004).
Figura 7. Seguimiento de las variables con el tiempo para el SE.
Figure 7. Time response for EW.
El comportamiento de los azúcares en el primer día mostró un descenso en los azúcares, de 49 a 19,88 g/l, después del cual el comportamiento de éstos es muy suave con una reducción a lo largo de los 10 días llegando a un valor final de 4,14 g/l de azúcares en el medio. Algo similar a los azúcares, se presentó en el comportamiento de la concentración de ácido cítrico, donde en los primeros tres días su valor es bajo, pasó de 1,59 g/l a 3,88 g/l. A partir del tercer día, se notó un aumento constante del ácido en el medio hasta el octavo día donde se alcanzó una concentración de 30,31 g/l y en los días 9 y 10 la concentración parece estabilizarse alrededor de 38 g/l. Se deduce que A. niger, desdobla la lactosa al producir la b galactosidasa (De Vries, 1999).
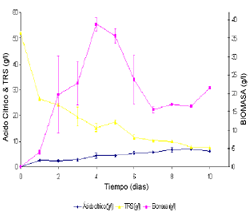
Suero de leche desproteinizado hidrolizado. En este tipo de sustrato se presentó un crecimiento en forma de pellets de gran tamaño; en los primeros días se formaron cadenas largas de micelio, acompañadas de pequeños pellets que con el tiempo se propagaron en el medio aumentando al mismo tiempo de tamaño. En los últimos días del proceso, los pellets se aglomeraron formando una masa. Esta configuración morfológica redujo considerablemente el movimiento del medio en los erlenmeyers cambiando las condiciones hidrodinámicas del cultivo. Las características antes citadas, dificultan la transferencia de nutrientes y oxígeno hacia el microorganismo lo que se ve reflejado en una concentración mayor de azúcares residuales finales en el medio.
Figura 8. Seguimiento de las variables con el tiempo para el SDH, NH4 + 135 ppm, PO4-3 775 ppm.
Figure 8. Time response for UHW, NH4 + 135 ppm and PO4-3 775 ppm.
El comportamiento de los azúcares reductores es muy similar en los dos sustratos con una gran disminución de éstos el primer día (de 52 a 26,47 g/l) y a partir de ese momento hubo una reducción gradual con el tiempo y en el décimo día se encontraron 7,49 g/l de azúcares.
En este sustrato, el comportamiento de la concentración de ácido cítrico es muy parecido al reportado en otros trabajos similares a éste (Betancourt, 2003), pero difiere totalmente de los resultados encontrados con el SE. El comportamiento de la concentración de ácido cítrico, muestra un incremento gradual con el tiempo, llegando a un máximo en el noveno día después del cual tiene una leve disminución para terminar en una concentración de 6,23 g/l de ácido cítrico en el décimo día. Sin embargo, la concentración mayor alcanzada de ácido cítrico en este caso, 7,02 g/l en el noveno día, es muy similar a la hallada en los ensayos previos y en el segundo bloque estudiado en la búsqueda de las mejores condiciones nutricionales.
El SDH resultó no ser un buen medio para la producción de ácido cítrico como se esperaba y como se había reportado en otros trabajos (Betancourt, 2003, Sánchez et al., 2005), cuando es comparado con el SE.
En la Tabla 12 se presentan los resultados obtenidos por distintos autores que utilizan el suero de leche como sustrato para la producción de ácido cítrico.
Tabla 12. Producción de ácido cítrico a partir del suero de leche por distintos autores.
Table 12. Citric acid production from milk whey reported by different authors.
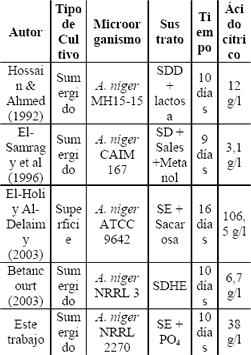
SE: suero de leche entero.
SDD: Suero de leche desproteinizado y descationizado.
SD: Suero de leche desproteinizado.
SDHE: suero desproteinizado hidrolizado y evaporado.
5. CONCLUSIONES
Para alcanzar un alto grado de hidrólisis utilizando ácido clorhídrico concentrado como catalizador se debe adicionar 3 g de HCl por kg. de lactosa a una temperatura de 80 °C por un tiempo de 74 minutos.
En la hidrólisis enzimática las mejores condiciones para un alto grado de hidrólisis se dan utilizando 2392 NLU/ l suero de leche, en un tiempo de 5,52 horas, a una temperatura de 37 °C, un pH de 6,6 y con agitación permanente.
En la etapa de hidrólisis, el uso de enzimas es la mejor alternativa ya que no presenta pardeamiento que es un indicio de la formación de subproductos más difíciles de asimilar que la glucosa y la galactosa. La remoción de metales divalentes o utilización de agentes quelantes en el suero de leche no es necesaria ya que los elementos de mayor influencia como el manganeso, el zinc y el hierro que se encuentran en concentraciones de 0,001, 0,2 y 1 ppm, respectivamente, están dentro de los intervalos recomendados para la producción de ácido cítrico con Aspergillus niger. En el tiempo evaluado para la producción de ácido cítrico (6 días) la complementación del medio con sacarosa no presenta ventajas con respecto al suero de leche. En el SE no se hace necesaria la adición de una fuente de nitrógeno para alcanzar altas producciones de ácido cítrico, mientras que en el SDH se deben adicionar 135 ppm de NH4+ y sin embargo no se alcanzan tan altas concentraciones de ácido cítrico. Este comportamiento indica que no es conveniente la eliminación de proteínas del suero de leche puesto que este sustrato ofrece los nutrientes necesarios para esta fermentación.
El SE necesita una adición de una fuente de fósforo, 480 ppm de PO4-3, mientras que el suero de leche desprotenizado e hidrolizado necesita 775 ppm de este mismo ión. El magnesio en concentraciones de 500 y 1000 ppm inhibe la producción de ácido cítrico a partir del SE con Aspergillus niger. Utilizar el SE como sustrato para la producción de ácido cítrico resulta ser la mejor opción ya que no conlleva ningún tratamiento previo a su utilización como sí ocurre con el SDH.
La adición de metanol (0,75 % v/v) y de gelatina (4 g/l) incrementaron la producción de ácido cítrico en 1,4 y 1,15 veces respectivamente. La adición de CMC no tuvo un efecto positivo.
Aspergillus niger NRRL 2270 es un buen microorganismo para la producción de ácido cítrico a partir de suero de leche ya que asimila fácilmente la lactosa sin necesidad de una hidrólisis previa.
BIBLIOGRAFÍA
[1] ADHAM, N.Z. 2002. Attempts at improving citric acid fermentation by Aspergillus niger beet-molasses medium; Bioresource Technology 84: 97–100. [ Links ]
[2] ALÍ, S.; HAQ, I.-U.; QADEER, M.A. AND IQBAL, J. 2002a. Production of citric by Aspergillus niger using cane molasses in a stirred fermentor. Electronic Journal of Biotechnology Vol. 5, No. 3. 258 – 271. [ Links ]
[3] ALÍ, S., HAQ, I.-U. AND IQBAL, J. 2002b. The role of Mn++ ions for high and consistent yield of citric acid in recycling fed-batch bioreactor system and its novelty on kinetic basis. EJB Electronic Journal of Biotechnology Vol. 5, No. 2. 110 –117. [ Links ]
[4] AMIOT, J. 1991. Ciencia y tecnología de la leche. Principios y Aplicaciones. Zaragoza España: Acribia. [ Links ]
[5] ANASTASSIADIS, S; AIVASIDES, A. AND WANDREY, C. 2002 Citric acid production by Candida strains under intracellular nitrogen limitation. Appl. Microbiol. Biotecnol. 60: 81-87. [ Links ]
[6] ARIAS, M. Y OSORIO, C. 1994. Evaluación de la enzima lactasa en el deslactosaje de leche fluida. Trabajo dirigido de grado, Universidad Nacional de Colombia Sede Medellín. [ Links ]
[7] ATES, S.; DINGIL, N.; BAYRAKTAR, E.; MEHMETOGLU, U. 2002. Enhancement of citric acid production by immobilized and freely suspended Aspergillus niger using silicone oil. Process Biochemistry 38: 433-436. [ Links ]
[8] BEROVIC, M. 1999. Scale up of citric acid fermentation by redox potential control. Biotechnology and Bioengineering, Vol. 64, No. 5. 552-557. [ Links ]
[9] BEROVIC, M. AND POPOVIC, M. 2001. Characterization of gas mixed bioreactors in submerged citric acid fermentation. Chem. Biochem. Eng., Vol. 15, No. 2. 65-69. [ Links ]
[10] BETANCOURT, A.L. . 2003. Obtención de ácido cítrico a partir de suero de leche por fermentación en cultivo líquido. Trabajo dirigido de grado, Universidad Nacional de Colombia, Sede Manizales. [ Links ]
[11] CAMESELLE, C.; NÚÑEZ, M.J. Y LEMA, J.M. 1994. Influencia del precrecimiento del inóculo sobre la producción de ácido cítrico con Aspergillus Níger. AFINIDAD LI 454: 439-444. [ Links ]
[12] DE VRIES R. P.; VAN DEN BROECK, H. C.; DEKKERS, E.; MANZANARES, P.; DE GRAAFF, L. H. AND VISSER, J. 1999. Differential Expression of Three b-galactosidase Genes and a Single b-galactosidase Gene from Aspergillus niger. Applied and Environmental Microbiology Vol. 65, No.6. 2453–2460.
[13] DI SERIO, M.; MATURO, C.; DE ALTERIIS, E.; PARASCANDOLA, P.; TESSER, R.; SANTACESARIA, E. 2003. Lactose hydrolysis by immobilized b-galactosidase: the effect of the supports and the kinetics. Catalysis Today. 79-80: 333-339. [ Links ]
[14] DOUGLAS C. ELLIOTT, CHRISTOPHER F. WEND, MIKHAIL S. ALNAJJAR. 2001. Lactose Processing Technology – Creating New Utilization Opportunities. Proceedings of the 38 th Annual Marschall Cheese Seminar, Tools of the Trade. [ Links ]
[15] EL-HOLI, M. A. AND AL-DELAIMY, K. S. 2003. Citric acid production from whey with sugar and additives by Aspergillus niger. African J. Biotechnol. Vol. 2, No 10. 356-359. [ Links ]
[16] EL-SAMRAGY, Y .A.; KHORSHID, M.A.; FODA, M.I.; SHEHATA, A.E. 1993. Suitability of strains and mutants of Aspergillus niger for the production of citric acid from cheese whey. Milchwissenschaft 48: 498-501. [ Links ]
[17] EL-SAMRAGY, Y .A.; KHORSHID, M.A.; FODA, M.I. AND SHEHATA, A.E. 1996. Effect of fermentation conditions on the production of citric acid from cheese whey by Aspergillus niger. International Journal of Food Microbiology 29: 411-416. [ Links ]
[18] GALLEGO, D. Y CUENCA, J. 1988. Análisis de tres alternativas para la separación de las proteínas del suero de leche lácteo proveniente de Queserías. Investigación Universidad Nacional de Colombia, Sede Medellín. [ Links ]
[19] GONZÁLEZ SISO, M. I. 1996. The biotechnological utilization of cheese whey: A review. Bioresource Technology 57: 1-11. [ Links ]
[20] GREWAL H. S.AND KALRA K. L. 1995. Fungal production of citric acid. Biotechnology Advances. Vol. 13, No 2. 209-234. [ Links ]
[21] HANG, Y. D. Enzymatic enhancement of citric production by Aspergillus niger from corn cobs. 2001 Lebensm Wiss. U. Technol. 34: 484-486. [ Links ]
[22] HAQ, I.-U.; ALI, S.; QADEER, M.A. AND IQBAL, J. 2002a. Effect of cooper ions on mould morphology and citric acid productivity by Aspergillus niger using molassess based media. Process Biochemistry 37: 1085-1090. [ Links ]
[23] HAQ, I.-U.; ALÍ, S.; QADEER, M.A. IQBAL, J. 2002b. Citric acid fermentation by mutant strain of Aspergillus niger GCMC-7 using molasses based medium. EJB Electronic Journal of Biotechnology Vol. 5, No. 2. 125 –132. [ Links ]
[24] HAQ, I.-U.; ALI, S.; QADEER M.A. AND IQBAL, J. 2003a. Stimulatory effect of alcohols (methanol and ethanol) on citric acid productivity by a 2-deoxy D-glucose resistant culture of Aspergillus niger GCB-47. Bioresource Technology. 86: 227–233. [ Links ]
[25] HAQ, I.-U.; ALI, S. AND IQBAL, J. 2003B. Direct production of citric acid from raw starch by Aspergillus niger Process Biochemestry. 38: 921-924. [ Links ]
[26] HOSSAIN, M.; BROOKS, J.D. AND MADDOX, I.S. 1983. Production of acid citric from whey permeate using Aspergillus niger. New Zealand Journal of Dairy Science and Technology 18: 161-168. [ Links ]
[27] HOSSAIN, M. AND AHMED, S. A. 1992. The effect of trace elements on citric acid production from whey permeate by fermentation using Aspergillus niger. Bangladesh J. Microbiol. Vol. 9, No 1. 1-9. [ Links ]
[28] JERNEJC, K. AND LEGISA, M. 2002. The influence of metal ions on malic enzyme activity and lipid synthesis in Aspergillus niger. FEMS Microbiology Letters 217: 185-190. [ Links ]
[29] JIANLONG, W. AND PING, L. 1998. Phytate as a stimulator of citric acid production by Aspergillus niger. Process Biochemistry Vol. 33, No. 3. 313-316. [ Links ]
[30] JIANLONG, W. 2000. Enhancement of citric acid production by Aspergillus niger using n-dodecane as an oxygen-vector. Process Biochemistry 35:1079-1083. [ Links ]
[31] JURADO, E.; CAMACHO, F.; LUZÓN, G. AND VICARIA, J.M. 2004. Kinetic models of activity for b-galactosidases: influence of pH, ionic concentration and temperature. Enzyme Microb Technol 34:33–40. [ Links ]
[32] KIM, K.S.; YOO, Y.J. AND KIM, M.H. 1995. Control of intracellular ammonium level using specific oxygen uptake rate for overproduction of citric acid by Aspergillus niger. Journal of Fermentation and Bioengineering. Vol. 79, No. 6. 555-559. [ Links ]
[33] KURBANUGLU, E.B. 2004. Enhancement of citric acid production with ram horn hydrolysate by Aspergillus niger. Bioresource Technology. 92: 97-101. [ Links ]
[34] MAGNUSON, J AND LASURE, L. 2004. Advances in fungal biotechnology for industry, agriculture and medicine. Edited by Jan and Lene Lange. Kluwer academic/Plenum Publishers. [ Links ]
[35] MARRIER JR. AND BOULET M. 1958. Direct determination of citric acid in milk with an improved pyridine-acetic anhydride method. Journal Dairy Science; 1: 1683-1692. [ Links ]
[36] MAYILVAHANAN, D.; ANNADURAI, G.; RAJU, V.; CHELLAPANDIAN, M.; KRISHNAN, M.R.V. AND JAYARAMAN, K. 1996. Citric acid production Part 1: Strategies for reduction in cycle time for targeted yields; Bioprocess Engineering. 15:323–326. [ Links ]
[37] MILLER, G. L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426-28. [ Links ]
[38] MUÑOZ, D. H.; OSORIO, M. A. Y GÓMEZ, L. A. 2000. Producción de ácido cítrico a partir de desechos de piña por fermentación en estado sólido. Trabajo dirigido de grado, Universidad Nacional de Colombia, Sede Medellín. [ Links ]
[39] NAJALPOUR, G.D. AND SHAN, C.P. 2003 Enzymatic hydrolysis molasses. Bioresource Technology. 86: 91-94. [ Links ]
[40] NETIK, A.; NESTOR V.; TORRES, J.M.; RIOL, C. AND KUBICEK, P. 1997. Uptake and export of citric acid by Aspergillus niger is reciprocally regulated by manganese ions. Biochimica et Biophysica Acta 1326: 287–294. [ Links ]
[41] PAPAGIANNI, M.; MATTEY, M. AND KRISTIANSEN, B. 1998. Citric acid production and morphology of Aspergillus niger as functions of the mixing intensity in a stirred tank and a tubular loop bioreactor. Biochemical Engineering Journal 2: 197-205. [ Links ]
[42] PAPAGIANNI, M.; MATTEY, M. AND KRISTIANSEN, B. 1999. The influence of glucose concentration on citric acid production and morphology of Aspergillus niger in batch and culture. Enzyme and Microbial Technology 25: 710 – 717. [ Links ]
[43] PAPAGIANNI, M. 2004. Fungal morphology and metabolite production in submerged mycelial processes. Biotechnology Advances 22: 189–259. [ Links ]
[44] PAUL, G.C.; PRIEDE, M.A. AND THOMAS, C.R. 1999. Relationship between morphology and citric acid production in submerged Aspergillus niger fermentations. Biochemical Engineering Journal 3: 121-129. [ Links ]
[45] PEKSEL, A. AND KUBICEK, C.P. 2003. Effects of sucrose concentration during citric acid accumulation by Aspergillus niger. Turk J. Chem. 27: 581-590. [ Links ]
[46] PEÑA, CLAUDIA Y FLOREZ, LUIS. 2002. Utilización del suero de leche de queso fresco en la elaboración de una bebida fermentada, con adición de pulpa de maracuya (passiflora edulis) y diferentes mezclas de carboximetil celulosa (cmc), enriquecida con vitaminas A y D. Trabajo dirigido de grado, Universidad Nacional de Colombia, Sede Medellín. [ Links ]
[47] PERA, L. M.; CALLIERI, D. A. 1997. Influence of calcium on fungal growth, hyphal morphology and citric acid production in Aspergillus niger. Folia Microbiol. Vol. 42, No 6. 551-556. [ Links ]
[48] ROUKAS, T. AND KOTZEKIDOU, P. 1986. Production of citric acid from brewery wastes by surface fermentation using Aspergillus niger. Journal of Food Science Vo. 51, No 1. 225-226. [ Links ]
[49] RUGSASEEL, S.; MORIKAWA, S.; KIRIMURA, K.AND USAMI, S. 1995. Stimulation of citric acid production in Aspergillus niger by addition of viscous substances in shake culture. Applied Microbiology and Biotechnology 42: 839-843. [ Links ]
[50] SÁNCHEZ TORO, O.J.; BETANCOURT GARCÉS, A.L. Y GARCÍA R. G.H. 2005 Obtención de productos de valor agregado a partir de suero de leche por fermentación. Memorias II Simposio sobre Biofábricas. UNAL-Medellín. [ Links ]
[51] SANIEZ 1999. Method for producing citric acid. United States Patent 5 928 911. [ Links ]
[52] SANROMÁN, A. 1996. Influencia de la concentración de nitrógeno en la producción de ácido cítrico por Aspergillus niger inmovilizado en un reactor de lecho fluidizado. Afinidad LIII 462. 131- 135. [ Links ]
[53] SCRAGG, A. 1996. Biotecnología para ingenieros. Editorial Limusa, México D.F: [ Links ]
[54] SZCZODRAK, J. 2000. Hydrolysis of lactose in whey permeate by immobilized b-Galactosidase from Kluyveromyces fragilis. Journal of Molecular Catalysis B: Enzymatic 10:631–637. [ Links ]
[55] SUZUKI, A.; SARANGBIN, S.; KIRIMURA, K.; USAMI, S. 1996. Direct production of citric acid from starch by a 2-deoxyglucose resitant mutant strain of Aspergillus niger. Journal of Fermentation and Bioengineering. Vol. 81, No.4. 320-323. [ Links ]
[56] TELES, F., YOUNG, C., STULL, J. 1978. A method for rapid determination of lactose. Journal of Dairy Science Vol. 61, No. 4 : 506-07. [ Links ]
[57] WERNER W, REY H.G. AND WIELINGER H. 1970. Properties of a new chromogen for the determination of glucose in blood according to the GOD/POD method. Anal. Chem. 252: 242-8. [ Links ]
[58] YIGITOGLU, M. 1992. Production of acid citric by fungi. Journal of Islamic Academy of Science. Vol. 5, No 2, 100-106. [ Links ]