Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353
Dyna rev.fac.nac.minas vol.80 no.177 Medellín Jan./Feb. 2013
DENSIDADES Y PROPIEDADES VOLUMÃTRICAS DE LA MEZCLA N,N-DIMETILFORMAMIDA (DMF) + 1-BUTANOL A DIFERENTES TEMPERATURAS
DENSITIES AND VOLUMETRIC PROPERTIES OF THE MIXTURE N,N-DIMETHYLFORMAMIDE (DMF) + 1-BUTANOL AT SEVERAL TEMPERATURES
MANUEL PÃEZ
Dr.Sc,Grupo de FisicoquÃmica Orgánica, Universidad de Córdoba, Monteria, Colombia. mspaezm@unal.edu.co
EDINELDO LANS
M.Sc. ,Grupo de FisicoquÃmica Orgánica, Universidad de Córdoba, Monteria, Colombia. edlans@sinu.unicordoba.edu.co
PLINIO CANTERO
QuÃmico, Grupo de FisicoquÃmica Orgánica, Universidad de Córdoba, Monteria, Colombia. pliniocantero@hotmail.com
Recibido para revisar Abril 2 de 2012, aceptado Diciembre 6 de 2012, versión final Enero 10 de 2013
RESUMEN: Se determinaron las densidades de la mezcla binaria de N,N-Dimetilformamida (DMF) + 1-Butanol usando un densÃmetro de tubo vibrador DMA 5000, sobre todo el intervalo de fracciones molares en el intervalo de temperaturas de 283.15K a 313.15K y 1.011 bar. Se calcularon los volúmenes molares de exceso (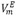 ), volúmenes molares parciales (
), volúmenes molares parciales (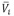 ), volúmenes molares parciales a dilución infinita (
), volúmenes molares parciales a dilución infinita (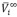 ), volúmenes molares parciales de exceso (
), volúmenes molares parciales de exceso (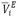 ) del soluto y del solvente. Los volúmenes molares de exceso se correlacionaron usando la ecuación de Redlich-Kister. Adicionalmente, se calcularon los coeficientes viriales (bv) de acuerdo a la teorÃa de McMillan-Mayer. Los valores obtenidos para estos parámetros fueron discutidos en términos de las interacciones presentes en solución.
) del soluto y del solvente. Los volúmenes molares de exceso se correlacionaron usando la ecuación de Redlich-Kister. Adicionalmente, se calcularon los coeficientes viriales (bv) de acuerdo a la teorÃa de McMillan-Mayer. Los valores obtenidos para estos parámetros fueron discutidos en términos de las interacciones presentes en solución.
PALABRAS CLAVE: Densidad, volúmenes molares de exceso, interacciones.
ABSTRACT: Densities of binary mixture of N, N-dimethylformamide (DMF) + 1-Butanol were determined using a vibrating-tube densimeter DMA 5000, over the entire range of molar fractions in the range temperatures from 283.15 K to 313.15 K and 1.011 bar. Excess molar volumes (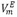 ), partial molar volumes (
), partial molar volumes (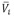 ), partial molar volumes at infinite dilution (
), partial molar volumes at infinite dilution (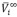 ), excess partial molar volumes (
), excess partial molar volumes (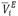 ) of the solute and solvent were calculated. The excess molar volumes were correlated using the Redlich-Kister equation. Additionally, the virial coefficients (bv) were calculated according to the McMillan-Mayer theory. The values obtained for these parameters were discussed in terms of the interactions present in solution.
) of the solute and solvent were calculated. The excess molar volumes were correlated using the Redlich-Kister equation. Additionally, the virial coefficients (bv) were calculated according to the McMillan-Mayer theory. The values obtained for these parameters were discussed in terms of the interactions present in solution.
KEYWORDS: Density , Excess molar volumes , Interactions.
1. INTRODUCCIÃN
Las mezclas lÃquidas de diferentes compuestos dan origen a soluciones que generalmente no se comportan idealmente. Es por ello que la interpretación de la no idealidad es un área muy interesante y un número grande de contribuciones se han realizado durante la última década, especialmente mediante el estudio de las propiedades de exceso. De esta forma el conocimiento de las densidades de sistemas binarios permite obtener cantidades termodinámicas de exceso tales como los volúmenes molares de exceso, volúmenes molares parciales de exceso; los cuales son útiles en el estudio de las interacciones moleculares y los efectos de empaquetamiento entre los componentes de sistemas binarios que contengan lÃquidos asociados, no asociados, polares, no polares, próticos o apróticos [1].
El estudio de interacciones moleculares mediante el uso de una propiedad termofÃsica como la densidad en un sistema amida + alcohol es de gran interés a nivel bioquÃmico debido a que este tipo de sistema constituye un modelo apropiado para el estudio de las interacciones entre péptidos y proteÃna-solvente [1,2]. Por tal motivo, en este trabajo se reportan las densidades (r) para la mezcla binaria DMF + 1-Butanol a una presión atmosférica de 1.011bar, a las temperaturas de (293.15, 298.15, 303.15, 308.15 y 313.15) K en todo el intervalo de composición (expresado en fracción molar). Los valores experimentales de r fueron usados para calcular los volúmenes molares de exceso 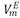 , los coeficientes de temperatura del volumen molar de exceso,
, los coeficientes de temperatura del volumen molar de exceso, 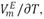 volúmenes molares parciales (
volúmenes molares parciales (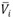 ), volúmenes molares parciales de exceso (
), volúmenes molares parciales de exceso (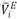 ), volúmenes molares parciales a dilución infinita (
), volúmenes molares parciales a dilución infinita (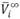 ).El comportamiento de estos parámetros con la concentración y la temperatura fue analizado en términos de las interacciones que ocurren a nivel de la solución .
).El comportamiento de estos parámetros con la concentración y la temperatura fue analizado en términos de las interacciones que ocurren a nivel de la solución .
2. PARTE EXPERIMENTAL
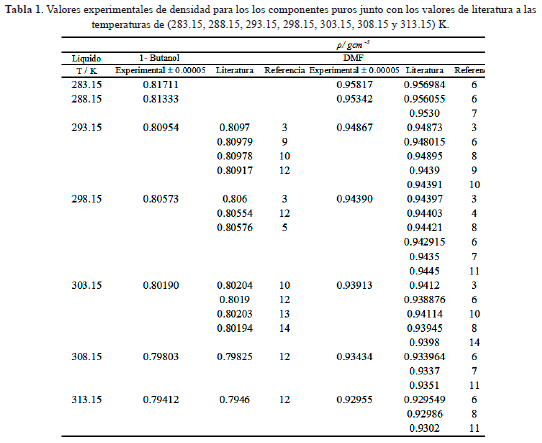
Los reactivos empleados fueron N,N-Dimetilformamida (99,9% de pureza),1-Butanol (99,5% de pureza); los cuales fueron obtenidos de Merck. Se verificó la pureza de estas sustancias mediante la comparación de las densidades de estos compuestos con los datos reportados en la literatura a las temperaturas de (283,15; 288,15; 293,15; 298,15; 303,15; 308,15 y 313,15) K como se muestra en la tabla 1.
Las soluciones fueron preparadas gravimétricamente usando agua doblemente destilada y desionizada (conductividad eléctrica menor de 2mS/cm), mediante una balanza (OHAUS modelo Explorer) con una sensibilidad de ±1x10-4 g, en botellas herméticamente cerradas para evitar perdida por evaporación de alguno de los componentes. Las densidades de los lÃquidos puros y/o mezclas fueron determinadas usando un densÃmetro de tubo vibrador ( Anton Paar, DMA 5000, Austria). La densidad del lÃquido puro y/o la solución problema (r) está dada por:
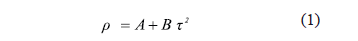
Donde A y B son constantes internas del densÃmetro que dependen de la geometrÃa de la celda que contiene la muestra, t es el periodo de oscilación del lÃquido y/o la solución problema. La incertidumbre experimental en la determinación de las densidades es del orden de ± 1x10-5 g/cm3. Para la calibración del densÃmetro se usó agua bidestilada y desgasificada como lÃquido puro de referencia.
3. RESULTADOS Y DISCUSIÃN
Las densidades r para los compuestos 1-butanol y DMF puros, obtenidas en este trabajo se presentan en la Tabla 1 junto con los valores de literatura. Estas se encuentran en buen acuerdo con los valores reportados por otros investigadores.
Los volúmenes molares fueron calculados a partir de las medidas de densidad a cada temperatura mediante la siguiente ecuación:

Donde M1, M2, x1, x2, y r son los pesos moleculares de los componentes puros, las fracciones molares de solvente (1) y del soluto (2) y la densidad de la solución respectivamente.
Los volúmenes molares parciales del 1-Butanol(2) se determinaron mediante la ecuación (3)
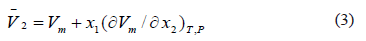
Donde Vm y 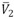 es el volumen molar de la solución y el volumen molar parcial del soluto respectivamente.
es el volumen molar de la solución y el volumen molar parcial del soluto respectivamente.
Los volúmenes molares de exceso (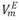 ) fueron calculados de acuerdo a la ecuación (4)
) fueron calculados de acuerdo a la ecuación (4)
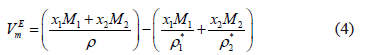
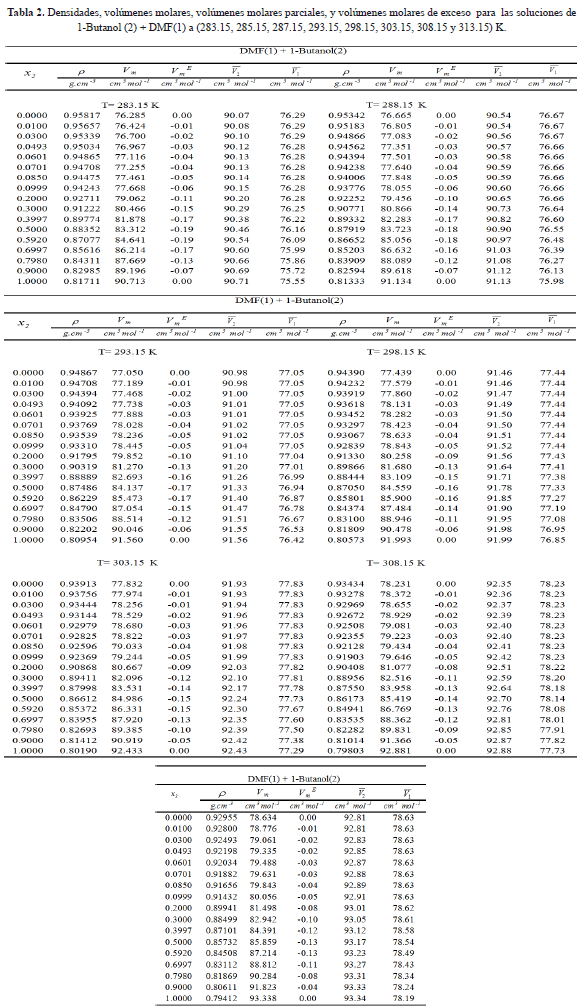
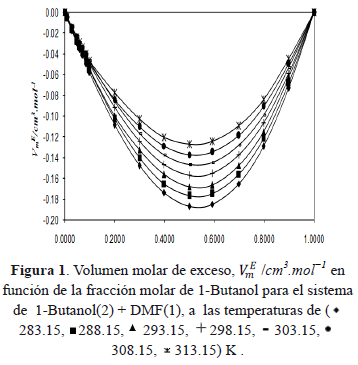
Donde 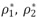 , r son las densidades de los componentes puros y la densidad de la solución a cada temperatura. Los datos experimentales para las densidades, los volúmenes molares, volúmenes molares parciales y volúmenes molares de exceso de la mezcla binaria DMF + 1-Butanol en función de la fracción molar se presentan en la tabla 2 y en la figura 1.
, r son las densidades de los componentes puros y la densidad de la solución a cada temperatura. Los datos experimentales para las densidades, los volúmenes molares, volúmenes molares parciales y volúmenes molares de exceso de la mezcla binaria DMF + 1-Butanol en función de la fracción molar se presentan en la tabla 2 y en la figura 1.
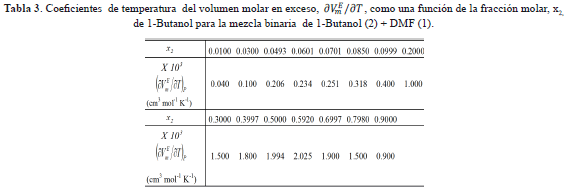
La tabla 2 muestra que las densidades del sistema DMF +1-Butanol disminuyen con el incremento de la temperatura y la concentración del alcohol en la solución. De la figura 1 se infiere que los valores de los volúmenes molares de exceso son negativos en todo el intervalo de fracción molar y a todas las temperaturas investigadas para el sistema en estudio; este comportamiento refleja la no idealidad de la mezcla, lo que podrÃa ser atribuido a interacciones entre los componentes presentes en la mezcla y/o a las contribuciones estructurales derivadas de la ubicación geométrica de un componente en el otro (efecto de empaquetamiento) [15]. De esta manera el signo negativo de VmE indica que a nivel de la solución están ocurriendo contracciones en el volumen de mezcla y podrÃa atribuirse a la formación de enlaces de hidrógeno entre componentes disimilares o a la asociación a través de fuerzas fÃsicas débiles. La probabilidad de la formación de enlaces de hidrógeno podrÃa originarse debido a que la adición de DMF al alcohol puro distorsiona la auto-asociación del alcohol total o parcialmente, formándose probablemente nuevos enlaces de hidrógeno entre el alcohol y la DMF; al mismo tiempo, también podrÃa ocurrir la inclusión parcial de la DMF en los espacios vacÃos dejados en la red estructural del 1-Butanol. La asociación por fuerzas fÃsicas de carácter débil puede ocurrir probablemente por la presencia interacciones débiles dipolo-dipolo. Es por ello que estos dos factores principalmente pueden ser responsables del comportamiento negativo del volumen molar de exceso resultante de la mezcla: DMF + 1-Butanol. Por otra parte, se calcularon los coeficientes de temperatura del volumen molar de exceso, 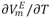 , para cada fracción molar y se muestran en la tabla 3. Observándose que estos son positivos y pequeños, lo que podrÃa indicar un debilitamiento de las interacciones entre componentes disimilares con el aumento de la temperatura. Asà los comportamientos de
, para cada fracción molar y se muestran en la tabla 3. Observándose que estos son positivos y pequeños, lo que podrÃa indicar un debilitamiento de las interacciones entre componentes disimilares con el aumento de la temperatura. Asà los comportamientos de 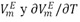 son consistentes entre si [16].
son consistentes entre si [16].
Los valores de los volúmenes molares de exceso fueron ajustados a la ecuación polinomial de Redlich-Kister (5)
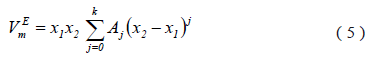
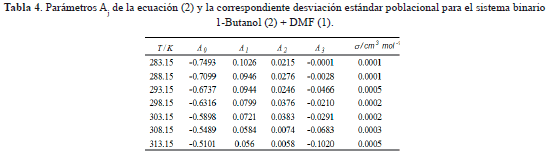
Donde Aj son parámetros ajustables, k es el número de parámetros. El ajuste fue realizado utilizando el método de los mÃnimos cuadrados, donde la desviación estándar (s) viene dada por la ecuación (6) [17].
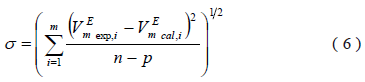
En esta ecuación 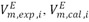 son los volúmenes molares de exceso determinados a partir de los datos de densidad reportados en este artÃculo y calculados por la ecuación (4), n es el número de puntos experimentales, p es el número de parámetros ajustables. Los resultados obtenidos se muestran en la tabla 4.
son los volúmenes molares de exceso determinados a partir de los datos de densidad reportados en este artÃculo y calculados por la ecuación (4), n es el número de puntos experimentales, p es el número de parámetros ajustables. Los resultados obtenidos se muestran en la tabla 4.
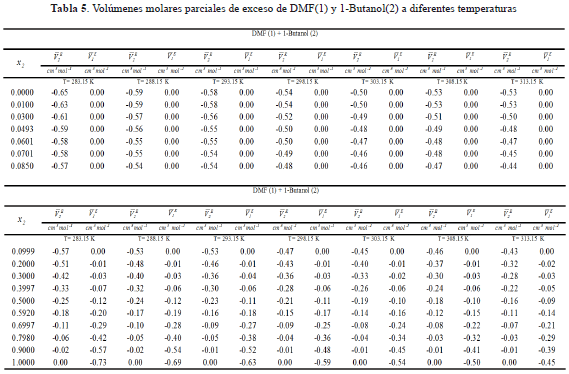
Otra cantidad importante para efectos de analizar el tipo de interacciones predominantes en una solución lo constituyen los volúmenes parciales de exceso derivados de la expresión (4), en la forma de las expresiones (7) y (8) para el componente 1 y 2.
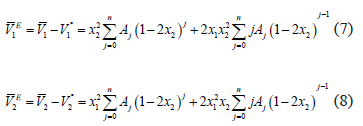
Los resultados obtenidos de los volúmenes molares parciales de exceso para el soluto y el solvente son presentados en la tabla 5.
El análisis de la tabla 5 permite inferir que los volúmenes molares parciales de exceso del soluto y del solvente muestran valores negativos en la gran mayorÃa de las isotermas y concentraciones de estudio, este comportamiento sugiere que los volúmenes molares para la DMF y el 1-butanol en la mezcla son menores que los volúmenes molares en estado puro, lo que podrÃa indicar una contracción en el volumen de la mezcla DMF + 1-Butanol, favoreciéndose asà las interacciones soluto-solvente en este sistema asà como en otros sistemas amida + alcohol[2,18].
Los volúmenes molares parciales a dilución infinita (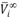 ) del soluto y del solvente se obtienen como el lÃmite de las ecuaciones (7) y (8) cuando la fracción molar del soluto tiende a cero [19], lo que permite rescribirlas en la forma
) del soluto y del solvente se obtienen como el lÃmite de las ecuaciones (7) y (8) cuando la fracción molar del soluto tiende a cero [19], lo que permite rescribirlas en la forma
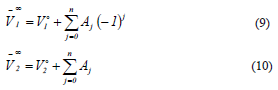
Donde 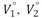 son los volumenes molares de los componentes puros.
son los volumenes molares de los componentes puros.
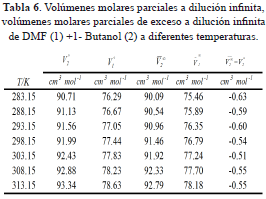
Los valores de los volúmenes molares a dilución infinita permitieron calcular los volúmenes molares parciales de exceso a dilución infinita por las expresiones (11) y (12)

Los valores de los volúmenes molares parciales a dilución infinita, asà como sus cantidades de exceso se muestran en la tabla 6. Los volúmenes molares parciales de exceso a dilución infinita de los dos componentes de la mezcla, son una medida de las interacciones soluto-solvente de los dos componentes en la mezcla. Los volúmenes molares parciales de exceso a dilución infinita (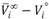 ) de la DMF (1) y el 1-Butanol (2) son negativos para todas las temperaturas de estudio, este comportamiento puede ser atribuido a que la contribución molar del 1-Butanol al volumen total del sistema es menor en solución que en el estado lÃquido puro; indicando que a nivel de la mezcla ocurre una contracción en el volumen y que las interacciones predominantes en la solución son las interacciones soluto-solvente. Resultado que es consistente con las tendencias observadas para los volúmenes molares de exceso y volúmenes molares parciales de exceso. Por otra parte, de acuerdo al criterio de Hepler (Hepler, 1969), valores negativos de la segunda derivada del volumen molar parcial a dilución infinita con temperatura (-0.00007 ± 0.00010) para el 1-Butanol, sugieren que este soluto actúa como un disruptor de la estructura de la DMF [20]. Los volúmenes molares parciales de exceso a dilución infinita (
) de la DMF (1) y el 1-Butanol (2) son negativos para todas las temperaturas de estudio, este comportamiento puede ser atribuido a que la contribución molar del 1-Butanol al volumen total del sistema es menor en solución que en el estado lÃquido puro; indicando que a nivel de la mezcla ocurre una contracción en el volumen y que las interacciones predominantes en la solución son las interacciones soluto-solvente. Resultado que es consistente con las tendencias observadas para los volúmenes molares de exceso y volúmenes molares parciales de exceso. Por otra parte, de acuerdo al criterio de Hepler (Hepler, 1969), valores negativos de la segunda derivada del volumen molar parcial a dilución infinita con temperatura (-0.00007 ± 0.00010) para el 1-Butanol, sugieren que este soluto actúa como un disruptor de la estructura de la DMF [20]. Los volúmenes molares parciales de exceso a dilución infinita (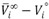 ) de la DMF (1) y el 1-Butanol (2) son negativos para todas las temperaturas de estudio, este comportamiento puede ser atribuido a que la contribución molar del 1-Butanol al volumen total del sistema es menor en solución que en el estado lÃquido puro; indicando que a nivel de la mezcla ocurre una contracción en el volumen y que las interacciones predominantes en la solución son las interacciones soluto-solvente. Resultado que es consistente con las tendencias observadas para los volúmenes molares de exceso y volúmenes molares parciales de exceso.
) de la DMF (1) y el 1-Butanol (2) son negativos para todas las temperaturas de estudio, este comportamiento puede ser atribuido a que la contribución molar del 1-Butanol al volumen total del sistema es menor en solución que en el estado lÃquido puro; indicando que a nivel de la mezcla ocurre una contracción en el volumen y que las interacciones predominantes en la solución son las interacciones soluto-solvente. Resultado que es consistente con las tendencias observadas para los volúmenes molares de exceso y volúmenes molares parciales de exceso.
Adicionalmente, el volumen molar parcial de exceso para el soluto de una mezcla binaria en la región diluida puede ser expresado de acuerdo a la teorÃa de McMillan-Mayer por una ecuación de la forma (13)
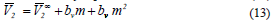
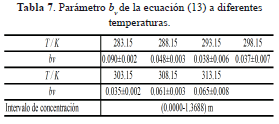
Donde 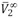 , m, bv, y bvv es el volumen molar parcial del 1-Butanol a dilución infinita, la molalidad de la solución y los coeficientes viriales. Los valores obtenidos para este parámetro se muestran en la tabla 7.
, m, bv, y bvv es el volumen molar parcial del 1-Butanol a dilución infinita, la molalidad de la solución y los coeficientes viriales. Los valores obtenidos para este parámetro se muestran en la tabla 7.
Un análisis de la tabla 7, indica que los valores de bv son positivos y pequeños en todas las isotermas de estudio. Basados en los modelos de solvatación de Wurzburger [21] y McMillan - Mayer, es posible argumentar que las interacciones soluto-soluto se favorecen con el incremento de la concentración en la región considerada en la tabla anterior (es decir, el 1-Butanol(2) presenta una buena tendencia a formar clusters por auto-asociación con la DMF(1)). Por otro lado, los valores positivos de bv a las temperaturas de estudio, indican que el 1-Butanol (2) presenta un pequeño efecto disruptor sobre la estructura del solvente [22].
4. CONCLUSIONES
En este trabajo se presentan datos experimentales no reportados previamente para las densidades del sistema binario DMF (1) +1-Butanol (2) en todo el intervalo de composición y a las temperaturas de (293.15, 298.15, 303.15, 308.15 y 313.15) K.
Los resultados para los volúmenes molares de exceso, volúmenes molares parciales de exceso, volúmenes molares parciales de exceso a dilución infinita son negativos en el intervalo de fracciones molares descrito y a las temperaturas de estudio, lo que podrÃa ser atribuido a la formación de enlaces de hidrógeno entre componentes disimilares o también a la asociación a través de fuerzas fÃsicas débiles; indicando a su vez que en la mezcla se favorecen las interacciones soluto-solvente. Resultado que es consistente con los valores obtenidos para los coeficientes de temperatura del volumen molar de exceso, 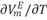 . Adicionalmente el signo positivo del coeficiente bv, indica que el 1-Butanol (2) presenta una tendencia a formar clusters por auto-asociación en presencia de la DMF(1) en la región diluida.
. Adicionalmente el signo positivo del coeficiente bv, indica que el 1-Butanol (2) presenta una tendencia a formar clusters por auto-asociación en presencia de la DMF(1) en la región diluida.
Finalmente el signo negativo de la segunda derivada del volumen molar parcial a dilución infinita con temperatura para el 1-Butanol(2) y el valor positivo del coeficiente bv a lo largo de todas las isotermas de estudio, sugieren que este soluto actúa como un disruptor de la estructura de la DMF.
LISTA DE SIMBOLOS
AGRADECIMIENTOS
Los autores agradecen a la universidad de Córdoba por el apoyo prestado para la realización de este trabajo
REFERENCIAS
[1] Kharat, S., Nikam, P., Density and viscosity studies of binary mixtures of aniline + benzene and ternary mixtures of (aniline + benzene + N,N-dimethylformamide) at 298.15, 303.15, 308.15, and 313.15 K, J. Mol. Liquids., 131-132, 81-86, 2007. [ Links ]
[2] Kumar, A., Molecular interactions in binary mixtures of formamide with 1-butanol,2-butanol, 1,3-butanediol and 1,4-butanediol at different temperatures: An ultrasonic and viscometric study, Fluid Phase Equilibria., 265, pp. 46-56, 2008. [ Links ]
[3] Riddick, J., A. Bunger, W. B. and Sakano, T. K., Organic solvents: Physical properties and methods of purification. Techniques of Chemistry, 4th ed., Wiley - Interscience, New York, 1986. [ Links ]
[4] Chun, T., Yao, J., Han, S., Excess Molar Volumes for the Ternary Mixture N,N-Dimethylformamide + Methanol + Water at the Temperature, J. Chem. Eng., 44, pp. 491-496, 1999. [ Links ]
[5] Segade, L., DomÃnguez, M., Cabeza, O., Cabanas, M., Jiménez, E., Density, Surface Tension, and Refractive Index of Octane + 1-Alkanol Mixtures at T = 298.15 K, J. Chem. Eng. Data., 48, pp. 1251-1255, 2003. [ Links ]
[6] Scharlin, P., Steinby, U., Volumetric properties of binary mixtures of N,N-dimethylformamide with water or water-d2 at temperatures from 277.13 K to 318.15K, Journal. Chem. Thermodynamics., 34, pp. 927-957, 2002. [ Links ]
[7] Pura, S., The Effect of Temperature on the Equivalent Conductivities and Ion-Association.Constants of Some Tris-(ethylenediamine)chromium(III) Complexes in N,N-dimethylformamide and N,N dimethylacetamiden, J. Solution Chem., 37, pp. 351-364, 2008. [ Links ]
[8] Yang, C., Sun, Y., He, Y., Ma, P., Volumetric Properties and Viscosities of Binary Mixtures of N,N-Dimethylformamide with Methanol and Ethanol in the Temperature Range (293.15 to 333.15) K, J. Chem. Eng. Data., 53, pp. 293-297, 2008. [ Links ]
[9] Iloukhani, H., Ali, H., Excess Molar Enthalpies of N,N-Dimethylformamide + Alkan-1-ols, J. Chem. Eng. Data., 47, pp. 195-197, 2002. [ Links ]
[10] Iloukhani, H., Rostami, Z., Measurement of Some Thermodynamic and Acoustic Properties of Binary Solutions of N,N-Dimethylformamide with 1-Alkanols at 30 °C and Comparison with Theories, Journal of Solution Chemistry., 32, pp. 451-463, 2003. [ Links ]
[11] Sanjeevan, K., Pandharinath, N., Density and viscosity studies of binary mixtures of aniline+benzene and ternary mixtures of (aniline+benzene+N,N-dimethylformamide) at 298.15, 303.15, 308.15, and 313.15 K, J. Mol. Liquids., 131-132, 81-86, 2007. [ Links ]
[12] Anil, N., Densities and Volumetric Properties of Binary Mixtures of Formamide with 1-Butanol, 2-Butanol, 1,3-Butanediol and 1,4-Butanediol at Temperatures between 293,15 and 318,15 K, J Solution Chem., 36, pp. 497-516, 2007. [ Links ]
[13] Venkatesu, G., Chandra, S., Prabhakara, R. and Tadeusz, H., Excess molar volumes of N,N-dimethylformamide + 2-pentanone + alkan-1-ols mixed solvent systems at 303.15K, Thermochimica Acta., 443, pp. 62-71, 2006. [ Links ]
[14] Oswal, S., Desai, H., Studies of viscosity and excess molar volume of binary mixtures 4. 1-Alkanol + tri-n-butylamine mixtures at 303,15 and 313,15 K, Fluid Phase Equilibria., 204, pp. 281-294, 2003. [ Links ]
[15] Magalhaes, J., Torres, R. and Volpe, P., Volumetric behaviour of binary mixtures of (trichloromethane + amines) at temperatures between T = 288.15 K and T = 303.15 K at p = 0.1 MPa, Journal Chem. Thermodynamics., 40, pp. 139-146, 2008. [ Links ]
[16] Bhuiyan, M., Uddin, M., Excess molar volumes and excess viscosities for mixtures of N,N-dimethylformamide with methanol, ethanol and 2-propanol at different temperatures, J. Mol. Liquids., 138, pp. 139-146, 2008. [ Links ]
[17] Kapadi, U., Hundiwale, D., Patil, N. and Lande, M. and Patil, P., Studies of viscosity and excess molar volume of binary mixtures of propane-1,2 diol with water at various temperatures, Fluid Phase Equilibria., 192, pp. 63-70, 2001. [ Links ]
[18] Kumar, A., Densities and Volumetric Properties of Binary Mixtures of Formamide with 1-Butanol, 2-Butanol, 1,3-Butanediol and 1,4-Butanediol at Temperatures between 293.15 and 318.15 K, J Solution Chem., 36, 497-516, 2007. [ Links ]
[19] Agudelo, A. and Restrepo, O., Termodinámica y Diagramas de fase, Dyna, 72, pp. 13-21, 2005. [ Links ]
[20] Páez, M., Lafont, J., Alvis, A., Densities and Volumetric Properties of Mixtures N,N-Dimethylformamide + Water at Constant Pressure of 98.93 kPa and various Temperatures, Technological information., 20, pp. 47-54, 2009. [ Links ]
[21] Wurzburger, S., Sartorio, R., Guarino, G., Nisi, M., Volumetric properties of aqueous solutions of polyols between 0.5 and 25 °C, J. Chem. Soc. Faraday Trans., 84, pp. 2279-2287, 1988. [ Links ]
[22] Alvarado, J., Caldera, J., Ferrer, G., Michelena, E., Silva, P., Volumetric, Electric, and Magnetic Properties of Thioxanthen-9-one in Aprotic Solvents as Revealed by High-Precision Densitometry, High-Accuracy Refractometry and Magnetic Susceptibility Measurements and by DFT Calculations, Journal of Solution Chemistry., 35, pp. 29-48, 2006. [ Links ]