Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.54 no.1 Bogotá Jan./Mar. 2003
* Profesor de perinatología, Departamento de Obstetricia y Ginecología, Facultad de Medicina, Universidad de Antioquia.
RESUMEN
Se realiza una revisión que comprende la asociación entre trombofilias maternas y tromboembolismo venoso, aborto, preeclampsia, abruptio, restricción del crecimiento intrauterino y mortinatos. Además, se hace énfasis en los factores predisponentes, los métodos diagnósticos, la vigilancia, la profilaxis y el tratamiento de la enfermedad tromboembólica.
Se hace hincapié en las heparinas de bajo peso molecular (HBPM) como los medicamentos de elección en la tromboprofilaxis y el tratamiento durante la gestación.
Finalmente, se hacen recomendaciones acerca del tratamiento de algunas situaciones especiales en alto riesgo obstétrico: manejo de la mujer embarazada con válvulas cardíacas mecánicas y el manejo de las embarazadas con riesgo incrementado para tromboembolismo venoso y pérdidas gestacionales.
Palabras clave: hipercoagulabilidad, lesión endotelial, estasis, trombosis, trombofilia, heparinas, warfarina, anticoagulantes.
SUMMARY
This paper reviews the association between maternal thrombophilias and venous thromboembolism, miscarriage, preeclampsia, abruption, intrauterine growth restriction and stillbirths. Emphasis is made on risk factors, diagnostic methods, surveillance, prophylaxis and treatment of thromboembolic disease.
Special mention is made to the low mollecular weight heparins as the anticoagulants of choice used for thromboprohylaxis and treatment during pregnancy.
Finally, recomendations are made for treatment of several special situations in high risk obstetric: management of pregnant women with mechanical heart valves, and management of pregnant patients at increased risk for venous thromboembolism and pregnancy loss.
Key words: hypercoagulable, endothelial injury, stasis, thrombosis, thrombophilia, heparins, warfarin, anticoagulant.
INTRODUCCIÓN
Las teorías actuales han caracterizado al embarazo como un estado de coagulación intravascular diseminada crónica compensada, en el que la elaboración de los componentes de la coagulación cubre o rebasa a su consumo.1 En 1856, Rudolf Virchow resume su célebre tríada trombogénica: lesión endotelial, hipercoagulabilidad y estasis venosa, como factores que predisponen a la trombosis venosa.2
El embarazo y la cirugía obstétrica representan dos circunstancias especiales para que se cumplan las condiciones de dicha tríada y se formen los trombos venosos. Es así como la incidencia de trombosis venosa profunda aumenta unas cinco a siete veces en el posparto, comparada con el preparto; igualmente, el riesgo de enfermedad tromboembólica (ETE) cuando el parto es atendido por cesárea (particularmente en la cesárea de urgencia), es tres a seis veces mayor, cuando se compara con la vía vaginal. Debemos recordar que 15% a 24% de estas pacientes sin tratamiento desarrollan tromboembolismo pulmonar, con una mortalidad de 12% a 15%.3
En general existen dos estados que predisponen a la ETE. Los estados de hipercoagulabilidad primaria son desórdenes genético-familiares en los que la anormalidad específica es antagonizada por otros mecanismos fibrinolíticos normales. Comprenden: deficiencia de antitrombina III, deficiencia de proteína C y S, trastornos en el sistema fibrinolítico, disfibrinogenemia, deficiencia del factor XII y otras trombofilias.4
Los estados de hipercoagulabilidad secundaria comprenden un grupo de condiciones clínicas asociadas a alto riesgo de ETE. Son más frecuentes e importantes, e incluyen:
Anormalidades de la coagulación y fibrinólisis: asociadas con cáncer, síndrome nefrótico, anticoagulante lúpico, embarazo y anticonceptivos orales (disminuyen At- III, proteína C y S; aumentan factores V, VIII y plaquetas).
Anormalidades de vasos sanguíneos:
- Condiciones que promueven estasis venosa: inmovilización, reposo, cirugía mayor.
- Hiperviscosidad: policitemia vera, leucemias, anemia de células falciformes.
- Vasculitis y enfermedad oclusiva crónica: enfermedades autoinmunes, Takayasu, Buerger.
- Infección: los trombos se producen por lesión directa de la toxina bacteriana a la pared vascular con exposición del colágeno, hipotensión que lleva a estasis venosa e hipoxia asociada.
- Otras patologías: homocistinuria, púrpura trombocitopénica trombótica, prótesis artificiales.
Anormalidades plaquetarias:
- Desórdenes mieloproliferativos: trombocitosis, hemoglobinuria paroxística nocturna.
- Diabetes mellitus.
- Otros factores: hiperbetalipoproteinemia tipo II, trombocitopenia por heparina.
PATOGÉNESIS DE LA ETE DURANTE EL EMBARAZO
La tendencia a la ETE durante el embarazo (sobre todo a la trombosis venosa profunda) tiene su explicación. Cada elemento de la tríada de Virchow se presenta en algún momento de la gestación, así:2,5
1. Estado de hipercoagulabilidad durante el embarazo y por lo menos seis semanas posparto, debido a:
Incremento de factores de coagulación: I, II, VII, IX, X, V, VIII, XII.
Incremento en la adhesividad plaquetaria.
Incremento de la concentración de tromboplastina tisular en la placenta, la cual puede ser liberada en la circulación sistémica coincidiendo con el desprendimiento placentario, iniciando así la vía extrínseca de la coagulación.
La placenta produce inhibidores de la fibrinólisis.
Contrarrestando parcialmente estos cambios procoagulantes, hay:
Disminución en los factores XI (antecedente tromboplastínico del plasma) y XIII (factor estabilizador de la fibrina).
Aumento de la síntesis de prostaciclina (PGI2).
Producción de PAPP-A: proteína específica del embarazo que facilita la neutralización de la trombina por la antitrombina III (como la heparina).
El parto es seguido de un rápido aumento en la actividad fribrinolítica del plasma.
El balance neto es: aumento en el potencial de trombosis, por aumento de los factores de coagulación y disminución de la fibrinóisis.
2. Lesión endotelial:
Los niveles altos de estrógenos circulantes pueden causar degeneración en las fibras elásticas de la capa media de las venas y desgarro de la íntima subyacente.
El endotelio vascular puede ser lesionado como resultado directo del trauma quirúrgico.
La inoculación de bacterias en el sistema venoso durante la cirugía obstétrica puede causar daño endotelial: las venas ováricas tienen comunicación extensa con los plexos venosos uterino y vaginal, facilitando así una puerta de entrada a las bacterias en la circulación venosa ovárica. La prevalencia de los trombos en la vena ovárica derecha puede ser debida al drenaje retrógrado de la vena ovárica izquierda y plexo venoso uterino en el plexo de la vena ovárica derecha. En presencia de endomiometritis posparto, posaborto, o poscesárea, este drenaje retrógrado puede hacer que la vena ovárica derecha reciba un alto inóculo bacteriano, resultando así la lesión endotelial y la formación de trombos.
La lesión endotelial que ocurre en el momento del parto.
En las cuatro situaciones anteriores, las plaquetas pueden adherirse a las áreas de desgarro endotelial y liberar factores que activan la vía intrínseca de la coagulación.
3. Estasis del flujo venoso:
Al término del embarazo el diámetro de las venas ováricas es aproximadamente tres veces mayor - comparado con el estado no grávido -, y la capacidad de las venas aumenta 60 veces.
La velocidad del flujo sanguíneo a través de las venas ováricas disminuye severamente después del parto.
La disfunción de las hojillas de las valvas de las venas ováricas, especialmente la derecha, crean condiciones para la estasis (lagunas venosas que actúan como nidos de trombos).
Dilatación de venas pélvicas y de miembros inferiores por la compresión del útero y por los cambios hormonales (progesterona), que llevan a la relajación del músculo liso. La vena ovárica derecha está sujeta a compresión por el útero y el uréter dilatado.
Aumento del volumen sanguíneo y de la viscosidad del plasma lo que, sumado a lo anterior, favorece la estasis.
TROMBOFILIA Y EMBARAZO
Recientemente, la atención se ha dirigido a una serie de deficiencias de proteínas aisladas, involucradas en la inhibición de la coagulación o en el sistema fibrinolítico (trombofilia). En algunas mujeres esas deficiencias pueden llevar a la hipercoagulabilidad y a tromboembolias venosas recurrentes. Así, según Hellgren (1989) citado por Williams,6 hasta 70% de los embarazos en mujeres con una deficiencia hereditaria de antitrombina III pueden presentar complicaciones tromboembólicas; de acuerdo con Trauschtvan Horn (1992) citado por el mismo Williams,6 una tercera parte de las mujeres con deficiencia de proteína C desarrollarán una tromboembolia durante la gestación. En general, los estados de hipercoagulación, tales como los asociados con una carencia de antitrombina III, proteína C o proteína S, son responsables de 15% a 20% de los episodios tromboembólicos recurrentes.
Más recientemente, Hellgren y cols. 7 han mostrado que 60% de las mujeres que desarrollan tromboembolismo venoso (TEV) durante el embarazo tenían factor V Leiden (resistencia a la proteína C, causada por un defecto en el gen del factor V). Otros desórdenes trombofílicos, tales como la mutación 20210-A en el gen de la protrombina, la hiperhomocisteinemia y los anticuerpos antifosfolípidos persistentes, están también asociados con un incremento del riesgo de TEV durante la gestación y el puerperio. Las impresiones clínicas y los datos retrospectivos sugieren que la deficiencia de antitrombina III se acompaña de un riesgo más alto de TEV que otras trombofilias, por lo cual debe ser tratada más agresivamente.8
Actualmente se reconoce que las trombofilias maternas se asocian con TEV y con complicaciones del embarazo como infarto placentario (incluyendo aborto), restricción del crecimiento intrauterino (RCIU), preeclampsia, desprendimiento prematuro de placenta (DPP) y muerte intrauterina. Con relación al aborto, varios estudios de casos y controles han mostrado una relación entre factor V Leiden y abortos del segundo trimestre; sin embargo, en contraste con lo que ocurre en el síndrome de anticuerpos antifosfolípidos (SAAF), no hay datos disponibles para vincular a las trombofilias congénitas con pérdidas del primer trimestre. De otro lado, la hiperhomocisteinemia ha sido asociada con pérdida gestacional temprana. Se puede postular entonces que los abortos del primer trimestre reflejan la falla de la implantación, mientras que los abortos del segundo trimestre reflejan eventos trombóticos en la placenta.9 Además, hay una asociación entre mortinatos y trombofilia, particularmente con deficiencia de antitrombina III, pero también con defectos combinados. Los mortinatos pueden reflejar un incremento en las complicaciones del embarazo con RCIU, preeclampsia y DPP. La principal relación parece ser con la hiperhomocisteinemia, factor V Leiden y el gen de la protrombina.10
En vista de lo anterior, las mujeres con pérdida gestacional recurrente, incluyendo al menos un aborto del segundo trimestre, una historia de muerte intrauterina o de preeclampsia severa o recurrente, o de RCIU, deben ser tamizadas esencialmente para trombofilias congénitas. Si bien la hiperhomocisteinemia no ha sido relacionada con TEV durante el embarazo, ésta y las concentraciones séricas de ácido fólico disminuidas, son factores de riesgo para aborto espontáneo recurrente; por lo tanto los suplementos de ácido fólico pueden ser beneficiosos en tales pacientes.8
El SAAF puede presentarse en pacientes con lupus eritematoso sistémico (LES), con el uso de ciertas drogas y en individuos aparentemente saludables. Hay evidencia convincente de que la presencia de SAAF está asociada con un incremento del riesgo de trombosis y pérdida de la gestación. Por tanto, las mujeres con pérdida gestacional recurrente deben ser tamizadas para la presencia de SAAF previamente al embarazo o durante la fase temprana del mismo.8
FRECUENCIA DE LA ETE
La incidencia de trombosis venosa de los miembros inferiores en el anteparto es de más o menos 2 x cada 1 000 embarazos (casi la misma que en las no embarazadas). De éstas, la mayoría son superficiales (1,7 por cada 1 000 embarazos); las trombosis venosas profundas son raras (3,6 por cada 10 000 embarazos).
La incidencia de trombosis venosa superficial aumenta unas siete veces (12 por cada 1 000 embarazos) y la trombosis venosa profunda lo hace cinco veces (15 por cada 10 000 embarazos) durante el periodo posparto. Hay una llamativa predisposición para que la trombosis venosa profunda (TVP) ocurra en la pierna izquierda (90%) (8). Resulta paradójico que el posparto sea el momento con mayor riesgo de complicaciones tromboembólicas, ya que en este periodo se produce un rápido aumento de la actividad fibrinolítica del plasma y de toda la sangre. En años recientes parece haberse producido una disminución de la incidencia del TEV durante el puerperio, pero un aumento anteparto; sin duda la incidencia del TEV durante el puerperio ha disminuido en forma notable con la deambulación temprana.6,8,11
El tromboembolismo pulmonar se observa rara vez durante la gestación, presentándose con una incidencia del 2,7 por 1 000; en alrededor de 95% de los casos el tromboembolismo pulmonar se produce como resultado de una trombosis venosa profunda íleofemoral, por lo general en el posparto inmediato.11
La trombosis venosa pélvica se presenta entre el 5 y 10 por 1 000 de todos los partos. La tasa de recurrencia del TEV durante el embarazo en mujeres con historia previa de TEV ha variado entre 0% y 13%.8
DIAGNÓSTICO CLÍNICO DE LA ETE
La ETE incluye trombosis venosa profunda (TVP), trombosis venosa pélvica y embolismo pulmonar (EP).
Los síntomas y signos de la ETE dependen de la obstrucción del retorno venoso, sola o acompañada de inflamación vascular. La mayoría de los trombos demostrados por métodos diagnósticos son asintomáticos, incluso en presencia de embolismo pulmonar y 80% sufren lisis espontánea.
Los síntomas y signos de la ETE son inespecíficos y las entidades que pueden confundirla son: rotura de un quiste de Baker, hematomas musculares, miositis, neuritis, artritis, linfangitis y síndrome varicoso.
Los principales síntomas y signos de la ETE dependen de la localización del trombo, así:
Tromboflebitis superficial: afecta las venas safenas, es más frecuente que la TVP y se trata con analgesia, sostén elástico y reposo. Las venas afectadas se palpan sensibles, calientes y eritematosas. Rara vez embolizan. Si no ceden rápidamente o si se sospecha un compromiso venoso profundo, se toman las medidas diagnósticas adecuadas y se administra heparina si se confirma el diagnóstico.6
Trombosis venosa profunda: son difíciles de diagnosticar, ya que el dolor y la hipersensibilidad del embarazo pueden simular su presencia. Ocurre generalmente en las venas de los miembros inferiores; en 80% de las gestantes la trombosis se inicia en las venas ilíacas y femorales. Se manifiesta por:
- Dolor o sensibilidad en las pantorrillas 60% a 90%
- Aumento de la temperatura y edema unilateral 40% a 75% (2 o más cm en el diámetro de la extremidad afectada)
- Signo de Homans (dolor hiperextensión del pie) 30% a 40%
- Prueba de Lowenberg positiva 30% (incremento del dolor distal al inflar tensiómetro a 180 mmHg)
- Varicosidades superficiales
- Cambios anormales de coloración de la extremidad (se dan en casos severos con compromiso del flujo arterial, originando la flegmasia cerulea dolens. Se presenta cianosis, disminución de pulsos y extremidad fría).
El comienzo es repentino y casi siempre se produce en el puerperio.
Se asocia con: parto por cesárea, obesidad, edad materna avanzada, multiparidad, toma de estrógenos para suprimir la lactancia, varicosidades, complicaciones obstétricas que requieren reposo prolongado en cama y con deficiencia de la actividad de los anticoagulantes naturales (antitrombina III, proteínas C y S) y con otras trombofilias maternas.
Las principales complicaciones son el síndrome postrombótico y el embolismo pulmonar. Este último se presenta hasta en 50% de los casos.11,12,13
- Embolismo pulmonar: constituye la complicación más grave de la trombosis venosa y la tercera causa de muerte de origen cardiovascular. Si bien el EP puede manifestarse en cinco formas diferentes, en el tromboembolismo pulmonar clásico el espectro clínico corresponde a una enfermedad cardiopulmonar aguda, encontrándose signos de rápida dilatación del ventrículo derecho, acentuación y desdoblamiento del segundo ruido pulmonar (50%). Además: disnea (70%), taquipnea, broncoespasmo, tos seca, hemoptisis, dolor torácico (65%) y lipotimia (4%). La taquipnea mayor de 16 por minuto es un hallazgo frecuente (80% a 90%), crépitos basales (50%), taquicardia (45%), fiebre (50%), presencia de S3 o S4 (34%), arritmias (7%). Las enfermedades cardíacas preexistentes predisponen al infarto pulmonar, cuyos signos clásicos son: dolor pleurítico agudo, disnea y hemoptisis.12
- Trombosis venosa pélvica: la TVP se presenta entre el cinco y el diez por mil de todos los partos. Es una complicación de la infección puerperal que pone en peligro la vida de la paciente. Puede causar enfermedad multisistémica como también enfermedad localizada en la pelvis. En 32% a 38% de los casos puede originar embolismo pulmonar recurrente. La trombosis venosa pélvica se puede presentar como dos síndromes clínicos diferentes:
1. Trombosis aguda de la(s) vena(s) ovárica(s) (TAVO).
2. Trombosis difusa de pequeños vasos pélvicos múltiples.
El desorden más comúnmente descrito es el de la TAVO. Por ser éste más frecuente en el lado derecho, muchos autores lo conocen como "el síndrome de la vena ovárica derecha". La TAVO ha sido reportada por Brown y Munsick. Inicialmente la paciente presenta cuadro compatible con endomiometritis o celulitis pélvica, para lo cual recibe tratamiento médico, sin ninguna mejoría. El signo más importante es la detección de una masa que corresponde a la vena trombosada (50% a 67% de los casos, uni o bilateral), la cual se origina centralmente cerca al cuerno uterino y se extiende lateral y cefálicamente hacia el abdomen superior.
El segundo desorden ha sido descrito como "fiebre enigmática", ya que no hay un origen claro para el aumento recurrente de la temperatura. Este síndrome es descrito por Gibbs, Dun, Vorrhis y Schulman. Estas pacientes también tienen evidencia de infección y reciben tratamiento, mejorando definitivamente, con excepción de la inestabilidad térmica. La paciente no aparece críticamente enferma.2,5
AYUDAS DIAGNÓSTICAS DE LA ETE
Trombosis venosa profunda (TVP)
Las pruebas diagnósticas son invasoras y no invasoras. Las primeras son más sensibles y específicas, pero implican más riesgo para la paciente. Las no invasoras son fiables, pero su precisión está afectada por las alteraciones fisiológicas del embarazo.
Venografía: continúa siendo el estándar para la confirmación del diagnóstico clínico de la TVP, pero no es un procedimiento inocuo ya que es invasivo. Es el método más seguro para diagnosticar las trombosis en las pantorrillas, pero con una técnica adecuada se puede valorar toda la extremidad inferior, incluyendo las venas ilíacas externa y primitiva. No es útil para valorar vasos pélvicos. Es positiva cuando hay un bloqueo venoso.2,12
Pletismografía de impedancia: es un instrumento capaz de registrar variaciones en el volumen de una extremidad. Es muy útil en casos de oclusión arterial, con unos valores predictivo negativo y predictivo positivo muy altos, con una sensibilidad de 95% y una especificidad de 90%. No se debe solicitar en casos de trombosis venosa, ya que tiene altos índices de falsos positivos y porque actualmente existen otros métodos altamente sensibles y específicos.14
Dúplex color (Triplex): estudio de primera elección en la evaluación de la sospecha de trombosis, ya sea superficial o profunda, tanto de miembros superiores como de inferiores. La sensibilidad para TVP es de 95% y la especificidad de 98%. En pacientes asintomáticos, la sensibilidad disminuye a 80%. Pronto se contará con estudios en configuración tridimensional.13,14
Gammagrafía con fibrinógeno marcado con I125: el fibrinógeno, cuando se inyecta en la corriente sanguínea, es captado e incorporado al trombo en formación. Es una técnica excelente para diagnosticar TVP en la pantorrilla y en tercio inferior del muslo, pero está contraindicada en la mujer embarazada y en la que va a lactar, ya que el yodo pasa al feto a través de la placenta y la leche y se concentra en el tiroides fetal (su efecto dura hasta 60 días).2,11,12
Embolismo pulmonar
Además del examen físico, los rayos por de tórax, el EKG y los gases arteriales ayudan al diagnóstico posible. Sin embargo, los métodos más confiables para el diagnóstico de EP son la gammagrafía de ventilación-perfusión (V/Q) y la arteriografía pulmonar.
Rayos de tórax: se han descrito siete signos más o menos típicos: amputación de una arteria pulmonar, dilatación de una arteria pulmonar o del ventrículo derecho, pulmón isquémico, imagen pulmonar de infarto, elevación de un hemidiafragma, atelectasia y derrame pleural.12
EKG: es normal en 30% de las pacientes y en 70% a 75% de los casos los hallazgos no son específicos, incluyendo: arritmias (taquicardias supraventriculares, fibrilación auricular, contracciones ventriculares prematuras), sobrecarga cardíaca derecha (patrón S1Q3T3, bloqueo de rama derecha y desviación del eje a la derecha), inversión de la onda T y ondas P altas en II, III y AVF.
Gases arteriales: un hallazgo muy frecuente es la presencia de alcalosis respiratoria con hipoxemia e hipocapnia (PO2 inferior a 80 mmHg y PCO2 superior a 30 mmHg). Son normales en 6%.12,13
Gammagrafía de V/Q: es el método diagnóstico no invasivo de elección en la paciente con sospecha clínica de EP. Inicialmente se realiza la gammagrafía de perfusión (Q), la cual se in terpreta como positiva cuando se registran zonas que no captan el radio trazador (macroagregados de albúmina marcados con Tc 99). Es útil cuando los rayos x de tórax son normales. Puede dar falsos positivos en presencia de quistes, bulas enfisematosas, tumores, atelectasias, neumonías, EPOC y sarcoidosis.
La gammagrafía de ventilación (V) sirve como complemento de la gamagrafía de perfusión, mejorando la especificidad (para descartar los falsos positivos); aquí se emplea un isótopo de xenón inhalado inmediatamente antes o después del estudio de Q.
En general se reportan tres patrones gammagráficos: alta probabilidad, intermedia y baja. Un estudio de baja probabilidad descarta EP, uno de alta probabilidad tiene una sensibilidad de 82% y una especificidad cercana a 90%.6,12,13
Arteriografía (angiografía): es considerada como la técnica más específica para diagnosticar EP. Está indicada en las pacientes con alta sospecha clínica y en quienes por otros métodos -(como el gammagráfico) no haya podido llegarse a una conclusión diagnóstica. Esta técnica invasiva implica los riesgos del cateterismo y reacciones al medio de contraste. El grado de exposición fetal a radiaciones es muy bajo.6,12,13
Trombosis venosa pélvica
Hasta hace poco, el diagnóstico de la trombosis venosa pélvica se hacía intraoperatoriamente en pacientes con masa pélvica, síndrome febril y dolor en FID, o tras la respuesta satisfactoria a la prueba terapéutica con heparina. Además, se han utilizado métodos como la urografía, la venografía femoral, la flebografía uterina y el ultrasonido para aproximarse al diagnóstico. Actualmente, gracias al progreso de la imagenología, las técnicas de elección son:12,13
Tomografía axial computarizada (TAC): recurso adecuado no sólo para realizar el diagnóstico, sino también en el seguimiento de la TVP proximal y pélvica. Se lleva a cabo usando medio de contraste. Los criterios usados para el diagnóstico de trombosis venosa por TAC, son los recomendados por Zerhouni y colaboradores, estos son: ensanchamiento de la vena, una baja densidad de flujo luminoso dentro de la pared del vaso y una pared del vaso agudamente definida, mejorada por el medio de contraste.
Imagen de resonancia magnética (IRM): lo que más ha revolucionado el diagnóstico de la trombosis venosa pélvica es la IRM, técnica bastante costosa (vale el doble del TAC). Según Erdman (1990), citado por Williams(6), la IRM tiene una sensiblidad de 100% y una especificidad de 90% para la detección de trombosis venosa pélvica venográficamente demostrada. Tiene las ventajas de que en ella no se usan medios de contraste, de que los vasos normales aparecen oscuros debido a la presencia de flujo sanguíneo, mientras que los trombos se ven claros (color blanco leche) y que tiene la capacidad para formar imágenes en los planos coronal y sagital.
TERAPIA ANTICOAGULANTE DURANTE LA GESTACIÓN
Los anticoagulantes disponibles para la prevención y el tratamiento del TEV y el tromboembolismo arterial incluyen: la heparina estándar (HE), las heparinas de bajo peso molecular (HBPM) y los heparinoides; además, los derivados del coumadín y el ácido acetilsalicílico. Los "inhibidores directos de la trombina" como el hirudin, cruzan la placenta y todavía no han sido evaluados durante el embarazo, por lo cual no se discutirán.
La HE tiene un peso molecular mayor de 40 000 daltons, se debe administrar parenteralmente y su efecto antitrombótico es difícil de mantener sin complicaciones hemorrágicas. La dosis de HE requerida para prevenir la trombosis arterial o la trombosis de las válvulas cardíacas protésicas es más alta que la necesaria para preve nir el TEV(8). Produce su efecto anticoagulante por la formación de un complejo con la antitrombina III (cofactor de la heparina), el cual neutraliza o inhibe los factores de coagulación activados en la vía intrínseca y común de la coagulación, incluyendo trombina (IIa), Xa, IXa, XIa, XIIa y calicreína, siendo cuantitativamente más importantes la inhibición de la trombina y del factor Xa (1f) (figura 1).
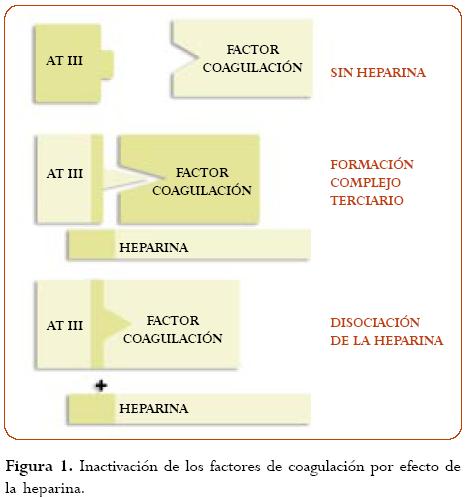
La antitrombina III es un lento inhibidor sin la heparina; ésta última liga a la antitrombina III a través de la alta afinidad pentasacárida (observada en 30% de las moléculas de heparina) e induce un cambio conformacional en la molécula de aquélla, convirtiéndola en un rápido inhibidor. La antitrombina III liga covalentemente al factor de coagulación, y la heparina se separa del complejo y puede ser reutilizada.
Durante el embarazo la dosis necesaria de heparina es mayor, debido al aumento del volumen plasmático, al mayor aclaramiento renal, a la presencia de heparinasa placentaria y al aumento de lípidos de baja densidad durante el parto.
Las HBPM (entre 3 200 y 6 000 daltons) son utilizadas con el fin de reducir los efectos adversos. Estas HBPM se unen a la antitrombina III y producen un efecto anti-Xa altamente selectivo, el cual es inversamente proporcional al peso molecular del fragmento de heparina. Por otro lado, su actividad contra el factor IIa es menor (3,5 a 5 veces menos que la heparina)15,16,17 (figura 2).
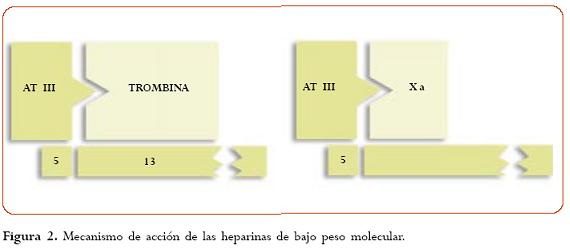
Para inactivar al factor Xa, la HE y las HBPM deben ligar antitrombina III a través de la alta afinidad pentasacárida (estructura requerida para el efecto antitrombótico de la heparina), pero no necesitan ligar al factor Xa. Para inactivar al factor IIa, la HE debe ligar antitrombina III a través de la alta afinidad pentasacárida y trombina a través de una unidad adicional de 13 monosacáridos. Las HBPM que contienen menos de 18 sacáridos no pueden ligar trombina y por tanto son incapaces de inactivarla. Se usan y consiguen en nuestro medio:
Enoxaparina sódica (Clexane®): cajas con jeringas prellenadas con 20 mg/0,2 mL, 40 mg/0,4 mL, 60 mg/0,6 mL y 80 mg/0,8 mL (1 mg = 100 UI anti-Xa ) para uso SC.
Nadroparina cálcica (Fraxiparine®): caja con dos jeringas prellenadas de 20 mg/0,2 mL, 30 mg/0,3 mL, 40 mg/0,4 mL y 60 mg/0,6 mL (0,1 mL = 950 UI anti-Xa) para uso SC.
Fraxiparine® Tx: caja con dos 2 jeringas precargadas de 120 mg/0,6 mL (conteniendo 11 400 UI anti-Xa) y 160 mg/0,8 mL (conteniendo 15 200 UI anti-Xa) para uso SC.
Dalteparina sódica (Fragmin®): jeringa prellenada con 2 000 ó 5 000 UI anti-Xa en 0,2 mL, en dosis única y frasco vial con 10 000 UI anti-Xa en 1 mL para uso SC.
Las ventajas de las HBPM son:
Gran actividad anti-Xa y débil acción frente a la trombina, lo que se traduce en un gran efecto antitrombótico y un débil efecto anticoagulante.
Menos riesgo de hemorragia (menor efecto sobre el factor IIa).
Menor incidencia de trombocitopenia (menor efecto sobre el factor IV plaquetario).
Mejor biodisponibilidad y prolongada vida media (lo que permite 1 ó 2 dosis SC/día).
Menor incidencia de osteoporosis.
Prácticamente no requieren controles biológicos.
Son más efectivas que la HE en la prevención del tromboembolismo venoso recurrente.
Amplio uso en cirugía general, ortopedia y ginecología.
Se asocian con una baja rata de mortalidad (grupo de pacientes con cáncer).
La administración ambulatoria (hogar) disminuye los costos de la hospitalización.
Fácil aplicación, lo que mejora la tolerancia y la obediencia.16,17,18,19,20,21
La revisión de la experiencia publicada con relación al uso de las HBPM en obstetricia y ginecología revela que:
Son eficaces, seguras y para muchos las drogas de elección, en la tromboprofilaxis y tratamiento durante el embarazo, trabajo de parto, parto y puerperio.
Son ideales en la tromboprofilaxis y tratamiento en la cirugía ginecológica.
No atraviesan la barrera placentaria en ningún trimestre.
No producen efectos teratogénicos ni mutagénicos.17,18,20,22,23,24,25,26,27
La warfarina actúa impidiendo que la vitamina K intervenga en el hígado en la gammacarboxilación de los residuos terminales de ácido glutámico de la protrombina, de los factores VII, IX y X, y de las proteínas C y S. Los cumarínicos bloquean la acción de una reductasa que transforma la vitamina K1 epóxido (inactivo) en una forma hidroquinona (activa) en los microsomas hepáticos. El inicio del efecto depende de la vida media de los factores: los primeros en ser inhibidos son la proteína C y el factor VII, completándose la inhibición de los otros factores 48 a 72 horas más tarde. En resumen, los cumarínicos afectan la síntesis de los factores de coagulación vitamina K dependientes.18,28,29
Los anticoagulantes orales (AO) cruzan la barrera placentaria, por tanto durante la sexta a la décima segunda semanas de gestación pueden producir la embriopatía warfarínica caracterizada por hipoplasia del cartílago nasal, alteraciones óseas (condrodisplasia punteada), alteraciones oftalmológicas y RCIU. No tienen efectos fetopáticos cuando se administran en las primeras seis semanas de gestación. En el segundo y tercer trimestres pueden producir alteraciones a nivel del SNC como: agenesia del cuerpo calloso y del cerebelo, atrofia óptica y cerebral. Después de las 36 semanas de gestación se asocian con hemorragias fetales intracraneanas y retroplacentarias.29,30
El ácido acetilsalicílico es un antagonista de la función plaquetaria utilizado con el fin de preve nir trombosis. Impide la producción de tromboxano A2 mediante acetilación irreversible de la ciclooxigenasa. Debido a que las plaquetas no sintetizan proteínas nuevas, el efecto de el ácido acetilsalicílico en la ciclooxigenasa plaquetaria es permanente y dura toda la vida de la plaqueta (siete a diez días); con dosis de 160 mg/día, se logra inactivación de la ciclooxigenasa. Muchos estudios indican que el ácido acetilsalicílico, como antitrombótico, tiene eficacia máxima en dosis de 160 a 320 mg/día.8,30,31
Indicaciones de la terapia anticoagulante y/o de antiagregación plaquetaria durante el embarazo8,31,32
1. Prevención y tratamiento del TEV
- Antecedente de ETE en gestaciones previas.
- Episodio tromboembólico agudo durante el embarazo.
2. Prevención y tratamiento del tromboembolismo sistémico en mujeres con válvulas cardíacas mecánicas (VCM).
3. Frecuentemente, en combinación con ácido acetilsalicílico:
- Para la prevención de la pérdida gestacional en mujeres con SAAF.
- Trombofilias y pérdidas gestacionales previas.
4. Lupus eritematoso sistémico (LES) con o sin anticuerpos antifosfolípidos.
5. Otras indicaciones cardiológicas:
- Prevención del tromboembolismo sistémico en el contexto de la fibrilación auricular aislada, fibrilación auricular con o sin valvulopatía reumática, portadores de válvulas cardíacas biológicas y en la miocardiopatía dilatada.
- Terapia antitrombótica en la enfermedad coronaria (angina inestable e infarto agudo del miocardio) y en el intervencionismo coronamrio.
Complicaciones fetales
La terapia materna anticoagulante presenta dos complicaciones fetales potenciales: teratogenicidad y hemorragia. Las heparinas no atraviesan la barrera placentaria, y aunque es posible la hemorragia en la unión uteroplacentaria, la terapia es segura para el feto. Es probable que los AO sean seguros en las primeras seis semanas de gestación, y existe riesgo de embriopatía entre las seis y 12 semanas, pero el riesgo para el feto depende de la dosis. Los AO causan un efecto anticoagulante en el feto, lo cual es particularmente preocupante en el momento del parto, cuando la combinación de dicho efecto anticoagulante y el trauma obstétrico, pueden conducir a hemorragias severas en el neonato.
Complicaciones maternas
En la madre, los anticoagulantes pueden producir:
- Hemorragia: en un estudio de cohortes, la rata de hemorragia importante en pacientes tratadas con HE fue de 2%. Las hemorragias son poco frecuentes con las HBPM. Se recomienda descontinuar las heparinas antes de la inducción del trabajo de parto.8
- De las mujeres no gestantes que reciben HE, 3% desarrollan trombocitopenia severa de mediación inmune, la cual aparece en los primeros siete a diez días y es debida al desarrollo de anticuerpos contra el complejo heparina-plaquetas. Ésta debe diferenciarse de una trombocitopenia benigna, temprana y transitoria que puede suceder con la iniciación de la HE. En pacientes embarazadas que desarrollan trombocitopenia inducida por la heparina (TIH) y que requieren el uso de terapia anticoagulante continua, el uso del heparinoide danaparoid sódico es recomendado debido a que es un agente antitrombótico efectivo, que tiene mucho menos reactividad cruzada con la HE y, por tanto, es menos probable que produzca TIH recurrente que las HBPM.8
- Osteoporosis: en general, las fracturas vertebrales sintomáticas son reportadas en cerca de 2% a 3% de las pacientes, y la reducción significativa en la densidad ósea se presenta en más de 30% de las pacientes que reciben HE a largo plazo. Las HBPM tienen un riesgo mucho menor de osteoporosis.
La HE y las HBPM no se excretan por la leche materna y pueden ser administradas con seguridad a las madres que amamantan. El uso de AO en mujeres que requieren anticoagulación posparto es seguro y estas mujeres deben ser motivadas para la lactancia.
Las complicaciones potenciales de el ácido acetilsalicílico durante la gestación incluyen defectos del nacimiento y hemorragia en el neonato y en la madre. Dosis bajas de 60 a 150 mg/día administradas durante el segundo y tercer trimestre parecen ser seguras.8
TRATAMIENTO DE LA ETE
Actualmente las HBPM, o en su defecto la HE, son consideradas los anticoagulantes de elección para la prevención y el tratamiento del TEV durante la gestación; los AO están indicados únicamente en las mujeres embarazadas con VCM. La vía intrínseca de la coagulación se mide por el tiempo parcial de tromboplastina activado (TPTA) y es modificada fundamentalmente por la administración de heparina. Por otro lado, la función de la vía extrínseca se mide por el tiempo de protrombina (TP) o el INR, y es modificada más bien por la terapia con warfarina.1
Descripción de regímenes utilizados8,32
1. Profilaxis con HBPM:
- Enoxaparina sódica (Clexane®) 40 mg/día (4 000 UI anti-Xa) vía SC, o - Nadroparina cálcica (Fraxiparine®) 30 mg/día (0,3 mL) vía SC, o
- Dalteparina sódica (Fragmin®) 5 000 UI anti-Xa/día vía SC.
2. Profilaxis con HE:
- Menos de 12 semanas: 5 000 UI c/12 horas vía SC
- 13 - 29 semanas: 7 000 UI c/12 horas vía SC
- 30 o más semanas: 10 000 UI c/12 horas vía SC
3. Anticoagulación con HBPM:
- Enoxaparina: 1 mg/kg (100 UI anti-Xa/kg) c/12 horas o 1,5 mg/kg/24 horas vía SC o
- Nadroparina: 0,1 mL/10 kg (1 mg/kg). Cada 0,1 mL = 950 UI anti-Xa. También;
- Fraxiparine Tx: 0,6 mL = 120 mg o 0,8 mL = 160 mg c/24 horas vía SC, o
- Dalteparina: 100 UI anti-Xa/kg c/12 horas o 200 UI anti-Xa/kg c/24 horas vía SC.
4. Anticoagulación con HE:
- Dosis inicial: 5 000 a 15 000 UI (según se trate de una TVP o un EP).
- Sostenimiento: 1 000 a 1 600 UI/hora en infusión venosa continua.
5. Ácido acetilsalicílico (ASA): 60 a 150 mg/día (promedio de 100 mg/día), como antiagregante 160 a 320 mg/día, como antitrombótico.
6. Anticoagulación posparto: AO durante cuatro a 12 semanas, iniciándolos conjuntamente con HBPM o HE, hasta que el INR sea mayor o igual a dos, tiempo en el cual se suspende la HBPM o la HE.
7. Vigilancia: control clínico e investigación agresiva de mujeres con síntomas sospechosos de TVP o EP.
8. Medidas mecánicas: la utilización de medias de gradientes de presión y la deambulación precoz, han demostrado una prevención efectiva y económica de la ETE. Tales conductas previenen la estasis venosa y activan el sistema fibrinolítico.
Trombosis venosa profunda (TVP)
El tratamiento persigue: prevenir su progreso, prevenir el desarrollo de EP, disminuir el edema y el dolor y evitar el desarrollo del síndrome posflebítico. Para lograr lo anterior se deben adoptar las siguientes medidas:
- Exámenes básicos: hematocrito - hemoglobina, plaquetas cada tres días, TPTA.
- Reposo absoluto con elevación de la extremidad, evitando angulaciones de la misma (la deambulación se permite cinco a siete días después, siempre y cuando no exista dolor importante).
- Paquetes tibios en el trayecto de las venas afectadas.
- Vendaje elástico compresivo, cuando la paciente lo tolere.
- Anticoagulación con HBPM: la droga más usada para el tratamiento de la TVP, con o sin EP durante el embarazo, es la enoxaparina sódica; también se pueden usar la nadroparina cálcica o la dalteparina sódica (dosis antes mencionadas). La duración del tratamiento debe ser de diez días; luego se continúa con la droga seleccionada, a dosis de anticoagulación, en forma ambulatoria durante toda la gestación, debido a que la aparición de un episodio trombótico durante los primeros tres a seis meses del embarazo se acompaña de una recidiva aguda de 30%.8,32,33,34,35,36
Control biológico: medición de la actividad anti-Xa, preferiblemente por el método amidolítico. La toma de la muestra se hace el 2º día del tratamiento, entre la 3ª y 4ª hora posinyección. El rango terapéutico se sitúa entre 0,5 y 1 UI anti-Xa/mL. En caso de sobredosificación, los efectos anticoagulantes pueden neutralizarse mediante la inyección intravenosa lenta de protamina; en general, 1 mg de protamina inhibe el efecto de 100 UI anti-Xa.
Si no se cuenta con HBPM, se debe iniciar HE, la cual previene la extensión del trombo ya formado y ayuda a que los mecanismos fibrinolíticos participen en la digestión de éste. Además, las heparinas son antiinflamatorias y disminuyen la degranulación de los mastocitos y la liberación de serotonina. La dosis inicial es de 5 000 UI, seguida de 1 000 a 1 600 UI/hora en infusión venosa continua. Se debe realizar control de TPTA cada cuatro horas, hasta llevarlo a 1,5 a 2,5 veces el control inicial; una vez ajustado, se realiza cada cuatro horas el primer día y luego diario.12,13
Es importante reconocer que durante la gestación la respuesta del TPTA a la HE está frecuentemente atenuada debido al incremento del factor VIII y del fibrinógeno.8 En este caso sería recomendable el control con tiempo de trombina (rango dos veces el valor normal). El tratamiento debe durar igualmente diez días, seguido de HE por vía SC a dosis de anticoagulación (10 000 a 12 000 UI c/12 horas), manteniendo el TPTA o el tiempo de trombina en los rangos anotados, sobre todo en el tercer trimestre, época en que es más probable la recurrencia.32,33
En casos en que se use la warfarina (Coumadin®): simultáneamente con la heparina se inicia la warfarina a razón de 5 mg/día; no es necesario administrar dosis de carga. A las 48 horas del inicio la warfarina se solicita TP diario para ajustar la dosis de la droga, hasta cuando el TP esté en el rango de 1,3 a 1,6 (valores por encima de 2, sólo incrementan el sangrado) o el INR esté entre 2 y 3 (INR es igual a la relación del TP observado con respecto a un control o TP de referencia, que se obtiene usando una tromboplastina suministrada por la OMS), tiempo en el cual se suspende la heparina. Luego el TP o INR se solicitan una o dos veces por semana.
La severidad del episodio trombótico, su evolución durante el tratamiento y su causa, son importantes para determinar la duración del tratamiento; éste varía entre más o menos cuatro y 12 semanas (en caso de compromiso íleofemoral o poplíteo, siempre debe ser de 12 semanas). Experimentalmente se ha visto que la endotelización del coágulo ocurre entre siete y diez días y que la adhesión a la pared del vaso dura de una a dos semanas. Además, hay 4% de recurrencias dentro de los primeros nueve meses del episodio agudo. En pacientes con deficiencia de AT-III, proteína C o S y en casos de TVP recurrente, el tratamiento se mantiene indefinidamente.32,37,38
Embolismo pulmonar (EP)
Se debe instaurar tratamiento precoz. Si se produce paro cardíaco, realizar masaje externo intenso, lo que permite a veces fragmentar y desplazar el émbolo. Se debe administrar oxígeno y tratar la hipotensión con dopamina (2 a 10 µg/kg/minuto) o dobutamina. Si persiste la hipotensión se debe iniciar terapia fibrinolítica y, si no se obtiene mejoría, se debe realizar embolectomía.
Anticoagulación: administrar HBPM a dosis vistas para el manejo de la TVP. Si se va a utilizar HE, se inicia una dosis de carga de 10 000 a 15 000 UI y luego se continúa en la misma forma utilizada para la TVP. La duración del tratamiento es de tres a seis meses, recurriendo a la interrupción de la vena cava inferior en casos en que la anticoagulación esté contraindicada o cuando a pesar de ésta, el tromboembolismo persista en forma activa.12,13,32
Válvulas cardíacas mecánicas
La anticoagulación en mujeres embarazadas con VCM es polémica. Tradicionalmente se han utilizado los siguientes esquemas:8,39,40
- HE durante todo el embarazo.
- HE durante el primer trimestre, AO durante el segundo y tercer trimestre, y HE al término.
- AO durante todo el embarazo y HE al término del mismo.
Actualmente en Estados Unidos se realizan más de 60 000 reemplazos valvulares por año, lo que implica mayor presentación de embarazos con prótesis valvulares mecánicas. Las bioprótesis se han considerado clásicamente como las válvulas de elección en las pacientes en edad reproductiva que planean embarazarse. Los AO utilizados por pacientes con VCM se han relacionado con embriopatía, parto pretérmino, pérdida fetal y hemorragia materno-fetal; por este motivo, han sido desaconsejados durante la gestación. El riesgo de embriopatía depende de la dosis y está presente durante todo el embarazo, variando su prevalencia entre 4% y 7,9%.40,41 Si se utiliza HE durante el primer trimestre, la prevalencia se reduce a 3,4%. El uso de HE durante el primer trimestre evita la embriopatía, pero expone a la mujer a un mayor riesgo de trombosis y, por tanto, de morbimortalidad materna, ya que esta patología es una urgencia cardiovascular posiblemente catastrófica.
La prevalencia de abortos y de muertes fetales es alta y similar con los dos esquemas. Cuando se usan AO durante toda la gestación, la hemorragia materna es de 2,5% y las dos cuartas partes ocurre en el periodo periparto.39
Las válvulas biológicas presentan deterioro importante, y en mujeres gestantes 33% requieren recambio entre los siete y 12 meses posparto, debido a las condiciones hemodinámicas del embarazo y al alto recambio de calcio durante el mismo y durante la juventud (40,42). Igualmente, el recambio valvular aumenta la morbimortalidad; en estas pacientes existe un alto riesgo de eventos tromboembólicos, cuya incidencia varía de 10% a 15%, con mortalidad materna del 40%.43
Sin embargo, actualmente hay suficiente evidencia que sustenta el uso de AO durante toda la gestación con riesgos mínimos. Las pacientes con válvulas cardíacas protésicas tienen mayor riesgo de trombosis valvular y de eventos tromboembólicos arteriales, por lo cual requieren una adecuada anticoagulación con warfarina y con antiagregación plaquetaria con bajas dosis de ASA para disminuirlo.8,44
No hay estudios controlados que demuestren la utilidad de las HBPM en la prevención de fenómenos trombóticos en VCM; igualmente, las HBPM y la HE no han demostrado ser superiores a los AO en la prevención de la trombosis valvular y eventos tromboembólicos sistémicos(39,40,45). La mayoría de las trombosis de VCM y de fenómenos tromboembólicos asociados con éstas ocurren con el uso de HE (39,40,46). ¿Vale la pena, entonces, someter a las mujeres en edad reproductiva a este mayor riesgo?
Por último, al escoger el régimen adecuado de anticoagulación en la embarazada con VCM, se deben considerar los riesgos materno-fetales; igualmente se debe explicar a la pareja las posibles complicaciones de cada régimen. En el servicio de ARO del Hospital Universitario San Vicente de Paul, Departamento de Obstetricia y Ginecología de la Universidad de Antioquia, el régimen de elección consiste en administrar warfarina durante todo el embarazo en dosis menores de 5 mg/día, asociados o no a dosis bajas de ASA. Si la paciente no acepta el riesgo inherente al uso del coumadín, se utiliza cualquiera de los dos siguientes esquemas:
1. Sustituir el coumadín por HE en infusión intravenosa continua entre las semanas seis y doce y a partir de la semana 38, o
2. HE por vía SC o intravenosa en dosis de anticoagulación durante todo el embarazo; esta última opción no sólo tiene los inconvenientes señalados, sino el alto costo.
La administración de AO se evalúa con controles seriados de INR, el cual debe mantenerse entre 2,5 y 3,5 para reemplazos valvulares mitrales y entre 1,5 y 2,5 para los aórticos, en lo posible asociados a 100 mg de ASA (8). La HE debe utilizarse a dosis entre 35 000 y 40 000 UI/día en infusión intravenosa continua, controlada con TPTA de 2 a 2,5 veces el control, con la paciente hospitalizada. La gestante se cita por consulta de ARO cada 15 días los dos primeros trimestres y cada semana durante el último trimestre. Se solicita ecocardiografía transtorácica o transesofágica cada tres meses, con el fin de establecer rápidamente el diagnóstico de disfunción valvular.
La paciente se cita para una nueva hospitalización a la semana 38 (o antes en caso de trabajo de parto pretérmino), con el fin de sustituir el warfina por HE intravenosa a las dosis mencionadas. Debido a que hay un mayor riesgo de trombosis si se deja a la paciente durante mucho tiempo sin warfarina, la HE se mantiene durante dos días, y luego la paciente es llevada a una cesárea electiva atraumática, con el fin de disminuir la hemorragia intracraneana, previa suspensión de la HE seis horas antes. A las seis horas poscesárea se reinician la HE y, la warfarina, solicitando TPTA a las seis horas del inicio de la HE y control de INR a las 72 horas del inicio de la warfarina, a fin de lograr los valores adecuados para el alta con warfarina.
En caso de parto vaginal, la incidencia de hemorragia intracraneana será menor en los hijos de multíparas, con partos fáciles, de término, con cráneo bien osificado, sin moldeamiento y sin sufrimiento fetal(47). Los AO no están contraindicados en la lactancia.8,48
En caso de trombosis valvular, se debe administrar HE intravenosa en dosis de anticoagulación, siempre y cuando el trombo sea menor de 5 mm y no produzca obstrucción. Si, por el contrario, es mayor de 5 mm, se acompaña de mayor morbimortalidad y se aconseja reemplazo valvular. En pacientes inestables con riesgo quirúrgico alto, se puede administrar fibrinólisis, la cual es efectiva en 70% de los casos con una mortalidad asociada del 10% y un riesgo de embolismo de 19%, siendo más efectiva en trombosis valvular aórtica y en pacientes con una evolución de los síntomas menor a dos semanas.49
Anticoagulación y parto. La pérdida de sangre por los efectos de la heparina en el momento del parto depende de las siguientes variables: dosis, vía y tiempo de administración; de la magnitud de las incisiones y laceraciones existentes; la calidad de la retracción uterina e intensidad de las contracciones (una vez expulsados el feto y la placenta) y existencia de otros defectos de la coagulación.6
Igualmente, la pérdida de sangre en los casos de parto vaginal no aumenta de manera importante si la episiotomía no es muy profunda o no se hace, si no hay desgarros en el canal blando del parto y si hay una buena y precoz contracción uterina. En general, debe suspenderse el tratamiento con heparina durante el trabajo de parto y en el parto. Si el TPTA es mayor de 60 segundos durante el expulsivo, se utilizará protamina para disminuir el sangrado. Si se proyecta colocar anestesia conductiva, se aplica la dosis por vía SC al inicio del trabajo de parto y antes de colocar el catéter se comprueba que el TPTA esté normal o cerca. La dosis siguiente de heparina se coloca una vez retirado el catéter.
Si la paciente recibe coumadín, las fuerzas del parto pueden inducir una grave hemorragia en el feto; por tanto, se debe administrar vitamina K1 IV lenta, a la dosis de 10 mg. Los niveles de los factores de coagulación vitamina K dependientes aumentarán a un nivel seguro en unas ocho horas en la madre y menos rápidamente en el feto.
Anticoagulación y puerperio. Lo antes posible en el posparto (seis horas), la paciente debe recibir la siguiente dosis de HBPM o de HE vía SC, ya que rápidamente logran un nivel terapéutico en plasma. La dosis será de 5 000 UI cada 12 horas por vía SC para la HE o las dosis antes anotadas para las HBPM. La warfarina se inicia concomitantemente con la heparina. Se aconsejan como profilácticas las medias elásticas hechas a la medida que lleguen hasta la cintura; luego hasta la rodilla, de por vida.
Anticoagulación y aborto. El tratamiento de la TVP con heparina no impide la terminación de la gestación con un legrado cuidadoso. La heparina se administra al final de la intervención.
En caso de cesárea. Es probable que ocurra una hemorragia grave cuando se administra HE a dosis terapéuticas a una mujer que ha sido sometida a una cesárea en las 48 ó 72 horas previas. Los defectos preexistentes del mecanismo hemostático, como una trombocitopenia o una alteración de la función plaquetaria como la inducida por ASA, aumentarán la probabilidad de una hemorragia con la HE. La mujer con EP reciente, que requiere cesárea, representa un grave problema, ya que la reversión de la anticoagulación puede ser seguida de otra embolia, y mientras la paciente está completamente anticoagulada, la cirugía con frecuencia da como resultado una hemorragia potencialmente letal o hematomas problemáticos. La cesárea y la ligadura de la vena cava inferior y de la vena ovárica izquierda mejorarán su pronóstico.6
Terapia trombolítica
Los agentes fibrinolíticos son drogas que pueden disolver un trombo preformado de fibrina dentro de un vaso sanguíneo. Son útiles en el tratamiento de la TVP proximal y del EP, cuando se aplican en los primeros cinco días de aparición de los síntomas. Son costosos y sólo deben ser aplicados por personal experto en su manejo. Tradicionalmente, el embarazo, el trabajo de parto y los primeros diez días del puerperio han sido considerados una contraindicación relativa para su uso, debido al riesgo materno-fetal de complicaciones hemorrágicas.12,18
Entre 1961 y 1995, fueron publicados 36 reportes describiendo su uso durante la gestación. En una revisión de la literatura mundial, 172 mujeres afectadas por eventos tromboembólicos fueron tratadas con trombolíticos. La rata de mortalidad materna fue de 1,2%; se presentaron pérdidas gestacionales en 5,8 % de los casos y las complicaciones hemorrágicas se presentaron en 8,1 % de las gestantes (más alta que la cifra de 2% reportada con dosis completas de HE subcutánea).
Este riesgo puede minimizarse, aplazando la terapia durante el periodo intraparto y restringiendo la administración simultánea de la HE con la terapia fibrinolítica. No deben usarse antes de las 14 semanas de gestación debido al riesgo teórico de interferencia con la implantación placentaria, debido a fibrinolisis de la capa de fibrina entre las vellosidades coriales y el miometrio. En resumen, pueden ser usados durante el embarazo en situaciones apropiadas con aparente relativa seguridad. Hasta que haya estudios controlados disponibles, la terapia fibrinolítica debe ser usada únicamente si otras terapias más tradicionales son inadecuadas o están contraindicadas.50
Las dosis son: para la estreptocinasa, 250 000 U (2,5 mg) en infusión durante 30 minutos, seguidas de 100 000 U por hora durante 48 a 72 horas. Para la uroquinasa, 1 000 a 4 400 U/kg de peso en infusión durante 15 minutos, seguidos de 4 400 U/kg por periodos variables. Para el t-PA (activador tisular del plasminógeno) el régimen que hoy se recomienda (acelerado) para trombolisis coronaria consiste en una inyección intravenosa rápida de 15 mg, seguida de 0,75 mg/kg durante 30 minutos (sin exceder de 50 mg), y 0,5 mg/kg (hasta una dosis acumulada de 35 mg) durante la hora siguiente (30). La principal complicación es la hemorragia. Cuando hay necesidad de neutralizar urgentemente la fibrinólisis, algunos utilizan el ácido épsilon aminocaproico (100 mg/kg de peso) o el ácido transnesánico (10 mg/kg de peso).
El control de su uso se debe hacer con: fibrinógeno, TP, TPTA, tiempo de trombina y tiempo de lisis total de euglobulinas (previamente y durante la infusión).12,18,30
Trombosis venosa pélvica
Diferentes tratamientos médicos y quirúrgicos se han utilizado en la trombosis venosa pélvica, pero ninguno de estos esquemas representa investigaciones controladas y prospectivas. Como se vio, la trombosis venosa pélvica incluye dos síndromes clínicos: TAVO y fiebre enigmática.
Basados en datos retrospectivos, es posible establecer ciertos principios generales para el manejo de la trombosis venosa pélvica, así:
La administración de HBPM o de HE en dosis de anticoagulación (esquema antes visto por vía SC para las HBPM o en infusión IV continua para la HE) durante diez días, seguido de warfarina por tres meses en el caso de la TAVO y de antibióticos de amplio espectro, debe ser el primer paso en el manejo.
La laparotomía exploradora (LE) está indicada cuando el diagnóstico es dudoso o cuando la paciente no responde al tratamiento médico. Varios reportes informan de LE por posible ruptura apendicular, absceso pélvico o torsión de ovario, encontrándose únicamente un trombo extenso en una o ambas venas ováricas. Estas pacientes se cerraron y se inició terapia con heparina, con recuperación completa.
La controversia que no ha sido resuelta aún, es qué procedimiento se debe realizar en las pacientes que no responden al tratamiento médico. Se han propuesto:
Ligadura bilateral de venas ováricas y de VCI.
Ligadura unilateral de una vena con o sin ligadura de VCI.
Escisión de vena infectada con o sin ligadura de la vena contralateral y de la VCI.
Brown y Munsick proponen ligadura de venas infectadas y ligadura de VCI únicamente cuando el trombo de una vena se extiende dentro de los grandes vasos. También se debe realizar ligadura de VCI en caso de embolia pulmonar recidivante (procedente de miembros inferiores o de pelvis) y en quienes no responden a más medidas conservadoras quirúrgicas.
El sitio de la ligadura debe ser por debajo del nivel de las venas renales, pero por encima de la entrada de la vena ovárica derecha, además de la ligadura de la vena ovárica izquierda por debajo de su entrada en la vena renal izquierda. Se han utilizado también con buenos resultados, la inserción de un filtro en el interior de la VCI o la aplicación de grapas serradas de teflón.6
Teóricamente las venas infectadas representan un absceso localizado y, por tanto, se debería hacer su escisión. No obstante, Maull y Robinson demuestran que la disección y escisión de la vena ovárica pueden ser extremadamente difíciles, debido a la marcada inflamación y edema. Por tanto, la ligadura de los vasos afectados más la anticoagulación son suficientes para prevenir la propagación de los trombos y émbolos sépticos recurrentes; la antibioticoterapia y las defensas del huésped deben resolver la infección perivascular localizada.
MANEJO DE ALGUNAS SITUACIONES ESPECIALES EN ARO
Manejo de pacientes embarazadas con riesgo aumentado para TEV: 8,30,32,38
1. Episodio único previo de TEV asociado con un factor de riesgo transitorio (sin factores de riesgo corrientes adicionales, tales como obesidad mórbida o reposo estricto en cama).
- Episodio mayor de un año: vigilancia.
- Episodio reciente: profilaxis con HBPM preferiblemente, o con HE durante todo el embarazo, parto y puerperio.
2. Episodio único de TEV idiopático, en pacientes que no reciben terapia anticoagulante a largo plazo.
- Profilaxis con HBPM o HE durante toda la gestación parto y puerperio.
3. Episodio único de TEV y trombofilia (confirmada por laboratorio), en pacientes que no reciben terapia anticoagulante a largo plazo.
- Anticoagulación con HBPM o HE durante todo el embarazo, parto y puerperio
4. Trombofilia (confirmada por laboratorio) y no TEV previo: la indicación para profilaxis enérgica, es más fuerte para deficiencia de Antitrombina III que para otras trombofilias.
- Presencia de factor V Leiden, gen de la protrombina: vigilancia.
- Deficiencia de antitrombina III, proteína C, proteína S: profilaxis con HBPM o HE durante toda la gestación, parto y puerperio.
5. Múltiples episodios de TEV (más de dos) y/o mujeres recibiendo terapia anticoagulante a largo plazo (ejemplo: episodio único de TEV, idiopático o asociado a trombofilia).
- Anticoagulación con HBPM o HE durante toda la gestación, seguida de la reanudación de la terapia anticoagulante en el posparto.
6. Pacientes con LES.
- No trombosis previa y anticuerpos antifosfolípidos negativos: vigilancia.
- No trombosis previa y anticuerpos antifosfolípidos positivos: profilaxis con HBPM o HE en el periodo anteparto.
- Con antecedentes de TEV y anticuerpos antifosfolípidos positivos: anticoagulación durante la gestación, parto y puerperio. Luego, indefinidamente.
Manejo de la mujer embarazada con riesgo incrementado para pérdida fetal.
1. Mujeres con pérdida gestacional recurrente (tres o más abortos), deben ser tamizadas para SAAF. Si las pérdidas incluyen uno o más abortos del segundo trimestre, se debe realizar igualmente una tamización para trombofilias congénitas. Las mujeres con preeclampsia severa o recurrente previa, RCIU, DPP o muerte intrauterina inexplicada deben ser tamizadas para trombofilias congénitas y SAAF.
2. Pacientes embarazadas con SAAF y una historia de múltiples pérdidas gestacionales tempranas (dos o más), o pérdidas gestacionales tardías (una o más), o preeclampsia, RCIU o DPP; deben recibir profilaxis con HBPM o HE más ASA en el periodo anteparto.
3. Mujeres homocigotas para la variante termolábil (C677T) de la metilentetrahidrofolato reductasa: deben ser tratadas con suplementos de ácido fólico y/o vitamina B6, previa a la concepción o, si ya están embarazadas, tan pronto como sea posible, para disminuir los niveles de homocisteinemia.
4. Mujeres con un déficit trombofílico y aborto recurrente, pérdida del segundo trimestre o tardía, o preeclampsia, RCIU o DPP, deben recibir profilaxis con HBPM o HE más ASA durante la gestación. El consenso americano administra anticoagulantes posparto a estas pacientes.
5. Pacientes con SAAF y una historia de TEV, que estén recibiendo terapia anticoagulante oral a largo plazo debido al alto riesgo de recurrencia; deben recibir anticoagulación con HBPM o HE durante el embarazo. En el puerperio se reasumirán los anticoagulantes orales indefinidamente.
6. Pacientes con SAAF y sin TEV previo ni pérdida fetal, deben ser consideradas de riesgo para TEV y quizás para pérdida fetal. De ahí, que deban recibir profilaxis con HBPM, HE o ASA.
REFERENCIAS BIBLIOGRÁFICAS
1. Rigby FB, Nolan TE. Coagulopatías hereditarias en el embarazo. Clin Obstet y Ginecol 1995; 3:475-490. [ Links ]
2. Duff P, Gibbs RS. Pelvic vein thrombophlebitis: diagnostic dilemma and therapeutic challenge. Obstet Gynecol Surv 1983; 38(6):365-373. [ Links ]
3. Rutherford SE, Phelan JP. Thromboembolic disease in pregnancy. Clin Perinatol 1986;13(4):719-739. [ Links ]
4. Schafer AI. The hypercoagulable states. Annals of Internal Medicine 1985; 102 (6):814-828. [ Links ]
5. Munsick RA, Gillanders LA. A review of the syndrome of puerperal ovarian vein thrombophlebitis. Obstet Gynecol Surv 1981; 36(2):57-66. [ Links ]
6. Enfermedades pulmonares. Enfermedad tromboembólica. En: Hankins DV, Clark SI, Williams. Obstetricia. 20a ed. Buenos Aires: Editorial Médica Panamericana; 1998. p. 1025-1044. [ Links ]
7. Hellgren M, Svensson PJ, Dahlback B. Resistance to activated protein C as a basis for venous thromboembolism associated with pregnancy and oral contraceptives. Am J Obstet Gynecol 1995; 173:210. [ Links ]
8. Ginsberg JS, Greer I, Hirsh J. Use of antithrombotic agents during pregnancy. Chest Supplement 2001; 119(1):122S-131S. [ Links ]
9. Greer FA. Thrombosis in pregnancy: maternal and fetal issues. Lancet 1999; 353:1258-1265. [ Links ]
10. Sanson BJ, Friederich PW, Simioni P, et al. The risk of abortion and stillbirth in antithrombin, protein C and protein S deficient women. Thromb Haemost 1996; 75: 387-388. [ Links ]
11. Alteraciones hematológicas durante el embarazo. Trastornos de la coagulación. En: Arias F. Guía práctica para el embarazo y el parto de alto riesgo. 2a ed. Madrid: Ed. Mosby Doyma Libros; 1994. p. 260-266. [ Links ]
12. Tobón Acosta LI. Enfermedad tromboembólica venosa. En: Actualización en medicina interna. 1a ed. Medellín: Editorial Universidad de Antioquia; mayo 1991. p. 229-239. [ Links ]
13. Gómez LF. Tromboembolismo venoso. En: Actualización en medicina interna. 1a ed. Medellín: Editorial Universidad de Antioquia; julio 1996. p. 68-74. [ Links ]
14. Tobón LI. Métodos no invasores en las enfermedades vasculares periféricas. En: Actualización en medicina interna. 1a ed. Medellín; Editorial Universidad de Antioquia: agosto 1998. p. 34-43. [ Links ]
15. Hirsh J, Warkentin E, Shaughnessy SG, et al. Heparin and low molecular weight heparin. Mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest Suppl 2001;119(1):64S-94S. [ Links ]
16. Hirsh J, Levine MN. Low molecular weight heparin. Blood 1992;79(1):1-17. [ Links ]
17. Fejgin MD, Lourwood DL. Low molecular weight heparins and their use in obstetrics and gynecology. Obstet Gynecol Surv 1994;49(6):424-431. [ Links ]
18. Sistema sanguíneo. En: Isaza CA, Isaza G, Fuentes J, Marulanda T. Fundamentos de farmacología en terapéutica. 3a ed. Pereira: Ed. Postergraph; 1996: p. 439-461. [ Links ]
19. Siragusa S, Cosmi B, Piovella F, Hirsh J, et al. Low molecular weight heparins and unfractionated heparin in the treatment of patients with acute venous thromboembolism: results of a meta_analysis. Am J Med 1996; 100(3):269-277. [ Links ]
20. Gillis S, Shushan A, Eldor A. Use of low molecular weight heparin for prophylaxis and treatment of thromboembolism in pregnancy. Int J Gynecol Obstet 1992; 39:297-301. [ Links ]
21. Levine M, Gent M, Hirsh J, Leclerc J, et al. A comparison of low molecular weight heparin. Administered primarily at home with unfractionated heparin administered in the hospital for proximal deep - vein thrombosis. N Eng J Med 1996;334(11):677-681. [ Links ]
22. Nelson-Piercy C. Low molecular weight heparin for obstetric thromboprophylaxis. Br J Obstet Gyn 1994;101(1):6-8. [ Links ]
23. Dulitzki M, Pauzner R, Laugevitz P, Pras M, et al. Low molecular weight heparin during pregnancy and delivery: preliminar experience with 41 pregnancies. Obstet Gynecol 1996; 87(3):380-383. [ Links ]
24. Slunsky R. General perioperative prevention of thromboembolism in gynecology with low molecular weight heparin: clinical experiences with enoxaparin over 7 years. Zentralbl-Gynakol 1995;117(11):598-601. [ Links ]
25. Wessel N, Gerner T, Grogaard HK. Should oral contraceptives and postmenopausal hormonal substitution be withdrawn prior to surgery? A questionnaire study in departments of surgery and gynecology. Tidsskr-Nor-Laege-Foren 1995;115(8):935-937. [ Links ]
26. Shiozaki A, Arai T, Tzumi R, Niiva K, Sakuragawa N. Congenital antithrombin III deficient neonate treated with antithrombin III concentrates. Thromb Res 1993; 70(3):211-216. [ Links ]
27. Borstad E, Urdal K, Handeland G, Abildgaard U. Comparison of low molecular weight heparin vs unfractionated heparin in gynecological surgery II: reduced dose of low molecular weight heparin. Acta Obstet Gynecol Scand 1992;71(6):471-475. [ Links ]
28. Castillo Cofiño R, Ordinas Bauzá A, Reverter Calatayud JC y otros. Enfermedades de la hemostasia. En: Farreras P, Rozman C. Medicina Interna. 3a ed. Madrid: Ed. Mosby Doyma Libros; 1995:1770-1804. [ Links ]
29. Weiner CP. Coagulopatías obstétricas. Diagnóstico y tratamiento de la enfermedad tromboembólica durante el embarazo. Clin Obstet y Ginecol 1985;1:131-144. [ Links ]
30. Majerus PW, Broze GJ, Miletich JP y Tollefsen DM. Anticoagulantes, trombolíticos y antiplaquetarios. En: Goodman y Gilman. Las bases farmacológicas de la terapéutica. 9a ed. México: Mc Graw-Hill Interamericana; 1996; (II): p. 1423-1443. [ Links ]
31. Heras M, Fernández A, Gómez J, et al. Guías de actuación clínica de la Sociedad Española de Cardiología. Recomendaciones para el uso de tratamiento antitrombótico en cardiología. www.gtcv.org/guia.htm; visitado 25 de junio 2001:1-29. [ Links ]
32. Restrepo O. Enfermedad tromboembólica en obstetricia y ginecología. Rev Colomb Obstet Ginecol 1997;48(2):79-92. [ Links ]
33. Hull RD, Raskob GE, Rosenbloom D, et al. Treatment of proximal vein thrombosis with subcutaneous low molecular weight heparin vs. intravenous heparin. Arch Intern Med 1997;157:289-294. [ Links ]
34. Dolovich LR, Ginsberg JS, Douketis JD, et al. A meta-analysis comparing low molecular weight heparins with unfractionated heparin in the treatment of venous thromboembolism. Arch Intern Med 2000;160:181-188. [ Links ]
35. Hull RD, Raskob GE, Brant RF, et al. Low molecular weight heparin vs heparin in the treatment of patients with pulmonary embolism. Arch Intern Med 2000;160:229-236. [ Links ]
36. Charbonnier BA, Fiessinger JN, Banga JD, et al. Comparison of a once daily with a twice daily subcutaneous low molecular weight heparin regimen in the treatment of deep vein thrombosis. Thrombosis and Haemostasis 1998;79(5):897-901. [ Links ]
37. Ginsberg J, Hirsh J. Use of antithrombotic agents during pregnancy. Chest 1998;114(5):524S-530S. [ Links ]
38. Verstraete M, Prentice CR, Samama M, Verhaeghe R. A European view on the North American Fifth consensus on antithrombotic terapy. Chest 2000;117(6):1755-1770. [ Links ]
39. Chan WS. Anticoagulation of pregnant women with mechanical heart valves. A systematic review of the literature. Arch Intern Med 2000;160:191-196. [ Links ]
40. 40. Sbarouni E, Oakley C. Outcome of pregnancy in women with valve prostheses. Br Heart J 1994;71:196-201. [ Links ]
41. Hall JG, Pauli RP, Wilson KM. Maternal and fetal sequelae of anticoagulation during pregnancy. Am J Med 1980; 68:122-140. [ Links ]
42. Barbour LA. Current concepts of anticoagulation therapy in pregnancy. Obstet Gynecol Clin North Am 1997;24:499-510. [ Links ]
43. Martínez CV, Señor JM. Cardiopatía y embarazo. En: Señor JM. Manual de normas y procedimientos en cardiología. Medellín: Editorial Universidad de Antioquia; 2000. p. 282-296. [ Links ]
44. Massel D, Little SH. Risk and benefits of adding anti - platelet therapy to warfarin among patients with prosthetic heart valves: a meta-analysis. J Am Coll Cardiol 2001;37:569-578. [ Links ]
45. Tiede DJ. Modern management of prosthetic valve anticoagulation. Mayo Clin Proc 1998;73:665-680. [ Links ]
46. Iturbe-Alessio I, Fonseca MC, Mutchinik O, et al. Pregnant women with artificial Herat valves. N Engl J Med 1986;315:1390-1393. [ Links ]
47. Stewart KS, Philpott RH. Fetal response to cephalopelvic desproportion. Br J Obstet Gynecol 1980;87:641-649. [ Links ]
48. McKenna R, Cole ER, Vasan U. Is warfarin sodium contraindicated in the lactating mother? J Pediatr 1983;103:325-327. [ Links ]
49. Vongpatanasin W. Prosthetic Heart valves. N Engl J Med 1996;335:407-416. [ Links ]
50. Turrentine MA, Braems G, and Ramírez MM. Use of thrombolytics for the treatment of thromboembolic disease during pregnancy. Obstet Gynecol Surv 1995;50(7):534-541. [ Links ]














