Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.34 no.1 Bogotá Jan./Mar. 2009
(1)Internista Nefrólogo, Director Científico RTS Ltda. Sucursal Caldas, Profesor Asociado Universidad de Caldas. Manizales, Colombia.
(2) Enfermera Jefe RTS Ltda Sucursal Caldas, Manizales. Manizales, Colombia.
(3) Enfermera Jefe RTS Ltda Sucursal Caldas, Manizales. Manizales, Colombia.
Correspondencia. Dr. César A Restrepo V. RTS Ltda. Sucursal Caldas, Manizales-Caldas (Colombia, Sur América). Carrera 28 B No. 71ª56/ Teléfonos: 5768891022 y 5768871572. FAX: 5768876692. Manizales Caldas (Colombia, Sur América). E-mail: caugustorv@une.net.co
Recibido: 15/VI/08 Aceptado: 30/I/09
Resumen
La plasmaféresis es un procedimiento extracorpóreo, en el cual a partir de la sangre extraída del paciente se procede a separarla en sus componentes plasma y elementos celulares. Constituye una variedad de aféresis, y su objetivo principal es remover elementos específicos del plasma, los cuales se consideran que son mediadores de procesos patológicos. Existen dos métodos de plasmaféresis: plasmaféresis por centrifugación, el cual requiere de equipos complicados y de uso común en bancos de sangre, y plasmaféresis por filtración, la que se puede practicar también por equipos exclusivamente diseñados para ese propósito y que son de difícil obtención. La plasmaféresis por filtración con plasmafiltros adaptados a máquinas de hemodiálisis es un alternativa terapéutica de fácil utilización, bajo costo y con la posibilidad de ser practicada por el personal médico y paramédico que labora en unidades renales. Con base en nuestra experiencia de 16 años en la práctica de este procedimiento, presentamos nuestras recomendaciones de cómo llevar a cabo el procedimiento, detalles técnicos y acercamiento al manejo de las complicaciones que se presentan durante el mismo.
Palabras clave: plasmaféresis, aféresis, equipos de hemodiálisis, técnica, complicaciones.
Abstract
Plasmapheresis is an extracorporeal procedure by which the patient’s blood is separated into its components: plasma and cellular elements. It represents a variety of apheresis, and its main objective is to remove specific elements from plasma, which are considered mediators of pathological processes. There are 2 methods of plasmapheresis: plasmapheresis with centrifugation devices, which requires complicated equipment commonly used in blood banks, and plasmapheresis with highly permeable filter, which is also carried out in equipment exclusively designed for the purpose. This equipment is difficult to obtain. Plasmapheresis with highly permeable filters adapted to standard hemodialysis equipment is a simple, low-cost therapeutic option that can be put into practice by the medical and paramedical staff working in renal units. Based on our experience of 16 years practicing this procedure, we present our recommendations on how to perform it, as well as technical details and an approach on how to handle the complications that may arise.
Key words: plasmapheresis, apheresis, hemodialysis equipment, technical, complications.
Definición
La aféresis terapéutica es un procedimiento extracorpóreo, en el cual la sangre removida de un paciente es separada en sus componentes, permitiendo posteriormente que sólo los elementos deseados retornen al paciente. En la citoféresis se remueven selectivamente células (leucoféresis, eritrocitoféresis y plaquetoféresis) y en la plasmaféresis (PF) plasma completo, aunque hoy en día mediante técnicas especiales en cascada y con la adición de filtros con fibras que generen absorción es posible la remoción de elementos específicos del plasma, los cuales se consideran que son mediadores de procesos patológicos.
Antecedentes históricos
Las primeras técnicas de aféresis fueron manuales, y básicamente se trataban de plasmaféresis, en ellas se obtenía una décima parte del volumen sanguíneo del paciente, el cual era sometido a centrifugación separando el plasma de los elementos celulares, siendo estos últimos reinfundidos al paciente después de ser calentados y diluidos en el plasma de donantes (1). Pero fue el Dr. Edwin J. Cohn, PhD, en la escuela de medicina de Harvard en los años 50 quien a partir de la técnica de centrifugación inventada en Suiza en 1877 por el Dr. Carl Gustav Patrik de Laval y patentada en los Estados Unidos en 1881, quien diseño la centrífuga de campana e impulsó el desarrollo de la aféresis a los logros actuales (2). Esta tecnología se basa en la separación de los componentes del plasma de acuerdo con su densidad, y tiene la enorme ventaja de permitir la citoféresis, de tal manera que es la que se utiliza principalmente en los bancos de sangre.
La aféresis por filtración es una tecnología más reciente, y sólo permite la plasmaféresis. Habitualmente se realiza con máquinas (Autopheresis C de Baxter) que utilizan diversas bombas, siendo su uso restringido por sus costos a instituciones en las cuales se lleven a cabo un número significativo de procedimientos anualmente.
La plasmaféresis por filtración con la utilización de máquinas de hemodiálisis, representa para nosotros hoy en día la mejor alternativa, puesto que estos equipos se encuentran más difundidos en el país, son de fácil utilización, se cuenta con enfermeras y médicos familiarizados con su manejo, y finalmente es posible acceder fácilmente a todos los componentes necesarios para su práctica.
Experiencia a nivel mundial con esta técnica es relativamente poca a pesar de los múltiples beneficios que puede proporcionar. En 1992 se encuentra la primera publicación al respecto por el grupo de Gerhardt y colaboradores (3), quienes practicaron 281 plasmaféresis en 49 pacientes durante siete años.
En Colombia Restrepo CA y Díaz R en el año de 1993 (4) publicaron su experiencia con plasmaféresis por filtración transmembrana utilizando un equipo convencional de hemodiálisis en pacientes con síndrome de Guillain Barré, quienes requirieron ventilación mecánica, y en quienes se logró una rápida recuperación con tan sólo tres plasmaféresis por paciente. Esta experiencia fue publicada en las memorias del VIII Congreso Colombiano de Nefrología e Hipertensión Arterial, con lo cual se demostró que las personas conocedoras de las terapias dialíticas y los circuitos extracorpóreos son las más competentes para realizarla.
Mecanismos por los cuales la plasmaféresis resulta efectiva
Depleción rápida de factores específicos asociados a la enfermedad
Incluyen autoanticuerpos patogénicos tipo inmunoglobulina G y M, complejos inmunes circulantes, crioglobulinas, cadenas ligeras de inmunoglobulinas y lipoproteínas con alto contenido de colesterol.
El objetivo principal es remover estas sustancias y permitir la reversión del proceso patológico o disminuir sus manifestaciones clínicas (5, 6).
Sustitución de factores deficitarios del plasma
Se remueve el plasma y se reemplaza con plasma normal. Su propósito es administrar elementos deficitarios en el plasma como en pacientes con púrpura trombocitopénica trombotica en la que el ADAMTS 13 (quien evita la excesiva agregación plaquetaria) es deficitario.
Modulación de la respuesta inmune
Descargando al sistema reticuloendotelial y mejorando la depuración endógena de anticuerpos o complejos inmunes.
Otros efectos sobre el sistema inmune
Remoción de mediadores inflamatorios (citoquinas, complemento).
Cambio en la relación antígeno-anticuerpo, dando como resultado formas más solubles de complejos inmunes.
Estimulación de clones de linfocitos para mejorar la terapia citotóxica.
Bases farmacocinéticas para su prescripción
Puesto que la plasmaféresis se utiliza principalmente para la remoción de autoanticuerpos patógenos, el análisis de su farmacocinética nos permite más fácilmente entender su prescripción.
Las inmunoglobulinas tienen una vida media de 5 (IgM) a 21 (IgG) días, y tienen una distribución intravascular entre 45-75% de su masa total (75% IgM y 45% IgG). Este contenido determina qué tan eficientemente son removidas del cuerpo cuando se practica una sesión de plasmaféresis (7).
La mayor cantidad de inmunoglobulinas removidas ocurre con la remoción del volumen plasmático, alcanzando cifras de 45-75% del total; posteriores remociones de iguales volúmenes plasmáticos sólo logran grados menores de eliminación de estas macromoléculas, siendo por lo tanto recomendado que cada sesión de plasmaféresis no practique remociones superiores a dos volúmenes plasmáticos.
Posterior al procedimiento se presenta reacumulación de las macromoléculas en el intravascular, ello ocurre a partir de varios orígenes:
1. Drenaje linfático.
2. Difusión simple a través de la pared de los capilares sanguíneos, siendo estas dos últimas rutas las que transfieren las macromoléculas del intersticio al intravascular, en tal forma que si la tasa de equilibrio del extravascular al intravascular es de 1 a 2% por hora, se requerirían cinco plasmaféresis en 7-10 días para remover 90% de la carga de inmunoglobulinas corporales.
3. Síntesis endógena por células plasmáticas, mecanismo muy importante como lo demuestran los bajos resultados terapéuticos que se presentan cuando la plasmaféresis se practica sin terapia inmunosupresora coadyuvante, situaciones en las cuales se observa un rebote inmune al suprimir las sesiones programadas.
Se calcula que posterior a la plasmaféresis en 24 a 36 horas las concentraciones intravasculares de macromoléculas se elevan en 35-60% de las concentraciones basales, siendo claro que la prescripción de la plasmaféresis se basa por lo tanto en las características de la macromolécula por remover y su tasa de reacumulación. Por ejemplo si la macromolécula es IgG con una vida media de 21 días, el paciente requeriría en teoría un menor número de plasmaféresis, y a intervalos más prolongados, pero su baja remoción en cada plasmaféresis requiere su prescripción más frecuente, en cambio para la remoción de IgM con una vida media de cinco días se requerirán mayor número de sesiones de plasmaféresis e intervalos más cortos, a pesar de que por su alto contenido intravascular se logra remover alrededor del 75% de su masa corporal en un solo procedimiento.
Estimación del volumen plasmático (VP)
Se requiere un estimado del volumen de plasma para llegar a una prescripción apropiada de la plasmaféresis. Para este propósito, hay varios nomogramas y ecuaciones usando altura, peso y hematocrito (Hct). Un método empírico útil es considerar que el volumen de plasma sea aproximadamente 35-40 mL por kg de peso corporal, con el número más bajo (35 mL por kg) aplicable a pacientes con valores normales de hematocrito (Hct) y 40 mL por kg aplicables a pacientes con valores de Hct que están por debajo de lo normal. Por ejemplo, en un paciente de 70 kg con un Hct normal (45%), el volumen de plasma (VP) sería 70 x 40 = 2.800 mL.
Kaplan (7) recomienda un método simplificado para predecir el volumen estimado de plasma (VEP):
VEP (litros) = [0.07 x peso (kg)] x (1 – Hct)
Nota: el hematocrito del paciente se expresa así: Hct (%)/100.
Indicaciones de plasmaféresis
Las indicaciones más comunes para plasmaféresis son enfermedades neurológicas (síndrome de Guillain-Barré y miastenia gravis), aunque también en algunas entidades nefrológicas y hematológicas (síndrome de Goodpasture, y púrpura trombocitopénica trombótica).
La prescripción en estas entidades es como se indica en la Tabla 1.

Sin embargo, ha sido usada como recurso terapéutico en más de 80 enfermedades. La Asociación Americana para Aféresis (ASFA) y la Asociación Americana de Bancos de Sangre (AABB) (8-11) dividen las enfermedades tratadas por plasmaféresis en cuatro categorías, según el soporte en la literatura que se encuentre en relación con su eficacia:
Categoría I: la aféresis terapéutica es una terapia aceptable ya sea como terapia de primera línea o adyuvante a otras terapias. Su eficacia es basada en pruebas bien controladas o bien diseñadas.
Categoría II: la aféresis es generalmente aceptada en una terapia de soporte.
Categoría III: la aféresis terapéutica no está claramente indicada, basado en evidencia insuficiente o resultados contradictorios.
Categoría IV: la aféresis terapéutica ha sido demostrada que carece de efectividad.
Las siguientes enfermedades corresponden a su respectiva categoría
Categoría I: enfermedad por anticuerpos antimembrana basal glomerular (SGP), hipercolesterolemia familiar, enfermedad por almacenamiento de ácido fitánico, púrpura trombocitopénica trombótica (PTT), púrpura postransfusión, polirradiculoneuropatía desmielinizante inflamatoria aguda o crónica, polineuropatía desmielinizante con IgG e IgA y miastenia gravis.
Categoría II: glomérulonefritis rápidamente progresiva, enfermedad por aglutininas frías, artritis reumatoidea, púrpura trombocitopénica idiopática (PTI), receptores de trasplante de médula ósea con incompatibilidad ABO, mieloma múltiple y síndromes de hiperviscosidad, falla renal aguda por mieloma múltiple, presencia de inhibidores de factores de la coagulación, síndrome miasteniforme de Eaton-Lambert, enfermedad desmielinizante inflamatoria aguda del sistema nervioso central, corea de Sydenham, polineuropatía con IgM (con o sin Waldenstrom), crioglobulinemia con o sin polineuropatía, desórdenes neuropsiquiátricos autoinmunes pediátricos e hipercolesterolemia familiar
Categoría III: aplasia pura de células rojas, lupus eritematoso sistémico, fenómeno de Raynaud, esclerosis múltiple progresiva, esclerosis sistémica o esclerodermia, tormenta tiroidea, anemia hemolítica autoinmune, síndrome hemolítico urémico (SHU), sensibilización a trasplante renal, glomeruloesclerosis focal segmental, rechazo de trasplante cardiaco, falla hepática aguda, sobredosis por drogas o envenenamientos, vasculitis, enfermedad hemolítica del recién nacido, miositis por cuerpos de inclusión, síndromes neurológicos paraneoplásicos, mieloma múltiple con polineuropatía o síndrome POEMS, polimiositis o dermatomiositis, encefalitis de Rasmussen y síndrome del hombre rígido.
Categoría IV: AIDS, esclerosis lateral amiotrófica, PTI crónica, nefritis lúpica, psoriasis, rechazo de trasplante renal, esquizofrenia y amiloidosis sistémica.
Consideraciones técnicas y tipos de plasmaféresis
Existen dos técnicas principales de aféresis:
El método más antiguo es aféresis por centrifugación, ésta puede ser por dispositivos manuales o mecánicos, a su vez las técnicas mecánicas pueden ser intermitentes o continuas. En la centrifugación, las células sanguíneas son separadas con base en su densidad (Figura 1), en tal forma que al centrifugar la sangre los elementos celulares se van hacia la periferia, y el plasma ocupa la parte central de la centrífuga o campana de donde puede ser evacuado, retornando luego el componente celular al paciente previa redilución y calentamiento (Figura 2). Este método es el utilizado en bancos de sangre, y tiene la enorme ventaja de que permite citoféresis, con lo cual el grupo celular de interés puede ser retirado del paciente con fines terapéuticos o para donaciones posteriores. Requiere la anticoagulación con citrato, la cual puede generar hipocalcemia, se asocia en ocasiones a trombocitopenia postratamiento, tiene la ventaja de que utiliza venas periféricas, bajo flujo sanguíneo (50 ml/minuto), pero requiere de cinco a seis horas por procedimiento y máquinas sofisticadas de difícil transporte (Fresenius AS104 y Cobe Spectra), lo cual limita su utilización en aféresis terapéutica.

El segundo método de aféresis es por filtración transmembrana, se basa en la utilización de membranas de alta permeabilidad por el gran tamaño de sus poros (0,3-0,6 micrones), lo cual permite que todo el plasma y sus moléculas sea filtrado a su paso, reteniéndose sólo el componente celular (Figura 3). Tiene la desventaja de que no permite la citoféresis, requiere de la implantación de un catéter venoso central y anticoagulación con heparina. Esta técnica involucra bien sea el uso de máquinas diseñadas exclusivamente para este propósito [Autopheresis C (Baxter)], o la adopción de máquinas estándar para hemodiálisis, las cuales cuentan con una bomba de sangre tipo roller y a las que se les acopla los filtros de alta permeabilidad en forma idéntica a como se lo hace con los filtros convencionales para hemodiálisis, puesto que el conjunto de líneas arteriovenosas se adapta perfectamente a los plasmafiltros comercializados en el país.
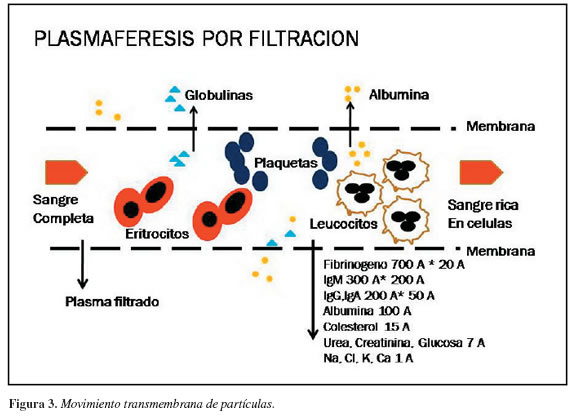
Este método tiene las ventajas de un volumen de circulación muy bajo (100 a 150 ml de sangre por minuto), remoción de plasma (2 litros) en mucho menor tiempo (1 a 1 ½ hora), y además porta bajo riesgo de generar trombocitopenia. Como las máquinas de hemodiálisis se encuentran comúnmente en hospitales de tercer nivel, y son de fácil transporte, se entiende que es el procedimiento más práctico para llevar a cabo en estos centros hospitalarios.
Una representación esquemática del circuito montado de plasmaféresis se observa en la Figura 4.
Elementos necesarios para realizar plasmaféresis transmembrana con máquina de hemodiálisis

Debe tenerse en cuenta que es indispensable que se garantice la consecución del PFC o la albúmina requeridos no sólo para la primera sesión, sino para todas las que el paciente vaya a requerir según su patología, con el fin de no interrumpir el tratamiento al paciente. Al respecto debe además de resaltarse que el éxito terapéutico está directamente relacionado con la oportunidad en que se inicie el tratamiento una vez se haya realizado el diagnóstico, puesto que a mayor tiempo de evolución de la enfermedad son mayores las secuelas. Es de recordar que el PFC se debe someter a proceso de descongelación y utilizarlo en las siguientes ocho horas.
La albúmina a 20% es la utilizada para este procedimiento y su presentación es en frasco ampolla por 50 cc (12). Se recomienda su dilución en lactato de Ringer para lograr una concentración a 2%. Es importante aclarar que la recomendación de utilizar albúmina a 2% es producto de nuestra experiencia, la cual busca reducir significativamente los costos del procedimiento, experiencias internacionales se llevan a cabo con diluciones finales que llevan la albúmina a valores entre 2 a 5%.
Procedimiento
En vista de que la utilización de este procedimiento ha sido reservada a unas pocas unidades renales en el país, y de que en nuestra experiencia durante casi 16 años ha demostrado facilidades para llevarse a cabo, enormes beneficios terapéuticos y carencia de mayores efectos colaterales, consideramos que los detalles relacionados con todo el procedimiento deben ser de dominio de todo el personal médico y de enfermería que están directamente relacionados con los aspectos técnicos que él implica, y por lo tanto a continuación pasamos a describir de una manera muy detallada todos los pasos necesarios para incursionar en esta terapia.
El licenciado Humberto Moreno Espitia en el año 1998 en su documento Guías de Manejo para la Realización de la Plasmaféresis Transmembrana detalla en forma clara varios de los pasos por seguir, por lo tanto algunos de los aspectos técnicos y gráficas (algunas modificadas bajo su autorización) presentados a continuación exhiben recomendaciones semejantes.
Antes de preparar el equipo, revisar la máquina de hemodiálisis con su bomba roller, evaluando el estado de alarmas y su funcionamiento. Además, verificar que la conductividad esté en sus límites si se utiliza ácido y bicarbonato lo cual no es estrictamente necesario. El catéter central venoso debe estar bien implantado y permeable antes de abrir el equipo. Recordar que el catéter cuando no se encuentre en uso debe quedar lleno con heparina sin diluir por cada extensión de acuerdo con la indicación descrita en cada vía. El catéter por ser de alto flujo no debe ser utilizado en situaciones diferentes a la plasmaféresis para infusiones de medicamentos, líquidos y otros porque se puede obstruir y favorecer el riesgo de infecciones sistémicas; solamente se utilizaría con estos fines cuando exista una urgencia vital que requiera una vía permeable.
Preparación del circuito
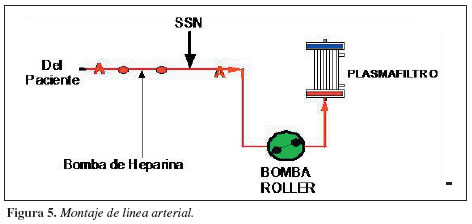
1. Extraer la línea arterial del kit de plasmaféresis o de hemodiálisis convencional de forma estéril.
2. Ubicar la línea de conexión roja o arterial en la bomba roller y colocarla según el trayecto para ésta, estipulado en la máquina para hemodiálisis.
3. Cerrar clamps a medida que se va destapando la línea.
4. Conectar esta línea arterial, con el polo rojo del plasmafiltro de forma estéril (Figura 5).
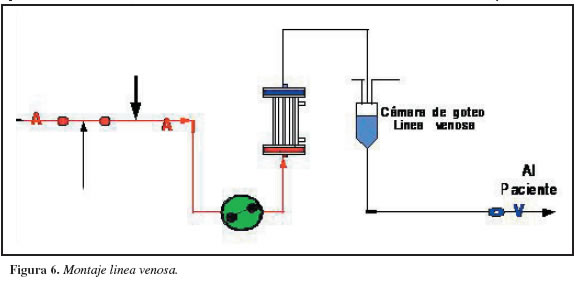
5. Ubicar la línea de conexión azul o venosa y colocarla según el trayecto estipulado en la máquina para hemodiálisis.
6. Cerrar clamps a medida que se va destapando la línea.
7. Ubicar la cámara de esta línea en la trampa de aire y colocarla según el trayecto para ésta, estipulado en la máquina para hemodiálisis.
8. Pasar la línea venosa por el clamp de seguridad de la máquina que queda por debajo de la trampa de aire (Figura 6).
9. Conectar esta línea venosa, con el polo azul del plasmafiltro de forma estéril.
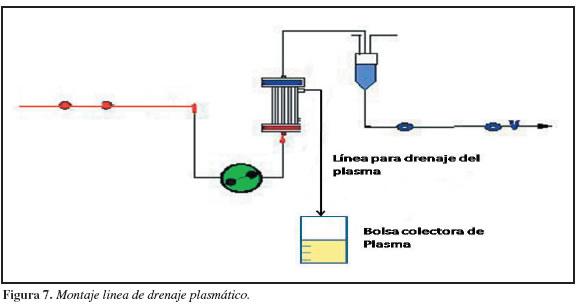
10. Colocar el plasmafiltro en el brazo lateral de la máquina de hemodiálisis con el polo azul hacia arriba.
11. Conectar el cistoflo al terminal azul lateral-superior del plasmafiltro y camplear su línea mientras se realiza el purgado arteriovenoso. El terminal rojo lateral inferior si está presente debe anularse en su función utilizando el conector cerrado que trae el kit de plasmaféresis (Figura 7).
Purgado del equipo
12. Preparar las soluciones salinas heparinizadas (SSH) así: 5.000 UI de heparina más 1.000 cc de SSN. Se deben preparar en total 2.000 cc de SSN para ser utilizadas en su totalidad durante el purgado. Disponerlas en un atril alto.
13. Conectar las soluciones salinas heparinizadas una a una, al puerto de purgado de la línea arterial, teniendo la precaución de que todos los clamps deben estar perfectamente cerrados. Iniciar el purgado desde el puerto de purgado hacia la terminal arterial con el fin de garantizar la salida del aire de la línea, purgando por gravedad. Luego se inicia el purgado del resto del circuito encendiendo la bomba roller máximo a 200 ml/min con el fin de conservar la integridad de las fibras del plasmafiltro. No golpear el plasmafiltro, basta con ubicarlo en forma vertical en el brazo lateral de la máquina de hemodiálisis, se debe eliminar la solución salina que es drenada por el terminal venoso de la línea arteriovenosa.
14. Con los últimos 500 cc de SSH de cada bolsa se purga la parte externa de la membrana cerrando la línea venosa y pasando esta solución a través de la conexión del plasmafiltro hacia el cistoflo previo desclampeo de su línea de drenaje hacia el cistoflo y encendiendo la bomba roller a un máximo de 100 ml/minuto. Al terminar con el purgado de todo el equipo, cerrar la conexión al cistoflo y conectar la línea arterial a la venosa con el recirculador.
15. Iniciar la recirculación de la solución heparinizada dando inicio a la bomba roller a 100 ml/min, con el fin de extraer restos de aire, y de heparinizar todo el circuito.
16. Mientras recircula, conectar el equipo multiflujo o la llave de tres vías a la cámara atrapaburbujas de la línea azul por la cual se infunde la albúmina, o PFC o la solución de reposición (Hartman).
17. Conectar un equipo macrogoteo con una SSN de 500 cc al puerto de purgado de la línea arterial o puerto de lavado, la cual se utilizará en el momento de la desconexión para devolver la sangre, o en situaciones en que el paciente requiere una carga de volumen durante el procedimiento.
18. Desechar la solución salina heparinizada del purgado del cistoflo.
Iniciación del procedimiento
Deben seguirse los siguientes pasos:
1. Retirar el apósito que cubre las líneas del catéter y retirar la heparina de cada extensión verificando permeabilidad.
2. Iniciar la máquina en modo de diálisis y en bypass en el caso de utilizar soluciones dialisantes (ácido y bicarbonato), con el fin de dar conductividad, lo cual no es absolutamente necesario.
3. Conectar la línea arterial al catéter del paciente.
4. Invertir el plasmafiltro antes del inicio con el polo arterial hacia arriba.
5. Abrir los clamps de las líneas arterial y venosa, y de la extensión arterial del catéter.
6. Encender la bomba roller a un flujo de 50-100 ml/min y continuar el procedimiento con un flujo de 100 a 200 ml/min.
7. Una vez eliminado todo el contenido de la solucion salina heparinizada en el circuito arteriovenoso detener la bomba y conectar la terminal venosa a la extensión venosa del catéter, abrir luego los respectivos clamps venosos.
8. Colocar la dosis de anticoagulante (heparina) en la línea arterial, 5000 UI (o 50 UI/kgr) y refuerzo de 1.000 UI a la hora o según las pruebas de coagulación del paciente de acuerdo a la orden medica.
9. Confirmar que la sangre fluya adecuadamente por todo el circuito arteriovenoso.
10. Aplicar una ampolla de gluconato de calcio por 10 cc por el puerto de administración de medicamentos de la línea venosa, lentamente.
11. Iniciar la remoción de plasma abriendo el clamp de la línea que va hacia el cistoflo
12. Iniciar la reposición de volumen a través de la llave de tres vías en la cámara venosa atrapaburbujas, de acuerdo con la solución de reemplazo escogida, utilizando los infusores para tal fin.
13. Monitorizar la presión venosa y arterial con la ayuda de las cámaras arterial, venosa y filtros hidrofóbicos, la cual no debe exceder los 200 mm Hg en la presión arterial y 150 mm Hg en la presión venosa, valores más altos de inmediato tornarán el plasma filtrado de color rojizo indicando el paso de glóbulos rojos.
14. Observar durante todo el procedimiento las características del plasma filtrado para detectar la presencia de hemólisis.
15. Valorar permanentemente el funcionamiento del acceso vascular, para detectar flujo inadecuado que puede conducir a hemólisis o a trombosis del circuito y/o del plasmafiltro.
16. Mantener abrigado el paciente para evitar hipotermia.
17. Valorar permanentemente al paciente para detectar posibles complicaciones del procedimiento.
Finalización del procedimiento
1. Cerrar el clamp al cistoflo y luego cerrar el clamp de la línea arterial.
2. Abrir el clamp de paso de la SSN de purgado o lavado.
3. Dejar pasar 300 cc de SSN para devolver la sangre del circuito extracorpóreo en su segmento venoso al paciente, para ello se usa la bomba roller a un flujo de 100 a 200 ml/min; el lado correspondiente al segmento arterial se devuelve por gravedad.
4. Aplicar la segunda y última ampolla de gluconato de calcio por 10 cc por el puerto de administración de medicamentos de la línea venosa, lentamente.
5. Una vez devuelta la sangre al paciente, apagar la bomba roller, cerrar el clamp de la línea venosa y desconectar las líneas del catéter central con técnica aséptica.
6. Lavar el catéter con 10 cc de SSN por cada lumen a presión y dejar cada vía con heparina sin diluir según lo indicado en cada extensión por el fabricante.
7. Realizar desinfección y colocar vendaje en el sitio de inserción del catéter central según protocolos del servicio.
8. Desechar e inactivar el plasma removido (midiendo su volumen total).
9. Desechar todo el equipo utilizado en el procedimiento.
10. Realizar nota médica y de enfermería.
Pruebas de laboratorio por solicitar
La recomendación internacional es evaluar pre y posplasmaféresis electrolitos (calcio, fosforo, sodio, potasio y magnesio), cuadro hemático completo, albúmina, globulinas, fibrinógeno, TTP y TP. En nuestra experiencia la práctica de estos para clínicos sólo se debe de realizar inicialmente, y su determinación posterior es innecesaria cuando los procedimientos se llevan a cabo sin observarse complicaciones dentro de los mismos. Sin embargo, para grupos que practiquen por primera vez este procedimiento y mientras se familiarizan con el mismo, lo más conveniente es que acepten las recomendaciones internacionales.
Complicaciones
Las relacionadas con cualquier circuito extracorpóreo, anticoagulación y catéteres venosos centrales son las mismas descritas en procedimientos hemodialíticos, y por lo tanto no serán tocadas en esta revisión.
El siguiente es un breve resumen de los problemas más comunes que pueden presentarse durante la plasmaféresis y su manejo recomendado (13-15).
Hipocalcemia
Esta complicación está relacionada con el descenso en el calcio sérico total, bien sea producido por la pérdida de éste adherido a la albúmina, o de su fracción libre a través de los plasmafiltros de alta permeabilidad. La fijación del calcio libre a la albúmina recién infundida también puede contribuir a esta complicación.
El reemplazo de calcio intravenoso es útil para eliminar completamente esta complicación, en nuestra experiencia con la administración de una ampolla de gluconato de calcio al inicio del procedimiento y otra al final se obtienen muy buenos resultados.
Sensibilidad al plasma fresco congelado
Se incluyen en esta categoría reacciones anafilácticas severas, broncoespasmo y transmisión de enfermedades virales (16). Generalmente pueden manejarse fácilmente con antihistamínicos y líquidos IV, reacciones alérgicas más serias pueden requerir el uso de esteroides y adrenalina IV.
Hipotensión relacionada con volumen
Se presenta esta complicación cuando no se vigila esmeradamente la cantidad de líquido filtrado y la administrada. La misma cantidad perdida por unidad de tiempo debe reemplazarse en igual medida con albúmina al 2% (o 5%) diluida en Hartman. Cuando sólo se utiliza lactato de Ringer como solución de reemplazo, es común que el volumen de reemplazo infundido sea superior al filtrado para lograr mantener la volemia del paciente, en esta última situación en nuestra unidad renal administramos de rutina entre 4 a 6 unidades de plasma fresco al terminar el procedimiento, con el fin de restaurar parcialmente la presión osmótica proporcionada por las proteínas que contiene el plasma fresco.
Debido a que una proporción importante de la albúmina infundida tempranamente se filtra durante la plasmaféresis, una alternativa importante por tener en cuenta sería la de reemplazar 30% del volumen plasmático inicialmente removido con Hartman, y luego 70% restante con albúmina a 2%, ello evitaría que una parte importante de la albúmina infundida se pierda en el procedimiento.
Tendencias hemorrágicas
Son el resultado de pérdidas de los factores de coagulación a través de la membrana del plasmafiltro; así después de cada plasmaféresis el fibrinógeno, antitrombina III y factor VIII pueden caer en un 80%, la protrombina y otros factores de la coagulación en un 50-70%, con recuperación en sus niveles normales a las 48 horas (17). Cuando los procedimientos se realizan cada 24 horas, o son múltiples, la depleción de factores de la coagulación es prolongada y requiere de varios días para su recuperación espontánea. Bajo estas circunstancias y en pacientes con un alto riesgo de hemorragia, se recomienda la infusión de 500 ml de plasma fresco congelado (aproximadamente dos unidades) hacia el final de la plasmaféresis, con el fin de recuperar los factores de coagulación. Otra alternativa recomendada es evaluar el TTP, TTP antes de la tercera plasmaféresis, y si este es mayor en 1,5 veces el control se debe de administrar el plasma fresco según la recomendación anterior.
Hipotermia
El circuito arteriovenoso es básicamente extracorpóreo, y a diferencia de los equipos diseñados exclusivamente para plasmaféresis, en los de hemodiálisis no es posible el calentamiento de la sangre durante su tránsito por sus bombas, lo cual predispone al paciente a desarrollar hipotermia. A lo anterior se le suma el reemplazo rápido de grandes cantidades de volumen con líquidos a temperatura ambiental. La anterior complicación puede evitarse calentando el plasma, y otros líquidos por infundir a una temperatura de 370 C, o utilizando frazadas que permitan calentar al paciente durante el procedimiento.
Infeccion posplasmaféresis
Durante la plasmaféresis se pierden además de albúmina otras proteínas incluidas las gammaglobulinas, con lo cual se puede presentar hipogammaglobulinemia, de esta manera la reducción de las inmunoglobulinas pueden predisponer a las infecciones o agravar las presentes. En pacientes de alto riesgo para desarrollar infecciones, o si ellas están presentes la recomendación es aplicar gammaglobulina 100-400 UI/Kg IV al finalizar cada plasmaféresis
De todas formas el tratamiento debe garantizar las estrictas medidas de asepsia y antisepsia.
Situaciones especiales
En pacientes con PTT/SHU, defectos preexistente en la hemostasia como bajos niveles de fibrinógeno pretratamiento (menores a 125 mgs/dl) y riesgo de depleción de colinesterasa, es imprescindible que la solución de reemplazo sea plasma fresco congelado.
Se debe recordar que la plasmaféresis remueve medicamentos con alta fijación a las proteínas plasmáticas y pequeños volúmenes de distribución tisular. En estos casos es imprescindible la administración del medicamento posplasmaféresis. Entre los medicamentos que no se remueven por plasmaféresis se resaltan la prednisona, ciclofosfamida, azatioprina, aminoglucósidos, tobramicina, digoxina y vancomicina (15).
En paciente que reciben IECAS se ha presentado reacciones anafilactoides durante el procedimiento, no está claro el origen de ellas, pero se sugiere que pueden ser el resultado de un aumento en la generación de kininas. Para evitarlas se recomienda en pacientes que las presentan retirar el IECA 24 horas previas al procedimiento (18).
Conclusiones
La plasmaféresis terapéutica es un procedimiento con enormes beneficios terapéuticos cuando se utiliza en patologías con demostrada eficacia. La técnica por centrifugación es fácil de practicar, pero requiere equipos y personal con experiencia en el manejo de los mismos, los cuales no se encuentran en hospitales de tercer nivel. La plasmaféresis por filtración utilizando máquinas de hemodiálisis aporta los mismos beneficios terapéuticos, con la enorme ventaja de su más bajo costo, facilidad en obtención de los equipos necesarios y fácil entrenamiento del personal necesario.
Referencias
1. Quillen K, Berkman EM. Introduction to Therapeutic Apheresis; McLeod BC, Price T H, Weinstein R, eds, Apheresis: Principles and Practice, second edition, Bethesda, AABB press, 2003, pag 49-69. [ Links ]
2. Corbin F, Cullis HM, Freireich EJ, Ito Y, Kellogg RM, Latham A, Mcleod BC. Development of Apheresis Instrumentation, , McLeod B C, Price T H, Weinstein R, eds, Apheresis: Principles and Practice, second edition, Bethesda, AABB press, 2003, pag 1-27. [ Links ]
3. Gerhardt RE, Ntoso KA, Koethe JD, Lodge S, Wolf CJ. Acute plasma separation with hemodialysis equipment. J Am Soc Nephrol 1992; 2: 1455-8. [ Links ]
4. Restrepo CA, Diaz R. Plasmaferesis modificada en Síndrome de Guillain Barre. VIII Congreso Colombiano de Nefrología e Hipertensión Arterial, Memorias Trabajos Libres. 1993: 32. [ Links ]
5. Perea Buenaventura D. Terapias de Reemplazo Renal. En: Nefrología Básica. 1a ed. Manizales: Editorial la patria; 2007.p.141-8. [ Links ]
6. Rahman T, Harper L. Plasmapheresis in nephrology: an update. Curr Opin Nephrol Hypertens 2006; 15: 603-9. [ Links ]
7. Kaplan AA. Toward the rational prescription of therapeutic plasma exchange: the kinetics of immunoglobulin removal. Semin Dial 1992; 5: 227-9. [ Links ]
8. Smith JW, Weinsten R. Therapeutic apheresis: a summary of current indication categories endorsed by the AABB and the American Society for Apheresis. Transfusion 2003; 43: 820-2. [ Links ]
9. Szczepiorkowski ZM, Bandarenko N, Kim HC, Linenberger ML, Marques MB; Sarode R, et al. Guidelines on the use of therapeutic apheresis in clinical practice: evidence-based approach from the Apheresis Applications Committee of the American Society for Apheresis. J Clin Apher 2007; 22: 106-75. [ Links ]
10. Szczepiorkowski ZM, Shaz BH, Bandarenko N, Winters JL. The new approach to assignment of ASFA categories--introduction to the fourth special issue: clinical applications of therapeutic apheresis. J Clin Apher 2007; 22: 96-105. [ Links ]
11. Shaz BH, Linenberger ML, Bandarenko N, Winters JL, Kim HC, Marques MB, et al. Category IV indications for therapeutic apheresis: ASFA fourth special issue. J Clin Apher 2007; 22: 176-80. [ Links ]
12. Orlin JB, Berkman EM. Partial plasma exchange using albumin replacement: removal and recovery of normal plasma constituents. Blood 1980; 56: 1055-9. [ Links ]
13. Basic-Jukic N, Kes P, Glavas-Boras S, Brunetta B, Bubic-Filipi L, Puretic Z. Complications of therapeutic plasma exchange: experience with 4857 treatments. Ther Apher Dial 2005; 9: 391-5. [ Links ]
14. Mokrzycki MH, Kaplan AA. Therapeutic plasma exchange: complications and management. Am J Kidney Dis 1994; 23: 817-27. [ Links ]
15. Kaplan AA. Therapeutic plasma exchange: core curriculum 2008. Am J Kidney Dis 2008; 52: 1180-96. [ Links ]
16. Schreiber GB, Busch MP, Kleinman SH, Korelitz JJ. The risk of transfusion-transmitted viral infections. The Retrovirus Epidemiology Donor Study. N Engl J Med 1996; 334: 1685-90. [ Links ]
17. Wood L, Jacobs P. The effect of serial therapeutic plasmapheresis on platelet count, coagulation factors, plasma immunoglobulin, and complement levels. J Clin Apher 1986; 3: 124-8. [ Links ]
18. Owen HG, Brecher ME. Atypical reactions associated with use of angiotensin-converting enzyme inhibitors and apheresis. Transfusion 1994; 34: 891-4. [ Links ]














