Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.38 no.4 Bogotá Oct./Dec. 2010
Artículos de Reflexión
Tromboembolismo venoso postoperatorio: grave riesgo prevenible
Postoperatory Venous Thromboembolism: A Serious Preventable Risk
Wilson Valencia A.*, Johnnie Smith Husbands Luque**
* Médico Anestesiólogo Universidad del Valle. Profesor Facultad de Medicina Universidad Santiago de Cali. Anestesiólogo Hospital San Juan de Dios, Cali, Colombia. wilsonvalenciaa@hotmail.com
** Médico Anestesiólogo Universidad Nacional de Colombia. Profesor Facultad de Medicina Universidad Libre Seccional Cali. Instructor Reanimación AHA BLS ACLS Fundación Reanimación Colombia SCARE. Anestesiólogo Clínica Nuestra Señora de los Remedios, Clínica Rafael Uribe Uribe, Cali, Colombia. jshusbands@hotmail.com
Recibido: mayo 27 de 2010. Enviado para modificaciones: julio 26 de 2010. Aceptado: octubre 2 de 2010.
RESUMEN
La trombosis venosa profunda y el tromboembolismo pulmonar postoperatorio son complicaciones que tienen influencia en la morbimortalidad. Múltiples investigaciones evidencian sus cifras y la reducción del riesgo con la tromboprofilaxis. Han sido evaluados diferentes medicamentos y su nivel de protección, pero el seguimiento de las guías de práctica clínica publicadas no es óptimo debido a la falta de claridad en el manejo de pacientes con factores de riesgo intermedio. La prevención demostrada por la tromboprofilaxis obliga a implementar estrategias para detectar pacientes en riesgo y seguir las guías.
Palabras clave: Trombosis, embolismo, riesgo profilaxis. (Fuente: DeCS, BIREME).
Summary
Postoperative deep venous thrombosis and pulmonary thromboembolism are complications which have incidence on morbimortality. Many researches evidence their figures and how thromboprophylaxis can reduce these risks. Different drugs and their level of protection have been evaluated, but the adherence to the published clinical practice guidelines is not optimal because of the lack of clarity in the management of patients with intermediate risk factors. The proved prevention with thromboprophylaxis forces to implement strategies to detect the patients at risk and to follow the guidelines.
Keywords: Thrombosis, embolism, risk, prophylaxis. (Source: MeSH, NLM).
Introducción
Durante el período postoperatorio (POP) los pacientes pueden desarrollar trombosis venosa profunda (TVP) y tromboembolismo pulmonar (TEP), entidades conocidas como tromboembolismo venoso (TEV), consecuencias de un estado de hipercoagulabilidad debido a estasis, a la activación de la agregación plaquetaria y de los factores de coagulación por el contacto del colágeno subendotelial vascular y de fosfolípidos tisulares con el plasma. Es la tercera causa de muerte postoperatoria, y el TEP postoperatorio es la primera causa de muerte prevenible (1). El objetivo de este artículo es hacer una reflexión alrededor de la literatura existente sobre el tema, en el marco de las guías de práctica clínica -cuyo seguimiento no es óptimo-, y hacer una propuesta sobre la adopción de algunas estrategias para detectar a los pacientes y seguir las guías.
Estado del arte
El riesgo de TVP POP cuando no se realiza profilaxis se encuentra entre el 3 y el 80 %, cursando la mayoría de forma asintomática (13). Motte y colaboradores (3) encontraron en 2006 que en cirugía general la incidencia de TVP postoperatoria en pacientes sin profilaxis es del 19 %, presentándose tromboembolismo en 1,6 % y TEP mortal en 0,20,9 %. Si la cirugía involucra cáncer, la incidencia de TVP asintomática es de
29 %. En cirugía ginecológica varía entre el 4 y el 38 %, en reemplazo total de cadera (RTC) puede ser hasta del 57 %, con TEP fatal del 0,13 %. Las cirugías por fractura de cadera muestran cifras de TEP fatal entre 2,5 y 7,5 %. En reemplazo total de rodilla (RTR) se presenta TVP entre el 41 y el 85 %, con TEP fatal entre 0,1 y 1,7 %. En neurocirugía se encontró incidencia de TVP asintomático postoperatorio de 24 a 33 %.
Sweetland y colaboradores (4) encontraron que de 239.614 mujeres llevadas a cirugía, 5.419 desarrollaron TEV, causa de 270 muertes, 40 veces más que en las pacientes no quirúrgicas. En la primera semana el riesgo relativo (RR) fue de 40,3, (IC 95 % 30,752,8), con aumento a 110 veces en la tercera semana (RR 112,5, IC 95 % 95,3132,8). El RR fue de 69,1 (IC 95 % 63,175,6) en las primeras seis semanas postoperatorias y de 19,6 (IC 95 % 16,6 23,1) entre las semanas 7 y 12.
El solo hecho de estar hospitalizado predispone al desarrollo de TVP (5). El riesgo aumenta con comorbidades. Mantilla y colaboradores (6) encontraron como factor de riesgo un nivel igual o mayor a 3 en la clasificación de estado físico preoperatorio de la ASA (p = 0,002), RR 2,6, (IC 95 %: 1,44,7). Entre los factores de riesgo asociados al desarrollo de TEV se encuentran: TVP o TEP previos que sugieran síndrome de hipercoagulabilidad, cirugía de cadera o pelvis, presencia de cáncer, edad mayor de 60 años, inmovilidad igual o mayor a cuatro días, obesidad (IMC > 30), terapia con estrógenos, embarazo, tabaquismo, várices en miembros inferiores, enfermedad inflamatoria intestinal, síndrome nefrótico, sepsis, etc. (1,3,6). La magnitud de la cirugía influye en el riesgo; por ejemplo, la incidencia de TEV en cirugías para herniorrafia es baja: 0,04 % (1).
Existe controversia sobre el menor riesgo de TVP POP cuando se utiliza anestesia conductiva en comparación a cuando se emplea anestesia general. Sharrok y colaboradores analizaron datos de pacientes llevados a cirugía ortopédica mayor entre 1986 y 1995, y no encontraron diferencia en el riesgo entre los dos tipos de anestesia (6).
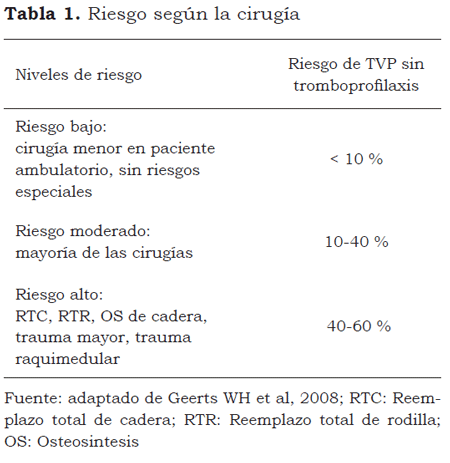
El American College of Chest Physicians (ACCP) publicó en 2008 la octava edición de sus guías de práctica clínica (GPC) para la prevención de TEV postoperatorio. Allí se clasifican tres grupos de riesgo (tabla 1), según la magnitud de la cirugía, modelo que es similar al de los esquemas europeos que determinan el riesgo conjugando factores de la cirugía con los del paciente (3).
La prevención inicia con la educación del paciente. Se recomienda usar medidas mecánicas para disminuir la estasis como, por ejemplo, la deambulación precoz. Las medias de compresión continua y los aparatos de compresión intermitente (CI) son los métodos más estudiados; se ha reportado disminución de TVP postoperatoria del 19 al 7 %, al usarlos en cirugía general, y asociados a medidas farmacológicas mejoran los resultados (1).
Las tromboprofilaxis farmacológicas reducen la incidencia de TEV entre 60 y 72 %, y de TEP mortal en un 64 %. Los medicamentos recomendados son:
- Heparina convencional (recomendación clase I): en cirugía general disminuye la incidencia de TEP mortal de 0,71 a 0,21 %. Puede producir hematoma de la herida quirúrgica entre el 4,1 y el 6,3 % de los casos (1,3), y trombocitopenia entre el 2 y el 3 %.
- Heparinas de bajo peso molecular (HBPM ) (clase I): previenen TEV en forma similar a la HC, pero inducen trombocitopenia sólo en el 0,1 % de los casos.
- Fondaparinux, pentasacárido sintético inhibidor del factor Xa (clase I): previene TEV POP en forma igual a las HBPM, con mínimos efectos secundarios (1,3).
- Inhibidores de factor Xa por vía oral como rivaroxabán (7,8): aprobados para uso por la FDA en 2009, por lo cual no aparecen en las GPC del ACCP.
- Inhibidores directos de trombina como dabigatrán, uso por VO : ofrecen protección similar a las HBPM. Aprobados para uso por la European Medicine Agency en 2009 (5); tampoco aparecen en las GPC del ACCP.
- Warfarina: puede usarse en pacientes de alto riesgo (clase IIa), pero se asocia a sangrado mayor POP de hasta el 5 %, y requiere monitoreo por laboratorio.
- Aspirina: su efectividad en la prevención ha demostrado consistentemente ser inferior a la de otros sistemas de tromboprofilaxis, por ello el ACCP no recomienda su uso.
En 1997 la FDA reportó 41 casos de hematoma espinal asociados al uso de HBPM (9), la mayoría ocurrieron en pacientes con punciones traumáticas o múltiples. Para el uso de heparinas, el ACCP recomienda abstenerse de realizar punciones espinales o retirar catéteres hasta 12 horas después de su administración. Si se realiza punción o retiro de catéter, debe esperarse dos horas antes de aplicarlas. No deben dejarse catéteres en el espacio epidural más de 24 horas, ni se deben realizar punciones en quienes reciben anticoagulación por vía EV, han consumido trombolíticos en los últimos 10 días o clopidrogel en la última semana. La aspirina no se asocia a riesgo de hematoma espinal.
La profilaxis puede iniciarse antes o después de la cirugía (10). Se ha demostrado que el riesgo abarca varias semanas POP y la profilaxis debe ser extendida, principalmente en pacientes con riesgos especiales (4,5,11,12). Los casos asintomáticos pueden reducirse dos o tres veces más con profilaxis hasta tres semanas. La TVP sintomática aparece en promedio 17 días después de RTC, y la incidencia continúa siendo alta hasta por dos meses.
Las recomendaciones del ACCP 2008 se resumen en la tabla 2. Para todo ello el nivel de recomendación es clase I. Cuando exista alto riesgo de sangrado sólo se usarán medidas mecánicas y la tromboprofilaxis farmacológica se iniciará si desaparece ese riesgo.
Discusión
El TEV es una complicación postoperatoria claramente establecida. Existe evidencia irrefutable de que la profilaxis reduce significativamente la morbimortalidad. Aun así, el seguimiento de las GPC no es el esperado (4,5). En 1986 sólo un tercio de los pacientes en riesgo recibían profilaxis. Kakkar y colaboradores (2) encontraron que del 92,5 % de pacientes operados entre 2006 y 2007 que presentaban riesgo para TEV, el 37,7 % no recibieron la profilaxis recomendada. La aceptación de nuevas GPC para prevención de TEV postoperatorio presenta dificultades especiales pues, en algunos aspectos, no son concretas:
- La diferencia entre cirugía menor y mayor es subjetiva. El ACCP define como cirugía mayor, sin especificar, a la mayoría de cirugías general, ginecológica y urológica abiertas, y con ello genera incertidumbre para prescribir tromboprofilaxis en pacientes con riesgos intermedios, o en pacientes de cirugía abierta pero sin riesgos especiales.
- La recomendación de ordenar profilaxis hasta la salida del hospital no es concreta. Márgenes tan amplios para el tiempo (desde la salida del hospital hasta 28 días, entre 10 y 35 días) producen inseguridad. Esta variación se supone determinada por los factores de riesgo existentes, pero no se describen parámetros concretos.
- Algunos autores consideran incierta la relación entre TVP asintomática y el desarrollo de embolismos significativos. La mayoría de estudios publicados buscan casos de TEV, y no casos clínicos. Existe relación entre los casos asintomáticos y la morbimortalidad, pero su magnitud no es clara (3).
- Existen diferentes percepciones de la magnitud del riesgo. La American Academy of Orthopedic Surgeons establece que existen pocos estudios que asocien el desarrollo de TVP con TEP, y que la tromboprofilaxis farmacológica produce sangrado importante postoperatorio en una tasa mayor a la descrita en los estudios publicados (13). Sus recomendaciones sugieren prevenir solamente el TEP sintomático.
- Los pacientes de cirugía abierta recibirán profilaxis farmacológica, recomendación basada en múltiples estudios que establecen el riesgo, pero de manera global, sin discriminar modelos concretos.
Así, aunque disponemos de GPC, existe incertidumbre acerca de las clases de cirugías que requieren tromboprofilaxis y su duración. Por ello, el TEV continúa siendo la primera causa de mortalidad postoperatoria prevenible.
En consecuencia, pueden hacerse las siguientes propuestas:
- Seguir las GPC del ACCP, pues existe suficiente cantidad y calidad de evidencia que demuestra una reducción significativa de la mortalidad secundaria al TEV postoperatorio con la práctica de la tromboprofilaxis, y el TEP mortal puede ser su primera manifestación. Esto es más eficiente que tratar los casos ya presentados clínicamente. Las diferencias entre el tiempo propuesto para profilaxis, la incertidumbre relacionada con diferentes magnitudes de las cirugías y con la asociación del carácter sintomático o asintomático de la TVP con el episodio embólico, serán resueltas mediante la realización de estudios que permitan tener un panorama más concreto.
- Los hospitales deben implementar estrategias para el conocimiento y la prevención del TEV, como lo recomienda el ACCP. Esto ha sido impulsado por programas que buscan la excelencia en la calidad. El Surgical Care Improvement Project, de la Asociación Médica Americana y agencias gubernamentales de los Estados Unidos, busca reducir las complicaciones quirúrgicas en ese país en un 25 % durante el período comprendido entre 2005 y 2010 (5), y ha intervenido en procesos para mejorar la profilaxis del TEV. Se han usado sistemas computarizados que alertan sobre la existencia de riesgos y permiten evaluar la necesidad de profilaxis.
- En Colombia es necesario crear comités para la prevención del TEV postoperatorio e implementar estrategias para detectar el riesgo y la necesidad de tromboprofilaxis, mediante sistemas automatizados o manuales, y con ello se puede evitar el olvido o la percepción inadecuada del riesgo. Así mismo, deben crearse grupos de investigación multidisciplinarios para tener estadísticas propias y contribuir a la adecuación de las GPC.
References
1. Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM. Prevention of Venous Thromboembolism. American College of Chest Physicians EvidenceBased Clinical Practice Guidelines. Eight Edition. CHEST, 2008; 133: 381S453S. [ Links ]
2. Kakkar AK, Cohen AT, Tapson VF, Bergmann JF, Goldhaber SZ, Deslandes B. Venous Thromboembolism Risk and Prophylaxis in the Acute Care Hospital Setting. Ann Surg. 2010; (251): 3308 [ Links ]
3. Motte S, Samama CM, Guay J, Barre J, Borg JY. Prevention of Postoperative Venous Thromboembolism. Risk Assessment and Methods of Prophylaxis. Can J Anesth. 2006; (53): S68S79. [ Links ]
4. Sweetland S, Green J, Liu B, Berrington A, Canonico M, Reeves G. Duration and Magnitude of The Postoperative Risk of Venous Thromboembolism in Middle Aged Women: Prospective Cohort Study. BMJ. 2009; (339): b4583. Doi: 10.1136/bmj.b4583. [ Links ]
5. Michota FA. Prevention of Venous Thromboembolism after Surgery. Clev Clin J Med. 2009; (76), Suppl. 4: S45S52. [ Links ]
6. Mantilla C, Horlocker TT, Schroeder DR, Berry DJ. Risk Factors for Clinically Relevant Pulmonary Embolism and Deep Venous Thrombosis in Patients Undergoing Primary Hip or Knee Arthroplasty. Anesthesiology. 2003; (99): 55260. [ Links ]
7. Turpie AG, Lassen MR, Davidson BL. Rivaroxaban versus Enoxaparin for Thromboprophylaxis after Total Knee Arthroplasty: a Randomised Trial. Lancet. 2009; (373): 167380. [ Links ]
8. Eriksson BI, Borris LC, Friedman RJ. Rivaroxaban versus Enoxaparin for Thromboprophylaxis after Hip Arthroplasty. N Engl J Med. 2008; (358): 276575. [ Links ]
9. Lumpkin M. FDA Public Health Advisory. Anesthesiology. 1998; (88): 27A-8A. [ Links ]
10. Eikelboom JW, Quinlan DJ, Douketis JD. Extended Duration Prophylaxis against Venous Thromboembolism after Total Hip or Knee Replacement: a MetaAnalysis of the Randomized Trials. Lancet; 2001; (358): 915. [ Links ]
11. Bergqvist D, Agnelli G, Cohen AT. Duration of Prophylaxis against Venous Thromboembolism with Enoxaparin after Surgery for Cancer. N Engl J Med. 2002; (346): 97580. [ Links ]
12. Strebel N, Prins M, Agnelli G, Büller HR. Preoperativeor Postoperative Start of Prophylaxis for Venous Thromboembolismwith LowMolecularWeight Heparin Inelective Hip Surgery? Arch Intern Med, 2002; 162: 14516 [ Links ]
13. American Academy of Orthopedic Surgeons. Clinical Guideline on Prevention of Symptomatic Pulmonary Embolism in Patients undergoing Total Hip or Knee Arthroplasty. Available from http://www.aaos.org/Research/guidelines/PE_guideline.pdf. released may, 2007. Last accessed: April 19, 2010. [ Links ]











 text in
text in 

