Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.39 no.4 Bogotá Oct./Dec. 2011
https://doi.org/10.5554/rca.v39i4.133
http://dx.doi.org/10.5554/rca.v39i4.133
Artículo de Revisión
Sistemas de soporte hepático extracorpóreo
Fredy Ariza Cadena*, Luis Felipe Carmona Serna**, Iván Fernando Quintero C.***, Luis Armando Caicedo*, Carlos A. Vidal Perdomo*, Luis Fernando González*.
* Departamento de Trasplante de Órganos Sólidos, Fundación Valle del Lili, Cali, Colombia. Correspondencia: Carrera 98 No. 18-49 Cali, Colombia. Correo electrónico: fredyariza@hotmail.com
** Anestesiólogo, Hospital de la Misericordia. Bogotá, Colombia. Correo electrónico: pipecarmonaserna@gmail.com
*** Residente de Anestesiología. Universidad del Valle. Cali, Colombia.
Recibido: noviembre 16 de 2010. Enviado para modificaciones: noviembre 22 de 2010. Aceptado: mayo 18 de 2011.
RESUMEN
Introducción. Los sistemas de soporte hepático extracorpóreo (SHE) surgen como una alternativa al trasplante hepático (TH), dado el incremento en la incidencia de falla hepática aguda (FHA), falla hepática crónica agudizada (FHCA), así como las restricciones en la oferta de órganos.
Objetivo. Revisión de la literatura de los sistemas de soporte hepático extracorporeo.
Metodología. Búsqueda de la literatura publicada entre julio de 1990 y noviembre de 2010 en las principales bases de datos médicas que incluyeron MEDLINE, SciELO y EMBASE, de artículos que analizaran tecnologías relacionadas con sistemas de soporte hepático en cuanto a sus especificaciones técnicas, sus usos y la evidencia respecto a su efectividad en pacientes con algún tipo de falla hepática que requirieran soporte.
Resultados. Estos sistemas pueden dividirse en artificiales (hemofiltración, sistema MARS) y bioartificiales (como el Hepatassist™). Su fundamento consiste en reemplazar los procesos de destoxificación relacionados específicamente con el sistema de bilirrubinas, la eliminación de aminoácidos aromáticos, agentes inflamatorios y el manejo de los productos de degradación del sistema de la coagulación. Los recientes avances en bioingeniería y biogenética han hecho que estas tecnologías se acerquen cada vez más a una forma ideal, permitiendo que sean utilizados con relativo éxito en humanos. Los SHE, en su gran mayoría en desarrollo, pretenden no solo actuar como puente al TH, sino que, en casos puntuales, pueden llegar a ser la piedra angular del tratamiento mientras la FHA logra resolverse.
Palabras clave: Insuficiencia hepática, fallo hepático agudo, hígado artificial, fallo hepático. (Fuente: DeCS, BIREME).
INTRODUCCIÓN
La falla hepática aguda (FHA), fulminante (FHF) y la crónica agudizada (FHCA) son un motivo cada vez más frecuente de admisión a las unidades de cuidado intensivo pediátrico y de adultos. Aunque su incidencia es baja (1-6 casos/millón/año) el riesgo de disfunción multiorgánica, deterioro severo y muerte es alto, así como también los costos derivados de su atención (1). La incidencia de FHF es probablemente más alta en aquellas zonas donde son frecuentes las hepatitis infecciosas, aunque la toxicidad inducida por medicamentos como el acetaminofén y, en nuestro medio, la ingesta accidental o los intentos de suicidio con fósforo blanco también son causas importantes (2,3,4).
Teniendo en cuenta la escasa disponibilidad de donantes y la frecuente ineficacia del manejo médico convencional para soportar la vida de estos pacientes en espera potencial de un trasplante hepático (TH) (5,6), se han venido desarrollando nuevas tecnologías de soporte vital que permitan mantener temporalmente a estos pacientes como un puente al trasplante, o en algunos casos, pueden incluso funcionar como terapia definitiva mientras la FH se autoresuelve (7,9). Estos sistemas, denominados “sistemas de soporte hepático extracorpóreo” (SHE), tienen como función primordial eliminar de manera eficaz metabolitos tóxicos, como las bilirrubinas, y otros derivados del catabolismo con actividad biológica, que de otra manera ocasionarían serias implicaciones en la función orgánica y hemodinámica de los pacientes con FH (9-13).
FISIOLOGIA DE LA FALLA HEPATICA: FUNDAMENTOS
La FHA sobreviene como resultado de una injuria hepática directa que ha sido lo suficientemente severa como para producir lesión he patocitaria masiva y diátesis hemorrágica. Algunas condiciones sistémicas, como la sepsis y el shock cardiogénico, pueden causar disfunción hepatocitaria y falla multiorgánica como parte de su presentación clínica (3). Para efectos prácticos, la FHA puede clasificarse de acuerdo a su tiempo de inicio en fulminante (< 2 semanas luego del inicio de la ictericia), y subfulminante (2 semanas a 3 meses luego del inicio de la ictericia). La FHF representa la forma más letal de FHA, con una mortalidad de casi el 100% cuando esta se asocia a falla renal aguda, una de las dos complicaciones más importantes junto con la aparición de edema cerebral severo (1,4,15). Las anormalidades químicas más frecuentes en estos pacientes incluyen la elevación de las concentraciones séricas de bilirrubinas, sales biliares, amonio, lactato, ácidos grasos libres, aminoácidos aromáticos, ácido gamma-aminobutírico (falso neurotransmisor) y mercaptanos. De estos, el amonio parece jugar un rol central en la patogénesis de la encefalopatía hepática y el edema cerebral, mientras que las bilirrubinas han mostrado ser tóxicas para los neutrófilos polimorfonucleares al inhibir su repuesta citotóxica frente a las bacterias (14).
Los principios en que se basa la terapia médica convencional en FHA, suponen tres pilares fundamentales (7,8,10,16): soporte metabólico, soporte de la coagulación y destoxificación.
a. Soporte metabólico: se pueden aportar nutrientes y electrolitos mediante el soporte nutricional parenteral y enteral.
b. Soporte de la coagulación: se soporta fundamentalmente mediante terapia transfusional, aunque atañe todos los riesgos inherentes a las reacciones transfusionales que ello implica.
c. Destoxificación: es posible realizarla en forma parcial mediante la lactulosa y terapias de reemplazo renal modificadas como la hemofiltración.
Cuando es insuficiente la terapia médica convencional, se hace necesario implementar estrategias basadas en la ingeniería biomédica, las cuales pretenden reemplazar funciones específicamente relacionadas con procesos de destoxificación que están relacionados con el sistema de bilirrubinas, la eliminación de aminoácidos aromáticos y el manejo de los productos de degradación del sistema de la coagulación. Los SHE pueden ser artificiales (sin elementos biológicos) y bioartificiales (que contienen líneas celulares humanas o animales, generalmente hepatocitos cultivados) (8,17). A diferencia de los primeros, que tienen como única función la desintoxicación del paciente, los SHE bioartificiales adicionan algunas funciones de síntesis (proteínas plasmáticas y factores de coagulación).
METODOLOGÍA DE LA REVISIÓN
Se realizó una búsqueda de la literatura publicada entre julio de 1990 y noviembre de 2010 en las principales bases de datos médicas que incluyeron MEDLINE, SciELO y EMBASE, con el objetivo de encontrar artículos que analizaran tecnologías relacionadas con sistemas de soporte hepático en cuanto a sus especificaciones técnicas, sus usos y la evidencia respecto a su efectividad en pacientes con algún tipo de falla hepática que requirieran soporte. Los términos MeSH (Medical Subject Headings) que se emplearon para la búsqueda incluyeron: “Hepatic Insufficiency/therapy”, “Life Support Systems/instrumentation”, “Liver Failure”, “Sorption Detoxification”, “Liver, Artificial” y “bioartificial liver”, solos o en combinación. De igual manera, se amplió la búsqueda a posibles investigaciones en curso que pudieran estar inscritas en registros como clinicaltrials.gov y reportes de abstracts presentados en congresos internacionales de gastroenterología, hepatología o trasplante hepático.
Se revisó la literatura estratificando su grado de evidencia, estableciendo en orden de importancia, en primer lugar, los estudios clínicos, luego los cohortes, prospectivas y retrospectivas, y por último, las series de casos. Se eliminaron las publicaciones que fueran reportes de casos o aquellas que, por su enfoque, no correspondieran al tema de revisión.
SISTEMAS DE SOPORTE HEPÁTICO EXTRACOPÓREO ARTIFICIALES (SHEA)
Sistemas de Hemofiltración
Son sistemas basados en el principio físico natural de convexión (difusión facilitada por fuerzas centrípetas que transportan aniones a través de una membrana semipermeable). Su principal diferencia con la hemodiálisis radica en que en la interface extracorpórea no se encuentra ninguna sustancia de tipo dialisato que medie el intercambio molecular (12,16). (El término ‘dialisato' se define como una sustancia química que permite el intercambio y la depuración de metabolitos y toxinas).
La utilidad de esta terapia de reemplazo se centra en la posibilidad de eliminar líquidos y tóxicos, al tiempo que se mantiene la estabilidad hemodinámica del paciente. Para su implementación se requiere una máquina de hemofiltración, de accesos vasculares con catéteres de hemodiálisis de doble vía y de personal entrenado en el manejo de estos sistemas (Figura 1). Se ha descrito su utilidad en el manejo de la falla renal asociada a FHA y encefalopatía; sin embargo, los estudios publicados no han sido conclusivos sobre su verdadera utilidad terapéutica (8,18).
Sistemas de Adsorción / Readsorción Molecular Recirculante (MARS)
De la sigla inglesa MARS (Molecular Adsortion/Readsortion System), los Sistemas de Adsorción/Readsorción Molecular Recirculante constituyen la evolución de los sistemas de hemofiltración. Este sistema incorpora dos interfaces adicionales al hemofiltro: una interface de albúmina para adsorber algunos aminoácidos y otros tóxicos, y una interface de carbón activado para adsorber elementos iónicos. (El término ‘adsorción' se define como la capacidad de una sustancia para atraer y atrapar otros materiales o partículas sobres su superficie). (11,19,20)
Se ha documentado su efectividad en la disminución de los niveles séricos de aminoácidos aromáticos, bilirrubinas, triptófano, óxido nítrico, interleuquinas 3 y 6, y factor de necrosis tumoral, impactando de manera significativa en la progresión a encefalopatía hepática en FHA y en la reducción de la severidad de la misma, además de facilitar la “recuperación” hepática mientras se resuelve la noxa desencadenante (21-25).
Los escenarios donde el sistema MARS ha sido utilizado con mejores resultados incluyen la FHF tóxica, las FHF secundarias a sepsis o fallo circulatorio y también la FHASC (26-29).
La capacidad del MARS para eliminar elementos tóxicos y ayudar a mejorar el balance electroquímico está dada por la combinación de sus interfaces, las cuales incluyen (Figura 2):
a. H H emodializador de albúmina: a través de una cámara hueca, este actúa como dialisato y permite eliminar las sustancias tóxicas ligadas a proteínas como substancias tóxicas hidrosolubles. Posteriormente, esta albúmina es dializada y filtrada de nuevo, devolviéndose libre de toxinas al circuito.
b. H H emodializador prototipo: el hemodialisador de flujo MARS tiene un área de superficie de 2,1 m2, un grosor de membrana de 100 nm y un peso molecular máximo de 50kDa. Este circuito está conectado a una columna de diálisis con dialisato y una columna de carbón activado. Se considera que la hemodiáliasis es de bajo flujo y que el gradiente de difusión se mantiene por la recirculación constante de albúmina.
c. Interface activa de carbón activado: contribuye a la destoxificación de aniones orgánicos.
d. Interface de resina de intercambio aniónico: colabora en la consecución de electroneutralidad y balance electroquímico.
Dentro de los resultados obtenidos con el MARS en las diferentes series se ha descrito mejoría del perfil hemodinámico con incremento de la resistencia vascular sistémica, así como disminución de los requerimientos de vasopresores y de la resistencia vascular renal, probablemente asociados a la depuración de citoquinas (30-32). De igual manera, se ha evidenciado disminución de los niveles séricos de bilirrubinas (especialmente conjugada), azoados y creatinina, disminución de la presión intracraneana y de la hipertensión portal, mejoría de la encefalopatía, de la perfusión renal y prurito (24,30,31,33-36).
A pesar de los aparentes beneficios que esta terapia extracorpórea puede ofrecer, realmente se han realizado muy pocos estudios con una metodología adecuada para evaluar su verdadero beneficio. Se han descrito casos en los cuales pacientes con insuficiencia hepática han sido tratados con MARS sin transplante hepático, evidenciándose altas tasas de mortalidad (78-100 %), motivo por el cual su empleo esta indicado para servir como puente hasta realizar el transplante, ya que permite optimizar y mantener el estado clínico previo al mismo. Además, se encuentra indicado en el manejo posterior de la disfunción del injerto (7,19,26,33,37,38).
Se ha descrito que el sistema MARS puede empeorar la coagulopatía y el sangrado, por lo que se hace necesario minimizar la anticoagulación durante el proceso de la diálisis (39-41). Aunque se ha propuesto que la única contraindicación para la utilización de este sistema sea la presencia de coagulación intravascular diseminada, muchos de los pacientes con FHA se presentan con fibrinólisis aumentada y pueden reconocerse frecuentemente estados de coagulación intravascular diseminada leves (3,40). En un estudio realizado por Faybik y Cols (42), se demostró que, a pesar de asociarse con recuentos bajos de plaquetas y de niveles de fibrinógeno, la cinética del coágulo evaluada mediante tromboelastografía no se alteraba de manera importante en pacientes que habían sido tratados con el MARS; tampoco se observó que este sistema empeorara la fibrinólisis, siendo bien tolerado aún en pacientes con coagulopatía severa.
Por último, desde el punto de vista de la relación costo-efectividad podría considerarse que, a pesar del elevado costo del MARS y las demás terapias de soporte hepático (6.000 euros en promedio), estos tienen un potencial prometedor en el manejo de la FHCA (43,44). Los defensores de estos sistemas han sugerido que, en algunos casos, puede producirse la recuperación de la disfunción hepática aguda, evitándose incluso la necesidad de un trasplante hepático y los costos derivados de su seguimiento (27,28,33,45,46).
DIÁLISIS CON SISTEMA DE SEPARACIÓN FRACCIONADA DE PLASMA Y ADSORCIÓN (FP SA):
El sistema Prometheus, desarrollado por Fresenius Medical, es una evolución de un sistema de diálisis de alto flujo conectado a un módulo para separación plasmática fraccionada y adsorción (FPSA, Fractionated Plasma Separation and Adsorption). Las áreas de aplicación de este sistema no abarcan solamente el manejo de la FHA o la FHCA como puente al trasplante o mientras esta se resuelve, sino que, además, el mismo podría funcionar como soporte en los casos de resecciones amplias de tumores u otras lesiones hepáticas, o incluso como soporte mixto cuando algún paciente presenta un síndrome hepatorrenal (7,8,11,47,48).
El sistema FPSA posee una membrana permeable a la albúmina, la cual permite el paso de toxinas unidas a esta. A diferencia de lo que ocurre en el sistema MARS, estas toxinas son adsorvidas en 2 columnas (resina neutral e intercambiador iónico), retornando posteriormente al paciente libre de las mismas. (11,48,49) (Figura 3).
El sistema FPSA depura más eficientemente las toxinas (nitrógeno ureico, creatinina, amonio y bilirrubinas) que el MARS, aunque no pasa lo mismo con las sales biliares y citoquinas (50). Varios estudios reportan una baja efectividad de este sistema para la depuración de las últimas, lo cual puede explicar el por qué se asocia con pobre mejoría del perfil hemodinámico al compararse con el sistema MARS (30,50,51).
La evolución de la encefalopatía hepática con respecto a la aplicación del FPSA ha sido poco evaluada y la información actual carece de adecuados diseños metodológicos. Por el momento, se cuenta solo con reportes de casos en los cuales se menciona una ligera mejoría en la misma luego de administrar terapia con este sistema (47).
SISTEMAS DE SOPORTE HEPÁTICO BIOARTIFICIALES (SSHEB)
Estos sistemas fueron diseñados para suplementar las funciones vitales hepáticas, y se constituyeron en una terapia puente que no solo cumple con tareas de adsorción de solutos tóxicos, sino que, además, tiene funciones de metabolismo y síntesis. Su principal diferencia con los SHEA radica en la inclusión de hepatocitos vivos en sus interfaces (8). Básicamente, fuera de los elementos que pueden integrarse en un sistema de soporte hepático bioartificial convencional, para el funcionamiento de estos sistemas en particular se incluyen columnas de hepatocitos en una interface denominada biorreactor (Figura 4). El plasma entra en los biorreactores donde es ultrafiltrado, realiza procesos de intercambio metabólico, oxigenación y adición de plasma alogénico, para luego reingresar nuevamente al paciente (10).
De acuerdo al origen de los hepatocitos se pueden tener tres líneas celulares diferentes dentro de los biorreactores: a. líneas C3A, derivadas de hepatoblastoma humano; b. líneas derivadas de órganos no candidatos a trasplantar; y c. líneas porcinas (HepatAssist 2000™).
Las líneas celulares derivadas de hepatoblastoma, aunque mantienen una funcionalidad aceptable, generan dudas sobre el control de su sobrecrecimiento y también el temor de una potencial transfusión de células malignas a los pacientes.
La seguridad de los biorreactores compuestos por líneas derivadas de hígados no candidatos a trasplantar ha sido mayor que en el caso de las líneas provenientes de hepatoblastoma o de tejidos animales; sin embargo, la dificultad de su multiplicación in-vitro y la corta sobrevida de estos cultivos celulares dentro de los bioreactores han hecho que su eficiencia haya sido menor que la esperada (16).
Las líneas derivadas de tejido porcino (HepatAssist 2000™; Circe Biomedical, Lexington, Massachusetts 02173, USA) han sido evaluadas con respecto a su potencial cancerígeno sin que se haya encontrado aumento en su incidencia, así como también en relación con su duración funcional dentro del biorreactor, ante lo cual han presentado un buen desempeño (11). La experiencia con este tipo de líneas celulares ha sido satisfactoria en términos de seguridad y efectos adversos, pero el temor potencial ha sido la transmisión de infecciones por retrovirus, hecho que hasta el momento no ha sido bien documentado (52). Este sistema se compone de una línea de carbón activado, un oxigenador, la interface de hepatocitos y una bomba de perfusión que están incluidos en un sistema de plasmaféresis convencional.
SHE Y EVIDENCIA
Hasta la fecha se han publicado pocas revisiones sistemáticas diseñadas para evaluar la eficacia de los SSHEB y SHEA. Kjaergard y sus colegas (53) realizaron una, la cual evaluó 12 estudios (que incluían 483 pacientes) y en la que se comparaban los SSHEB o SHEA con el tratamiento convencional, así como dos estudios más que comparaban los sistemas artificiales con los bioartificiales (en 105 pacientes). Se concluyó que solamente los SHEA redujeron la mortalidad en los casos de FHCA, mientras que, en términos globales, no hubo diferencias en la mortalidad cuando se evaluó su utilidad en FHA. Con respecto a su utilidad como puente para transplante hepático (TH) y los casos de encefalopatía, los autores no especificaron el número de pacientes analizados y se limitaron a determinar el riesgo relativo, lo cual dificulta la interpretación de esos desenlaces.
Liu y sus colegas (16) confirmaron nuevamente los hallazgos de Kjaergard al publicar un año después, con la colaboración Cochrane, una revisión sistemática de diseño llamativamente muy similar, que contaba incluso con el mismo número de pacientes. Comparados con la terapia médica convencional, los SHE no se asociaron a ningún efecto significativo sobre la mortalidad, ni se encontraron grandes diferencias en su uso como terapia puente para transplante hepático, pero sí se detectó una disminución significativa en la evolución de la severidad de la encefalopatía. Nuevamente, el mayor efecto notado sobre la disminución en la mortalidad fue para el grupo de FHCA, pero no fue significativo en los grupos de FHA.
EL PRESENTE Y EL FUTURO
Las principales barreras para la implementación de estas tecnologías y las que están por venir son principalmente de tipo económico, pero también se relacionan con la poca experiencia acerca del tema que tienen los grupos de soporte hepatobiliar y de cuidado intensivo. Sin embargo, en un futuro muy próximo estas tecnologías serán probablemente más accesibles, lo cual redundará en la adquisición de mayor experiencia en ellas, así como en la aparición de nuevas publicaciones al respecto. Sin duda, la creciente incidencia de FHA, FHF y FHCA, sumada a la pobre oferta de donación de órganos, impulsará este tipo de terapias de soporte.
En países en vía de desarrollo como el nuestro, los grupos de cuidado intensivo y hepatobiliar demuestran cada vez mayor interés en la justificación de estas terapias de soporte artificiales y bioartificiales, de modo que sean cubiertas y aseguradas bajo el nombre de “enfermedades catastróficas” en nuestro sistema de salud, situación que ya se ha dado principalmente en Norteamérica, Europa y Asia (6,54,55). Como conclusión, es posible decir que los SHE son una tecnología en desarrollo que promete notables beneficios para los pacientes con FHA y FHCA de diferentes etiologías, como un puente mientras se consigue un injerto hepático, o en el mejor de los casos, como parte del tratamiento integral mientras la etiología de la FH se resuelve. Se requieren mayores estudios que determinen la relación costo-beneficio de estos sistemas, así como un mayor desarrollo en lo correspondiente a bioingeniería e ingeniería genética. Los recientes avances en conocimiento y manipulación de células madres abren un potencial eje de desarrollo para estos sistemas, dados los problemas actuales de inmuno-histo-compatibilidad y transmisión genética y/o celular no deseada. 1. Bower WA, Johns M, Margolis HS, Williams IT, Bell BP. Population-based surveillance for acute liver failure. Am J Gastroenterol 2007 Nov;102(11):2459-63. [ Links ] 2. Escorsell A, Mas A, De la Mata M. Acute liver failure in Spain: analysis of 267 cases. Liver Transpl 2007 Oct;13(10):1389-95. [ Links ] 3. Bernal W, Auzinger G, Dhawan A, Wendon J. Acute liver failure. Lancet 2010 Jul 17;376(9736):190-201. [ Links ] 4. Sierra F. Acute liver failure: Socratic and hypothetic discussion with the resident. Rev Col Gastroenterol, 2006 Sep;21(3):182-9. [ Links ] 5. Bernal W, Cross TJ, Auzinger G, Sizer E, Heneghan MA, Bowles M, et al. Outcome after wait-listing for emergency liver transplantation in acute liver failure: a single centre experience. J Hepatol 2009 Feb;50(2):306-13. [ Links ] 6. Mas A, Escorsell A, Fernandez J. Liver transplantation for acute liver failure: a spanish perspective. Transplant Proc 2010 Mar;42(2):619-21. [ Links ] 7. Atienza Merino G. Evaluation of extracorporeal liver support systems in the treatment of liver failure. A systematic review. Gastroenterol Hepatol 2010 May;33(5):352-62. [ Links ] 8. Carpentier B, Gautier A, Legallais C. Artificial and bioartificial liver devices: present and future. Gut 2009 Dec;58(12):1690-702. [ Links ] 9. Lafuente S, Bertran MJ, Escorsell A. Artificial liver support. Literature review. Med Clin (Barc) 2010 Apr 21. [ Links ] 10. McKenzie TJ, Lillegard JB, Nyberg SL. Artificial and bioartificial liver support. Semin Liver Dis 2008 May;28(2):210-7. [ Links ] 11. Phua J, Lee KH. Liver support devices. Curr Opin Crit Care 2008 Apr;14(2):208-15. [ Links ] 12. Santoro A, Mancini E, Ferramosca E, Faenza S. Liver support systems. Contrib Nephrol 2007;156:396-404. [ Links ] 13. Stadlbauer V, Jalan R. Acute liver failure: liver support therapies. Curr Opin Crit Care 2007 Apr;13(2): 215-21. [ Links ] 14. DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey LM. Pharmacoterapy: a pathophysiologic approach. 7 ed. (NY): McGraw Hill; 2008. [ Links ] 15. Clemmesen JO, Larsen FS, Kondrup J, Hansen BA, Ott P. Cerebral herniation in patients with acute liver failure is correlated with arterial ammonia concentration. Hepatology 1999 Mar;29(3):648-53. [ Links ] 16. Liu JP, Gluud LL, Als-Nielsen B, Gluud C. Artificial and bioartificial support systems for liver failure. Cochrane Database Syst Rev 2004(1):CD003628. [ Links ] 17. Kobayashi N. Life support of artificial liver: development of a bioartificial liver to treat liver failure. J Hepatobiliary Pancreat Surg 2009;16(2):113-7. [ Links ] 18. Davenport A, Will EJ, Davison AM. Effect of renal replacement therapy on patients with combined acute renal and fulminant hepatic failure. Kidney Int Suppl 1993 Jun;41:S245-51. [ Links ] 19. Catalina-Rodríguez MV, Banares-Canizares R. Artificial liver support systems: update on albumin dialysis (MARS). Gastroenterol Hepatol 2005 Oct;28(8): 453-60. [ Links ] 20. Boyle M, Kurtovic J, Bihari D, Riordan S, Steiner C. Equipment review: the molecular adsorbents recirculating system (MARS). Crit Care 2004 Aug;8(4): 280-6. [ Links ] 21. Isoniemi H, Koivusalo AM, Repo H, Ilonen I, Hockerstedt K. The effect of albumin dialysis on cytokine levels in acute liver failure and need for liver transplantation. Transplant Proc 2005 Mar;37(2):1088-90. [ Links ] 22. Chiu A, Fan ST. MARS in the treatment of liver failure: controversies and evidence. Int J Artif Organs 2006 Jul;29(7):660-7. [ Links ] 23. Guo LM, Liu JY, Xu DZ, Li BS, Han H, Wang LH, et al. Application of Molecular Adsorbents Recirculating System to remove NO and cytokines in severe liver failure patients with multiple organ dysfunction syndrome. Liver Int 2003;23 Suppl 3:16-20. [ Links ] 24. Stadlbauer V, Wright GA, Jalan R. Role of artificial liver support in hepatic encephalopathy. Metab Brain Dis 2009 Mar;24(1):15-26. [ Links ] 25. Ilonen I, Koivusalo AM, Hockerstedt K, Isoniemi H. Albumin dialysis has no clear effect on cytokine levels in patients with life-threatening liver insufficiency. Transplant Proc 2006 Dec;38(10):3540-3. [ Links ] 26. Gaspari R, Avolio AW, Zileri Dal Verme L, Agnes S, Proietti R, Castagneto M, et al. Molecular adsorbent recirculating system in liver transplantation: safety and efficacy. Transplant Proc 2006 Dec;38(10): 3544-51. [ Links ] 27. Kantola T, Koivusalo AM, Hockerstedt K, Isoniemi H. The effect of molecular adsorbent recirculating system treatment on survival, native liver recovery, and need for liver transplantation in acute liver failure patients. Transpl Int 2008 Sep;21(9):857-66. [ Links ] 28. Tan HK. Molecular adsorbent recirculating system (MARS). Ann Acad Med Singapore 2004 May; 33(3): 329-35. [ Links ] 29. Wagholikar GD, Lee KH, Pandey D, Leong SO, Singh R, Tan KC. Pre-transplant optimization by molecular adsorbent recirculating system in patients with severely decompensated chronic liver disease. Indian J Gastroenterol 2007 May-Jun;26(3):110-2. [ Links ] 30. Laleman W, Wilmer A, Evenepoel P, Elst IV, Zeegers M, Zaman Z, et al. Effect of the molecular adsorbent recirculating system and Prometheus devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit Care 2006;10(4):R108. [ Links ] 31. Lai WK, Haydon G, Mutimer D, Murphy N. The effect of molecular adsorbent recirculating system on pathophysiological parameters in patients with acute liver failure. Intensive Care Med 2005 Nov;31(11):1544-9. [ Links ] 32. Donati G, Piscaglia F, Coli L, Silvagni E, Righini R, Pini P, et al. Acute systemic, splanchnic and renal haemodynamic changes induced by molecular adsorbent recirculating system (MARS) treatment in patients with end-stage cirrhosis. Aliment Pharmacol Ther 2007 Sep 1;26(5):717-26. [ Links ] 33. Lee KH, Lee MK, Sutedja DS, Lim SG. Outcome from molecular adsorbent recycling system (MARS) liver dialysis following drug-induced liver failure. Liver Int 2005 Oct;25(5):973-7. [ Links ] 34. Montero JL, Pozo JC, Barrera P, Fraga E, Costan G, Dominguez JL, et al. Treatment of refractory cholestatic pruritus with molecular adsorbent recirculating system (MARS). Transplant Proc 2006 Oct;38(8):2511-3. [ Links ] 35. Schmidt LE, Svendsen LB, Sorensen VR, Hansen BA, Larsen FS. Cerebral blood flow velocity increases during a single treatment with the molecular adsorbents recirculating system in patients with acute on chronic liver failure. Liver Transpl 2001 Aug;7(8):709-12. [ Links ] 36. Stadlbauer V, Davies NA, Sen S, Jalan R. Artificial liver support systems in the management of complications of cirrhosis. Semin Liver Dis 2008 Feb;28(1):96-109. [ Links ] 37. Camus C, Lavoue S, Gacouin A, Le Tulzo Y, Lorho R, Boudjema K, et al. Molecular adsorbent recirculating system dialysis in patients with acute liver failure who are assessed for liver transplantation. Intensive Care Med 2006 Nov;32(11):1817-25. [ Links ] 38. Chiu A, Chan LM, Fan ST. Molecular adsorbent recirculating system treatment for patients with liver failure: the Hong Kong experience. Liver Int 2006 Aug;26(6):695-702. [ Links ] 39. Bachli EB, Schuepbach RA, Maggiorini M, Stocker R, Mullhaupt B, Renner EL. Artificial liver support with the molecular adsorbent recirculating system: activation of coagulation and bleeding complications. Liver Int 2007 May;27(4):475-84. [ Links ] 40. Doria C, Mandala L, Smith JD, Caruana G, Scott VL, Gruttadauria S, et al. Thromboelastography used to assess coagulation during treatment with molecular adsorbent recirculating system. Clin Transplant 2004 Aug;18(4):365-71. [ Links ] 41. Tan HK, Yang WS, Chow P, Lui HF, Choong HL, Wong KS. Anticoagulation minimization is safe and effective in albumin liver dialysis using the molecular adsorbent recirculating system. Artif Organs 2007 Mar;31(3):193-9. [ Links ] 42. Faybik P, Bacher A, Kozek-Langenecker SA, Steltzer H, Krenn CG, Unger S, et al. Molecular adsorbent recirculating system and hemostasis in patients at high risk of bleeding: an observational study. Crit Care 2006 Feb;10(1):R24. [ Links ] 43. Hessel FP. Economic evaluation of the artificial liver support system MARS in patients with acute-on-chronic liver failure. Cost Eff Resour Alloc 2006;4:16. [ Links ] 44. Hessel FP, Bramlage P, Wasem J, Mitzner SR. Cost-effectiveness of the artificial liver support system MARS in patients with acute-on-chronic liver failure. Eur J Gastroenterol Hepatol 2010 Feb;22(2):213-20. [ Links ] 45. Wolff B, Machill K, Schumacher D, Schulzki I. MARS dialysis in decompensated alcoholic liver disease: a single-center experience. Liver Transpl 2007 Aug;13(8):1189-92. [ Links ] 46. Wai CT, Lim SG, Aung MO, Lee YM, Sutedja DS, Dan YY, et al. MARS: a futile tool in centres without active liver transplant support. Liver Int 2007 Feb;27(1): 69-75. [ Links ] 47. Oppert M, Rademacher S, Petrasch K, Jorres A. Extracorporeal liver support therapy with Prometheus in patients with liver failure in the intensive care unit. Ther Apher Dial 2009 Oct;13(5):426-30. [ Links ] 48. Saito A. Current progress in blood purification methods used in critical care medicine. Contrib Nephrol 2010;166:100-11. [ Links ]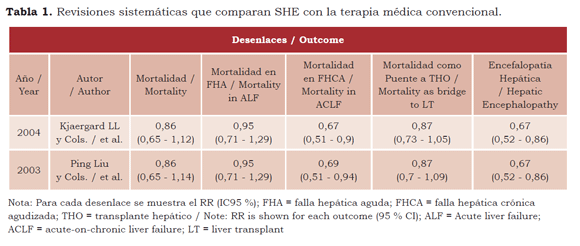
49. RifaiK, Ernst T, Kretschmer U, Haller H, Manns MP, Fliser D. Removal selectivity of Prometheus: a new extracorporeal liver support device. World J Gastroenterol 2006 14 Feb ;12(6):940-4. [ Links ]
50. Evenepoel P, Laleman W, Wilmer A, Claes K, Kuypers D, Bammens B, et al. Prometheus versus molecular adsorbents recirculating system: comparison of efficiency in two different liver detoxification devices. Artif Organs 2006 Apr;30(4):276-84. [ Links ]
51. Stadlbauer V, Krisper P, Aigner R, Haditsch B, Jung A, Lackner C, et al. Effect of extracorporeal liver support by MARS and Prometheus on serum cytokines in acute-on-chronic liver failure. Crit Care 2006;10(6):R169. [ Links ]
52. Meyburg J, Hoffmann GF. Liver, liver cell and stem cell transplantation for the treatment of urea cycle defects. Mol Genet Metab 2010;100 Suppl 1:S77-83. [ Links ]
53. Kjaergard LL, Liu J, Als-Nielsen B, Gluud C. Artificial and bioartificial support systems for acute and acute-on-chronic liver failure: a systematic review. JAMA 2003 Jan 8;289(2):217-22. [ Links ]
54. Onodera K, Sakata H, Yonekawa M, Kawamura A. Artificial liver support at present and in the future. J Artif Organs 2006;9(1):17-28. [ Links ]
55. Varo Pérez E, Castroagudin JF. The future of liver transplantation. Transplant Proc 2010 Mar;42(2): 613-6. [ Links ]
Conflicto de intereses: Ninguno declarado.
Financiación: Los autores niegan cualquier relación con la industria que haya suscitado la elaboración de este manuscrito.











 text in
text in 

