Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.18 no.2 Bogotá May/Aug. 2013
CAMBIO ESTACIONAL EN LA FAUNA ACOMPAÑANTE DE LA PESQUERÍA ARTESANAL DE ARRASTRE DE CAMARÓN DEL GOLFO DE SALAMANCA, MAR CARIBE DE COLOMBIA
Seasonal Shift of Bycatch in the Artisanal Shrimp Trawl Fishery of the Gulf of Salamanca, Caribbean Sea of Colombia
LUIS ORLADO DUARTE1 , ROY DÍAZ-VESGA1 FÉLIX CUELLO1 , LUIS MANJARRÉS1
1 Laboratorio de Investigaciones Pesqueras Tropicales, Intropic. Universidad del Magdalena, carrera 32 # 22-08, laboratorio 10. Santa Marta, Colombia. gieep@unimagdalena.edu.co. Autor de correspondencia: Luis Orlando Duarte, luisorlandoduarte@gmail.com.
Presentado el 27 de marzo de 2013, aceptado el 4 de mayo de 2013, correcciones el 13 de junio de 2013.
RESUMEN
La evaluación de la fauna acompañante en las pesquerías de arrastre se ha referido generalmente a una escala anual, ignorando eventuales variaciones estacionales. En el golfo de Salamanca, recientemente opera una flota artesanal de arrastre de camarón, cuya fauna acompañante es evaluada por primera vez en el presente estudio, considerando la estacionalidad climática y oceanográfica que domina la región (descargas continentales y surgencia). Para ello, 90 lances en la época de calmas o lluviosa (noviembre 2010) y 86 en la época de vientos (abril 2011) fueron muestreados a bordo de embarcaciones pesqueras. La proporción fauna acompañante - camarón resultó ser 2,69 (2,37 - 3,21; IC 95 %) y 6,37 (5,10 - 8,24; IC 95 %) en la época de calmas y vientos, respectivamente. Un total de 101 taxa se registraron, con un elevado número de juveniles. La estructura comunitaria de la fauna acompañante difirió entre las épocas climáticas (Anosim, P < 0,001), siendo caracterizada en las dos épocas por Stellifer spp., Symphurus caribbeanus y Callinectes sapidus, en tanto que, adicionalmente, la época de calmas fue caracterizada por Cathorops mapale, Anchovia clupeoides, Trichiurus lepturus y la época de vientos por Larimus breviceps, Cnidaria (medusas), Cetengraulis edentulus (Simper). Los resultados evidenciaron un cambio estacional en la fauna acompañante, indicando la necesidad de implementar programas de monitoreo y medidas de manejo que atiendan a esa variabilidad temporal. Los efectos ecológicos negativos de esta pesquería urgen la utilización de estrategias de mitigación, concertadas con los pescadores, para balancear las necesidades sociales y la conservación del ecosistema.
Palabras clave: ecosistema, estuario, manejo pesquero, surgencia, tropical.
ABSTRACT
Bycatch assessments in trawl fisheries have been mainly referred to an annual scale, ignoring possible seasonal variations. In the Gulf of Salamanca, an artisanal shrimp trawl fleet operates recently and this study evaluates its bycatch for first time, considering the climatic and oceanographic seasonality that dominates the region (runoff and upwelling). 90 hauls in the calm or rainy season (November 2010) and 86 in the windy season (April 2011) were sampled on board of fishing boats. The bycatch to shrimp ratio was 2,69 (2,37 -3,21, 95 % CI) and 6,37 (5,10 - 8,24, 95 % CI) for the calm season and windy season respectively. We recorded a total of 101 taxa, with a large number of juveniles. The community structure of bycatch differed between seasons (ANOSIM, p < 0,001), being characterized both seasons by Stellifer spp., Symphurus caribbeanus y Callinectes sapidus, whereas, in addition, the calm season was characterized by Cathorops mapale, Anchovia clupeoides, Trichiurus lepturus, and the windy season by Larimus breviceps, Cnidaria (jellyfish), Cetengraulis edentulus (Simper). The results showed a seasonal change in the bycatch, raising the need to implement monitoring programs and management measures that address that temporal variability. Negative ecological effects of this fishery prompt the use of mitigation strategies, involving fishermen, to balance social needs and the ecosystem conservation.
Keywords: ecosystem, estuary, fisheries management, tropical, upwelling.
INTRODUCCIÓN
Las pesquerías de arrastre de fondo se han convertido en un problema a nivel global por sus efectos negativos en el ecosistema (Alverson et al., 1994; Jennings y Kaiser, 1998) y por la pérdida acelerada de biodiversidad (Worm et al., 2006). Se han caracterizado por afectar las poblaciones de especies no objetivo y los ecosistemas en que operan, al punto que se ha estimado que la pesca de arrastre de camarón genera más del 27 % de las aproximadamente siete millones de toneladas de biota que desechan las pesquerías mundialmente (Kelleher, 2005). En el Caribe de Colombia, se ha estimado que la pesca acompañante de la pesquería industrial de camarón ascendió anualmente a 7045 t, a partir de observaciones realizadas en las principales áreas de pesca en los años 2000 y 2005 (Duarte et al., 2010). En efecto, la pesquería de arrastre de camarón captura grandes cantidades de pesca acompañante producto de su método de pesca y de los hábitats en que regularmente se desarrolla (Hall et al., 2000; Earys, 2007). La pesca acompañante hace parte de la pesca ilegal, no reportada, ni regulada (Bray, 2000) que es foco de interés de la comunidad científica dado que se requiere tener estimaciones de la captura total (objetivo más acompañante) de los organismos marinos para evaluar apropiadamente el impacto de las pesquerías sobre los ecosistemas (Pitcher et al., 2002). La pesca acompañante está constituida por la captura incidental (especies no objetivo que son aprovechadas debido a su importancia comercial o al interés para el consumo local) y descarte (especies no objetivo sin importancia comercial o que son desechadas por causas culturales o legales) (Alverson et al., 1994). En la actualidad, las implicaciones de la pesca de arrastre en la degradación de los ecosistemas y sus consecuencias sobre la seguridad alimentaria son motivos de investigaciones y del desarrollo de políticas de manejo que conlleven a la reducción de la pesca acompañante (Hall et al., 2000; Davies et al., 2009).
Los estudios globales de la pesca acompañante se han enfocado en las pesquerías industriales toda vez que se ha reconocido que generan elevadas cantidades de descartes y se ha asumido que los niveles de pesca acompañante en las pesquerías artesanales son muy bajos (Kelleher, 2005), no obstante, pesquerías de arrastre de pequeña escala que operan en zonas de crianza, como áreas costeras o estuarios, suelen capturar y desechar grandes cantidades de juveniles de especies comerciales, reduciendo su reclutamiento y el tamaño del stock objetivo de otras flotas (Broadhurst et al., 1996; Sobrino et al., 2005). Existen pocos estudios que evalúen la pesca acompañante de las pesquerías artesanales de arrastre de camarón (Maharaj y Recksiek, 1991; Ambrose et al., 2005; Akyol, 2008; Leal et al., 2009), si bien la identificación y cuantificación de los organismos que son descartados es una información base para poner en la práctica el manejo pesquero basado en el ecosistema que demanda la comunidad científica en la actualidad (Marasco et al., 2007).
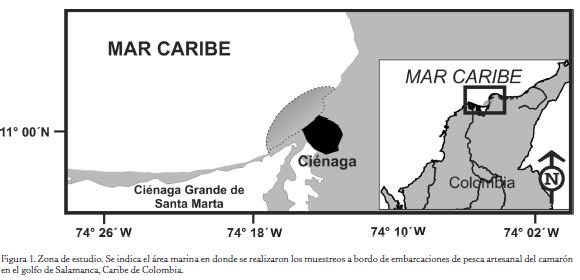
La variabilidad temporal de la fauna acompañante promovida por cambios estacionales climáticos, hidrológicos u oceanográficos ha tenido poca atención, pues los estudios se han centrado en estimaciones anuales (Pitcher et al., 2002). Sin embargo, la estacionalidad de algunos ecosistemas puede ser marcada, como es el caso de los ambientes estuarinos con variaciones intraanuales en la descarga de los cuerpos de agua continentales y de las zonas de surgencia. El golfo de Salamanca (Fig. 1) es un área que recibe la influencia alternada de la surgencia estacional tipo Ekman provocada por los vientos alisios del nororiente que aumentan su intensidad de diciembre a abril (Criales et al., 2002) y las descargas continentales que se incrementan progresivamente en el resto del año durante la época de calmas o de mayor pluviosidad, generada por el desplazamiento hacia el norte de la zona de convergencia intertropical (Mooers y Maul, 1998) (Fig. 2). En esta área, desde aproximadamente el año 2000, se ha desarrollado una pesquería artesanal de arrastre de camarón, conformada por embarcaciones propulsadas con motor fuera de borda, generalmente de 40 hp, que arrastran por popa una red de 7,7 m de relinga superior y tamaño de malla que oscila entre 1/2" y 7/8". La flota estaba constituida por 22 embarcaciones en el año 2011, operando en el sector aledaño a la desembocadura de la Ciénaga Grande de Santa Marta, mediante faenas diarias que parten de las localidades de Ciénaga y Pueblo Viejo. La especie de camarón que significa la mayor captura de la flota es Xiphopenaeus kroyeri (Heller, 1862), siendo menores los desembarques de Farfantepenaeus subtilis (Pérez Farfante, 1967) y Litopenaeus schmitti (Burkenroad, 1936).
Dada la estacionalidad que caracteriza al golfo de Salamanca, se plantea la hipótesis que la proporción y captura por unidad de esfuerzo (CPUE), de fauna acompañante en la pesquería artesanal de arrastre de camarón difiere entre épocas climáticas contrastantes (vientos vs. calmas), al igual que la composición taxonómica de las capturas. El presente estudio prueba dicha hipótesis, evaluando por primera vez la fauna acompañante en la pesquería artesanal de arrastre en el Caribe de Colombia y planteando las implicaciones para el monitoreo y el manejo pesquero de la variación estacional en las capturas.

MATERIALES Y MÉTODOS
El área de estudio corresponde a la zona costera oriental del golfo de Salamanca, departamento del Magdalena (Fig. 1), donde opera la pesquería artesanal de arrastre de camarón. El muestreo se llevó a cabo en noviembre de 2010 y en abril de 2011, meses que corresponden a la finalización de las épocas de calmas (mayor pluviosidad) y de vientos (sequía) respectivamente, a fin de registrar el efecto acumulado de las épocas climáticas contrastantes que caracterizan a la región (Fig. 2).
Dos observadores a bordo de las embarcaciones artesanales registraron el peso total de las capturas, el peso del recurso objetivo (camarones) y el peso de los grupos taxonómicos mayores (peces, crustáceos, moluscos, cnidarios) en cada lance de pesca. Para este propósito se empleó un dinamómetro de 25 g de precisión. La pesca incidental fue identificada taxonómicamente, medida y pesada a bordo. En cada lance, una muestra equivalente a mínimo el 50 % de los descartes, fue trasportada refrigerada al Laboratorio de Investigaciones Pesqueras Tropicales de la Universidad del Magdalena, ubicado en Santa Marta, para su posterior análisis (identificación, pesaje y medición de los especímenes). Para la identificación de los ejemplares se emplearon claves taxonómicas especializadas (Williams, 1984; Farfante, 1988; Cervigón, 1991; Cervigón, 1993; Cervigón, 1994; Cervigón, 1995; Carpenter, 2002; Nelson, 2006).
La proporción entre la biomasa capturada de cada fracción de la fauna acompañante (descartes, incidental) y la biomasa capturada de camarón fue estimada mediante el estadígrafo presentado por Scheaffer et al., (1990) ya que se ha encontrado que brinda resultados más confiables aún en casos en que tanto la fauna acompañante como el camarón son variables (Ye, 2002):
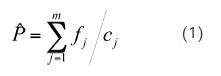
Donde fj es el peso (g) de la fauna acompañante en el lance j de los m lances muestreados y cj es el peso del camarón en el lance j.
Los intervalos de confianza para las proporciones fauna acompañante - camarón se calcularon mediante el método t de Bootstrap (Efron, 1982) ya que ha mostrado mejor desempeño que otros métodos de remuestreo para la estimación de intervalos de confianza de cocientes (Choquet et al., 1999). En cada estimación se calcularon 10000 remuestras Bootstrap empleando una rutina programada en Matlab 6.5 (Mathworks, 2003).
Se estimó la captura por unidad de esfuerzo (CPUE) de los camarones y los componentes de la fauna acompañante (total de la captura y grupos taxonómicos mayores) mediante la ecuación (1) por dos vías: (a) teniendo como denominador la duración del lance a fin de suministrar la CPUE unidades de kg h-1 aplicable para el cálculo de las capturas si se cuenta con el tiempo de arrastre ejercido por la flota y (b) teniendo como denominador el área barrida en cada lance para obtener la CPUE en g m-2, lo cual permite tener un indicador de la densidad capturada por la pesquería como base para eventuales planes de monitoreo de la biota en la región. El área barrida A (m2) fue calculada en cada lance como sigue:
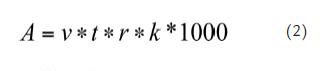
Donde v es la velocidad promedio de la embarcación durante el lance (km h-1), t es la duración del lance (h), r es la longitud de la relinga superior (7,7 m), k es el coeficiente de la abertura de trabajo de la red (0,6).
Los taxa con mayor representación en la fauna acompañante capturada, en cada época cimática, fueron obtenidas empleando la generalización del índice porcentual de Importancia Relativa (IR %) propuesta por Vogler et al., (2009):
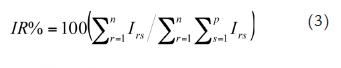
Donde Irs es el valor de la r contribución relativa (en el presente estudio se emplearon el porcentaje en peso, el porcentaje en número y el porcentaje de ocurrencia) del taxón s.
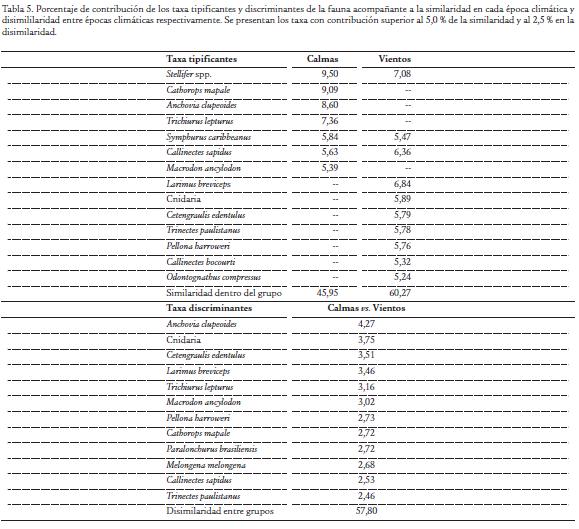
La hipótesis de que no existe diferencia significativa en la estructura comunitaria de la fauna acompañante capturada por la pesquería artesanal de arrastre de camarón entre épocas climáticas contrastantes (calmas vs. vientos), se evaluó con el procedimiento de permutaciones Monte Carlo conocido como Análisis de Similaridad de una vía (Clarke y Green, 1988). Como medida de distancia se empleó el algoritmo de similaridad de Bray Curtis en los datos de densidad (g m-2) capturada de cada taxón por lance, transformados logarítmicamente. Los taxa que caracterizaron la estructura comunitaria de cada época climática (tipificantes) y que diferenciaron la comunidad entre épocas (discriminantes), fueron determinadas calculando la contribución porcentual que hizo cada taxón a la similaridad de una época y a la disimilaridad entre épocas (Clarke, 1993).
RESULTADOS
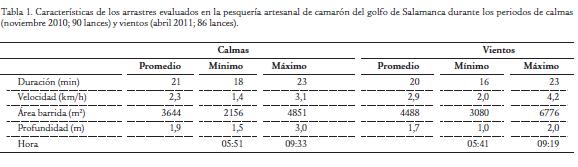
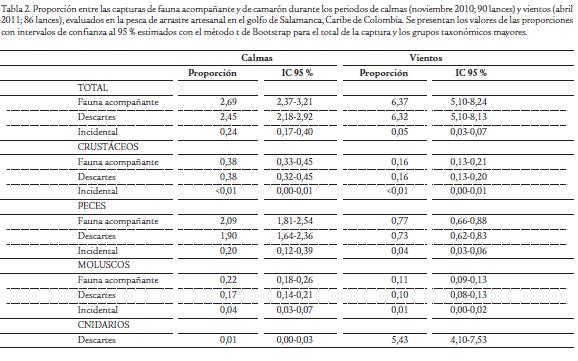
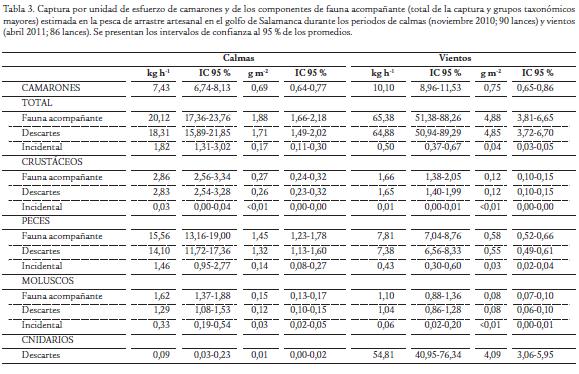
Se muestrearon a bordo un total de 90 lances en la época de calmas y 86 en la época de vientos. Cada día se realizaron seis lances en el horario de la mañana (de acuerdo a la manera cómo opera la flota en la región), por lo cual el muestreo en cada época duró 15 días. Los parámetros de operación fueron similares entre los muestreos (Tabla 1) lo cual permite realizar la comparación de la fauna acompañante capturada entre épocas climáticas. La proporción de fauna acompañante total y de los descartes totales respecto a la captura de camarón varió entre las épocas climáticas, siendo mayor en la época de vientos (Tabla 2), producto de que la captura por unidad de esfuerzo de las medusas (Cnidaria) se incrementó en dos órdenes de magnitud (Tabla 3). La proporción de los demás grupos taxonómicos mayores tendió a ser menor en la época de vientos (Tabla 2), evidenciando una disminución de dichos grupos ya que la captura por unidad de esfuerzo de camarón varió marginalmente entre épocas (Tabla 3) y por tanto es limitada su incidencia en el cambio de las proporciones. Dentro de los grupos taxonómicos mayores, los peces observan los más altos valores de CPUE en las dos épocas, seguidos en su orden por crustáceos (diferentes a los camarones) y moluscos (Tabla 3).
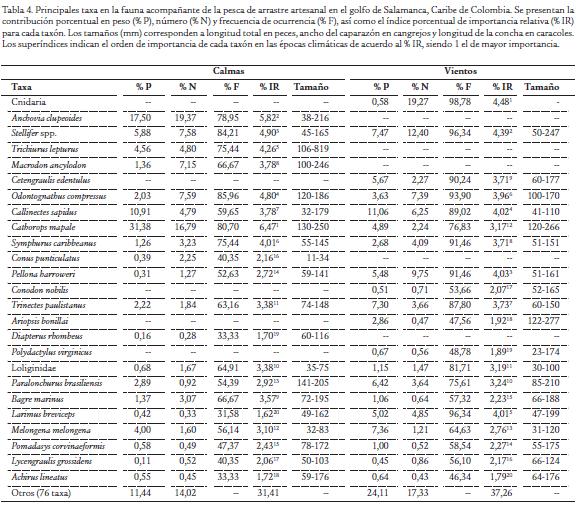
Los descartes representaron el 66 % de la captura total (incluyendo camarones) y el 91 % de la fauna acompañante en la época de calmas, mientras que representaron el 86 % de la captura total y el 99 % de la fauna acompañante en la época de vientos. En todos los grupos taxonómicos mayores, la mayor fracción de la fauna es descartada, aprovechándose como pesca incidental menos del 5 % en crustáceos, menos del 10 % en peces y menos del 20 % en moluscos (Tabla 3). De los 176 lances evaluados a bordo, se analizó en el laboratorio la captura de 134 lances (52 muestreados en la época de calmas y 82 en la época de vientos). Se registraron 101 taxa para un total 34278 individuos que pesaron 3095,85 kg. La tabla 4 muestra las 20 especies de mayor importancia en las capturas de cada época climática de acuerdo con el índice porcentual de importancia relativa (% IR). La composición de la fauna acompañante presentó dos características principales: (a) unos taxa que resultaron dominantes solo en una de las épocas climáticas como es el caso de Anchovia clupeoides, Trichiurus lepturus y Macrodon ancylodon en la época de calmas. En tanto que, en la época de vientos tuvieron esa característica: Cnidaria (medusas), Cetengraulis edentulus y Conodon nobilis; (b) un grupo de taxa dominantes en ambas épocas entre las que se destacan Stellifer spp., Odontognathus compressus, Callinectes sapidus, Cathorops mapale, Symphurus caribbeanus, Pellona harroweri (Tabla 4). Los taxa de invertebrados incluidas dentro de las 20 más importantes en las capturas fueron Cnidaria, Callinectes sapidus, Conus punticulatus, Loliginidae y Melongena melongena (Tabla 4).
Los especímenes capturados fueron de tamaño pequeño, bien sea por ser la característica de la especie (e.g. Cetengraulis edentulus, Odontognathus compressus) o por tratarse de juveniles de especies de mayor tamaño (e.g. Cathorops mapale, Trichiurus lepturus, Paralonchurus brasiliensis, Conodon nobilis) (Tabla 4). El análisis de similaridad indicó que la comunidad de fauna acompañante difirió en estructura entre las épocas climáticas evaluadas (R = 0,560; p < 0.001); aún si se excluyen las medusas, que se capturaron abundantemente en la época de vientos, el análisis muestra diferencias significativas (R = 0,542; p= 0,001). Los taxa que explican la estructura comunitaria, en términos de biomasa, se presentan en la Tabla 5 y son Stellifer spp., Symphurus caribbeanus y Callinectes sapidus, mostrando una elevada biomasa y caracterizan (tipifican) las capturas de las dos épocas climáticas, por lo que pueden considerarse como las especies que dominan permanentemente la comunidad capturada por la pesca artesanal de arrastre de camarón. Los taxa que más contribuyen a la diferenciación de la fauna acompañante entre épocas climáticas (discriminantes) fueron capturadas principalmente en una de las dos épocas, lo que sugiere que ocurren estacionalmente en la zona de pesca (Tabla 5).
DISCUSIÓN
La hipótesis de que la fauna acompañante de la pesquería artesanal de camarón cambia estacionalmente en el golfo de Salamanca fue evaluada en el presente estudio, brindando evidencia de que existe variación en la proporción, cantidad (CPUE) y estructura comunitaria de las capturas entre las épocas climáticas de la región (calmas y vientos). La identificación de la variabilidad temporal de las capturas a varias escalas resulta fundamental para el establecimiento de estrategias de monitoreo apropiadas y formulación de esquemas de manejo efectivos para los recursos acuáticos (Rice, 2001). Con base en el análisis que aquí se presenta, se identifica la necesidad de implementar medidas que mitiguen el efecto de la pesca artesanal considerando el cambio estacional de las capturas; por ejemplo, especies dominantes en las capturas como Cathorops mapale, Anchovia clupeoides, Trichiurus lepturus ameritan particular atención en la época de calmas, en tanto que en la época de vientos se debería enfatizar en especies como Larimus breviceps, Cetengraulis edentulus, Pellona harroweri. En efecto, la aplicación del manejo pesquero basado en el ecosistema debe considerar la variabilidad y requerimientos de las especies que no son objetivo de las pesquerías, así como la protección de especies y hábitats vulnerables con el propósito que se conserve la estructura y dinámica de los ecosistemas, junto con los bienes y servicios que de ellos se derivan (Marasco et al., 2007).
Uno de los cambios estacionales más notorios observados en el análisis, es la dominancia de medusas en las capturas durante la época de vientos (abril), siendo descartadas por la pesquería en su totalidad. La ocurrencia estacional de estos organismos ha sido descrita previamente en la región asociada a los eventos de surgencia (Bernal y Zea, 2000). No obstante, los incrementos recientes en las poblaciones de medusas en ecosistemas impactados antropogénicamente, alerta sobre la posibilidad de tal situación en el golfo de Salamanca, ya que zonas costeras en las que confluyen impactos ambientales promovidos por la pesca (remoción de depredadores de medusas), la variación en los regímenes hidrológicos, los cambios en las salinidad, la contaminación con materia orgánica (eutroficación) y las construcciones portuarias han favorecido la proliferación de medusas (Purcell et al., 2007). Los eventuales incrementos en las poblaciones de medusas deben ser evaluados en el área de estudio, en consideración de que alteraciones, como las previamente mencionadas, ocurren en la región (Vilardy y González, 2011).
La abundancia de especies de peces pelágicos pequeños, principalmente Cetengraulis edentulus, se han asociado a los eventos de surgencia en la región (Duarte y García, 2004); las importancia de esta especie y de Pellona harroweri en las capturas durante la época de vientos (abril) concuerda con esa observación. Otras especies de peces pelágicos pequeños resultaron más importantes en la época de calmas (Anchovia clupeoides, Odontognathus compressus). Una posible alternancia estacional de estas especies ha de ser evaluada, considerando que cumplen papeles ecológicos similares en la trasferencias de energía entre los niveles tróficos inferiores y los depredadores (Duarte y García, 2004).
Las proporciones entre las biomasas de fauna acompañante y la biomasa de camarón que por primera vez se presentan para la pesquería artesanal de arrastre de camarón del golfo de Salamanca, serán de utilidad para estimaciones de la fauna acompañante a partir de los datos de desembarco de camarón, con lo cual se avanza hacia una estimación de la biomasa total extraída por la pesquería, información fundamental para una evaluación real del impacto de la actividad sobre el ecosistema (Pitcher et al., 2002). Esto sin dejar de reconocer la necesidad de programas de monitoreo permanente a bordo de las embarcaciones pesqueras como prerrequisito para diagnosticar el problema, sin recurrir a información anecdótica, y avanzar hacia posibles soluciones (Kenelly y Broadhurst, 1995).
Se ha asumido que los niveles de pesca acompañante en las pesquerías artesanales son muy bajos (Kelleher, 2005) debido a que existen pocos estudios que evalúen ese aspecto en las pesquerías de pequeña escala (Ambrose et al., 2005; Akyol, 2008; Leal et al., 2009). Los resultados del presente estudio indican que cantidades considerables de capturas asociadas a la pesquería artesanal de arrastre de camarón son generadas en el golfo de Salamanca, producto de operación poco selectiva. Si bien los valores de la proporción entre la fauna acompañante y la captura de camarón (de 2,69 a 6,37) en esta pesquería no alcanzan las estimaciones de las pesquerías industriales de camarón tropical (9,30 a 26,00; Duarte et al., 2010), son superiores a las obtenidas en otras regiones en las que operan pesquerías artesanales de camarón, como la Península de Yucatán (0,14; Leal et al., 2009), Nigeria (0,20; Ambrose et al., 2005) y la Bahía Izmir en Turquía (0,78 a 1,30; Akyol, 2008). Esta situación tiene el agravante de que prácticamente toda la fauna acompañante es descartada (91 % en época de calmas y 99 % en época de vientos, de acuerdo a las CPUE estimadas), lo que significa que cantidades considerables de organismos muertos (materia orgánica) están entrando al ecosistema, con posibles efectos en los flujos energéticos y en la estructura trófica por el incremento de detritus (Jennings y Kaiser, 1998; Duarte, 2008). El presente estudio contribuye con información que permitirá obtener evaluaciones más completas de la pesca acompañante en pesquerías de pequeña escala a nivel global.
El área de pesca de camarón del golfo de Salamanca corresponde a una zona estuarina de crianza y de elevada diversidad, como se evidencia con los 101 taxa (la mayoría a nivel de especie) y el tamaño reducido de los especímenes que se registraron en los muestreos. La actividad permanente de la pesquería de arrastre en este tipo de áreas afecta los ciclos vitales de especies comerciales reduciendo su reclutamiento y el tamaño del stock objetivo de otras flotas (Broadhurst et al., 1996; Sobrino et al., 2005). Varias de las especies que dominaron las capturas fueron capturadas como juveniles (e.g. Cathorops mapale, Callinectes sapidus, Paralonchurus brasiliensis, Conodon nobilis) siendo de importancia comercial en estado adulto para otras flotas artesanales que operan en la región. La extracción de juveniles también ha sido registrada en las capturas de la pesca industrial de arrastre de camarón, lo cual evidencia una elevada presión pesquera en la región (Duarte et al., 2006). Adicionalmente, una serie de especies de tamaño pequeño, sin importancia comercial, observan valores de CPUE elevados en las dos épocas climáticas, como es el caso de Symphurus caribbeanus, Trinectes paulistanus, Stellifer spp., pueden jugar un papel crucial en la estructura del ecosistema y en la trasferencia de energía en las redes alimentarias, particularmente en el ambiente bentónico donde depredan organismos infaunales y epifaunales que basan su alimentación en los detritus (e.g. Guedes y Araujo, 2008).
El panorama que aquí se presenta, confirma la necesidad de acciones de mitigación, como el uso de dispositivos reductores de juveniles en la pesca acompañante, evaluadas con la participación de los pescadores, a fin de evitar posibles rechazos a los cambios tecnológicos en las redes (Kenelly y Broadhurst, 1996; Eayrs, 2007). Adicionalmente, se precisan programas de monitoreo y manejo participativo, pues se ha reconocido que la actividad pesquera artesanal sustenta a un número elevado de pescadores artesanales y puede ofrecer ventajas en relación a la pesca industrial, en términos ecológicos, sociales y como fuente de proteína para el consumo humano (Chuenpagdee y Pauly, 2008), en la medida que se implemente efectivamente un manejo responsable.
La pesquería artesanal de arrastre de camarón del golfo de Salamanca observa un cambio estacional en las capturas de fauna acompañante que debe ser considerado en las estrategias de manejo; produce elevados niveles de descartes que pueden alterar la estructura y función del ecosistema; opera en una zona de crianza de una diversidad de especies comerciales y no comerciales, lo cual puede conducir a una sobrepesca por crecimiento. Al tiempo, esta actividad cumple un papel fundamental para la seguridad alimentaria local, pues brinda sustento a pobladores que viven en condiciones de marginalidad. Frente a estos dilemas propios de las áreas explotadas o sobreexplotadas urge que se establezcan estrategias de manejo concertadas entre los diferentes actores involucrados en la zona costera respondiendo a las necesidades sociales, pero respetando la base ecológica que viabiliza el uso de los recursos naturales en el largo plazo.
AGRADECIMIENTOS
Este estudio se desarrolló en el marco del proyecto "Evaluación del efecto ecológico de la pesca artesanal de camarón en el ecosistema del golfo de Salamanca y experimentación de medidas de mitigación" auspiciado por Colciencias (Cód. 1117-489-25529) y la Universidad del Magdalena. Los autores agradecen a los pescadores de la localidad de Ciénaga por su colaboración durante el muestreo y a Rubén Acevedo, Andrés Felipe González, Laura Camacho, Karen Cardona, Andrés Vélez, Johan Rodríguez y Sandra Pérez por su contribución en el procesamiento de las muestras en laboratorio.
BIBLIOGRAFÍA
Akyol O. Fish by-catch species from coastal small-scale shrimp trammel net fishery in the Aegean Sea (Izmir Bay, Turkey). J Appl Ichthyol. 2008;24(3):339-341. [ Links ]
Alverson DL, Freeberg MH, Pope JG, Murawsky SA. A global assessment of fisheries bycatch and discards. Rome: FAO. Fish Tech Pap. 1994;339:1-233. [ Links ]
Ambrose EE, Solarin BB, Isebor CE, Williams AB. Assessment of fish by-catch species from coastal artisanal shrimp beam trawl fisheries in Nigeria. Fish Res. 2005;71(1):125-132. [ Links ]
Bernal AR, Zea S. Estructura de la comunidad de zooplancton en condiciones de descarga continental y de afloramiento costero en Santa Marta, Caribe colombiano. Bol Inst Inv Mar Cost. 2000;29(1):3-26. [ Links ]
Bray K. A global review of illegal, unreporteda nd unregulated (IUU) Fishing Expert consultation on illegal, unreported and unregulated fishing. FAO: IUU/2000/6, 2000. p. 53. [ Links ]
Broadhurst MK, Kenelly SJ, Isaksen B. Assessment of modified codend that reduce the bycatch of fish in two esturine prawn-trawl fisheries in New South Wales, Australia. Fish Res. 1996;27(1):89-111. [ Links ]
Carpenter KE. (ed.) The living marine resources of the Western Central Atlantic. FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. Rome: FAO; 2002. [ Links ]
Cervigón F. Los peces marinos de Venezuela. Vol. I. Caracas: Fundación Científica Los Roques; 1991. [ Links ]
Cervigón F. Los peces marinos de Venezuela. Vol. II Caracas: Fundación Científica Los Roques; 1993. [ Links ]
Cervigón F. Los peces marinos de Venezuela. Vol. III. Caracas: Fundación Científica Los Roques; 1994. [ Links ]
Cervigón F. Los peces marinos de Venezuela. Vol. IV. Caracas: Fundación Científica Los Roques; 1995. [ Links ]
Choquet D, L'ecuyer P, Leger C. Bootstrap confidence intervals for ratios of expectations. ACM TOMACS. 1999;9(4):326-348. [ Links ]
Chuenpagdee R, Pauly D. Small is beautiful? A database approach for global assessment of small-scale fisheries: preliminary results and hypotheses. En: Nielsen JL, Dodson JJ, Friedland K, Hamon TR, Musick J, Vespoor E, editores. Proceedings of the Fourth World Fisheries Congress: Reconciling Fisheries with Conservation. American Fisheries Society, Symposium 49, Bethesda, Maryland. 2008. p. 575-584. [ Links ]
Clarke KL. Non-parametric multivanate analyses of change in community structure. Aust J Ecol. 1993;18(1):117-143 [ Links ]
Clarke KL, Green RH. Statistical design and analysis for a 'biological effects' study. Mar Ecol Prog Ser. 1998; 46:213-22. [ Links ]
Criales MM, Yeung C, Amaya F, Lopez AC, Jones DL, Richards WJ. Larval supply of fishes, shrimps, and crabs into the nursery ground of the Cienaga Grande de Santa Marta, Colombian Caribbean. Caribb J Sci. 2002;38(1-2):52-65. [ Links ]
Davies RWD, Cripps SJ, Nickson A, Porter G. Defining and estimating global marine fisheries bycatch. Mar Pol. 2009;33(4):661-672. [ Links ]
Duarte LO. Coastal Ecosystem Status in Bottom-Up vs. Top. Down Pressures. En: Datta, R, editor. Coastal Ecosystems. Hazards, Management and Rehabilitation. Delhi: NAM S&T Centre; 2008. p. 249-260. [ Links ]
Duarte LO, Garcia CB. Trophic role of small pelagic fishes in a tropical upwelling ecosystem. Ecol Model. 2004; 172(2-4):323-338. [ Links ]
Duarte LO, Gómez-Canchong P, Manjarrés L, García CB, Escobar F, Altamar J, et al. Variabilidad circadiana de la tasa de captura y la estructura de tallas en camarones e ictiofauna acompañante en la pesquería de arrastre del Mar Caribe de Colombia. Invest Mar. 2006;34(1):3-42. [ Links ]
Duarte LO, Manjarrés L, Escobar F. Bottom trawl bycatch assessment of the shrimp fishery in the Caribbean Sea off Colombia. Proc Gulf Caribb Fish Inst. 2010;62:114-119. [ Links ]
Eayrs S. Guía para reducir la captura de fauna incidental (Bycatch) en las pesquerías por arrastre de camarón tropical. Rome: FAO; 2007. [ Links ]
Efron B. The jackknife, the bootstrap and other resampling plans, SIAM CMNS-National Science Foundation Monographs. 1982. p. 38. [ Links ]
Farfante IP. Illustrated Key to Penaeoid Shrimps of Commerce in the Americas. NOAA Tech Rep. NMFS. 1988;64:1-32. [ Links ]
Guedes APP, Araújo FG. Trophic resource partitioning among five flatfish species (Actinopterygii, Pleuronectiformes) in a tropical bay in south-eastern Brazil. J Fish Biol. 2008;72(4):1035-1054. [ Links ]
Hall MA, Alverson DL, Metuzals KI. By-catch: Problems and solutions. Mar Pollut Bull. 2000;41(1-6):204-219. [ Links ]
Jennings S, Kaiser MJ. The effects of fishing on marine ecosystems. Adv Mar Biol. 1998:34:201-352. [ Links ]
Kelleher K. Discards in the world's marine fisheries. An update. Rome: FAO. Fish Tech Pap. 2005;470:1-131. [ Links ]
Kenelly SJ, Broadhurst MK. Fishermen and scientist solving bycatch problems: Examples from Austr alia and Possibilities for the Northeastern United States. En: Solving Bycatch: Considerations for Today and Tomorrow. Alaska Sea Grant College Program Report. No. 96-03. University of Alaska, Fairbanks. 1995; p. 121-128. [ Links ]
Leal SA, Cabrera MA, Salas S. Caracterización de la fauna incidental en la pesquería artesanal de camarón en la laguna de Chabihau, Yucatán, México. Proc Gulf Caribb Fish Inst. 2009;61:163-172. [ Links ]
Maharaj V, Recksiek C. The By-catch From the Artisanal Shrimp Trawl Fishery, Gulf of Paria, Trinidad. Mar Fish Rev. 1991;53(2):9-15. [ Links ]
Marasco RJ, Goodman D, Grimes CB, Lawson PW, Punt AE, Quinn TJ. Ecosystem-based fisheries management: some practical suggestions. Can J Fish Aquat Sci. 2007;64(6): 928-939. [ Links ]
MATHWORKS. Matlab 6.5. Product and documentation. Version 13. The Mathworks, Inc., Natick, MA, USA, 2003. [ Links ]
Mooers CNK, Maul GA. Intra-Americas sea circulation. En: Robinson AR, Brink K, editors. The Sea, vol. 11. New York: Wiley; 1998. p. 183-208. [ Links ]
Nelson J. Fishes of the World. New Jersey; John Wiley & Sons; 2006. [ Links ]
Pitcher TJ, Watson R, Forrest R, Valtysson HP, Guenette S. Estimating illegal and unreported catches from marine ecosystems: a basis for change. Fish Fish. 2002;3(4):317-339. [ Links ]
Purcell JE, Uye S, Lo WT. Anthropogenic causes of jellyfish blooms and their direct consequences for humans: a review. Mar Ecol Prog Ser. 2007;350:153-174. [ Links ]
Rice J. Implications of variability on many time scales for scientific advice on sustainable management of living marine resources. Progr Ocean. 2001;49(1-4):189-209. [ Links ]
Scheaffer RL, Mendenhall W, Ott L. Elementary Survey Sampling, Fourth Edition: Duxbury Press; 1990. [ Links ]
Sobrino I, Baldo F, García-González D, Cuesta JA, Silva-García A, Fernández-Delgado C, et al. The effect of estuarine fisheries on juvenile fish observed within the Guadalquivir Estuary (SW Spain). Fish Res. 2005;76(2):229-242. [ Links ]
Vogler R, Milessi AC, Duarte LO. Changes in trophic level of Squatina Guggenheim with increasing body length: relationships with type, size and trophic level of its prey. Environ Biol Fish. 2009;84(1):41-52. [ Links ]
Vilardy S, González JA, editores. Repensando la Ciénaga: Nuevas miradas y estrategias para la sostenibilidad en la Ciénaga Grande de Santa Marta. Santa Marta Universidad del Magdalena y Universidad Autónoma de Madrid; 2011. [ Links ]
Williams AB. Shrimps, lobsters, and crabs of the Atlantic coast of the Eastern United States, Maine to Florida. Washington: Smithsonian institution press; 1984. [ Links ]
Worm B, Barbier E, Beaumont N, Duffy J, Folke C, Halpern B, et al. Impacts of biodiversity loss on ocean ecosystem services. Science. 2006;314(5800):787-760. [ Links ]
Ye Y. Bias in estimating bycatch-to-shrimp ratios. Aquat Living Resour. 2002;15(3):149-154. [ Links ]