Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina
Print version ISSN 0120-8705
CES Med. vol.26 no.1 Medellín Jan./Jun. 2012
ARTÍCULO DE REVISIÓN
Lo que debemos saber sobre los métodos de sensibilidad a los antifúngicos
What we must know about antifungal suceptibility testing
FRANCHEZCA ZAPATA GONZÁLEZ1, NORA CARDONA CASTRO2
1 Residente Dermatología Universidad CES. Correo: franchezca@gmail.com
2 M.D., MSc. Investigadora Instituto Colombiano de Medicina Tropical - Universidad CES. Grupo de investigación Medicina Tropical CES-ICMT
RESUMEN
El aumento creciente de infecciones fúngicas y la aparición de resistencia a los antimicóticos, han hecho necesario el desarrollo de métodos estandarizados para la determinación de la susceptibilidad antifúngica. Tales métodos deben ser reproducibles y adaptables a un laboratorio asistencial, de manera que permitan la detección de resistencia in vitro, la cual, en la mayoría de los casos, suele correlacionarse con una evolución clínica desfavorable. Tanto el Clinical Laboratory Standards Institute, como el European Committee for Antimicrobial Susceptibility Testing han desarrollado guías para la medición estandarizada de la sensibilidad de varias especies de hongos a los antimicóticos actuales. En la literatura científica colombiana son pocos los datos disponibles sobre la sensibilidad antifúngica, por lo que frente al creciente aumento de la resistencia a los antifúngicos, se hace necesario comenzar a recopilar datos propios. En este artículo se hace una revisión de las últimas publicaciones indexadas en Pubmed con relación a los distintos métodos disponibles para medir la sensibilidad antifúngica y, adicionalmente, se destaca su utilidad en la práctica clínica.
PALABRAS CLAVE
Pruebas de sensibilidad para antifúngicos, Concentración inhibitoria mínima, Antimicóticos, Hongos filamentosos, Levaduras, Revisión
ABSTRACT
The increasing number of fungal infections and the emergence of antifungal resistance, have prompted the development of standardized methods for determining antifungal sensitivity profiles, aiming at obtaining reproducible and adaptable tests that could be done in hospital laboratories for the in vitro determination of resistance as, in most cases, data correlate with an unsatisfactory clinical outcome. Both the Clinical Laboratory Standards Institute (CLSI) and the European Committee for Antimicrobial Susceptibility Testing (EUCAST), have developed guidelines for the interpretation of standardized sensitivity measurements of the various fungal species to current antifungal compounds. In the Colombian scientific literature, few data are available on antifungal sensitivity; however, with the increasing number of antifungal resistant isolates, it is necessary to begin collecting our own data. This paper reviews recent publications in PubMed regarding the various methods of antifungal susceptibility testing and highlights their usefulness in clinical practice.
KEY WORDS
Sensitivity test for antifungals, Minimal inhibitory concentration, Antifungal, Filamentous fungi, Yeasts, Review
INTRODUCCIÓN
Durante las últimas décadas el aumento en la prevalencia de las infecciones fúngicas ha sido constante (1). Los motivos son varios, pero entre ellos destacan el incremento de pacientes inmunosuprimidos, así como de las técnicas diagnósticas y de las estrategias terapéuticas, que han aumentado la población susceptible de sufrir una micosis invasiva (2).
Por tal razón, el establecimiento de un método reproducible in vitro para medir la susceptibilidad antimicrobiana es una herramienta importante para la identificación de microorganismos biológicamente resistentes y seleccionar la terapia antimicrobiana óptima (3).
METODOLOGÍA
En este artículo se hace una revisión exhaustiva de las publicaciones registradas en Pubmed sobre sensibilidad antifúngica realizadas entre enero de 1989 y septiembre de 2011, gracias al empleo de palabras y frases clave como "pruebas de sensibilidad antifúngica", "concentración inhibitoria mínima", "antimicóticos", "hongos filamentosos", y "levaduras". La búsqueda se realizó para los idiomas inglés y castellano. La revisión menciona los diferentes métodos de sensibilidad antifúngica, su papel en la práctica clínica y menciona, por último, los antifúngicos disponibles en nuestro país y su perfil de susceptibilidad in vitro.
PAPEL DE LOS MÉTODOS DE SENSIBILIDAD ANTIFÚNGICOS
En comparación con la terapia antibacteriana, los tratamientos antifúngicos son limitados en cuanto a su eficacia y también son pocos los fármacos disponibles (4). Por otra parte, a diferencia de las bacterias, cuya resistencia emerge rápidamente, los hongos no se vuelven resistentes prontamente, debido a su largo tiempo de replicación.
En la actualidad, la emergencia de resistencia antimicótica se debe, principalmente, al reciente aumento de especies con resistencia natural y a la selección de cepas resistentes durante la terapia antimicótica. Sin embargo, con el uso crónico de tratamientos antifúngicos, principalmente en pacientes inmunosuprimidos, se ha generado menor susceptibilidad y se ha establecido cierta resistencia a los azoles, por parte de algunos aislamientos (3,5).
Así también, el uso de azoles en medicina, agricultura y salud animal, ha producido una selección y diseminación de microorganismos resistentes (5). Para enfrentar este reto es necesario entender los mecanismos de resistencia antifúngica, además de realizar el aislamiento microbiológico de los microorganismos patógenos, junto con pruebas de sensibilidad antifúngica.
MÉTODOS DE SENSIBILIDAD ANTIFÚNGICA
Métodos de dilución en caldo
Anteriormente se empleaban métodos no estandarizados de susceptibilidad a los antifúngicos, los cuales eran inconsistentes y muy poco reproducibles; esto debido a los múltiples factores que influyen en dichos ensayos, como el tamaño del inóculo, la composición y pH del medio, el formato de la prueba y la temperatura de incubación.
En 1992 se publicó en Estados Unidos el primer documento estándar internacional para susceptibilidad de levaduras elaborado por el National Committee for Clinical Laboratory Standards (NCCLS), actualmente Clinical Laboratory Standards Institute (CLSI) basado en un método de macrodilución en caldo (adaptado posteriormente a microdilución) (6,7). Este documento (denominado M27-A) fue aprobado en 1997 para estudiar especies de Candida, hongos filamentosos y en determinados puntos de corte permite medir las concentraciones inhibitorias mínimas (CIM) (definida como concentración mínima de un antimicótico expresada en g/mL, que inhibirá o reducirá el crecimiento de un moho o levadura in vitro de las principales especies de levaduras oportunistas [Candida spp, Cryptococcus neoformans] y hongos filamentosos microscópicos, (documento M38-A) (7).
Además, en los últimos años, se ha logrado estandarizar el método de difusión en agar en el documento M-44 del CLSI (8,9). Más recientemente, el European Committee on Antimicrobial Susceptibility Testing (EUCAST) ha aprobado metodologías de referencia para algunos compuestos antifúngicos (documento EDef 7.1) (10).
Los métodos de dilución en caldo constituyen el estándar de oro para determinar la susceptibilidad in vitro, tanto de levaduras como de hongos filamentosos y miden la concentración inhibitoria mínima de distintos fármacos antifúngicos, como anfotericina B, fluocitosina, fluconazol, ketoconazol, itraconazol y los nuevos triazoles como voriconazol, posaconazol y ravuconazol (10).
El método EUCAST ha demostrado equivalencia al CLSI, en materia de levaduras no fermenta doras y por lo tanto, sólo ha sido validado para Candida spp (6,11-14).
Varios de los trabajos que han comparado el CLSI con el EUCAST, han encontrado una concordancia esencial (concordancia dentro de ± una dilución del sistema evaluado y el método de referencia) que va desde 96,9% (voriconazol) hasta 98,6 % (fluconazol) para especies de Candida (15).
Pfaller y colaboradores también hallaron una excelente concordancia categórica (concordancia entre los resultados interpretados del test evaluado y el método de referencia) entre ambos métodos y especies de Candida; la cual variaba entre 90,8 % y 99,2 % para todas las comparaciones entre el EUCAST y el CLSI, empleando fluconazol, posaconazol y voriconazol, en cultivos de C. albicans, C. Glabrata, C parapsilosis, C tropicalis y C. Krusei.
Para la medición de dicha concordancia categórica se emplearon valores de corte epidemiológico (VCE) previamente determinados (16). Estos valores separan las poblaciones que carecen o no expresan mecanismos de resistencia, de aquellas que sí los presentan y expresan. Los puntos de corte que definen la categoría clínica sensible no necesariamente han de coincidir con los VCE (12).
Ambos métodos de dilución en caldo, EUCAST y CLSI, han demostrado ser comparables al predecir falla terapéutica cuando se determina una CIM > 4 mcg/ml luego de 24 horas de tratamiento con fluconazol. Demostrándose un 91,6 % de tasa de éxito cuando la CIM es < de 2 mcg/ml, 82,7% para una CIM de 4 mcg/ml y sólo 37,3% de éxito cuando la CIM es 8 mcg/ml (16).
Ambos estándares son cultivados en el mismo medio (RPMI 1640 con glutamina, sin bicarbonato y con una concentración de glucosa de 0,2 % y 2 %, CLSI y EUCAST, respectivamente) y se incuban a una temperatura de 35-37 °C (ver cuadro 1). Sin embargo, difieren en su metodología para evaluar susceptibilidad de levaduras fermentadoras como Candida spp y el tiempo de incubación (24 horas para EUCAST y 48 horas para el estándar CLSI), pues el primero utiliza un inóculo mayor, el fondo del pocillo de la placa de microdilución (plano para EUCAST y redondo para CLSI) y en su lectura (espectrofotométrica en EUCAST, visual en CLSI) (6,13).
Desde el punto de vista práctico, el método EUCAST es menos laborioso, más fácil de interpretar y arroja resultados definitivos a las 24 horas de incubación. Recientemente, se han realizado estudios para validar la lectura de las CIM de levaduras del género Cándida a las 24 horas, utilizando el método del CLSI con buenos resultados (6,11,12,17).
Las desventajas de las pruebas de susceptibilidad basados en microdilución son:
• Fallas en discriminar cepas resistentes a anfotericina B (el uso de medio AM3 o de Etest® es mejor).
• Aún falta por establecer puntos de corte a varios hongos y fármacos antifúngicos.
• Crecimiento residual descrito con fármacos fungistáticos como los azoles y la fluorocitosina.
• Problemas de crecimiento en determinadas especies como C. neoformans y otras levaduras (2,6,13).
Métodos de difusión de disco
Es un método simple, idóneo para ser realizado en agentes solubles en agua como flucitosina, fluconazol y voriconazol. Fue estandarizado por el CLSI en el documento M44-P para especies de Candida (6,18-20). Este método provee una zona de inhibición y la medida de ésta puede ser correlacionada con el valor de CIM, el cual fue demostrado por varios miles de levaduras aisladas en un estudio multinacional (18,21,22) La desventaja es que sólo existen puntos de corte para fluconazol y voriconazol. La utilización de azul de metileno, disperso en la superficie de la placa, parece mejorar los límites de la zona de inhibición y facilitar la lectura.
Métodos comerciales
Etest
Es uno de los métodos más utilizados debido a su fácil implementación y lectura. Actualmente se encuentra aprobado por la Food and Drug Administration (FDA) para susceptibilidad in vitro de Candida spp contra fluconazol e itraconazol (6). Involucra la inoculación del hongo en la superficie de un agar, seguido de la aplicación de una tira plástica impregnada con un gradiente de concentración del antifúngico, lo cual permite determinar la CIM. Luego, la placa se incuba a 37 °C por 24-48 h y se genera una elipse de inhibición que permite obtener la CIM. Se ha utilizado en levaduras y en hongos filamentosos y mide la CIM a la anfotericina B, fluconazol, itraconazol, fluocitosina, voriconazol, posaconazol y caspofungina.
Este método ha sido uno de los más eficaces comparado con el método de referencia de microdilución para detectar resistencia a anfotericina B en especies de Candida. Presenta dificultades en la lectura con C. tropicalis, C. neoformans y Trichosporon asahii. Además, estudios recientes han fallado en validar la correlación entre el curso clínico y la resistencia in vitro determinada por Etest o por métodos de microdilución CLSI (23-26).
Otros métodos comerciales
El método comercial cuyo formato se asemeja más a la metodología del CLSI es el Sensitre® YeastOne (TREK Diagnostic Systems). Ha sido aprobado por la FDA y se basa en la microdilución en caldo, pero con un sustrato cromogénico para facilitar la interpretación de la CIM (6,13). Incluye el uso de medio RPMI suplementado con glucosa e incorporación de azul alamar como indicador colorimétrico de oxidación-reducción.
En este sistema, el color rojo indica crecimiento, mientras que el púrpura revela inhibición. Esta prueba ha sido investigada para la evaluación de la sensibilidad de Candida spp. a la anfotericina B, flucitosina, fluconazol, itraconazol, y más recientemente contra voriconazol, caspofungina y posaconazol, con buenos porcentajes de equivalencia cuando se compara con el estándar CLSI (6,13,27,28).
Otro método disponible en Colombia, junto con el Etest®, es el Vitek 2® (Biomerieux), que es un método automatizado para determinar la CIM, utilizando una lectura espectrofotométrica. Tiene la ventaja de encontrarse acoplado a la identificación de levaduras y ha demostrado tener un alto nivel de reproductibilidad y equivalencia comparado con el CLSI. Además, los resultados pueden obtenerse a partir de las 10 hasta las 26 horas de incubación (29-31).
Indicaciones de los estudios de sensibilidad a los antifúngicos
No existen indicaciones estrictas para hacer estudios de sensibilidad y las recomendaciones se basan en opiniones de expertos, conferencias de consenso y estudios controlados con muestras reducidas. Algunos autores recomiendan realizar estudios de sensibilidad en (1,2,6,32,33):
• Estudios de vigilancia epidemiológica que permitan conocer los perfiles de susceptibilidad y resistencia de cepas clínicas, aisladas principalmente de infecciones invasoras en un país o zona geográfica. De esta forma se pueden establecer cuáles son los tratamientos iniciales más adecuados o si se debe cambiar de tratamiento una vez que se ha identificado la especie (sensibilidad predecible).
• Todas las cepas que proceden de infecciones invasivas o de enfermos con algún tipo de inmunosupresión.
• Casos de fracaso terapéutico.
• Enfermos que han recibido profilaxis antifúngica previa.
• Casos en los que se ha aislado una especie poco frecuente, de la que se desconoce su espectro de sensibilidad in vitro o que presentan alta resistencia a medicamentos antifúngicos.
• Determinar el nivel de resistencia frente a nuevos compuestos con actividad antifúngica.
En estas situaciones, el estudio de sensibilidad puede ayudar a elegir el tratamiento más adecuado o incluso a variar la estrategia terapéutica específica, aumentando la dosis del antifúngico, cambiando de fármaco o instaurando una terapia combinada (13,32,33).
PERFILES DE SUSCEPTIBILIDAD IN VITRO DE LOS DIFERENTES MEDICAMENTOS ANTIFÚNGICOS
Anfotericina B
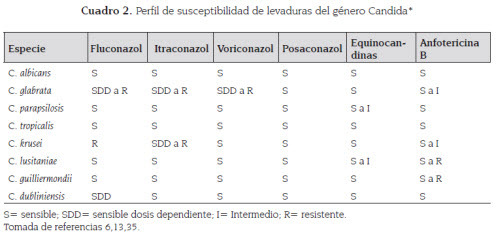
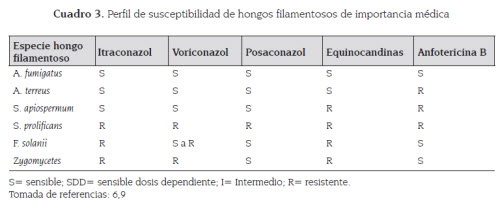
Es un antifúngico de amplio espectro de la familia de los polienos. Actúa contra casi todos los hongos causantes de micosis endémicos y oportunistas. Las excepciones son Candida lusitaniae (ver cuadro 2) y algunos patógenos emergentes como Trichosporon asahii, Fusarium spp., Pseudallescheria boydii, Scedosporium prolificans, y Paecilomyces lilacinus (ver cuadro 3) (3,34).
Reportes más recientes han sugerido que C. glabrata y C. krusei podrían ser menos susceptibles a la anfotericina B que otras especies de levaduras. También Aspergillus terreus y Scedosporium apiospermum han demostrado una reducida susceptibilidad in vitro a la anfotericina B y aun así responden mejor in vivo que otros agentes (18,35,36).
La resistencia a anfotericina puede ser primaria o secundaria. La primera es la más frecuente y se debe principalmente a alteraciones en el ergosterol que forma la membrana. La descripción de resistencia secundaria se restringe a casos anecdóticos de pacientes que habían recibido polienos no reabsorbibles como profilaxis antifúngica (37,38). Los datos disponibles sugieren que la anfotericina B debe ser suministrada en dosis diarias y que para el éxito de la terapia se deben alcanzar concentraciones elevadas. Las infusiones prolongadas deben evitarse y las dosis de escalamiento parecen ser útiles en las infecciones clínicamente refractarias (18).
Azoles
Los triazoles son efectivos contra los dermatofitos, C. albicans, especies no C. albicans s., Cryptococcus neoformans y hongos dimórficos endémicos (39-41). El fluconazol es inefectivo contra todos los mohos, mientras que itraconazol, voriconazol, posaconazol y ravuconazol, ofrecen una mejor actividad (42-46).
La suceptibilidad in vitro del posaconazol ha demostrado una excelente efectividad contra Aspergillus spp., Fusarium spp., Zigomicetos (incluyendo Rhizopus, Absidia y Cunninghamella spp.) y Scedosporium apiospermum. Sin embargo, no es efectivo para S. prolificans, que es refractario a todos los antifúngicos disponibles. La efectividad in vitro de posaconazol es superior a voriconazol contra de Fusarium spp. y Zigomicetos. Esta actividad ha sido demostrada clínicamente en varios estudios utilizando posaconazol para el tratamiento de fusariosis y otras infecciones fúngicas refractarias (36,47-49).
Con respecto a las levaduras, el tratamiento con derivados azólicos ha sido asociado con la nueva emergencia de Candida krusei (la cual es innatamente resistente a fluconazol) y Candida glabrata (que puede tener resistencia innata o desarrollarla rápidamente mediante generación de bombas de eflujo del medicamento) (18,33). Las curvas de dispersión de CIM de voriconazol o posaconazol versus CIM de fluconazol para C. glabrata muestran altos niveles de correlación, sugiriendo que el aislamiento de ésta, a menudo muestra reducida susceptibilidad, aunque no necesariamente resistencia completa a los otros azoles. Esto no es cierto para C. krusei, la cual, a pesar de ser innatamente resistente a fluconazol, es susceptible a voriconazol y posaconazol (18).
Antes de la introducción del tratamiento antirretroviral altamente efectivo para el VIH (HAART, por sus siglas en inglés), la resistencia emergente a los azoles en contra de C. albicans de la cavidad oral era un problema; sin embargo, esta infección ha venido en descenso en los últimos años. Concomitantemente, se ha reconocido que altas dosis con regímenes cortos de azoles disminuyen el riesgo de resistencia (18,50).
También ha habido reportes de resistencia a Cryptococcus neoformans en pacientes con VIH con tratamientos prolongados con fluconazol. Sin embargo, a pesar del tratamiento supresor a largo plazo con fluconazol en este grupo de pacientes, no han surgido problemas clínicos serios y la resistencia es raramente la causa de las recaídas (18,51).
Equinocandinas
Hay tres equinocandinas disponibles en la práctica clínica: caspofungina, micofungina y anidulafungina. Los tres medicamentos han demostrado buena efectividad contra Candida spp. y Aspergillus spp, pero poca actividad para otros géneros de levaduras.
En particular, los basidiomicetos como Cryptococcus spp., Rhodotorula spp. y Trichosporon spp., los mohos del género Fusarium y los zigomicetos, demostraron resistencia innata a este tipo de agentes.
Las ventajas de las equinocandinas son considerables debido a sus excelentes perfiles de seguridad; además, con micafungina y anidulafungina es posible escalar sus dosis por encima de la dosis estándar. Como resultado, las equinocandinas tienden a ser usadas en combinación con otros antifúngicos en el manejo de afecciones por mohos.
Hasta el momento hay pocos reportes de fallas clínicas debido a la emergencia de resistencia a esta clase de agentes (cuadro 3) (5,52-56).
CONCLUSIONES
Desde hace más de 20 años tenemos a nuestra disposición distintos métodos de susceptibilidad antimicótica, que han demostrado ser una herramienta muy útil para combatir las infecciones fúngicas emergentes. La detección de resistencia a los medicamentos antifúngicos permite cambiar o ajustar las terapias de acuerdo con la sensibilidad, desarrollar nuevos fármacos y modificar los ya existentes. Sin embargo, en nuestro medio estos métodos no están siempre disponibles y son muy pocos los estudios epidemiológicos que evalúan la susceptibilidad de las infecciones fúngicas a los antimicóticos disponibles. Por ello, es importante contar con un centro de referencia que disponga de los recursos humanos y económicos para realizar este tipo de pruebas.
REFERENCIAS
1. Gadea I, Cuenca-Estrella M, Martín E, Pemán J, Pontón J, Rodríguez-Tudela JL. Microbiological procedures for diagnosing mycoses and for antifungal susceptibility testing. Enferm Infecc Microbiol Clin 2007 May; 25(5):336-40. [ Links ]
2. Gadea I, Cuenca-Estrella M. Guidelines for fungal diagnoses and antifungal sensitivity studies. Enferm Infecc Microbiol Clin 2004 Ene; 22(1):32-9. [ Links ]
3. Groll AH, Kolve H. Antifungal agents: in vitro susceptibility testing, pharmacodynamics, and prospects for combination therapy. Eur J Clin Microbiol Infect Dis 2004 Abr; 23(4):256-70. [ Links ]
4. Gupta AK, Cooper EA. Update in antifungal therapy of dermatophytosis. Mycopathologia 2008 May 14; 166:353-67. [ Links ]
5. Chamilos G, Kontoyiannis DP. Update on antifungal drug resistance mechanisms of Aspergillus fumigatus. Drug Resist Upda. 2005 Dic; 8(6):344-58. [ Links ]
6. Tapia P CV. An update on antifungal susceptibility testing. Rev Chilena Infectol 2009 Abr; 26(2):144-50. [ Links ]
7. Espinel-Ingroff A, Fothergill A, Ghannoum M, Manavathu E, Ostrosky-Zeichner L, Pfaller MA, et al. Quality control and reference guidelines for CLSI broth microdilution method (M38-A Document) for susceptibility testing of anidulafungin against molds. J Clin Microbiol. 2007 May 2; 45:2180-2. [ Links ]
8. Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Meis JF, Gould IM, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance study, 1997 to 2005: an 8.5-year analysis of susceptibilities of Candida species and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing. J Clin Microbiol 2007 Jun; 45(6):1735-45. [ Links ]
9. Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Bijie H, Dzierzanowska D, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance Study, 1997 to 2007: A 5-year analysis of susceptibilities of noncandidal yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing. J Clin Microbiol 2009 Ene; 47(1):117-23. [ Links ]
10. EUCAST definitive document EDef 7.1: method for the determination of broth dilution MICs of antifungal agents for fermentative yeasts. Clin Microbiol Infect 2008 Abr; 4(4):398-405. [ Links ]
11. Duarte C, Pulido N, Rivas P, Sánchez R, Cortés JA, Cuervo S. Comparación de métodos de microdilución CLSI M27-A2 y EUCAST en aislamientos de Candida spp. en pacientes con cáncer. Infectio 2010 dic; 14(S2):s107- s115. [ Links ]
12. Pfaller MA, Espinel-Ingroff A, Boyken L, Hollis RJ, Kroeger J, Messer SA, et al. Comparison of the broth microdilution (BMD) method of the European Committee on Antimicrobial Susceptibility Testing with the 24-Hour CLSI BMD method for testing susceptibility of candida species to fluconazole, posaconazole, and voriconazole by use of epidemiological cutoff values. J Clin Microbiol 2011 Ene 12; 49:845-50. [ Links ]
13. Arikan S. Current status of antifungal susceptibility testing methods. Medical Mycology 2007 Ene; 45:569-87. [ Links ]
14. Cuenca-Estrella M, Rodriguez-Tudela JL. The current role of the reference procedures by CLSI and EUCAST in the detection of resistance to antifungal agents in vitro. Expert Review of Anti-infective Therapy 2010 Mar; 8:267-76. [ Links ]
15. Pfaller MA, Andes D, Diekema DJ, Espinel- Ingroff A, Sheehan D. Wild-type MIC distributions, epidemiological cutoff values and species-specific clinical breakpoints for fluconazole and Candida: Time for harmonization of CLSI and EUCAST broth microdilution methods. Drug Resistance Updates 2010 dic; 13(6):180-95. [ Links ]
16. Cantón R. Lectura interpretada del antibiograma: una necesidad clínica. Enfermedades Infecciosas y Microbiología Clínica. 2010 jun; 28(6):375-85. [ Links ]
17. Pfaller MA, Boyken LB, Hollis RJ, Kroeger J, Messer SA, Tendolkar S, et al. Validation of 24-hour posaconazole and voriconazole MIC readings versus the CLSI 48-hour broth microdilution reference method: application of epidemiological cutoff values to results from a global Candida antifungal surveillance program. J Clin Microbiol 2011 Abr; 49(4):1274-9. [ Links ]
18. Johnson EM. Issues in antifungal susceptibility testing. J Antimicrob. Chemother 2008 Ene; 61 Suppl 1:i13-8. [ Links ]
19. Pfaller MA, Messer SA, Boyken L, Rice C, Tendolkar S, Hollis RJ, et al. Evaluation of the NCCLS M44-P disk diffusion method for determining susceptibilities of 276 clinical isolates of Cryptococcus neoformans to fluconazole. J Clin Microbiol 2004 Ene; 42(1):380-3. [ Links ]
20. Cantón E, Espinel-Ingroff A, Pemán J. Trends in antifungal susceptibility testing using CLSI reference and commercial methods. Expert Review of Anti-infective Therapy 2009 Feb;7:107-19. [ Links ]
21. Pfaller MA, Boyken L, Hollis RJ, Kroeger J, Messer SA, Tendolkar S, et al. Comparison of results of fluconazole and voriconazole disk diffusion testing for Candida spp. with results from a central reference laboratory in the ARTEMIS DISK Global Antifungal Surveillance Program. Diagn Microbiol Infect Dis 2009 Sep;65(1):27-34. [ Links ]
22. Pfaller MA, Hazen KC, Messer SA, Boyken L, Tendolkar S, Hollis RJ, et al. Comparison of results of fluconazole disk diffusion testing for Candida species with results from a central reference laboratory in the ARTEMIS global antifungal surveillance program. J Clin Microbiol 2004 Ago;42(8):3607-12. [ Links ]
23. Metin DY, Hilmioglu-Polat S, Samlioglu P, Doganay- Oflazoglu B, Inci R, Tumbay E. Evaluation of antifungal susceptibility testing with microdilution and Etest methods of Candida blood isolates. Mycopathologia 2011 Sep; 172(3):187-99. [ Links ]
24. Fleck R, Dietz A, Hof H. In vitro susceptibility of Candida species to five antifungal agents in a German university hospital assessed by the reference broth microdilution method and Etest. J Antimicrob Chemother 2007 Abr; 59(4):767-71. [ Links ]
25. Pfaller MA, Castanheira M, Diekema DJ, Messer SA, Moet GJ, Jones RN. Comparison of European Committee on Antimicrobial Susceptibility Testing (EUCAST) and Etest methods with the CLSI broth microdilution method for echinocandin susceptibility testing of Candida species. J Clin Microbiol 2010 May; 48(5):1592-9. [ Links ]
26. Lass-Flörl C. In vitro susceptibility testing in Aspergillus species: an update. Future Microbiol. 2010 May; 5(5):789-99. [ Links ]
27. Bernal S, Aller AI, Chávez M, Valverde A, Serrano C, Gutiérrez MJ, et al. Comparison of the Sensititre YeastOne colorimetric microdilution panel and the NCCLS broth microdilution method for antifungal susceptibility testing against Candida species. Chemotherapy. 2002 Mar; 48(1):21-5. [ Links ]
28. Pfaller MA, Espinel-Ingroff A, Jones RN. Clinical evaluation of the Sensititre YeastOne colorimetric antifungal plate for antifungal susceptibility testing of the new triazoles voriconazole, posaconazole, and ravuconazole. J Clin Microbiol 2004 Oct; 42(10):4577-80. [ Links ]
29. Pfaller MA, Diekema DJ, Procop GW, Rinaldi MG. Multicenter comparison of the VITEK 2 antifungal susceptibility test with the CLSI broth microdilution reference method for testing amphotericin B, flucytosine, and voriconazole against Candida spp. J Clin Microbiol 2007 Nov; 45(11):3522-8. [ Links ]
30. Peterson JF, Pfaller MA, Diekema DJ, Rinaldi MG, Riebe KM, Ledeboer NA. Multicenter comparison of the Vitek 2 antifungal susceptibility test with the CLSI broth microdilution reference method for testing caspofungin, micafungin, and posaconazole against Candida spp. J Clin Microbiol 2011 May; 49(5):1765-71. [ Links ]
31. Farina C, Manso E, Andreoni S, Conte M, Fazii P, Lombardi G, et al. Interlaboratory evaluation of VITEK2 system and Sensititre YeastOne® for antifungal susceptibility testing of yeasts isolated from blood cultures against four antifungal agents. New Microbiol. 2011 Abr;34(2):195-201. [ Links ]
32. Cuenca-Estrella M, Rodriguez-Tudela JL. Should antifungal treatments be based upon results of antifungal susceptibility testing? Rev Iberoam Micol 2002 Sep; 19(3):133-8. [ Links ]
33. Fothergill AW, Rinaldi MG, Sutton DA. Antifungal susceptibility testing. Infect Dis Clin North Am 2006 Sep; 20(3):699-709. [ Links ]
34. Groll AH, Walsh TJ. Uncommon opportunistic fungi: new nosocomial threats. Clin Microbiol Infect 2001;7 Suppl 2:8-24. [ Links ]
35. Pfaller MA, Diekema DJ. Rare and emerging opportunistic fungal pathogens: concern for resistance beyond Candida albicans and Aspergillus fumigatus. J Clin Microbiol 2004 Oct; 42(10):4419-31. [ Links ]
36. Forrest G. Role of antifungal susceptibility testing in patient management. Curr OpinInfect Dis 2006 Dic; 19(6):538-43. [ Links ]
37. Kontoyiannis DP, Lewis RE. Antifungal drug resistance of pathogenic fungi. Lancet 2002 Mar 30; 359(9312):1135-44. [ Links ]
38. Perea S, Patterson TF. Antifungal resistance in pathogenic fungi. Clin Infect Dis 2002 Nov 1; 35(9):1073-80. [ Links ]
39. Groll AH, Gea-Banacloche JC, Glasmacher A, Just-Nuebling G, Maschmeyer G, Walsh TJ. Clinical pharmacology of antifungal compounds. Infect Dis Clin North Am 2003 Mar; 17(1):159-91, ix. [ Links ]
40. Grant SM, Clissold SP. Fluconazole. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in superficial and systemic mycoses. Drugs 1990 Jun; 39(6):877-916. [ Links ]
41. Grant SM, Clissold SP. Itraconazole. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in superficial and systemic mycoses. Drugs 1989 Mar; 37(3):310-44. [ Links ]
42. Cuenca-Estrella M, Gomez-Lopez A, Mellado E, Buitrago MJ, Monzon A,Rodriguez-Tudela JL. Head-to-head comparison of the activities of currently available antifungal agents against 3,378 Spanish clinical isolates of yeasts and filamentous fungi. Antimicrob Agents Chemother 2006 Mar; 50(3):917-21. [ Links ]
43. Pfaller MA, Messer SA, Hollis RJ, Jones RN. Antifungal activities of posaconazole, ravuconazole, and voriconazole compared to those of itraconazole and amphotericin B against 239 clinical isolates of Aspergillus spp. and other filamentous fungi: report from SENTRY Antimicrobial Surveillance Program, 2000. Antimicrob Agents Chemother 2002 Abr;46(4):1032-7. [ Links ]
44. Gupta A, Tomas E. New antifungal agents. Dermatologic Clinics 2003 Jul;21:565-76. [ Links ]
45. Rubio Calvo MC, Gil J, Ramírez de Ocáriz I, Benito R, Rezusta A. [In vitro activity of fluconazole, voriconazole and posaconazole against Candida spp] Rev Esp Quimioter. 2003 Jun;16(2):227-32. [ Links ]
46. Pemán J, Cantón E, Calabuig E, Bosch M, Valentí A, Viudes A, et al. [In vitro activity of voriconazole against yeast and algae isolates according to new resistance pattern cut-off points]. Rev Esp Quimioter 2006 Mar;19(1):21-33. [ Links ]
47. Raad II, Hachem RY, Herbrecht R, Graybill JR, Hare R, Corcoran G, et al. Posaconazole as salvage treatment for invasive fusariosis in patients with underlying hematologic malignancy and other conditions. Clin Infect Dis 2006 May 15;42(10):1398-403. [ Links ]
48. van Burik J-AH, Hare RS, Solomon HF, Corrado ML, Kontoyiannis DP. Posaconazole is effective as salvage therapy in zygomycosis: a retrospective summary of 91 cases. Clin Infect Dis 2006 Abr 1;42(7):e61-5. [ Links ]
49. Klepser M. Development, clinical utility, and place in therapy of posaconazole for prevention and treatment of invasive fungal infections. Drug Design, Development and Therapy 2010; 4: 299-311. [ Links ]
50. Johnson EM, Warnock DW, Luker J, Porter SR, Scully C. Emergence of azole drug resistance in Candida species from HIV-infected patients receiving prolonged fluconazole therapy for oral candidosis. J Antimicrob Chemother 1995 Ene; 35(1):103- 14. [ Links ]
51. Birley HD, Johnson EM, McDonald P, Parry C, Carey PB, Warnock DW. Azole drug resistance as a cause of clinical relapse in AIDS patients with cryptococcal meningitis. Int J STD AIDS. 1995 Oct; 6(5):353-5. [ Links ]
52. Maertens J, Raad I, Petrikkos G, Boogaerts M, Selleslag D, Petersen FB, et al. Efficacy and safety of caspofungin for treatment of invasive aspergillosis in patients refractory to or intolerant of conventional antifungal therapy. Clin. Infect. Dis. 2004 Dic 1; 39(11):1563-71. [ Links ]
53. Kahn JN, Hsu M-J, Racine F, Giacobbe R, Motyl M. Caspofungin susceptibility in Aspergillus and non-Aspergillus molds: inhibition of glucan synthase and reduction of beta- D-1,3 glucan levels in culture. Antimicrob Agents Chemother 2006 Jun;50(6):2214-6. [ Links ]
54. Zaas AK, Steinbach WJ. Micafungin: the US perspective. Expert Rev Anti Infect Ther. 2005 Abr;3(2):183-90. [ Links ]
55. Mazzei T, Novelli A. Pharmacological properties of antifungal drugs with a focus on anidulafungin. Drugs 2009;69 Suppl 1:79-90. [ Links ]
56. Holt SL, Drew RH. Echinocandins: Addressing outstanding questions surrounding treatment of invasive fungal infections. Am J of Health-System Pharmacy 2011 Jun 20;68:1207-20. [ Links ]
Recibido en: noviembre 3 de 2011. Revisado en: abril de 2012. Aceptado en: junio 30 de 2012
Forma de citar: Zapata-González F, Cardona-Castro N. Lo que debemos saber sobre los métodos de sensibilidad a los antifúngicos. Rev CES Med 2012; 26(1): 71-83