Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 no.3 Bogotá July/Sept. 2012
Tumores quísticos del páncreas: visión quirúrgica y cohorte de pacientes
Cystic tumors of the pancreas: Surgical vision and a patient cohort
Manuel Santiago Mosquera, MD (1), Akram Kadamani A, MD (1), Carlos Felipe Chaux MD (2), Humberto Bohórquez, MD (3), Carlos A. Sánchez Pignalosa, MD (4), Gabriel Sánchez de Guzmán, MD (1)
(1) Servicio de Cirugía y Especialidades. Fundación Cardioinfantil - Instituto de Cardiología (FCI-IC). Bogotá. Colombia
(2) Cirujano General. Cirujano Laparoscopista Clínica VIP. Bogotá, Colombia
(3) Cirujano de Trasplante de Órganos Abdominales. Sección de Transplante de Órganos Abdominales. Ochsner Clinic. New Orleans, Los Angeles, USA.
(4) Residente IV Cirugía General Universidad de la Sábana. Bogotá, Colombia
Fecha recibido: 30-08-11 Fecha aceptado: 17-08-12
Resumen
Se presenta una cohorte retrospectiva de diez pacientes con tumores quísticos del páncreas, intervenidos en su mayoría – algunos por laparoscopia –, haciendo énfasis en su estudio, diagnóstico y tratamiento quirúrgico, mostrando algunas de las variables evaluadas en su manejo y con especial mención de su enfoque quirúrgico con base en una revisión sistemática de la literatura.
Palabras clave
Tumores quísticos del páncreas (TQP), cistadenoma seroso (CS), cistadenoma mucinoso (CM), tumor papilar intraductal (TPI), tumor quístico papilar (TQP).
Abstract
We present a retrospective study of a cohort of ten patients with cystic tumors of the pancreas, most of whom underwent surgery. The study emphasizes study, diagnosis, and treatment of the four who underwent laparoscopic surgery. It presents some of the variables analyzed in their management and pays special attention to their surgery treatment. A systematic review of the literature is also included.
Key words
Cystic tumors of the pancreas, serous cystadenoma, mucinous cystadenoma, intraductal papillary tumors, cystic papillary tumors.
INTRODUCCION
Recientemente, los tumores quísticos del páncreas (TQP) han recibido atención por cirujanos y gastroenterólogos por el avance de las imágenes diagnósticas que los detectan frecuentemente. La prevalencia de los tumores quísticos es incierta en la población general, solo son identificados aquellos que causan síntomas (1). En series de registros quirúrgicos y radiológicos de lesiones pancreáticas se identificó una tasa de 1,2% para TQP de los cuales la mitad eran asintomáticos (2).
Cuando la lesión es sintomática el paciente puede manifestarse con pancreatitis recurrente, dolor abdominal crónico o ictericia. Estos síntomas normalmente implican que hay compresión u obstrucción del ducto pancreático.
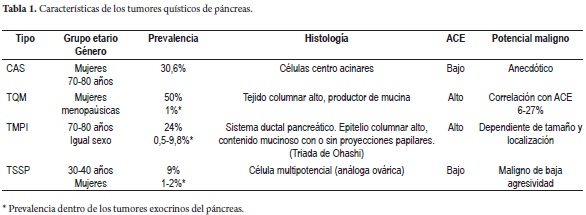
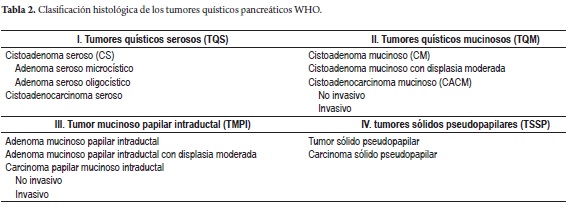
Dentro de los TQP se encuentran el cistadenoma seroso (CAS), tumor quístico mucinoso (TQM), tumor mucinoso papilar intraductal (TMPI) y el tumor sólido pseudopapilar (TSSP) (3-15), neoplasias que varían en cuanto a su histología, potencial maligno, prevalencia, sexo y edad de presentación (tabla 1). La World Health Organization (WHO) describió y estableció su clasificación histológica (16, 17) (tabla 2).
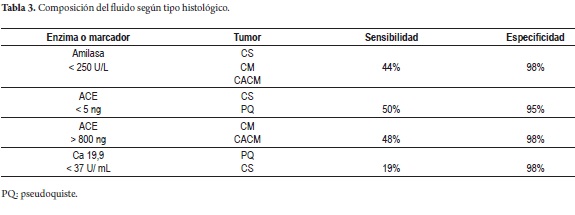
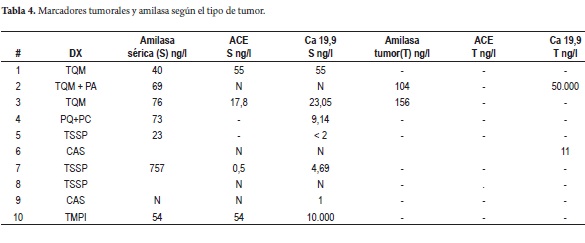
La mayoría de los TQP son detectados por tomografía axial computarizada (TAC) o resonancia magnética (RM), en las lesiones dudosas o con diámetro menor o igual a 3 cm el ultrasonido endoscópico (UE) facilita su tipificación por punción con aguja fina (sensibilidad 50-60%) y el estudio de marcadores en el líquido, sin ser un procedimiento inocuo (18-20). El nivel de antígeno carcinoembrionario (ACE) es mejor predictor de tumores mucinosos logrando una precisión del 79% con niveles superiores a 192 ng/ml (21). Se complementa el estudio con CA 19,9 y amilasa en el tumor y séricos, con baja sensibilidad pero alta especificidad (22)(tabla 3).
El manejo quirúrgico se define en términos del tipo histológico, tamaño, localización de la neoplasia y riesgo del paciente, así: el CAS, por considerarse benigno se observa; sin embargo, en pacientes sintomáticos con lesiones > 4 cms y duda diagnóstica debe pensarse cirugía (23, 24). El TQM, por tener potencial maligno, igual o mayor a 3cm se reseca (25). El TMPI tiene indicación absoluta de cirugía cuando se localiza en el ducto principal, los de ductos secundarios de 2 cm o mayores sin nódulos murales o menores con la presencia de ellos, también la tienen. Si no es posible, se manejan médicamente y se observan (26); aunque se ha descrito la ablación con etanol obteniendo buenos resultados (21, 27). El TSSP tiene potencial maligno independientemente de su tamaño o localización, por lo que se recomienda tratamiento quirúrgico, encontrando beneficio en términos de supervivencia a largo plazo en grupos con experiencia (28).
Nuestro objetivo es presentar el enfoque, manejo quirúrgico y su resultado en los pacientes tratados.
METODOLOGIA
Se realizó un estudio de serie de casos, tomando una cohorte retrospectiva de pacientes que fueron tratados en la Fundación Cardioinfantil - Instituto de Cardiología entre los años 2006-2010 y que a la fecha tienen entre 24 y 78 meses de seguimiento clínico con diagnóstico de neoplasia quística del páncreas.
Los datos fueron tomados directamente de la historia clínica como documento fuente y guardados en una base de datos para su posterior análisis, que se planteó en estadística de tipo descriptivo teniendo en cuenta las variables usadas.
RESULTADOS
En total se incluyeron 10 pacientes, se muestra la presentación clínica, evaluación, tratamiento y diagnóstico histológico definitivo. La edad promedio fue de 50 años (rango 29-86), 8 de sexo femenino con tumores quísticos de páncreas de diferentes tipos y una más con un pseudoquiste pancreático como diagnóstico histológico en la pieza quirúrgica sin sospecha clínica o paraclínica previa. El varón presentó un TMPI.
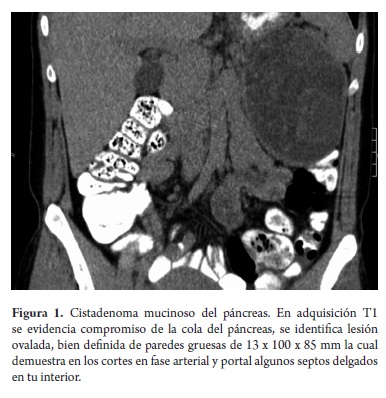
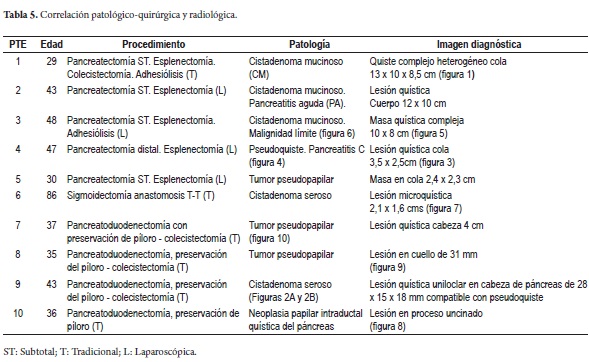
En su mayoría, los pacientes manifestaron inicialmente un cuadro clínico de dolor abdominal de severidad e intensidad variables, uno con episodios de pancreatitis a repetición, otra debutó con abdomen agudo siendo intervenida extrainstitucionalmente y biopsiada con posterior remisión para tratamiento completo, otra paciente en estudios de extensión para adenocarcinoma de sigmoide mostró incidentalmente lesión quística en la cabeza del páncreas (figura 1) con diagnóstico histológico de cistadenoma seroso (biopsia de páncreas) en la resección de su tumor de colon, presentando dos años después otro tumor metacrónico de colon derecho resecado. Su estudio, diagnóstico y tratamiento se presentan en las tablas 4 y 5 .
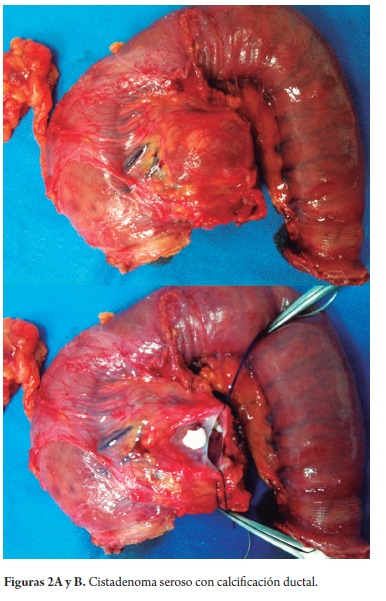
Nueve de diez pacientes fueron manejados quirúrgicamente, 4 con lesiones de cuerpo y cola fueron intervenidos por laparoscopia. El tiempo quirúrgico en estos pacientes osciló entre los 165-210 minutos con un promedio de 185 minutos en contraste con 105 minutos en el paciente reoperado convencionalmente por laparotomía. A los otros 5 pacientes con lesiones de cabeza y cuello de páncreas se les practicó pancreatoduodenectomía con preservación de píloro, una paciente presentó sepsis por catéter (estafilococo), otra neumonía nosocomial por enterobacter cloacae y hemorragia de vías digestivas alta autolimitada y bacteriobilia a repetición. Estas situaciones cedieron con manejo médico (antibióticos dirigidos). No tuvimos fístulas en ninguna de las anastomosis que secuencialmente realizamos así: pancreático yeyunostomía término lateral en dos planos, hepático yeyunostomía término lateral en un plano y duodeno yeyunostomía término lateral en dos planos. Tampoco hubo infección intrabdominal o del sitio operatorio, ni mortalidad. La paciente con el CAS continúa en observación por más de 60 meses sin que haya crecido o requerido cirugía, los marcadores tumorales séricos permanecen normales. A la paciente intervenida por CAS, se le practicó una ecoendoscopia que informó una lesión quística de 2 cm con lesión papilar intraductal de 0,5cm, lo que motivó su cirugía; el reporte final de patología mostró un cistadenoma seroso con una calcificación intraductal (figuras 2A y 2B).
El tiempo de estancia hospitalaria fue menor para la paciente intervenida convencionalmente de pancreatectomía distal, con 7 días y los de cirugía mínimamente invasiva oscilaron entre los 6 a 12 días con un promedio de 9 días.
Las complicaciones se consideraron como menores en la mayoría de los casos siendo el dolor postoperatorio el más frecuente. Dentro de los mayores, 2 pacientes presentaron episodios de obstrucción intestinal, uno intervenido inicialmente por laparoscopia requirió drenaje percutáneo postoperatorio por colección y posterior colectomía izquierda convencional por estenosis del ángulo esplénico del colón por isquemia, con evolución postoperatoria adecuada. En ninguno de los casos se presentó mortalidad.
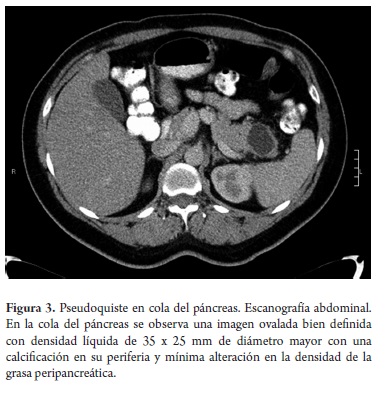
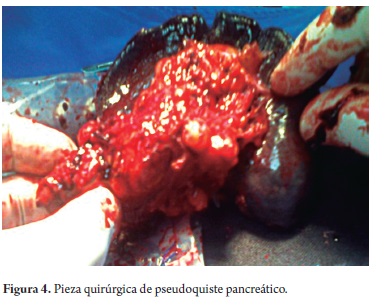
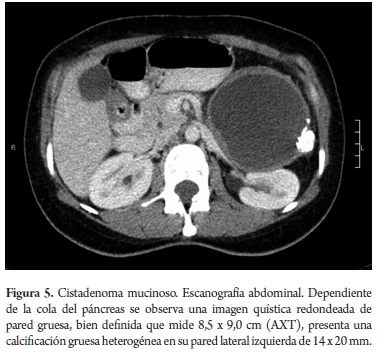
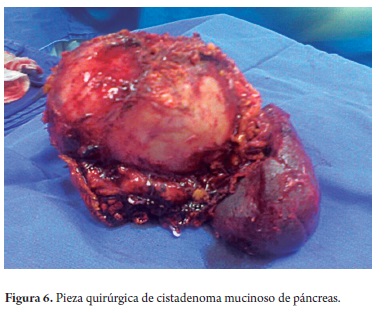
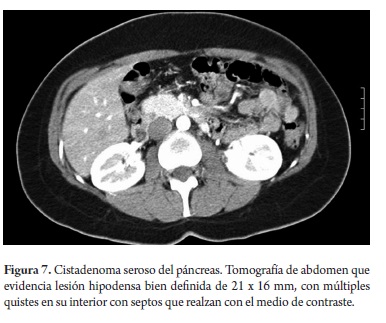
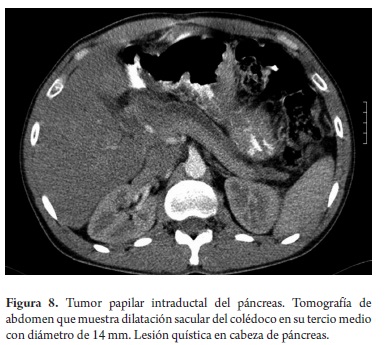
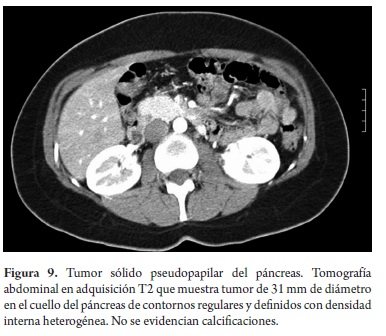
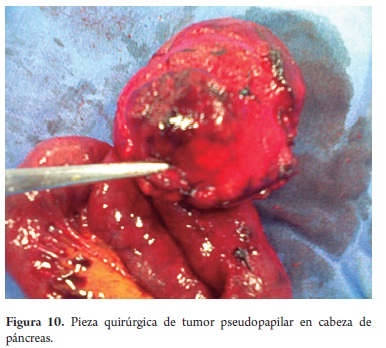
El estudio anatomopatológico reportó cistadenoma mucinoso en 3 de los casos de los cuales uno presentaba cambios inflamatorios por pancreatitis, 3 reportados como tumor pseudopapilar sólido quístico, 2 cistadenoma seroso, uno en biopsia de lesión intervenido por otra causa y otro por duda diagnóstica entre tumor mucinoso intrapapilar y pseudoquiste de páncreas; uno como papiloma intraductal y otro como pseudoquiste pancreático (tabla 5). Toda la serie de pacientes obtuvo resección completa y márgenes negativos del tumor. No se documentó ninguna lesión maligna e infiltrante. (Figuras 3, 4, 5, 6, 7, 8, 9 y 10).
Como parte del estudio prequirúrgico se le realizó punción a 3 de los pacientes y se estudió el líquido para marcadores tumorales y amilasa. El CA 19,9 fue reportado solo en 1 de los pacientes como positivo con un valor de 50.000 (tabla 5).
DISCUSION
En nuestra experiencia en lesiones tumorales, el estudio imagenológico con escanografía es el primer paso dentro de la evaluación de la masa ya que permite el estudio de las características del tumor y su diagnóstico. La punción percutánea o por endosonografía es una alternativa para la tipificación de la masa en los casos dudosos o cuando se considere relevante para tomar una decisión quirúrgica. La técnica puede ser transpapilar o transgástrica guiado por endosonografía (29, 30). Hubo dos casos intervenidos con lesiones menores a 3 cm, a quienes se les practicó pancreatectomía distal laparoscópica y pancreatoduodenectomía, el primero sin ecoendoscopia y el segundo con ella, que planteó la duda con la colangiorresonancia a favor de un TMPI; en ninguno de los dos se practicó punción citológica y estudio de marcadores de la lesión, tal vez con estas pruebas hubiésemos cambiado la conducta a favor de la observación, evitando la morbimortalidad de un procedimiento mayor como es la pancreatoduodenectomía. La fundación no cuenta con ecoendoscopia, es por eso que son pocos los pacientes a quienes se les practicó, teniendo en cuenta todas las dificultades que argumentan las EPS y los tiempos prolongados para realizar procedimientos diagnósticos de alto costo no incluidos en el POS, tanto ambulatorios como durante la hospitalización.
En esta cohorte, el estudio del líquido no proporciona mucha información acerca del diagnóstico y los valores de ACE y amilasa no se correlacionaron con el tipo de tumor como está descrito en la literatura, a pesar de lo cual consideramos que es una ayuda diagnóstica que no se debe desechar en casos específicos como lo mencionamos anteriormente.
El tratamiento quirúrgico convencional no es tema de debate en lesiones quísticas neoplásicas confirmadas o altamente sospechosas de potencial maligno, debe tenerse en cuenta tanto el tipo de tumor quístico como su localización y el riesgo del paciente (31). El tratamiento mínimamente invasivo ha adquirido fuerza como opción terapéutica. Igualmente, la pancreatectomía distal o subtotal ha sido reportada con buenos resultados en cuanto a baja recurrencia y morbimortalidad preservando el bazo en pacientes con tumores hasta de 5 cms (30).
Los 4 pacientes intervenidos por laparoscopia son parte del inicio de la experiencia en nuestra institución, aparte de uno que se intervino en forma convencional por cirugía previa reciente; aunque no encontramos una disminución objetiva del tiempo de hospitalización y tiempo quirúrgico, fue evidente el menor dolor postoperatorio, la ingesta oral temprana, no hubo necesidad de transfusiones sanguíneas trans o postoperatorias. En la literatura hay clara evidencia de que el procedimiento laparoscópico disminuye la pérdida sanguínea durante la cirugía, disminuye la estancia hospitalaria, las complicaciones globales son menores incluida la infección del sitio operatorio, sin detrimento del tiempo operatorio, la intención oncológica (márgenes positivos en casos de neoplasias malignas), incidencia de fistula pancreática y mortalidad como lo muestra un metanálisis publicado en Annals of Surgery de 2012 (32). No hubo conversión en ningún paciente a pesar del tamaño de algunas lesiones superiores a 10 cm; creemos que esto influyó en la complicación obstructiva del colon por íntima adherencia de la masa al mesocolon que probablemente se traumatizó en la liberación y generó isquemia y posterior estenosis. En la literatura se reportan tasas de conversión entre el 0%-30% (32). No tuvimos fístulas pancreáticas en ninguno de los pacientes, consideramos el refuerzo con polipropilene del muñón del páncreas posterior a la sección con sutura mecánica recarga verde, una medida relevante en este sentido. En el mismo metanálisis hay tasas de fístula clasificadas por gravedad que oscilan entre el 12,5%-19,1% de acuerdo al Grupo Internacional para el Estudio de la Fístulas Pancreáticas (ISGPF por sus siglas en inglés) (33). No tuvimos complicaciones infecciosas intrabdominales o del sitio operatorio lo que coincide con lo reportado en la literatura.
Se practicaron 4 pancreatoduodenectomías todas con preservación de píloro, hubo morbilidad en 3 de ellas, relacionadas con infección nosocomial sin origen en la cirugía en dos (neumonía y bacteremia por catéter) y un caso de bacteriobilia sin documentarse estenosis de la anastomosis bilioentérica por lo que no requirió reintervención, mejorando con manejo médico. Como vemos, este procedimiento supone riesgo, en series publicadas oscila entre el 30 a 40% (34, 35) y aunque la mortalidad en estos pacientes fue 0, asociada a un grupo etario joven, sin comorbilidades y técnica quirúrgica adecuada, no es despreciable, como lo demuestran otros estudios (36, 37). De ahí la importancia de un diagnóstico preciso e indicación quirúrgica correspondiente. Ya hay reportes en la literatura que muestran la factibilidad de realizar este procedimiento en forma totalmente laparoscópica o video asistido con buenos resultados en términos de mortalidad, tiempo operatorio, pérdida de sangre transoperatoria, recuperación rápida y seguridad oncológica (38).
CONCLUSIONES
Los tumores quísticos de páncreas continúan siendo una patología rara dentro de nuestra población, aunque el diagnóstico cada día se hace más frecuente debido a la evolución y resolución de los métodos diagnósticos. En nuestra serie, la escanografía abdominal contrastada fue suficiente para lograr un diagnóstico y manejo adecuado en las lesiones mayores a 3 cm, en las menores consideramos pertinente el uso de ecoendoscopia sumado al estudio histológico y de marcadores en la lesión con el fin establecer un diagnóstico certero, que no siempre es fácil.
El tratamiento laparoscópico continúa evolucionando y a medida que se va adquiriendo experiencia, procedimientos de mayor complejidad como pancreatectomías se logran hacer de forma mínimamente invasivas sin perjuicio de principios oncológicos. Los cuatro casos intervenidos por laparoscopia demostraron una resección completa, con mínimas complicaciones, y algunos beneficios de la mínima invasión. De cualquier manera, es un procedimiento que demanda experiencia y habilidad en laparoscopia avanzada y en el inicio de la experiencia no obtuvimos ahorro de tiempo quirúrgico ni de estancia hospitalaria.
Aunque está descrita la preservación del bazo en pancreatectomía distal, no se recomienda para lesiones mayores de 5 cm, y puede ser aún más exigente intentarla en la fase inicial de la curva de aprendizaje.
Esta experiencia inicial nos alienta a persistir en la práctica de la mínima invasión en el manejo de estas neoplasias de cuerpo y cola, independientemente del tamaño de las mismas, con la idea de evaluar en forma prospectiva y más específica las diferentes variables a tener en cuenta y los resultados a mediano y largo plazo.
La pancreatoduodenectomía por laparoscopia viene realizándose en forma progresiva por grupos americanos, franceses e hindúes con gran volumen, experiencia en cirugía pancreática y laparoscópica avanzada y disponibilidad tecnológica de punta, permitiendo resultados comparables a los centros de excelencia en cirugía convencional, lo que plantea el interrogante si estos desenlaces favorables pueden reproducirse en condiciones diferentes.
REFERENCIAS
1. Fasanella KE, McGrath K. Cystic lesions and intraductal neoplasms of the pancreas. Best Pract Res Clin Gastroenterol 2009; 23(1): 35-48. [ Links ]
2. Spinelli KS, Fromwiller TE, Daniel RA, Kiely JM, Nakeeb A, Komorowski RA, Wilson SD, Pitt HA. Cystic pancreatic neoplasms: observe or operate. Ann Surg 2004; 239(5): 651-7. [ Links ]
3. Zinner MJ. Solid and papillary neoplasms of the pancreas. Surg Clin North Am 1995; 75(5): 1017-24. [ Links ]
4. Aaloten LA, et al. World Health Organization Classification of Tumours. Pathology and Genetics Tumour of the Digestive System. Lyon: IARC Press; 2000. [ Links ]
5. Kloppel G, et al. Histological typing of tumours of the exocrine pancreas. World Health Organization International Histological Classification of Tumours. Berlin: Springer-Verlag; 1996. [ Links ]
6. Khalid A, Brugge W. ACG practice guidelines for the diagnosis and management of neoplastic pancreatic cysts. Am J Gastroenterol 2007t; 102(10): 2339-49. [ Links ]
7. Centeno BA, Lewandrowski KB, Warshaw AL, Compton CC, Southern JF. Cyst fluid cytologic analysis in the differential diagnosis of pancreatic cystic lesions. Am J Clin Pathol 1994; 101(4): 483-7. [ Links ]
8. Frossard JL, Amouyal P, Amouyal G, Palazzo L, Amaris J, Soldan M, Giostra E, Spahr L, Hadengue A, Fabre M. Performance of endosonography-guided fine needle aspiration and biopsy in the diagnosis of pancreatic cystic lesions. Am J Gastroenterol 2003; 98(7): 1516-24. [ Links ]
9. Zamboni G, et al. Mucinous cystic neoplasms of the pancreas. En Aaolten LA, Hamilton SR, eds. World Health Organization Classification of Tumours. Pathology and Genetics Tumour of the Digestive System. Lyon:IARC Press; 2000. [ Links ]
10. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, Yamaguchi K, Yamao K, Matsuno S; International Association of Pancreatology. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6(1-2): 17-32. [ Links ]
11. Reddy RP, Smyrk TC, Zapiach M, Levy MJ, Pearson RK, Clain JE, Farnell MB, Sarr MG, Chari ST. Pancreatic mucinous cystic neoplasm defined by ovarian stroma: demographics, clinical features, and prevalence of cancer. Clin Gastroenterol Hepatol 2004; 2(11): 1026-31. [ Links ]
12. Zamboni G, Scarpa A, Bogina G, Iacono C, Bassi C, Talamini G, Sessa F, Capella C, Solcia E, Rickaert F, Mariuzzi GM, Klöppel G. Mucinous cystic tumors of the pancreas: clinicopathological features, prognosis, and relationship to other mucinous cystic tumors. Am J Surg Pathol 1999; 23(4): 410-22. [ Links ]
13. Kosmahl M, Pauser U, Peters K, Sipos B, Lüttges J, Kremer B, Klöppel G. Cystic neoplasms of the pancreas and tumor-like lesions with cystic features: a review of 418 cases and a classification proposal. Virchows Arch 2004; 445(2): 168-78. [ Links ]
14. Vignesh S, Brugge WR. Endoscopic diagnosis and treatment of pancreatic cysts. J Clin Gastroenterol 2008; 42(5): 493-506. [ Links ]
15. Matsumoto T, Aramaki M, Yada K, Hirano S, Himeno Y, Shibata K, Kawano K, Kitano S. Optimal management of the branch duct type intraductal papillary mucinous neoplasms of the pancreas. J Clin Gastroenterol 2003; 36(3): 261-5. [ Links ]
16. Sugiyama M, et al. Predictive factors for malignancy in intraductal papillary – mucinous tumours of the pancreas. Br J Surg 2003; 90(10): 1244-9. [ Links ]
17. Buetow PC, Buck JL, Pantongrag-Brown L, Beck KG, Ros PR, Adair CF. Solid and papillary epithelial neoplasm of the pancreas: imaging-pathologic correlation on 56 cases. Radiology 1996; 199(3): 707-11. [ Links ]
18. Brugge WR. Management and outcomes of pancreatic cystic lesions. Dig Liver Dis 2008; 40(11): 854-9. [ Links ]
19. Brugge WR. Evaluation of pancreatic cystic lesions with EUS. Gastrointest Endosc 2004; 59(6): 698-707. [ Links ]
20. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, del Castillo CF, Warshaw AL. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004; 126(5): 1330-6. [ Links ]
21. Shah JN, Muthusamy VR. Minimizing complications of endoscopic ultrasound and EUS-guided fine needle aspiration. Gastrointest Endosc Clin N Am 2007; 17(1): 129-43. [ Links ]
22. Van der Waaij LA, van Dullemen HM, Porte RJ. Cyst fluid analysis in the differential diagnosis of pancreatic cystic lesions: a pooled analysis. Gastrointest Endosc 2005; 62(3): 383-9. [ Links ]
23. Tseng JF. Management of serous cystadenoma of the pancreas. J Gastrointest Surg 2008; 12(3): 408-10. [ Links ]
24. Harper AE, Eckhauser FE, Mulholland MW. Resectional therapy for cystic neoplasms of the pancreas. Am Surg 2002; 68(4): 353-7. [ Links ]
25. Balcom IV JH, Fernandez-Del Castillo C, Warshaw AL. Cystic lesions in the pancreas: when to watch, when to resect. CurrGastroenterol Rep 2000; 2(2): 152-8. [ Links ]
26. Kanazumi N, Nakao A, Kaneko T, Takeda S, Harada A, Inoue S, Nagasaka T, Nakashima N. Surgical treatment of intraductal papillary-mucinous tumors of the pancreas. Hepatogastroenterology 2001; 48(40): 967-71. [ Links ]
27. Palanivelu C, Shetty R, Jani K, Sendhilkumar K, Rajan PS, Maheshkumar GS. Laparoscopic distal pancreatectomy: results of a prospective non-randomized study from a tertiary center. SurgEndosc 2007; 21(3): 373-7. [ Links ]
28. Jang JY, Kim SW, Lee SE, Yang SH, Lee KU, et al. Treatment guidelines for branch duct type intraductal papillary mucinous neoplasms of the pancreas: when can we operate or observe? Ann SurgOncol 2008; 15(1): 199-205. [ Links ]
29. Roedor B, et al. Endocopic pancreatic pseudocyst drainage. Tech Gastrointest Endosc 2005; 7: 211-18. [ Links ]
30. Connell DB, Gregory JR, Sasaki TM, Vetto RM. Pancreatic pseudocyst. Am J Surg 1982; 143(5): 599-601. [ Links ]
31. Brugge WR. Should all pancreatic cystic lesions be resected? Cyst-fluid analysis in the differential diagnosis of pancreatic cystic lesions: a meta-analysis. Gastrointest Endosc 2005; 62(3): 390-1. [ Links ]
32. Venkat R, Edil BH, Schulick RD, Lidor AO, Makary MA, Wolfgang CL. Laparoscopic Distal Pancreatectomy is Associated with Significantly Less Overall Morbidity Compared to the Open Technique. A Systematic Review and Meta-Analysis. Ann Surg 2012; 00: 1-12. [ Links ]
33. Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005; 138: 8-13. [ Links ]
34. Cameron J, Riall TS, Coleman J, Belcher KA. One thousand consecutive pancreatoduodenectomies. Ann Surg 2006; 244: 10-5. [ Links ]
35. Buchler M, Wagner M, Schmied BM, Uhl W, Friess H, Z'Graggen K. Changes en morbidity afcter pancreatic resección; Toward the end of completion pancreatectomy. Arch Surg 2003; 138: 1310-4. [ Links ]
36. Hoyos S, Duarte A, Franco G, Chavez J, Gomez S, Sánchez JA. Evaluación y seguimiento de los pacientes sometidos a operación de Wipple o duodenopancreatectomía cefálica en un hospital de IV nivel de Medellín. Rev Colomb Cir 2012; 27: 114-120. [ Links ]
37. Qiao QL, Zhao YG, Ye ML, Yang YM, Zhao JX, Huang YT, et al. Carcinoma of de ampulla of Vater: Factors influencing long- term survival of 127 patients with resection. World J Surg 2007; 31: 137-43. [ Links ]
38. Dulucq JL, Wintringer P, Mahajna A. Laparoscopy pancreatoduodenectomy for benign and malignant diseases. Surg Endosc 2006; 20: 1045-1050. [ Links ]











 text in
text in