Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
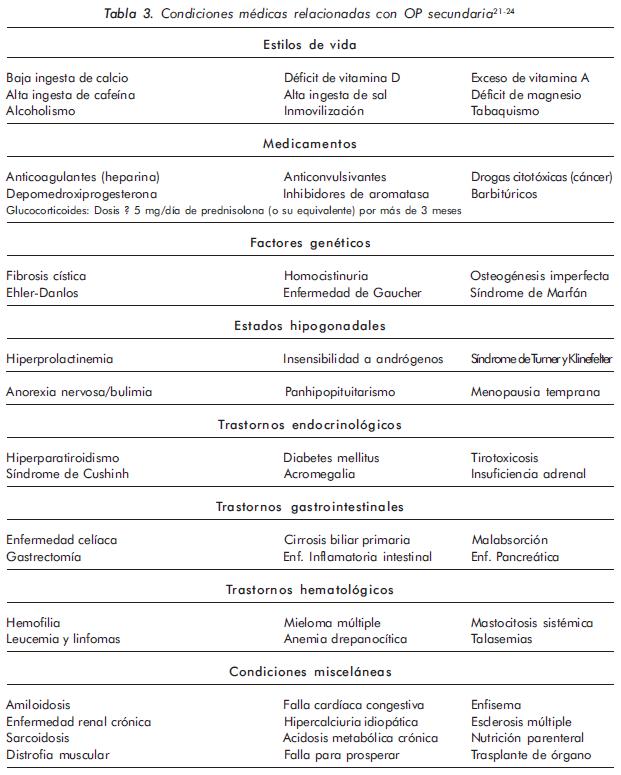
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.17 no.2 Bogotá Apr./June 2010
ARTÍCULO DE REVISIÓN
Pharmacological treatment of postmenopausal osteoporosis
Daniel G. Fernández Ávila1, Claudia Mora2, Elsa Reyes Sanmiguel2, John Darío Londoño2, Pedro Santos Moreno2, Rafael Valle-Oñate3
1 Médico Internista, Residente Reumatología, Universidad Militar Nueva Granada - Hospital Militar Central.
2 Médico Internista, Reumatólogo, Hospital Militar Central. Profesor Universidad de La Sabana.
3 Médico Internista, Reumatólogo, Jefe del Servicio de Reumatología, Hospital Militar Central. Profesor Universidad Militar Nueva Granada - Universidad de La Sabana.
Recibido: Noviembre 9 de 2009 Aceptado: Mayo 28 de 2010
Resumen
La osteoporosis es una enfermedad silenciosa hasta que se presenta su principal complicación: las fracturas; con un importante costo económico y social para el paciente y el sistema de salud, constituyéndose en un verdadero problema de salud pública. Las mujeres en la etapa postmenopáusica tienen un mayor riesgo de osteoporosis y por ende de fractura. Actualmente disponemos de un variado grupo de medicamentos que, a través de diferentes mecanismos de acción, mejoran la densidad mineral ósea y disminuyen el riesgo de fractura. En el presente artículo se presenta al lector información relevante de cada uno de los medicamentos empleados en el tratamiento de esta entidad desde el punto de vista farmacológico y de efectividad clínica.
Palabras clave: osteoporosis, fractura, menopausia, densidad mineral ósea.
Summary
Osteoporosis is a silent illness until fractures appears, with a very high economic and social cost for the patient and the health system, representing a true problem of public health. Postmenopausal women have a higher risk of osteoporosis and fracture. Actually are available different drugs that through a varied mechanism of action, increase bone mineral density and reduce fracture risk. In this article we present relevant information about the pharmacology and clinical effectiveness of each one of drugs used in the treatment of osteoporosis.
Key words: osteoporosis, fracture, menopause, bone mineral density.
Introducción
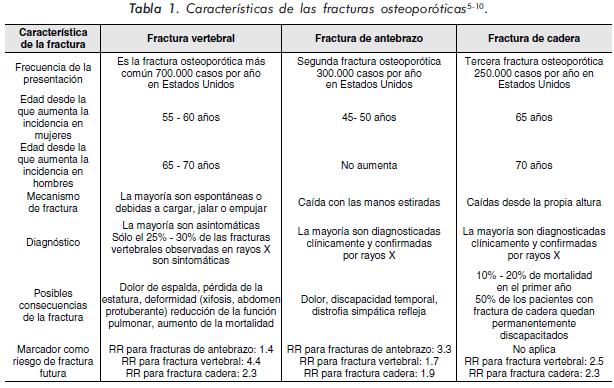
La osteoporosis (OP) es una enfermedad esquelética sistémica caracterizada por baja masa ósea y alteración de la microarquitectura del tejido óseo, lo cual lleva a un incremento en la fragilidad ósea y aumento en el riesgo de fractura1. Aproximadamente 8 millones de mujeres y 2 millones de hombres en los Estados Unidos tienen OP2. La más frecuente y seria complicación de esta entidad son las fracturas, las cuales pueden presentarse a nivel de la cadera y muñeca, usualmente por caídas desde la propia altura; también se pueden presentar fracturas a nivel de la columna (fracturas por compresión)3. La OP se constituye en un verdadero problema de salud pública a raíz de los efectos devastadores que pueden generarse por la presencia de fracturas osteoporóticas4, con significativo aumento de la morbimortalidad y alteración de la funcionalidad de los pacientes afectados (Tabla 1). La OP representa un problema significativo para el reumatólogo dado que el tejido óseo se afecta en forma negativa en las principales entidades reumatológicas (artritis reumatoide, espondiloartropatías, lupus eritematoso sistémico, entre otras) y adicionalmente se ve alterado por el uso de algunos medicamentos empleados en el tratamiento de estas entidades, como es el caso de los corticoides11.
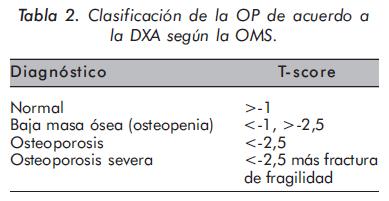
La densitometría ósea (DXA) es reconocida como el método de referencia para medir la densidad mineral ósea con aceptable precisión y reproducibilidad12. La organización Mundial de la Salud (OMS) ha establecido a la DXA como el método de elección para el diagnóstico de OP en mujeres postmenopáusicas y basa en esta técnica la clasificación de esta entidad13 (Tabla 2).
La DXA va más allá de la posibilidad de hacer el diagnóstico de OP, pues es útil para determinar el riesgo de fractura y además es un parámetro de evaluación de respuesta al tratamiento médico14.
Tratamiento
El tratamiento de la OP incluye medidas farmacológicas y no farmacológicas. Éstas últimas incluyen cuatro componentes principales: dieta, ejercicio, suspender el tabaquismo y abolir el uso de medicamentos que incrementen la pérdida de hueso15-17. Las medidas farmacológicas, por su parte, incluyen un grupo variado de medicamentos que buscan disminuir la pérdida de hueso o promover la formación del mismo a través de diferentes mecanismos de acción. El objetivo principal de cualquier intervención terapéutica es reducir el riesgo de futuras fracturas18 y de esa forma impactar positivamente en la morbimortalidad del paciente con OP. Todos los medicamentos empleados para el tratamiento de la OP postmenopáusica deben ir acompañados de una adecuada ingesta de calcio (1500 mg/día) y vitamina D (800U/día). En general, podemos decir que existen dos grupos de medicamentos con efectos opuestos:
Fármacos antirresortivos:
-Bifosfonatos: etidronato, alendronato, risedronato, ibandronato, ácido zoledrónico, pamidronato
-Calcitonina
-Raloxifeno
-Terapia de reemplazo hormonal (Estrógenos)
Fármacos formadores de hueso
-Teriparatida
Fármacos con efecto mixto (antirresortivo y formador de hueso)
-Ranelato de estroncio
La decisión de iniciar tratamiento farmacológico para pacientes con OP se debe basar en el riesgo de fractura del paciente19, el cual es, en últimas, el desenlace negativo de la enfermedad que se quiere evitar al instaurar un manejo médico específico. Las indicaciones de la National Osteoporosis Foundation20 para tratamiento de OP son las siguientes:
Mujeres postmenopáusicas y hombres mayores de 50 años de edad, con la presencia de alguno de los siguientes aspectos:
-Fractura de cadera o vertebral (clínica o morfométrica).
-T-score = -2.5 en cuello o columna lumbar después de una adecuada evaluación para excluir causas secundarias de OP (Tabla 3).
- Baja masa ósea (T-score entre -1 y -2.5 en cuello femoral o columna) y una probabilidad a 10 años de fractura de cadera = 3% o una probabilidad a 10 años de cualquier fractura relacionada con OP = 20% basado en el algoritmo de la OMS.
Bifosfonatos (BF)
La síntesis de los BF se dio por primera vez a comienzos del siglo XVII, pero su uso en la ciencia médica sólo se da hasta la década de 1960. Su primera aplicación como molécula fue en el campo industrial, como inhibidor de corrosión, siendo también empleado posteriormente en la industria textil, de fertilizantes y derivados del petróleo25.
Los BF son el grupo de medicamentos más usados para el tratamiento de la osteoporosis alrededor del mundo26. Son análogos sintéticos del pirofosfato que forman una estructura tridimensional capaz de quelar cationes divalentes como el calcio, razón por la cual tienen una mayor afinidad por el hueso y se orientan especialmente a superficies óseas que experimentan remodelado constante27. Por otro lado, reducen el recambio óseo gracias a la disminución del número de lugares de remodelado activo donde tiene lugar la resorción ósea excesiva. Adicionalmente, se ha encontrado que todos los BF aumentan la apoptosis de los osteoclastos; los aminobifosfonatos (alendronato, risedronato, ibandronato y ácido zoledrónico) interfieren con la función del osteoclasto (disminuyen el reclutamiento y actividad) bloqueando la sintasa farnesil pirofosfato, una enzima de la vía del mevalonato28,29. Se incorporan al hueso y allí permanecen por un periodo prolongado, con un tiempo de residencia ósea mayor para el zoledronato, intermedio para el alendronato y más corto para el risedronato.
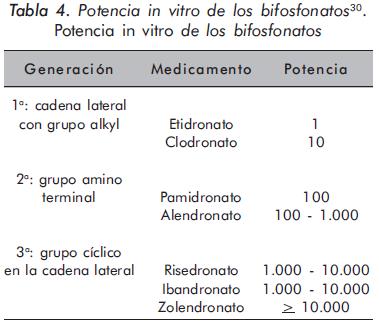
La potencia de este grupo de medicamentos es usualmente medida por su capacidad para disminuir in vitro el recambio óseo (Tabla 4).
En cuanto a la farmacología de los BF, cabe resaltar que cuando se administran por vía oral tienen una pobre absorción, pues menos del 0.7% de la dosis administrada es absorbida al torrente sanguíneo31. Para optimizar su absorción desde el tracto gastrointestinal, el paciente que recibe BF debe ser instruido sobre la importancia de tomar el medicamento en ayunas, con agua (por lo menos 8 onzas para minimizar el riesgo de que la tableta quede pegada a las paredes del esófago), mínimo 1 hora antes del desayuno32. Adicionalmente, se debe indicar mantenerse de pie o sentado, por lo menos 30 minutos después de la toma del medicamento para disminuir la presencia de síntomas dispépticos posterior a la ingesta del fármaco33. Aproximadamente el 50% de la dosis absorbida del BF se une al hueso y la otra mitad es excretada por el riñón34. Los pacientes con alteración en la función renal, con depuración de creatinina menor a 30 ml/min, retienen un mayor porcentaje del medicamento en el esqueleto, lo cual puede llevar a una disminución en el recambio óseo tan alta que genere una menor capacidad de reparación de los microdaños en el hueso, con un subsecuente aumento en la fragilidad ósea35.
Los BF son en general bien tolerados y se consideran medicamentos seguros y efectivos para el tratamiento de la OP. Entre los principales efectos adversos de este grupo de medicamentos se incluyen: irritación en el tracto gastrointestinal superior, ulceración esofágica, vómito, dolor abdominal, estreñimiento y cefalea. En el año 2003 se describieron los primeros casos de osteonecrosis de la mandíbula en pacientes oncológicos que venían recibiendo BF endovenosos (ácido zolendrónico o pamidronato)36,37. Esta rara complicación está relacionada con factores predisponentes claros como enfermedad o cirugía dental previa, pobre higiene oral, enfermedad oncológica de base, quimioterapia y uso de corticoides38-41. Previamente se consideró al uso de BF como un factor de riesgo para el desarrollo de fibrilación auricular42. Más recientemente, un ensayo clínico no encontró diferencia en la frecuencia de presentación de esta arritmia supraventricular en pacientes en tratamiento con BF comparado con sujetos control43.
Etidronato
Etidronato fue el primer BF desarrollado y aprobado para el tratamiento de la OP. Los estudios han mostrado reducción de fracturas vertebrales en poblaciones de alto riesgo (mujeres postmenopáusicas con antecedente de fractura vertebral)44 e incremento en la densidad mineral ósea45. Un meta-análisis de los ensayos clínicos controlados de etidronato sugiere una reducción en el riesgo de fractura vertebral, con un riesgo relativo de 0.63 (IC 95% 0.44-0.92), sin encontrarse efecto sobre las fracturas no vertebrales46. Actualmente no cuenta con aprobación por parte de la FDA y no está recomendado dentro de las guías de tratamiento desarrolladas por la National Osteoporosis Foundation20 ni en las guías europeas para el diagnóstico y manejo de OP en mujeres postmenopáusicas1.
Alendronato
Alendronato fue aprobado para la prevención y el tratamiento de la OP desde el año 199547. Demostró un aumento en la densidad mineral ósea en mujeres postmenopáusicas sin osteoporosis48. En el estudio Fracture Intervention Trial (FIT 1) se incluyeron 2027 mujeres con antecedente de por lo menos una fractura vertebral, las cuales recibieron durante 36 meses tratamiento con alendronato vs. placebo. Se encontró una disminución en la incidencia de fracturas vertebrales morfométricas del 48% (p<0.001) y en fracturas de cadera del 51% (p=0.047)49. En el estudio FIT 2 se incluyeron 4432 mujeres con baja densidad ósea (Densidad mineral ósea = 0.68 gr/cm2 en cuello femoral) pero sin antecedente de fractura vertebral. Se encontró una disminución en la presencia de nuevas fracturas vertebrales del 44% (p=0.002), sin encontrarse una disminución significativa para las fracturas de cadera50. En los dos estudios FIT se encontró un aumento significativo en la densidad mineral ósea de columna y cadera en los pacientes que recibieron alendronato comparado con placebo (p<0.001)49,50. La reducción en el riesgo de fractura vertebral se documentó también en un meta-análisis en el que se encuentra un riesgo relativo de fractura vertebral de 0.53 (IC 95% 0.43-0.65)51. La dosis semanal de alendronato 70 mg tiene el mismo efecto que la dosis diaria de 10 mg52,53.
Risedronato
Risedronato fue aprobado para la prevención y el tratamiento de la osteoporosis en el año 2000. En mujeres de 40 a 60 años de edad, en postmenopausia temprana y con densidad ósea normal, el tratamiento con risedronato 5 mg/ día durante dos años normalizó el recambio óseo e incrementó la densidad mineral ósea en columna lumbar y cadera comparado con placebo54. Este aumento en la densidad mineral ósea en columna lumbar y cadera también se demostró en un estudio realizado en mujeres con baja masa ósea, que recibieron risedronato 5 mg/día durante 24 meses55. En ensayos clínicos controlados en mujeres postmenopáusicas con fracturas vertebrales previas tratadas con risedronato 5 mg/día durante 3 años, las fracturas vertebrales fueron reducidas en 41% (p=0.003) y 49% (p<0.001) y las no vertebrales presentaron una reducción de 39% (p=0.02) y 33% (p=0.06) respectivamente; en los estudios VERT (Vertebral Efficacy with Rissedronate Therapy) en los cuales se estudiaron 2458 mujeres para el VERT NA, realizado en Norteamérica56 y 1226 para el VERT NM diseñado en forma multinacional57, respectivamente. Una extensión de este último estudio siguió a los pacientes durante 2 años más, para un total de 5 años de seguimiento, manteniendo el control con el grupo placebo y demostrando una reducción del 59% (p=0.01) en las fracturas vertebrales durante los años 3 a 5 y constituyéndose en el único estudio de un bifosfonato con seguimiento con placebo mas allá de 3 años58. La dosis semanal de risedronato 35 mg es equivalente a la dosis diaria de 5 mg59. Risedronato y alendronato son los dos medicamentos más frecuentemente utilizados en el tratamiento de la osteoporosis alrededor del mundo60,61. Su efectividad es similar, según se demostró en un estudio publicado recientemente62.
Ibandronato
El estudio BONE (The Oral Ibandronate Osteoporosis Vertebral Fracture Trial), llevado a cabo en Norteamérica y Europa, evaluó la eficacia del ibandronato sobre el riesgo de fractura vertebral en mujeres con osteoporosis. Este estudio comparó la dosis diaria de ibandronato (2.5 mg) con la dosis intermitente (20 mg cada 2 días durante 24 días, cada 3 meses) frente a placebo. En el estudio participaron 2946 mujeres postmenopáusicas con fractura vertebral previa. Después de 3 años de seguimiento se encontró una reducción estadísticamente significativa de nuevas fracturas vertebrales radiológicas, con reducción del riesgo de nueva fractura vertebral morfométrica de 62% para la dosis diaria (p=0.0001) y 50% para la dosis intermitente (p=0.0006). Ibandronato no demostró ser más eficaz que placebo en la reducción de las fracturas no vertebrales ni en fracturas de cadera63. El estudio MOBILE (Efficacy and Tolerability of Once Monthly Oral Ibandronate in Postmenopausal Osteoporosis), un estudio de no inferioridad aleatorizado fase III, mostró que la dosis mensual de ibandronato 150 mg vía oral era superior a la dosis oral de 2.5 mg/día en cuanto a incremento de la densidad mineral ósea en columna lumbar y cadera total (p<0.05) en mujeres con osteoporosis. Adicionalmente, se demostró que la dosis de 150 mg mensual produce una mayor supresión en el C-telopéptido de la cadena alfa del colágeno tipo I, en comparación con la dosis de 100 mg mensual y la de 2.5 mg/ día64. Con base en estos hallazgos, la dosis de 150 mg mensual de ibandronato fue aprobada para el tratamiento de la osteoporosis postmenopáusica. La efectividad de la aplicación endovenosa de ibandronato fue evaluada en el estudio DIVA (Dosing Intravenous Administration Trial), un ensayo clínico fase III, aleatorizado, doble ciego en el que se compararon dos regímenes de administración intermitente intravenosa de ibandronato (2 mg cada 2 meses y 3 mg cada 3 meses) con un régimen de ibandronato 2.5 mg VO al día, en un total de 1395 mujeres entre 55 y 80 años de edad con por lo menos 5 años de postmenopausia y con osteoporosis en columna lumbar. Después de un año de seguimiento, el incremento en la densidad mineral ósea de columna lumbar fue de 5.1%, 4.8% y 3.8% para los esquemas de 2 mg IV cada 2 meses, 3 mg IV cada 3 meses y 2.5 mg VO día respectivamente. Los cambios en la densidad mineral ósea para ambos grupos de administración intravenosa fueron significativamente mayores (p<0.001) en comparación con el grupo de administración vía oral. Adicionalmente, ambos grupos de ibandronato intravenoso tuvieron un cambio significativamente mayor (p<0.05) en la densidad mineral ósea de cadera total y trocánter. Todos los grupos de tratamiento tuvieron reducción similar en los niveles de C-telopéptido del colágeno tipo I65. Basados en estos resultados fue aprobada la dosis de 3 mg IV cada 3 meses para pacientes con osteoporosis postmenopáusica. Un estudio observacional retrospectivo publicado recientemente, en el que se incluyeron 7345 mujeres tratadas con ibandronato (150 mg mensual) y 56837 pacientes con BF semanal (alendronato 70 mg o risedronato 35 mg) mostró que las tasas de fractura después de un periodo de 12 meses fueron menores al 2% sin encontrar diferencia significativa entre los pacientes que recibieron ibandronato mensual o BF semanal para fractura de cadera, fractura no vertebral o cualquier fractura clínica. Los pacientes con ibandronato mensual tuvieron un riesgo de fractura significativamente menor que los pacientes con BF semanal (riesgo relativo ajustado 0.36 con IC 95%: 0.18-0.7, p=0.006)66. Ibandronato es una opción efectiva y con diferentes vías de administración a diferencia de los otros BF, lo cual lo convierte en una opción útil en diferentes escenarios clínicos67,68 como es el caso del paciente que presenta intolerancia gastrointestinal a un BF vía oral69.
Acido zoledrónico (Zolendronato)
El ácido zolendrónico está aprobado para el tratamiento de la OP postmenopáusica, hipercalcemia secundaria a malignidad y Enfermedad de Paget del hueso. En un estudio de fase II, la infusión de AZ demostró una disminución en el recambio óseo y mejoría en la densidad mineral ósea en mujeres postmenopáusicas con baja densidad mineral ósea70. El estudio HORIZON (Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis) es un ensayo clínico doble ciego controlado con placebo, en el que se incluyeron 7736 mujeres postmenopáusicas entre 65 y 89 años de edad, quienes tenían un T-score = 2.5 en cuello femoral, con o sin antecedente de fractura vertebral o mujeres con un T-score = -1.5 y antecedente de fractura vertebral. Se evaluó la eficacia de la infusión de AZ 5 mg cada 12 meses por 3 años, en la reducción de nuevas fracturas vertebrales y de cadera. Se documentó una reducción del 70% en la aparición de fracturas vertebrales morfométricas (p<0.001), así como una reducción del 41% en fracturas de cadera, (p<0.001) comparado con placebo. Los desenlaces secundarios dados por fracturas no vertebrales, todas las fracturas clínicas, fracturas vertebrales y fracturas vertebrales morfométricas múltiples también disminuyeron en forma significativa, (p<0.001) en los pacientes que recibieron AZ comparado con placebo. La densidad mineral ósea en cadera total, columna lumbar y cuello femoral aumentaron en comparación con placebo71. AZ también ha demostrado disminución del riesgo de fractura y de mortalidad secundaria a ésta, cuando se administra en forma temprana después de la primera fractura de cadera72.
Pamidronato
Al igual que etidronato, el pamidronato no está incluído dentro de las guías de tratamiento desarrolladas por la National Osteoporosis Foundation20 ni en las guías europeas para el diagnóstico y manejo de OP en mujeres postmenopáusicas1. Ha sido usado para pacientes que han presentado intolerancia gastrointestinal a BF administrados por vía oral, pero su eficacia en reducción de fracturas no ha sido bien establecida73 y ha sido desplazado actualmente por el ibandronato para uso en este tipo de pacientes. La efectividad de pamidronato ha sido estudiada en ensayos clínicos pequeños a dosis de 30 mg IV cada 3 meses demostrando estabilización o incremento de la densidad mineral ósea en columna lumbar y cuello femoral74,75.
Calcitonina
La calcitonina es una hormona polipeptídica de 32 aminoácidos secretada por las células C de la glándula tiroides que inhibe la resorción ósea por parte de los osteoclastos76. La calcitonina de salmón es aproximadamente 40 a 50 veces más potente que la calcitonina humana y ha sido usada en el tratamiento de la OP y la Enfermedad de Paget del hueso desde hace más de 30 años77. La calcitonina de salmón en spray nasal está aprobada para su uso en OP postmenopáusica en mujeres con 5 años de postmenopausia a dosis de 200 UI/dia. La calcitonina aumenta en forma modesta la densidad ósea en columna lumbar y antebrazo78. El estudio PROOF (Prevent Recurrence of Osteoporosis Fractures) fue conducido durante 5 años con un total de 1255 participantes (mujeres postmenopáusicas con osteoporosis establecida), las cuales fueron asignadas aleatoriamente a recibir calcitonina en spray nasal (100, 200 ó 400 UI al día) vs. placebo. Se encontró una disminución de nuevas fracturas vertebrales del 33% en los pacientes que recibieron calcitonina 200 UI/día en comparación con placebo (RR 0.67 con IC 95% 0.47-0,97, p=0.03). Las diferencias en los grupos de calcitonina 100 UI/día y 400 UI/ día en comparación con placebo no fueron estadísticamente significativas79. La Calcitonina ha sido desplazada por los BF para el tratamiento de la osteoporosis dado su relativamente modesto efecto sobre la densidad mineral ósea y débil eficacia antifractura a comparación de este grupo de medicamentos80.
Terapia de reemplazo hormonal (TRO)
Desde el punto de vista fisiopatológico es claro que la principal causa de OP es la deficiencia de estrógenos secundaria a la menopausia natural o inducida. Con la disminución de los niveles de estrógenos en la mujer postmenopáusica, se incrementa el recambio óseo con un consecuente desequilibrio entre las tasas de formación y resorción ósea, generando una disminución en la densidad mineral ósea81. En el estudio multicéntrico estadounidense Womens Health Initiative (WHI)-EPT se incluyeron 16608 mujeres postmenopáusicas, quienes recibieron TRO o placebo, con seguimiento por 5.6 años, documentándose una disminución de todas las fracturas de 24% y una reducción de fracturas de cadera del 33% comparado con placebo82. En un estudio posterior, también de la WHI, en el que se incluyeron 10739 mujeres histerectomizadas se demostró una reducción en el riesgo de fractura de cadera de 39% y de fractura vertebral del 38% comparado con placebo83. Como efectos positivos extra-esqueléticos de la TRO se encuentran la mejoría en los síntomas propios de la menopausia y una disminución en el riesgo de cáncer de colon de 8% - 33%84. Como efectos negativos de la TRO cabe mencionar los hallazgos del estudio WHI85, en los que se evidencia un incremento estadísticamente significativo de cáncer invasivo de seno (hazard ratio [HR] 1.26 con IC 95% 1.01-1.59), enfermedad coronaria (HR 1.29 con IC 95% 1.02-1.63), enfermedad cerebro vascular (HR 1.41 con IC 95% 1.07-1.85) y enfermedad tromboembólica (trombosis venosa profunda y tromboembolismo pulmonar) (HR 2.3 con IC 95% 1.39-3.25). En este orden de ideas, han sido más los efectos negativos de la TRO en diferentes aspectos de la salud de la mujer bajo este tipo de tratamiento, por lo que es considerada como una opción terapéutica de segunda línea en el tratamiento de la OP86.
Raloxifeno
Mientras que el tratamiento con estrógenos ha mostrado incrementar la densidad mineral ósea y disminuir el riesgo de futuras fracturas, la detección de los riesgos y efectos tóxicos de este tipo de terapia llevó a la investigación de compuestos que pueden actuar como agonistas o antagonistas de los estrógenos en diferentes órganos y tejidos. Los moduladores de los receptores selectivos de estrógenos (MRSE) se unen al receptor de estrógeno y dependiendo del órgano blanco pueden tener efectos agonistas (hueso y metabolismo lipídico) o antagonistas (mama y útero)87. El raloxifeno es el único MRSE disponible en el mercado y su uso está indicado en el tratamiento y prevención de la OP postmenopáusica y en la prevención del cáncer de mama88. Este medicamento fue especialmente desarrollado para tener un efecto antirresortivo en el hueso de la mujer postmenopáusica89. El estudio MORE (Multiple Outcome of Raloxifene Evaluation) fue un ensayo clínico multicéntrico, ciego, aleatorizado, controlado con placebo, que incluyó 7705 mujeres entre 31 y 80 años en postmenopausia por lo menos por dos años y con diagnóstico de OP según los criterios de la Organización Mundial de la Salud, con o sin fractura vertebral previa. En este estudio se encontró un aumento en la densidad mineral ósea de 2.6% en columna y 2.1% en cuello femoral a 3 años comparado con placebo (p<0.001). Adicionalmente, se encontró una reducción en el riesgo de fractura de columna en pacientes con fractura vertebral preexistente (reducción del 50%) y en pacientes sin antecedente de fractura vertebral (reducción del 30%), pero este efecto no se demostró para fracturas no vertebrales90. Un estudio de extensión de fase III llevado a cabo por 4 años más no encontró diferencias significativas en la tasa de presentación de fracturas no vertebrales91. Los datos de este último estudio sugieren que el raloxifeno no debe ser usado en pacientes con alto riesgo de fractura de cadera. Los efectos extra esqueléticos del raloxifeno también deben ser tenidos en cuenta a la hora de emplearlo en la práctica clínica, ya que el raloxifeno ha demostrado reducir el riesgo de cáncer de seno invasivo en 66% a los 8 años de seguimiento92, disminución del riesgo que también se demostró en el estudio MORE y otros ensayos clínicos93. Raloxifeno está recomendado en mujeres postmenopáusicas que no han tolerado los BF, sin antecedente de tromboembolismo venoso y sin síntomas vasomotores y que tengan alto riesgo de cáncer de seno. Raloxifeno aumenta el riesgo de trombosis venosa profunda en un grado similar al observado con los estrógenos. Este medicamento no reduce el riesgo de enfermedad coronaria.
Hormona paratiroidea
La hormona paratiroidea (PTH) es un polipéptido de 84 aminoácidos secretado por las glándulas paratiroides en respuesta a los cambios en la concentración de calcio sérico. La exposición crónica a altas cantidades de PTH sérica (como sucede en el hiperparatiroidismo primario o secundario) conlleva a un proceso de resorción ósea, lo cual haría pensar que la PTH exógena no es una buena opción para el tratamiento de la OP94. Sin embargo, la administración intermitente de la PTH (molécula completa 1-84 o su fragmento 1-34), ha mostrado estimular la formación ósea dado un incremento en el número y actividad de los osteoblastos, llevando a un aumento de la masa ósea y una mejoría en la arquitectura del hueso trabecular y cortical95-97. La molécula intacta (aminoácidos 1-84) y el fragmento 1-34 N-terminal son actualmente usados para el tratamiento de la osteoporosis. El primero es de mayor uso en Europa, mientras que el segundo (teriparatide) está autorizado por la FDA para el tratamiento de la OP en mujeres postmenopáusicas con alto riesgo de fractura y es el que está disponible en nuestro país. Teriparatide fue evaluado inicialmente en un ensayo clínico aleatorizado controlado con placebo, en el que se incluyeron 1637 mujeres postmenopáusicas con antecedente de fractura vertebral y con T-score <-1.0, quienes fueron aleatorizadas a recibir 20 ó 40 mcg de teriparatide o placebo. El seguimiento se hizo a 19 meses, documentándose un aumento en la densidad mineral ósea de 9.7% y 13.7% en la columna lumbar y de 2.8% y 5.1% en el cuello femoral para los grupos de teriparatide 20 y 40 mcg respectivamente, comparado con placebo (p<0.001). La incidencia de fracturas vertebrales se redujo en 65% y 67% y la de fracturas no vertebrales se redujo en 35% y 40% para los grupos de teriparatide 20 y 40 mcg respectivamente, comparado con placebo. Se concluyó en este estudio que aunque la dosis de 40 mcg mostraba un mayor aumento en la densidad mineral ósea, el riesgo de fracturas vertebrales y no vertebrales era similar para los dos grupos de intervención y la dosis de 40 mcg mostró más efectos adversos, por lo que se prefiere la dosis de 20 mcg/día, la cual es la dosificación estándar empleada actualmente para este medicamento98. El tratamiento con teriparatide ha sido estudiado por 18 a 24 meses y sus efectos benéficos sobre fracturas no vertebrales persisten por más de 30 meses después de descontinuar el medicamento99. Los efectos secundarios descritos con teriparatide son mínimos, incluyendo cefalea y náuseas. Este medicamento no debe ser usado en pacientes con hipercalcemia preexistente, insuficiencia renal, casos de elevación inexplicada de la fosfatasa alcalina y enfermedades óseas metabólicas distintas a la OP primaria. El tratamiento combinado de teriparatide y alendronato reduce el efecto anabólico de la PTH100, por lo que no está recomendado el uso conjunto de estos medicamentos. La opción terapéutica a seguir después del tratamiento con terapia anabólica para OP con PTH es el uso de un bifosfonato (terapia secuencial), lo cual lleva a un aumento de la densidad mineral ósea sostenido en el tiempo101.
Ranelato de Estroncio
El ranelato de estroncio (RE) es una molécula compuesta de una fracción orgánica (ácido ranélico) y dos átomos de estroncio102, la cual presenta un mecanismo de acción dual: inhibe la actividad osteoclástica disminuyendo la resorción ósea (como los BF) y estimula la actividad osteoclástica, incrementando, por tanto, la formación de hueso (como el teriparatide). Es usado en algunos países de Europa para el tratamiento de la OP postmenopáusica, reduciendo el riesgo de fracturas vertebrales y de cadera103. No está aprobado por la FDA para su uso en los Estados Unidos. El estudio SOTI (Spinal Osteoporotic Therapeutic Intervention) fue un estudio multicéntrico llevado a cabo en 11 países de Europa en el que participaron 1649 mujeres postmenopáusicas con OP y antecedente de fractura vertebral, aleatorizadas a recibir RE 2 gramos/día vs. placebo. Se encontró una reducción de fractura vertebral del 49% comparado con placebo en el primer año del estudio (p<0.001) y una reducción del 41% durante los 3 años de seguimiento (p<0.001), con lo cual se concluyó que el RE lleva a una disminución temprana y sostenida del riesgo de fractura vertebral. En el estudio TROPOS (The Treatment of Peripherical Osteoporosis) se evaluó la eficacia del RE para prevenir fracturas no vertebrales. Se incluyeron 5091 mujeres postmenopáusicas con OP en las que se demostró una disminución del 16% en el riesgo de fracturas no vertebrales (p=0.04), en el grupo tratado con RE comparado con placebo a los 3 años de seguimiento. También se documentó una reducción en las fracturas de cadera del 36% (p=0.046) con relación a placebo104. La dosis recomendada de RE es de 1 sobre de 2 gramos disuelto en agua cada día, preferentemente al acostarse. Los alimentos, los lácteos y los suplementos de calcio disminuyen su absorción, por lo que deberá administrarse al menos dos horas después de la cena. Los efectos adversos más comunes son náuseas y diarrea, los cuales son usualmente leves y desaparecen después del tercer mes de tratamiento105.
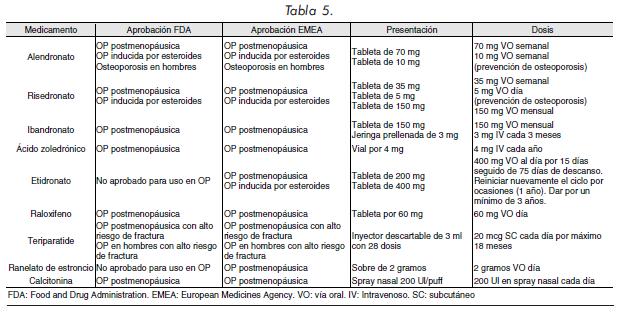
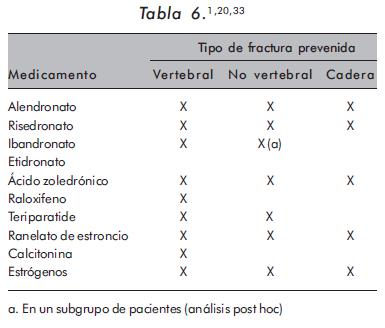
La Tabla 5 resume la presentación y dosis de los diferentes medicamentos usados en el tratamiento de la OP y sus respectivas indicaciones aprobadas por la Food and Drug Administration (FDA) y la European Medicines Agency (EMEA). En la Tabla 6 se presenta el tipo de fractura en el que se ha mostrado impacto con el uso de cada uno de los medicamentos empleados en OP.
Conclusión
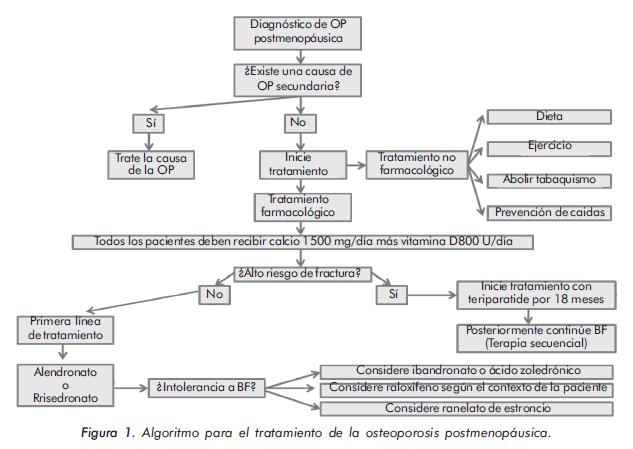
La OP es un problema de salud pública que requiere un diagnóstico oportuno y una intervención precoz para disminuir el riesgo de fractura y de esa forma lograr un impacto significativo sobre el principal desenlace de esta entidad. Los BF son la primera línea de tratamiento y dentro de éstos el alendronato y el risedronato son los más empleados alrededor del mundo. En general, son bien tolerados y están disponibles en nuestro medio. La intolerancia gastrointestinal es uno de los principales problemas de este tipo de fármacos. En caso de presentarse, está indicado el uso de una opción terapéutica intravenosa (ibandronato o ácido zoledrónico). En las pacientes con alto riesgo de fractura, el uso de teriparatide está indicado, seguido de terapia secuencial con bifosfonato (Figura 1).
Referencias
1. Kanis JA, Burlet N, Cooper C, Delmas PD, Reginster JY, Borgstrom F, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2008; 19:399-428. [ Links ]
2. U.S. Department of Health and Human Services. Bone health and osteoporosis: a report of the surgeon general (2004). http://www.surgeongeneral.gov/library/bonehealth/content.html. Acceso el 25 de febrero de 2009. [ Links ]
3. Nochowitz B, Siegert S, Wasik M. An update on osteoporosis. Am J Ther 2009;16(5):437-445. [ Links ]
4. Sambrook P, Cooper C. Osteoporosis. Lancet 2006;367:2010-2018. [ Links ]
5. Klotzbuecher CM, Ross PD, Landsman PB, Abbott TA, Berger M. Patients with prior fractures have an increased risk of future fractures: a summary of the literature and statistical synthesis. J Bone Miner Res 2000;15:721-739. [ Links ]
6. Ray NF, Chan JK, Thamer M, Melton LJ. Medical expenditures for the treatment of osteoporotic fractures in the United States in 1995: Report from the National Osteoporosis Foundation. J Bone Miner Res 1997;12:24-36. [ Links ]
7. Col NF, Eckman MH, Karas RH, Pauker SG, Goldberg RJ, Ross EM, et al. Patient - specific decisions about hormone replacement therapy in postmenopausal women. JAMA 1997;277:1140-1147. [ Links ]
8. Gehlbach SH, Bigelow C, Heimisdottir M, May S, Walker M, Kirkwood JR. Recognition of vertebral fracture in a clinical setting. Osteoporos Int 2000;11:577-582. [ Links ]
9. Sweet MG, Sweet JM, Jeremiah MP, Galazka SS. Diagnosis and treatment of osteoporosis. Am Fam Physician 2009;79(3):193-200. [ Links ]
10. Dennison E, Mohamed MA, Cooper C. Epidemiology of osteoporosis. Rheum Dis Clin N Am 2006;32:617-629. [ Links ]
11. Sinigaglia L, Varenna M, Girasole G, Bianchi G. Epidemiology of osteoporosis in rheumatic diseases. Rheum Dis Clin N Am 2006;32:631-658. [ Links ]
12. Blake GM, Fogelman I. The role of DXA bone density scans in the diagnosis and treatment of osteoporosis. Postgrad Med J 2007;83:509-517. [ Links ]
13. Writing Group for the ISCD Position Development Conference. Indications and reporting for dual-energy x-ray absorptimoetry. J Clin Denistom 2004;7:37-44. [ Links ]
14. Maghraoui AE, Roux C. DXA scanning in clinical practice. Q J Med 2008;101:605-617. [ Links ]
15. Lin JT, Lane JM. Nonpharmacologic management of osteoporosis to minimize fracture risk. Nat Clin Pract Rheumatol 2008;4:20-25. [ Links ]
16. Schwab P, Klein R. Nonpharmacological approaches to improve bone health and reduce osteoporosis. Curr Opin Rheumatol 2008;20:213-217. [ Links ]
17. Genuis SJ, Scwalfenberg GK. Picking a bone with contemporary osteoporosis management: nutrient strategies to enhance skeletal integrity. Clin Nutrition 2007;26:193-207. [ Links ]
18. Keen R. Osteoporosis: strategies for prevention and management. Best Pract Res Clin Rheumatol 2007;21:109-122. [ Links ]
19. Geusens PP, Roux CH, Reid DM, Lems WF, Adami A, Adachi JD, et al. Drugs insight: choosing a drug treatment strategy for women with osteoporosis - an evidence based clinical perspective. Nat Clin Pract Rheumatol 2008;4:240-248. [ Links ]
20. National Osteoporosis Foundation. Clinicians guide to prevention and treatment of osteoporosis. Washington, D.C. National Osteoporosis Foundation; 2008. [ Links ]
21. Stein E, Shane E. Secondary osteoporosis. Endocrinol Metab Clin N Am 2003;32:115-134. [ Links ]
22. Kelman A. The management of secondary osteoporosis. Best Pract Res Clin Rheumatol 2005;19:1021- 1037. [ Links ]
23. Allport J. Incidence and prevalence of medicationinduced osteoporosis: evidence based review. Curr Opin Rheumatol 2008;20:435-441. [ Links ]
24. Simon LS. Osteoporosis. Clin Geriatr Med 2005; 21:603-629. [ Links ]
25. Russel RG, Dunford JE, Oppermann U, Kaawasi A, Hulley PA, Kavanagh KL, et al. Bisphosphonates: an update on mechanisms of action and how these relate to clinical efficacy. Ann NY Acad Sci 2007;1117:209- 257. [ Links ]
26. Recker RR, Lewiecki EM, Miller PD, Reiffel J. Safety of bisphosfonates in the treatment of osteoporosis. Am J Med 2009;122:22-32. [ Links ]
27. Friedman PA. Agentes que modifican la homeostasia de iones minerales y el recambio de hueso. En: Brunton LL, Lazo JS, Parker KL, editores. Las bases farmacológicas de la terapéutica. 2006 New York, USA. McGraw-Hill Companies, 2007:1647-1675. [ Links ]
28. Imboden JB. Therapies: medications. En: Imboden J, Hellmann D, Stone J, editores. En: Current Rheumatology, diagnosis and treatment, 2ª edición. New York, USA. McGraw-Hill Companies, 2007. Capítulo 67. [ Links ]
29. Roux C. Potential effects of bisphosfonates on bone ultraestructure. Osteoporos Int 2009;20:1093-1095. [ Links ]
30. Lane NE. Metabolic bone disease. En: Ruddy S, Harris ED, Sledge CB, Budd RC, Sarjent JS, editores. En: Kelly ]s Testbook of Rheumatology, 8ª edición. Philadelphia: WB Saunders Co, 2008:1579-1599. [ Links ]
31. Russel RG. Bisphosfonates: from bench to bedside. Ann NY Acad Sci 2006;1068:367-401. [ Links ]
32. Pellegrini R. Which water for alendronate administration? Osteoporos Int 2009;20:1451. [ Links ]
33. Poole KE, Compston JE. Osteoporosis and its management. BMJ;2006:333:1251-1256. [ Links ]
34. Miller PD. Anti-resorptives in the management of osteoporosis. Best Pract Res Clin Endoc Metabol 2008;22:849-868. [ Links ]
35. Miller PD. Is there a role for bisphosfonates in chronic kidney disease? Semin Dial 2007;20:186-190. [ Links ]
36. Ruggiero SL, Mehrotra B, Rosenberg T. Osteonecrosis of the jaw associated with the use of biphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004;62:527-534. [ Links ]
37. Advisory task force on bisphosphonate-related osteonecrosis of the jaws. American Association of oral and maxillofacial surgeons position paper on bisphosphonate related osteonecrosis of the jaws. J Oral Maxillofac Surg 2007;65:369-376. [ Links ]
38. Khan AA, Sandor GK, Dore E, Morrison AD, Alzhali M, Amin F, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol 2009;36:478-490. [ Links ]
39. Bilezikian JP. Osteonecrosis of the jaw - Do bisphosphonates pose a risk?. NEJM 2006;355:2278-2281 [ Links ]
40. Goytia RN, Salama A, Khanuja HS. Bisphosphonates and osteonecrosis: potential treatment or serious complication?. Orthop Clin N Am 2009;40:223-234. [ Links ]
41. Ruggiero SL, Mehrotra B. Bisphoshponate related osteonecrosis of the jaw: diagnosis, prevention and management. Annu Rev Med 2009;60:85-96. [ Links ]
42. Majumdar SR. Oral bisphosphonates and atrial fibrillation. BMJ 2008;336(7648):784-785. [ Links ]
43. Sorensen HT, Christensen S, Mehnert F, Pedersen L, Chapurlat RD, Cummings SR, et al. Use of bisphosphonates among women and risk of atrial fibrillation and flutter: population based case control study. BMJ 2008;336(7648):813-816. [ Links ]
44. Watts NB, Harris ST, Genant HK, Wasnich RD, Miller PD, Jackson RD. Intermittent cyclical etidronate treatment of postmenopausal osteoporosis. NEJM 1990;322(18):1265-1271. [ Links ]
45. Storm T, Thamsborg G, Steiniche T, Genant HK, Sorensen OH. Effect of intermittent cyclical etidronate therapy on bone mass and fracture rate in woman with postmenopausal osteoporosis. NEJM 1990; 323(2):73-79. [ Links ]
46. Cranney A, Guyatt G, Krolicki N, Welch V, Griffith L, Adachi D, et al. A meta-analysis of etidronate for the treatment of postmenopausal osteoporosis. Osteoporos Int 2001;12:140-151. [ Links ]
47. Brown SA, Rossen CJ. Osteoporosis. Med Clin N Am 2003;87:1039-1063. [ Links ]
48. McClung M, Clemmesen B, Daifotis A, Gilchrist NL, Eisman J, Weinstein RS, et al. Alendronate prevents postmenopausal bone loss in women without osteoporosis: a double-blind, randomized, controlled trial. Ann Inter Med 1998;128(4):253-261. [ Links ]
49. Black D, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996; 348:1535-1541. [ Links ]
50. Cummings SR, Black DM, Thompson DE, Applegate WB, Barrett-Connor E, Musliner TA, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the fracture intervention trial. JAMA 1998; 280:2077-2082. [ Links ]
51. Cranney A, Tugwell P, Wells G, Guyatt G. Metaanalyses of therapies for postmenopausal osteoporosis. Endocr Rev 2002;23(4):508-516. [ Links ]
52. Schnitzer T, Bone HG, Crepaldi G. Therapeutic equivalence of alendronate 70 mg once-weekly and alendronate 10 mg daily in the treatment of osteoporosis. Aging (Milan, Italy) 2000;12(1):1-12. [ Links ]
53. The alendronate once-weekly study group. Two-years results of once-weekly administration of alendronate 70mg for the treatment of postmenopausal osteoporosis. J Bone Miner Res 2002;17:1988-1996. [ Links ]
54. Mortensen L, Charles P, Bekker J, Digennaro J, Johnston C. Risedronate increases bone mass in early postmenopausal population: two years for treatment plus one year for follow-up. J Clin Endocrinol Metabol 1998;83:396-402. [ Links ]
55. Fogelman I, Ribot C, Smith R, Ethgen D, Sod E, Reginster JY. Risedronate reverses bone loss in postmenopausal women with low bone mass: results from a multinational, double blind, placebocontrolled trial. BMD-MN Study Group. J Clin Endocrinol Metabol 2000;85:1895-1900. [ Links ]
56. Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M, et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. JAMA 1999;282 (14):1344-1352. [ Links ]
57. Reginster JY, Minne HW, Sorensen OH, Hooper M, Brandi ML, Lund B, et al. Randomized trial the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteoporos Int 2000;11:83-91. [ Links ]
58. Sorensen OH, Crawford GM, Hulder M, Hosking DJ, Gennari C, Mellstrom D, et al. Long-terms safety of risedronate: a 5 years placebo - controlled clinical experience. Bone 2003;32(2):120-126. [ Links ]
59. Brown JP, Kendler DL, McClung MR, Emkey RD, Adachi JD, Bolognese MA. The efficacy and tolerability of risedronate once a week for the treatment of postmenopausal osteoporosis. Calcif Tissue Int 2002;71:103-111. [ Links ]
60. Rizer MK. Osteoporosis. Prim Care Clin Office Pract 2006;33:943-951. [ Links ]
61. Adami S. Bisphosphnate antifracture efficacy. Bone 2007;41:s8-s15. [ Links ]
62. Curtis JR, Westfall AO, Cheng H, Saag KG, Delzell E. Risendronate and alendronate intervention over three years (REALITY): minimal differences in fracture risk reduction. Osteoporos Int 2009;20:973-978. [ Links ]
63. Chesnut CH III, Skag A, Christiansen C, Recker R, Stakkestad JA, Hoiseth A, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004;19:1241-1249. [ Links ]
64. Reginster JY, Adami S, Lakatos P, Greenwald M, Stepan JJ, Silverman SL, et al. Efficacy and tolerability of oncemonthly oral inbandronate in postmenopausal osteoporosis: 2 years results from the MOBILE study. Ann Rheum Dis 2006;65:654-661. [ Links ]
65. Delmas PD, Adami S, Strugala C, Stakkestad JA, Reginster JY, Felsenberg D. Intravenous ibandroante injections in postmenopausal women with osteoporosis: one year results from the dosing intravenous administration study. Arthritis Rheum 2006;54:1838-1846. [ Links ]
66. Harris ST, Reginster JY, Blumentals WA, Poston SA, Barr CE, Silverman SL. Risk of fracture in women treated with monthly oral ibandronate or weekly bisphosphonates: The evaluation of ibandronate efficacy (VIBE) database fracture study. Bone 2009;44:758-765. [ Links ]
67. Papapoulus SE, Schimmer RC. Changes in bone remodeling and antifracture efficacy of intermittent bisphosphonate therapy: implications from clinical studies with ibandronate. Ann Rheum Dis 2007; 66:853-858. [ Links ]
68. Muller R, Recker RR. Bisphosphonate action on bone structure and strength: preclinical and clinical evidence for ibandronate. Bone 2007;41:s16-s23. [ Links ]
69. Rizzoli R, Reid DM. Ibandronate: an IV injection for the treatment for postmenopausal osteoporosis. Bone 2007;41:s24-s28. [ Links ]
70. Reid IR, Brown JP, Burckhardt, Horowitz Z, Richardson P, Trechsel U. Intravenous zoledronic acid in postmenopausal women with low bone mineral density. NEJM 2002;346:653-661. [ Links ]
71. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA. Once-Year Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. NEJM 2007; 356:1809-1822. [ Links ]
72. Lyles KW, Colon-Emeric CS, Magazines JS, Adachi JD, Pieper CF, Mautalen C, et al. The HORIZON recurrent fracture trial, Zoledronic acid and clinical fractures and mortality after hip fracture. NEJM 2007;357:1799-1807. [ Links ]
73. Rosen CJ. Postmenopausal osteoporosis. NEJM 2005;353:595-603. [ Links ]
74. Watanabe Y, Ohshima H, Mizuno K, Sekiguchi C, Fukunaga M, Kohri K, et al. Intravenous pamidronate prevents femoral bone loss and renal stone formation during 90-day bed rest. J Bone Min Res 2004; 19(11):1771-1778. [ Links ]
75. Younes H, Farhat G, El-Hajj Fuleihan G. Efficacy and tolerability of cyclical intravenous pamidronate in patients with low bone mass. J Clin Densitometry 2002;5(2):143-149. [ Links ]
76. Mehta NM, Malootian A, Gilligan JP. Calcitonin for osteoporosis and bone pain. Curr Pharm Des 2003; 9(32):2569-2576. [ Links ]
77. Chesnut CH III, Azria M, Silverman S, Engelhardt M, Olson M, Mindeholm L. Salmon calcitonin: a review of current and future therapeutic indications. Osteoporos Int 2008;19:479-491. [ Links ]
78. Cranney A, Tugwell P, Zyatruk N, Robinson V, Weaver B, Shea B, et al. Meta-analysis of calcitonin for the treatment of postmenopausal osteoporosis. Endocr Rev 2002;23:540-551. [ Links ]
79. Chesnut CH III, Silverman S, Andriano K, Genant H, Giomama A, Harris S, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: The prevent recurrence of osteoporosis fracture Study. PROOF Study Group. Am J Med 2000;109:267-276. [ Links ]
80. Downs RW, Bell NH, Ettinger MP, Walsh B, Favus MJ, Mako B, et al. Comparison of alendronate and intranasal calcitonin for treatment in osteoporosis in postmenopausal women. J Clin Endocrinol Metab 2000;85:1783-1788. [ Links ]
81. Gallagher JC. Role of estrogens in the management of postmenopausal bone loss. Rheum Dis Clin N Am 2001;27(1):143-162. [ Links ]
82. Cauley JA, Robbins J, Chen Z, Cummings SR, Jackson RD, LaCroix AZ, et al. Effects of estrogens plus progestin on risk of fracture and bone mineral density: The women's health initiative randomized trial. JAMA 2003;290:1729-1738. [ Links ]
83. Anderson JL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: The women's health initiative randomized controlled trial; The women's health initiative steering committee. JAMA 2004;291:1701- 1712. [ Links ]
84. Clebowski RT, Wactawski-Wende J, Ritenbaugh C, Hubbell FA, Ascensao J, Rodabough RJ. Estrogen plus progestin and colorectal cancer in postmenopausal women. NEJM 2004;350:991-1004. [ Links ]
85. Writing group for the women's health initiative investigators. Risk and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the women's health initiative randomized controlled trial. JAMA 2002;288:321- 333. [ Links ]
86. Cranney A, Wells GA. Hormone replacement therapy for postmenopausal osteoporosis. Clin Geriatr Med 2003;19:361-370. [ Links ]
87. Lash R, Nicholson JM, Velez L, Van Harrison R, McCort J. Diagnosis and management of osteoporosis. Prim Care Clin Office Pract 2009;36:181-198. [ Links ]
88. Evista (inserto del empaque). Indianapolis: Eli Lilly y compañía; 2007. [ Links ]
89. Deal CL, Abelson AG, Carey JJ. Management of osteoporosis. En: Hocberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH. Rheumatology. Editorial Elsevier Science Health Science Division. 2007. p.1955-1968. [ Links ]
90. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: Results from a 3-year randomized clinical trial. JAMA 1999;282:637- 645. [ Links ]
91. Siris ES, Harris ST, Eastell R, Zanchetta JR, Goemaere S, Diez-Perez A, et al. Skeletal effects of raloxifene after 8 years: Results from the continuing outcomes relevant to Evista (CORE) study. J Bone Min Res 2005;20(9):1514-1524. [ Links ]
92. Martino S, Cauley JA, Barret-Connor E, Powles TJ, Mershon J, Disch D, et al. Continuing outcomes relevant to Evista: Breast cancer incidence in postmenopausal osteoporotic women in a randomized clinical trial of raloxifene. J Natl Cancer Inst 2004;96:1751-1761. [ Links ]
93. Vogel VG, Costantino JP, Wickerham DL. Effects of tamoxifen vs raloxifene on the risk of developing breast cancer and other diseases outcomes: The NSABP study of tamoxifen and raloxifene (STAR) P-2 trial. JAMA 2006;295(23):2727-2741. [ Links ]
94. Deal C. Potential new drugs targets for osteoporosis. Nat Clin Pract Rheumatol 2009;5:20-26. [ Links ]
95. Jilka RL. Molecular and cellular mechanisms of the anabolic effect of intermittent PTH. Bone 2007; 40:1434-1446. [ Links ]
96. Cortet B. Effects of bone anabolic agents on bone ultrastructure. Osteoporos Int 2009;20:1097-1100. [ Links ]
97. Compston JE. Skeletal actions of intermittent parathyroid hormone: Effects on bone remodeling and structure. Bone 2007;40:1447-1452. [ Links ]
98. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Effect of parathyroid hormone (1-34) on fractures and bone density in postmenopausal women with osteoporosis. NEJM 2001; 344:1434-1441. [ Links ]
99. Prince R, Sipos A, Hossain A, Syversen U, Ish-Shalom S, Marcinowaska E, et al. Sustained non vertebral fragility fracture risk reduction after discontinuation of teriparatide treatment. J Bone Min Res 2005; 20:1507-1513. [ Links ]
100. Black DM, Greenspan SL, Ensrud KE, Palermo L, McGowan JA, Lang TF, et al. The effects of parathyroid hormone and alendronate alone or in combination in postmenopausal osteoporosis. NEJM 2003; 349:1207-1215. [ Links ]
101. Black DM, Bilezikian JP, Ensrud KE, Greenspan SL, Palermo L, Trisha Hue MA, et al. One year of alendronate after one year of parathyroid hormone (1-84) for osteoporosis. NEJM 2005;353:555-565. [ Links ]
102. Marie PJ. Strontium ranelate: New insights into its dual mode of action. Bone 2007;40:s5-s8. [ Links ]
103. Roux C. Antifracture efficacy of strontium ranelate in postmenopausal osteoporosis. Bone 2007;40:s9-s11. [ Links ]
104. Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study. J Clin Endocrinol Metabol 2005;90:2816-2822. [ Links ]
105. Shoback D. Update in osteoporosis and metabolic bone disorders. J Clin Endocrinol Metabol 2007; 92:747-753. [ Links ]














