Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.23 Bogotá Jan./June 2012
Composición de ácidos grasos en ovas de trucha
arco iris (Oncorhynchus mykiss, Walbaum, 1792)
Rafael Rosado Puccini1 / Miguel Ángel Landines Parra2 / Gonzalo J. Díaz González3
1 Biólogo marino. MSc. Grupo de Fisiología de Peces, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia. rrosadop@unal.edu.co
2 Zootecnista. MSc, PhD. Grupo de Fisiología de Peces, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia. malandinezp@unal.edu.co
3 Médico veterinario. MSc, PhD. Grupo de Investigación en Toxicología y Nutrición Aviar, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia. gjdiazg@unal.edu.co
Recibido: 7 de noviembre del 2011. Aceptado: 17 de febrero del 2012
Resumen
En este artículo se analizan con parámetros de composición 58 puestas de trucha arcoiris obtenidas, manejadas y monitoreadas individualmente en desempeño desde la fertilización hasta finalizar la etapa de reabsorción de vesícula. Además de los valores reproductivos, el contenido de ácidos grasos en las ovas se determinó en fresco, mediante cromatografía de gases. En el perfil medio se destacan los ácidos palmítico (C16), oleico (C18:1n-9) y docosahexaenoico (C22:6n-3) como los más representativos, con casi el 60% del total y, en general, en concentraciones estables entre las hembras. Tanto para cada ácido determinado como para el conjunto de contenidos integrados de las series n-3 y n-6, y los colectivos de saturados (SAF), monoinsaturados (MUFA) y poliinsaturados (PUFA), se define un patrón de composición similar al reportado para la especie en otros esquemas de manejo y bajo regímenes nutricionales variables. Se analizó la condición conservativa en la incorporación de ácidos grasos al huevo, y se discutió su utilidad como posibles definitorios de calidad, teniendo como referente la alta variabilidad registrada en la supervivencia al final del proceso de incubación.
Palabras clave: ácidos grasos, calidad del huevo, composición del huevo, Oncorhynchus mykiss.
Fatty Acid Composition in Rainbow Trout Eggs
(Oncorhynchus mykiss, Walbaum, 1792)
Abstract
This article analyzes, with composition parameters, 58 rainbow trout egg-layings obtained, handled and monitored individually in performance from their fertilization until the end of the gallbladder reabsortion phase. Aside from the reproductive values, the content of fatty acids in the eggs was determined in fresh conditions through gas chromatography. The average profile highlights the palmitic acid (C16), oleic acid (C18:1n-9) and docosahexaenoic acid (C22:6n-3), as the most representative, with almost 60% of the total and, in general, in stable concentrations among females. Both for each determined acid and for the suite of integrated series n-3 and n-6, and the groups of saturated (SAF), monounstaturated (MUFA) and polyunsaturated (PUFA), a pattern of similar composition to the one reported is defined for the species in other management schemes and under varying nutritional regimes. The conservative condition was analyzed in the incorporation of fatty acids into the egg and its usefulness as possible quality definers was discussed, using the high variability recorded in survival at the end of the incubation process as reference.
Keywords: Fatty acids, egg quality, egg composition, Oncorhynchus mykiss.
Composição de ácidos graxos das ovas de truta arco-íris
(Oncorhynchus mykiss, Walbaum, 1792)
Resumo
Neste artigo analisam-se com parâmetros de composição, 58 posturas de truta arco-íris obtidas, manejadas e monitoradas individualmente em desempenho, desde a fertilização até a finalização da etapa de absorção de vesícula. Além dos valores reprodutivos, o conteúdo de ácidos graxos nas ovas foi determinado em fresco, mediante cromatografia de gases. No perfil médio destacam-se os ácidos palmíticos (C16), oleico (C18:1n-9) e docosaexaenoico (C22:6n-3), como os mais representativos, com quase 60% do total e, em geral, em concentrações estáveis entre as fêmeas. Tanto para cada ácido determinado quanto para o conjunto de conteúdos integrados das séries n-3 e n-6, e os coletivos de saturados (SAF), monoinsaturados (MUFA) e poli-insaturados (PUFA), define-se um padrão de composição similar ao relatado para a espécie em outros esquemas de manejo e em regimes nutricionais variáveis. Analisou-se a condição conservativa na incorporação de ácidos graxos à ova, e discutiu-se sua utilidade como possíveis determinantes de qualidade, tendo como referência a alta variabilidade registrada na sobrevivência ao final do processo de incubação.
Palavras chave: ácidos graxos, qualidade da ova, composição da ova, Oncorhynchus mykiss.
Introducción
La viabilidad larvaria es el referente que define la calidad de la ova en la producción de peces (1). Esta capacidad, inherente al huevo, es finalmente el potencial resultado de la interacción de componentes multifactoriales especie-específicos integrados en la arquitectura y relacionados con las propiedades que el ovocito adquiere durante su proceso formativo; en particular, es altamente dependiente de la información materna y del conjunto molecular que se le puede transmitir (2).
En el estatus nutricional de los reproductores se fundamenta la provisión energética necesaria para el desarrollo embrionario (3,4), y en esquemas piscícolas que involucran la utilización de dietas deficientes en ácidos grasos se demuestra la producción de semilla con una baja supervivencia (5). Los mayores componentes presentes en el vitelo del huevo son lipoproteínas, fosfoproteínas y, frecuentemente, inclusiones lipídicas que van desde pequeñas gotas dispersas hasta glóbulos de gran tamaño (6), compuestos casi exclusivamente por triglicéridos en varias especies de Oncorhynchus (7). El complejo precursor del vitelo es la vitelogenina (una glicolipofosfoproteína con 300-600 kDa), que actúa como vehículo a través del cual los lípidos son transportados al interior del huevo (8); bajo modulación de estrógenos es sintetizada en el hígado y posteriormente, de forma selectiva, por endocitosis se incorpora a los oocitos (9). Cuando la vitelogenina es integrada, se divide en un complejo lipoproteína-fosfoproteína (10), fuente de aminoácidos, lípidos, fosfatos inorgánicos y calcio requeridos en estadios tempranos.
El pez obtiene lípidos a través de los ácidos grasos provenientes de la dieta, de sus propias reservas y, posiblemente, de algunos que son sintetizados de novo (tanto en el ovario como en el hígado). Desde una perspectiva general, en los huevos de peces se considera que hay una relación positiva entre la cantidad de lípidos con el tiempo que transcurre desde la fertilización hasta que finaliza el desarrollo embrionario (11); los salmónidos en particular, caracterizados por elevados periodos de formación temprana, se incluyen dentro del grupo de peces cuyos huevos mantienen altos contenidos de lípidos (12). Los fosfolípidos actúan como fuente de energía en circunstancias asociadas a eventos de desarrollo temprano en peces, y los triglicéridos constituyen la clase principal para almacenamiento y provisión energética (13, 14).
Al igual que en otros animales, la acción principal de los ácidos grasos se focaliza en el mantenimiento de la estructura e integridad funcional de las membranas, además de actuar como precursor de eicosanoides (15). Si bien todos tienen función energética en el desarrollo, son los monoinsaturados (MUFA) los utilizados preferencialmente como sustrato para el catabolismo por parte de los embriones y sirven, además, de reserva de ácidos grasos estructurales. El complejo lipoproteico incluye tanto fosfolípidos como lípidos neutrales (principalmente triacilglicerol), siendo estos los que se reconocen como la fuente primaria de energía (6). Las lipoproteínas son esencialmente ricas en ácidos grasos poliinsaturados (PUFA) de la serie n-3, particularmente el ácido docosahexaenoico (DHA, 22:6n-3). En el periodo de desarrollo gonadal, los ácidos grasos se movilizan desde las reservas lipídicas y se incorporan al huevo (13, 16). Como se mencionó, la predicción temprana de la viabilidad se justifica en la producción de semilla de peces especialmente en aquellas especies con largos periodos o altos costos de incubación (17); los factores de composición de la ova proveen en esta línea un útil, aunque no único, acercamiento (18, 19), pues se supone que son una aproximación de la configuración nutricional que se requiere en estadios tempranos (20).
En referencia al contexto local se tiene que en el país la producción de truchas de consumo tiene una total dependencia de ovas que son importadas regularmente, en tanto hay elementos de calidad no superados en las condiciones nacionales. Así, la obtención de semilla se encuentra en una situación no competitiva y, por tanto, cualquier posibilidad de potenciar esta fase de la actividad truchícola requiere la superación de los factores negativos que la califican como inferior; encaminar este desarrollo requiere del avance técnico en varios aspectos, entre los que la calidad ocupa un lugar fundamental como función y como elemento básico de monitoreo. Dado que en la actualidad no se dispone de trabajos de tipo evaluativo que involucren los primeros estadios de desarrollo, el objetivo del trabajo se dirige a caracterizar la composición en ácidos grasos de las ovas de trucha obtenidas bajo esquemas propios de producción y manejo. Constituye un primer acercamiento a la valoración de elementos asociados a la ova misma que puedan constituir una base para posteriores estudios, en los que se considere la calidad como complemento para soportar un eventual avance en la producción nacional de semilla de la especie.
Materiales y método
Localización
El material fue obtenido en las instalaciones productivas de una explotación comercial ubicada en el municipio de Guasca (Cundinamarca, Colombia). La granja se localiza a 2850 msnm, y se alimenta de las aguas del río Chigüanos que mantiene aproximadamente 11 °C de temperatura media; en general, las condiciones climáticas y de agua en el área son particularmente aptas para la producción de semilla de la especie. Se mantiene un esquema de manejo reproductivo regulado, con un plantel compuesto por aproximadamente de 1500 reproductores, con una proporción similar entre sexos. En la explotación, los ejemplares son mantenidos en estanques construidos en ladrillo y cemento; el manejo general implica la limpieza rutinaria de las unidades mediante barrido y evacuación del sedimento presente. En la alimentación se utiliza concentrado comercial formulado para la fase de finalización de truchas (43% de proteína bruta), que contiene pigmento y se suministra ad libitum en dos raciones/día.
Desove y fertilización
De forma semanal y durante 30 días, 4 grupos de hembras de trucha arco iris seleccionadas por sus características de madurez fueron separadas del lote principal de reproductoras, manejadas y desovadas. Antes del desove, se registraron datos de longitud total (con aproximación a 1 cm) y peso (con aproximación a 25 g). Para el manejo de los individuos se utilizó como anestésico el metano sulfonato de tricaína (MS 222) a 75 ppm.
Las puestas fueron recibidas en recipientes plásticos previamente pesados (con aproximación a 0,1 g). Se evaluaron visualmente para identificar evidencias de sobremaduración y definir rechazos. Solamente se utilizaron aquellas con características primarias aparentemente aptas para proceder con la fertilización (n = 58) y para cada una se utilizó el esperma de al menos tres machos. Se registró el peso de cada puesta (con aproximación a 0,1 g) para determinar, por gravimetría, el número de huevos/hembra y el respectivo valor de fecundidad relativa.
En la fertilización, el esperma fue extraído mediante masajes manuales y recibido directamente sobre los huevos, mezclando continuamente en medio seco. Después de 5 min se continuó con la hidratación (60 min) y el lavado completo del material antes de su ingreso a incubación. Se tomaron medidas de diámetro, peso y volumen en cada grupo de huevos. Una muestra de 20-25 g de las ovas de cada hembra se retiró y se mantuvo refrigerada hasta su análisis. Las ovas restantes se ubicaron en incubadoras de flujo vertical, separadas por puesta/hembra y mantenidas hasta eclosión (T = 9,36 ± 1,04 °C). La mortalidad se retiró periódicamente y se calcularon índices parciales de eficiencia en el periodo de ova verde, embrionada, eclosión y alevinos comiendo.
Perfil de ácidos grasos
Los análisis se adelantaron sobre material vivo, mantenido en refrigeración (± 4 °C) desde su obtención hasta el análisis (< 24 h). La determinación del perfil de ácidos grasos se llevó a cabo en ovas vivas, las cuales se conservaron desde su obtención hasta su extracción por solventes a 4 °C. La extracción de los lípidos de las ovas se realizó de acuerdo con la metodología de Folch et ál. (21), y la determinación cromatográfica de los ácidos grasos según lo descrito por Betancourt et ál. (22). Estos procedimientos se resumen a continuación. Se homogeneizó una muestra de ovas de 1 g (peso húmedo) a 4 °C con una solución de cloroformo y metanol (2:1), utilizando un homogeneizador de tejidos de vidrio esmerilado. Una vez homogeneizada la muestra se filtró, se midió el volumen filtrado, y el solvente filtrado se centrifugó a 2000 rpm por 15 min. Luego de la centrifugación el extracto se observa separado en dos fases: una fase acuosa superior y una fase orgánica inferior. La fase acuosa superior se eliminó con la ayuda de una pipeta y la fase orgánica se llevó a sequedad mediante vacío a temperatura ambiente. El extracto lipídico seco se disolvió con una solución de cloroformo:metanol (1:1) y a una alícuota de 20 se le adicionó el reactivo de metilesterificación MethPrep II (Alltech Associates Inc., Deerfield, IL, USA), para obtener los metilésteres de los ácidos grasos. La determinación de los metilésteres de los ácidos grasos se llevó a cabo en un cromatógrafo de gases Shimadzu GC-14A equipado con un detector de ionización de llama (260 °C). La separación se realizó con una columna Supelco® Omegawax 320, de 30 m x 0,32 mm x 0,25 μm de grosor de película, mediante una rampa de temperatura (temperatura inicial de 80 °C, 10 °C/min hasta 190 °C, 20 min a 190 °C, 2 °C/min hasta 220 °C y 10 min 220 °C). Se utilizó helio como gas transportador. Los metil-ésteres de los ácidos grasos se identificaron por comparación con los tiempos de retención de una mezcla estándar de ácidos grasos (Supelco 37 component FAME Mix, Supelco Inc., Bellefonte, PA, USA).
Análisis estadístico
Los datos se agrupan de manera descriptiva y los resultados de composición de cada ácido graso identificado se expresan en porcentaje. Para efectos de análisis se hace referencia a registros provenientes de trabajos similares, con metodologías y forma de presentación de resultados comparables; cuando fue necesario y posible se calcularon relaciones no reportadas a partir de datos originales, lo cual se indica en el texto.
Resultados
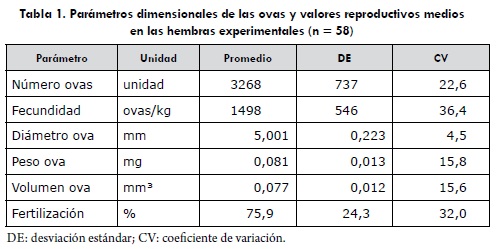
Las reproductoras seleccionadas presentaron una longitud total entre 39 y 67 cm con una media de 51,4 ± 4,37 cm. En peso, la variación fue de 1500 a 3700 g, con media 2078 ± 433 g. Los valores reproductivos del lote de hembras (tabla 1) se encontraron dentro de los que se consideran normales para la especie, de acuerdo con los estándares que se mencionan en Bromage y Cumaranatunga (18) y Gordon et ál. (23).
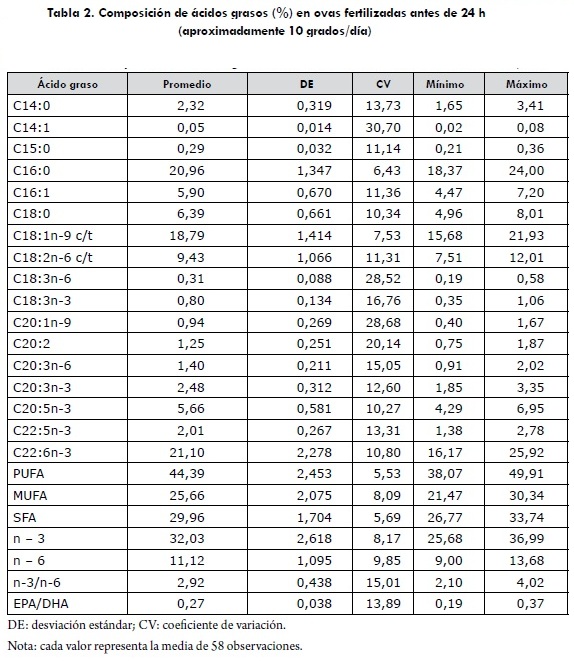
La fase de incubación tuvo una duración de 31 a 36 días, con un promedio de 318 grados/día entre fertilización y eclosión. La fertilización media en los 58 grupos fue del 75,9 ± 24,3% y fue medida en los 70-100 grados/día de desarrollo; se hizo mediante aclaramiento por inmersión de una muestra en una solución 1:1:1 de metanol:ácido acético:agua, y el conteo de las ovas en las que se presentó embrión con desarrollo normal. La supervivencia en incubación registró una alta variabilidad (entre 0 y 93%), y la viabilidad media al finalizar la reabsorción de la vesícula vitelina fue del 95,7 ± 13,6%. La composición promedio de ácidos grasos determinados como metil-éteres en las ovas se resume en la tabla 2.
Discusión
Los elevados valores del coeficiente de variación (CV) determinados para el número de ovas obtenidas por hembra, y la fecundidad relativa, se podrían explicar por el amplio rango de peso en los ejemplares trabajados, aunque la media corresponde a la esperada por unidad de peso en las reproductoras; la variable dimensional más estable en ovas fue el diámetro y el valor se ajusta a los indicadores que las definen como de talla comercial (18). La extrema variabilidad en los registros de eficiencia al finalizar la incubación es equivalente a las valoraciones que presentan Bromage et ál. (2), y es una evidencia de las circunstancias productivas, con un comportamiento no consistente entre puestas individuales que justifican los esfuerzos sobre la precisión en parámetros de calidad temprana en especies de interés piscícola (1,3). Por otro lado, los valores promedio de eficiencia obtenidos en las fases parciales de ova embrionada-eclosión y de eclosión-alevinos comiendo muestran una mayor estabilidad de las etapas de embrionamiento y de reabsorción de vesícula en términos de supervivencia; este comportamiento sugiere que los factores que intervienen en la calidad tendrían mayor influencia y se estarían expresando fuertemente durante la fase de ova verde (periodo de desarrollo que va desde la fertilización hasta el embrionamiento), que constituye aproximadamente el 65% del total del tiempo de incubación.
Como se anotó, la medición de ácidos grasos fue efectuada sobre ovas vivas, antes de las 24 h, mantenidas en refrigeración (± 4 °C) desde la fertilización hasta el análisis. Se supone que la composición determinada corresponde a la existente en huevos recién fertilizados, sin variaciones debidas a transformaciones metabólicas asociadas al desarrollo embrionario, lo que tiene fundamento práctico en los resultados de Halüloúlu et ál. (24), al comprobar que las diferencias en la composición de ácidos grasos entre huevos sin fertilizar y con 24 horas de desarrollo no son significativas. Bajo las condiciones experimentales, en las que el acumulado térmico fue inferior a los 10 grados/día, la evolución embrionaria alcanza únicamente las primeras segmentaciones (25), de lo que se infiere una mínima actividad metabólica.
La comparación con otras referencias sobre contenidos de ácidos grasos en huevos puede ser de difícil interpretación, tanto por los condicionamientos prácticos (métodos analíticos, proceso de las muestras, modos de expresión de resultados) que para este tipo de análisis estipula Wiegand (6), como por la influencia de variables asociadas a las características de los reproductores utilizados en las diferentes evaluaciones (26); aún con lo anterior, en los perfiles obtenidos se manifiesta un patrón general de configuración que conserva correspondencia entre las cantidades relativas de los diferentes ácidos, lo que finalmente tiene expresión en una estabilidad entre las proporciones similar a otros reportes (27). Según Wiegand (6), esta situación se presenta en varias especies y puede indicar una forma de regulación dirigida a mantener equilibrada la composición de ácidos grasos en el vitelo; la aparente movilización ácidos grasos específicos durante el desarrollo gonadal es también considerada por Sargent et ál. (12).
Por un lado, los menores contenidos (< 2,5% del total) se determinaron para los saturados C14 y C15; entre los monoinsaturados también se presentaron bajos valores en C14:1 (el más bajo) y C20:1n-9 (< 1% del total). Para estos ácidos en particular, o bien no se registran cambios significativos en cantidad a través del desarrollo hasta la etapa de alevinos comiendo (24), o tienden a permanecer en cantidades relativamente estables durante el mismo periodo (28). Los PUFA de contenido bajo (< 2,5%) fueron C18:3n-6, C18:3n-3, C20:2, C20:3n-6, C20:3n-3 y C22:5n-3. Niveles que se pueden considerar como medios (entre el 5 y el 10% del total) se registran para C16:1, C18:0, C18:2n-6 y C20:5n-3.
En el extremo superior, la mayor representación en contenido está en el palmítico (C16:0), el oleico (C18:1n-9) y el docosahexaenoico (DHA; C22:6n-3), en niveles que se confirman en valoraciones similares y que, por lo tanto, parecen caracterizar en tal sentido la composición de las ovas de trucha (constituyen un 60% del total de ácidos grasos). Según Tocher (9), los dos primeros son utilizados y consumidos como fuente energética en el proceso embrionario hasta el estadio de alevinos comiendo. Halüloúlu et ál. (24) coinciden en la interpretación aun cuando la variación que detectan particularmente para el C16, significativamente creciente a través del tiempo, no es consecuente con la afirmación; una tendencia similar, pero no significativa, registran Zengin y Akpinar (28). Por el contrario, conforme avanza el desarrollo embrionario la disminución en el contenido del ácido oleico es evidente, lo que confirma su importante consumo en estas etapas (24).
Con el 21,1% del total de ácidos grasos medidos, un 67% del total de los n-3 y el 47,3% de los PUFA, el DHA es el ácido graso más abundante en las ovas, lo que tiene total correspondencia con las mediciones de Leger et ál. (7), Wirth et ál. (16), Vasallo-Agius et ál. (29), Ballestrazzi et ál. (30) y AlSayed Mahmoud et ál. (31). Wiegand (6), quien reporta el mismo porcentaje en ovas de truchas, sostiene que la incorporación de ácidos grasos es selectiva y obedece a una estrategia adaptativa en la que la movilización hacia el huevo se traduce en perfiles que se ajustan dentro de rangos estrechos; esta condición conservativa en la incorporación de DHA en la ova es también corroborada por Ballestrazzi et ál. (30). La variabilidad que para el contenido de este ácido fue observada entre las hembras es baja (CV: 10,8%), lo que apoya la interpretación y puede indicar que en este caso en particular la formulación de la dieta utilizada para el plantel no limitó los requerimientos básicos del ácido en las ovas, traduciéndose en perfiles de composición relativamente uniformes. Así, no parece que, al menos con estos, se pueda explicar la alta variabilidad de los resultados de supervivencia que fueron registrados en incubación; es decir que, bajo el actual régimen de manejo nutricional, su utilidad como predictores individuales de calidad en la ova debe ser evaluada.
Se reconoce que la demanda particular de DHA y DPA es alta en el desarrollo temprano, especialmente por el papel que tienen en la formación de tejidos neurales de cerebro y retina (32). Como en el ambiente de aguas continentales hay una baja disponibilidad de estos ácidos en las presas naturales de las truchas, su contenido final debería ser asegurado por medio de la adición del precursor alfa-linolénico (ALA, 18:3n-3) que los genera a través del proceso desaturación-elongación, vía metabólica que ha sido confirmada en salmónidos (9, 32), lo que lo ubica como esencial para los procesos reproductivos en la especie (7). Siendo el aceite de pescado particularmente rico en DHA, se emplea como componente fundamental de los balanceados para peces y, en tales condiciones, Buzzi et ál. (33) y Sargent et ál. (12) anotan que la vía de transformación de EPA y DHA a partir del ALA parece ser que se limita. En este caso, el contenido de ALA fue del 0,8%, dentro del rango del 0,6% que registran Vasallo-Agius et ál. (29) y Ballestrazzi et ál. (30) y el 1,02% de Leger et ál. (7).
Dada su importancia, estos ácidos se determinan en la mayoría de las evaluaciones sobre composición o metabolismo en general (16, 26); la relación derivada DPA/DHA se convierte entonces en un factor de registro común y con utilidad comparativa entre diferentes trabajos. También tiende a ubicarse dentro de un rango relativamente estrecho, independiente de las condiciones experimentales y de determinación en laboratorio con, por ejemplo, valores de 0,16 en Yu et ál. (34), 0,29 en Halüloúlu et ál. (24), 0,32 en Ballestrazzi et ál. (30), 0,28 en Leger et ál. (7), 0,24 en Vasallo-Agius et ál. (29), 0,29 en Wirth et ál. (16) y 0,23 en Al-Sayed Mahmoud et ál. (31)1. En este caso, la relación fue similar con un valor promedio de 0,27 ± 0,038. Durante el desarrollo, para el DHA se detecta un incremento significativo en el contenido en las larvas poseclosión (24), mientras que el EPA permanece en cantidades estables durante el mismo periodo, lo que hace que la proporción EPA/DHA muestre una tendencia decreciente hasta la fase de alevinos en primera alimentación.
Considerados en combinación, la mayor representación la tiene la serie n-3 (superior al conjunto de los n-6), con una relación n-3/n-6 = 2,92 ± 0,44. En una generalización, Brooks et ál. (3) postulan que los huevos de peces que se pueden considerar de mayor calidad tienen altos contenidos de ácidos grasos de la serie n-3, lo que principalmente se define por los niveles de DHA y EPA.
Al igual de lo que sucede para los lípidos en peces en general, en los huevos en maduración se depositan elevadas cantidades de ácidos grasos poliinsaturados (PUFA); se ajusta al 44,39% del contenido total que se determinó para los PUFA, lo que es comparable con los resultados que registran para la especie Al-Sayed Mahmoud et ál. (31) con un 41,8% y Ballestrazzi et ál. (30) con un 47,36%. De las composiciones conjuntas entre los grupos de ácidos grasos el contenido de PUFA resultó ser el más estable entre las hembras trabajadas (CV: 5,53%). Los ácidos grasos saturados (SFA) y monoinsaturados (MUFA) son catabolizados para proveer energía en la síntesis de lipoproteínas en el huevo (8, 35), lo que Halüloúlu et ál. (24) demuestran a través del análisis de los cambios en los contenidos que se dan durante el desarrollo embrionario, en particular por la disminución progresiva y significativa en MUFA conforme se avanza en los diferentes estadios, desde el huevo recién fertilizado hasta la etapa de alevino.
Está definido que la formulación nutricional utilizada en reproductores tiene influencia en la composición final de los ácidos grasos en los huevos, por lo que dietas deficientes pueden generar variaciones sustanciales en la composición en ácidos específicos (27). Esta situación se hace evidente en condiciones experimentales en las que se promueven deficiencias de tipo extremo (26, 29, 30) dirigidas a identificar necesidades de ácidos grasos específicos. Aun así, Tocher (9) establece que la composición general, específicamente en los huevos, es más resistente a los cambios dietarios que aquella que se puede ocasionar sobre otro tipo de tejidos, en una regularidad de incorporación que particularmente sobre el DHA identifican Izquierdo (36) y Wiegand (6), explicándola como producto de una presión de selección y una selectividad en la retención durante la embriogénesis, de forma que se logra mantener dentro de rangos reducidos. La demostración de Watanabe et ál. (27) al respecto de la sensibilidad que sobre la fecundación y la eclosión generan aún pequeñas disminuciones del contenido de DHA en los huevos apoya la existencia de mecanismos de esta naturaleza. En tal sentido, es interesante anotar que Leger et ál. (7) encuentran que dietas deficientes en n-3 utilizadas en la alimentación de reproductores tienen una fuerte influencia sobre los contenidos de EPA en el huevo, pero se modera en la incorporación de DHA, demostrando, según Izquierdo et ál. (20), la importancia en el mantenimiento de niveles mínimos del ácido en el vitelo.
La evaluación comparativa entre los conjuntos de las series n-3 y n-6 no es procedente por las variables condiciones experimentales que la condicionan, especialmente por las características de método y los ácidos finalmente determinados. De forma general, se registran valores para los n-3 que van desde un 24,04% (24), hasta un 40,35% (30). La media registrada para este trabajo (32,03 ± 2,6%) cae dentro del rango. La situación es similar con la serie de n-6 determinados; la media definida de 11,12 ± 1,09% está también dentro del rango del 6,55% de Ballestrazzi et ál. (30) al 15% de Al-Sayed Mahmoud et ál. (31).
Conclusiones
El perfil promedio de ácidos grasos que fue determinado para el conjunto de puestas es equivalente en proporciones al que se referencia en valoraciones similares para la especie.
En términos de composición, los ácidos palmítico, oleico y docosahexaenoico conforman alrededor del 60% del contenido total determinado para las ovas y su estabilidad entre las hembras supone una incorporación selectiva. Así, parece que bajo esquemas de nutrición estandarizados (v. gr. que cumplan los mínimos exigidos por la especie), la estabilidad en las proporciones de elementos constitutivos puede obedecer a patrones de regulación de la hembra en maduración.
Este esquema de composición, y la baja variabilidad determinada entre las puestas sugieren que, al menos en los que son considerados como elementos mayores de contenido, su influencia como determinantes de calidad no es evidente y requiere de valoración posterior. Es posible que como factor determinante de calidad en lo que respecta a la composición de ácidos grasos, estos tengan mayor influencia en la primera fase del proceso de incubación (ova verde), en donde los indicadores parciales de eficiencia productiva presentan alta variabilidad.
Los ácidos grasos con menor representación en contenido tienden a presentar una mayor variabilidad entre las hembras. Lo contrario se observa en aquellos con mayor contenido. Bajo esta premisa, la relación calidad:contenido individual queda sujeta a comprobación experimental.
El ajuste de los perfiles obtenidos con valoraciones similares indica la pertinencia de los métodos de manejo de ovas y la precisión en la extracción de los ácidos grasos en laboratorio.
Agradecimientos
El soporte en laboratorio de la medición de ácidos grasos estuvo fundamentado en el apoyo de Ana Milena Cepeda, ingeniera química de la Universidad Nacional. En el trabajo de campo, la participación operativa de Amanda Reyes, auxiliar del laboratorio de Ictiología del Programa de Zootecnia de la Universidad Nacional, fue básica para la obtención y el manejo de las muestras.
1 Algunas de estas relaciones se calcularon a partir de los datos originales.
Referencias
1. Kjørsvik E, Mangor-Jensen A, Holmefjord T. Egg quality in fishes. En: Blaxter JHS, Sothward AJ, editores. Advances in Marine Biology. Academic Press 1990; 26:71-113. [ Links ]
2. Bromage NR, Jones J, Randall C, Thrush M, Davies B, Springate J et ál. Broodstock management, fecundity, egg quality and the timing of egg production in the rainbow trout (Oncorhynchus mykiss). Aquaculture 1992; 100:141-166. [ Links ]
3. Brooks S, Tyler C, Sumpter J. Egg quality in fish: what makes a good egg? Reviews in Fish Biology and Fisheries 1997; 7:387-416. [ Links ]
4. Tocher D, Bendiksen E, Campbell P, Bell JG. The role of phospholipids in nutrition and metabolism of teleost fish. Aquaculture 2008; 280:21-34. [ Links ]
5. Bromage NR. Broodstock management and seed quality - General considerations. En: Bromage NR, Roberts RJ, editors. Broodstock Management and Egg and Larval Quality. Blackwell: Oxford; 1995. p. 1-24. [ Links ]
6. Wiegand M. Composition, accumulation and utilization of yolk lipids in teleost fish. Reviews in Fish Biology and Fisheries 1996; 6:259-286. [ Links ]
7. Leger C, Fremont L, Marion D, Nassour I, Desfarges MF. Essential fatty acids in trout serum lipoproteins, vitellogenin and egg lipids. Lipids 1981; 16(8):593-600. [ Links ]
8. Patiño R, Sullivan CV. Ovarian follicle growth, maturation and ovulation in teleost fish. Fish Physiology and Biochemistry 2002; 26:57-70. [ Links ]
9. Tocher D. Metabolism and functions of lipids and fatty acids in teleost fish. Reviews in Fisheries Science 2003; 11(2):107-184. [ Links ]
10. Perazzolo LM, Coward K, Davail B, Normand E, Tyler CR, Pakdel F, Schneider W, Le Menn, F. Expression and localization of messenger ribonucleic acid for the vitellogenin receptor in ovarian follicles throughout oogenesis in the rainbow trout, Oncorhynchus mykiss. Biology of Reproduction 1999; 60:1057-1068. [ Links ]
11. Rainuzzo J, Reitan K, Olsen Y. The significance of lipids at early stages of marine fish: a review. Aquaculture 1997; 155:103-115. [ Links ]
12. Sargent JR, Henderson RJ, Tother DR. The lipids. En: Halver LE, editor. Fish Nutrition. Academic Press; 1989. [ Links ]
13. Tyler CR, Sumpter JP, Witthames PR. The dynamics of oocyte growth during vitellogenesis in the rainbow trout (Oncorhynchus mykiss). Biology of Reproduction 1990; 43:202-209. [ Links ]
14. Tocher DREA, Bendiksen J, Campbell JG. The role of phospholipids in nutrition and metabolism of teleost fish. Aquaculture 2008; 280:21-34. [ Links ]
15. Sargent J, Bell G, McEvoy L, Tocher D, Estevez, A. Recent developments in the essential fatty acid nutrition of fish. Aquaculture 1999; 177:191-199. [ Links ]
16. Wirth M, Steffens W, Meinelt T, Steinberg C. Significance of docosahexaenoic acid for rainbow trout (Oncorhynchus mykiss) larvae. Fett/Lipid 1997; 99(7):251-253. [ Links ]
17. Kamler E. Parent-egg-progeny relationships in teleost fishes: an energetics perspective. Reviews in Fish Biology and Fisheries 2005; 15:399-421. [ Links ]
18. Bromage NR, Cumaranatunga R. Egg production in the rainbow trout. En: Muir JF, Roberts R, editores. Recent Advances in Aquaculture. London: Croom Helm; 1988. [ Links ]
19. Sargent JR. Origins and functions of egg lipids: Nutritional implications. En: Bromage NR, Roberts RJ, editores. Broodstock Management and Egg and Larval Quality. Blackwell: Oxford; 1995. [ Links ]
20. Izquierdo M, Fernández-Palacios H, Tacon AGJ. Effect of broodstock nutrition on reproductive performance of fish. Aquaculture 2001; 197:25-42. [ Links ]
21. Folch J, Lees M, Stanley GHS. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry 1957; 226:497-509. [ Links ]
22. Betancourt L, Díaz GJ, Aguilar X, Ríos J. (2005). Effect of ensiled trout (Oncorhynchus mykiss) intestines on productive traits of broiler chickens and the content of omega-3 fatty acids in liver, thighs and breast. Livestock Research for Rural Development 2005; 17 (9), Article 106 http://www.cipav.org.co/lrrd/lrrd17/9/beta17106.htm. [ Links ]
23. Gordon M, Klotins KC, Campbell VM, Cooper M. Farmed Salmon Broodstock Management. Vancouver B C: Canadá; 1988. [ Links ]
24. Halüloúlu H, Aras N, Yanik T, Atamanalp M, Kocaman E. Investigation of changes in fatty acid composition at early development stages of rainbow trout (Oncorhynchus mykiss). Turk J Vet AnimSci 2003; 27:1105-1109. [ Links ]
25. Estay F, Cerisola H, Tellez V. Biología del desarrollo y reproducción artificial en la trucha arco iris. Chile: Conicyt-Fondef; 1994. [ Links ]
26. Leray C, Nonnotte G, Roubaud P, Léger C. Incidence of (n-3) essential fatty acid deficiency on trout reproductive processes. Reprod Nutr Dev 1985; 25(3):567-581. [ Links ]
27. Watanabe T, Takeuchi T, Saito M, Nishimura K. Effect of low protein-high calorie or essential fatty acid deficiency diet on reproduction of rainbow trout. Bulletin of the Japanese Society of Scientific Fisheries 1984; 50(7):1207-1215. [ Links ]
28. Zengin H, Akpinar MA. Fatty acid composition of Oncorhynchus mykiss during embryogenesis and other developmental stages. Biología Bratislava 2006; 61(3): 305-311. [ Links ]
29. Vasallo-Agius R, Watanabe T, Yoshizaki G, Satoh S, Takeuchi, Y. Quality of eggs and spermatozoa of rainbow trout fed an n-3 essential fatty aciddeficient diet and its effects on the lipid and fatty acid components of eggs, semen and livers. Fisheries Science 2001; 67:818-827. [ Links ]
30. Ballestrazzi R, Rainis S, Tulli F, Bracelli A. The effect of dietary coconut oil on reproductive traits and egg fatty acid composition in rainbow trout (Oncorhynchus mykiss). Aquaculture International 2003; 11:289-299. [ Links ]
31. Al-Sayed Mahmoud K, Linder M, Fanni J, Parmentier M. Characterisation of the lipid fractions obtained by proteolytic and chemical extractions from rainbow trout (Oncorhynchus mykiss) roe. Process Biochemistry 2008; 43:376-383. [ Links ]
32. Bell MV, Dick JR, Porter AEA. Biosynthesis and tissue deposition of docosahexaenoic acid (22:6n-3) in rainbow trout (Oncorhynchus mykiss). Lipids 2001; 36(10):1153-1159. [ Links ]
33. Buzzi M, Henderson RJ, Sargent JR. The desaturation and elongation of linolenic acid and eicosapentaenoic acid by hepatocytes and liver microsomes from rainbow trout (Oncorhynchus mykiss) fed diets containing fish oil or olive oil. Biochimica et Biophysica Acta 1996; 1299:235-244. [ Links ]
34. Yu TC, Sinnhuber RO, HendricksJD. Reproduction and survival of rainbow trout (Salmo gairdneri) fed linolenic acid as the only source of essential fatty acids. Lipids 1979; 14:572-575. [ Links ]
35. Kamler E. Resource allocation in yolk-feeding fish. Rev Fish Biol Fisheries 2008; 18:143-200. [ Links ]
36. Izquierdo M. Essential fatty acid requirements of cultured marine fish larvae. Aquacult Nutr 1996; 2:183-191. [ Links ]