Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.36 no.1 Santa Marta Jan./Dec. 2007
BRIOZOOS CHEILOSTOMADOS DEL CARIBE COLOMBIANO
COLOMBIAN CARIBBEAN CHEILOSTOME BRYOZOANS
Paola Flórez-Romero, Erika Montoya-Cadavid, Javier Reyes-Forero y Nadiezhda Santodomingo
Instituto de Investigaciones Marinas y Costeras (InveMar), Cerro Punta Betín, a.a. 1016, Santa Marta, Colombia. E-mail: paola.florez@invemar.org.co (PFR); erika_montoya@invemar.org.co (EMC); j_reyes_ forero@hotmail.com (JRF); nadiasantodomingo@hotmail.com (NS)
RESUMEN
El orden Cheilostomatida es el grupo de briozoos marinos vivientes más diverso de la actualidad, siendo común encontrar sus especies en todos los ecosistemas marinos del mundo. Sin embargo, la información del grupo en Colombia es escasa y se restringe a pocas localidades. Con la iniciativa de explorar la biodiversidad de los fondos blandos y complementar los inventarios de fauna marina en Colombia, se llevó a cabo la campaña INVEMAR-Macrofauna II, realizada en marzo de 2001, en la cual se recolectaron muestras a lo largo del Caribe colombiano sobre la plataforma continental y el talud superior entre 20 y 500 m de profundidad. Durante la expedición se encontraron 62 especies de cheilostomados pertenecientes a 39 familias, de las cuales 36 fueron primeros registros para el Caribe colombiano, cuatro para el Gran Caribe y una para el Atlántico Occidental Tropical, además se amplió la distribución batimétrica y geográfica de 13 especies. En esta revisión se consignan las fichas taxonómicas e imágenes de las cinco especies que constituyen primeros registros para el Gran Caribe y el Atlántico Occidental Tropical. Así mismo, se realizan anotaciones generales sobre la distribución, sustratos y tipos de crecimiento de los cheilostomados.
PALABRAS CLAVE: Biodiversidad, Bryozoa, Cheilostomata, Caribe colombiano, Plataforma continental, Talud superior.
ABSTRACT
The Cheilostomes are the most diverse existent bryozoans group. Its species are commonly found in all the marine ecosystems around the world. In Colombia, however, information about them is scarce and limited to few localities. With the initiative of exploring the soft bottom biodiversity and completing the Colombian marine fauna inventories, INVEMAR-Macrofauna II exploration took place in March 2001, during which samples were collected on soft bottoms throughout the Colombian Caribbean from the continental shelf and the upper slope (20 - 500 m depth) by trawling. 62 species of Cheilostomes that belong to 39 families were found, 36 are first records for the Colombian Caribbean, 4 for the Great Caribbean and 1 for the Tropical West Atlantic. Bathymetric and geographic ranges are extended for 13 species. Taxonomical notes and images of the five species that are first records for the Greater Caribbean and the Tropical West Atlantic are included in this survey. It also includes remarks about the distribution, substrata, and growth types of Cheilostomata studied.
KEY WORDS: Biodiversity, Bryozoans, Cheilostomata, Colombian Caribbean, Continental shelf, Upper slope.
INTRODUCCIÓN
Los briozoos son uno de los grupos epibiontes más importantes en los ambientes marinos, su éxito como colonizadores, sus adaptaciones morfológicas y elevada tolerancia los ha llevado a habitar diferentes tipos de sustratos y ecosistemas, siendo el orden Cheilostomatida el más variado actualmente. Durante la expedición “Siboga” (1899-1900) se logró establecer que, al igual que en las áreas templadas, los briozoos representan un componente importante de la biodiversidad y abundancia de la biota marina tropical (Harmer, 1915). Posteriormente, en el Caribe se desarrollaron algunos trabajos con enfoque taxonómico por Osburn (1927, 1940, 1947) y Powell (1971), los cuales contribuyeron al inventario publicado por Schopf (1973), donde se estimó un total de 273 especies de cheilostomados vivientes en el Atlántico Occidental Tropical. Conocimiento que ha incrementado con los estudios de Cuffey y Fonda (1977), Banta y Carson (1977), Winston (1984, 2004), Fransen (1986), Cheetham et al. (1998) y Jackson y Herrera-Cubilla (2000), entre otros, pero a la fecha no se cuenta con una recopilación unificada donde se estime el número total de especies y su distribución.
En el Caribe colombiano el trabajo taxonómico más representativo ha sido el de Osburn (1947), quien registró en total 44 especies de cheilostomados colectados en tres estaciones frente al departamento de La Guajira durante la expedición Allan Hancock en 1939. Posteriormente Reyes y Campos (1992) registraron seis especies más en un estudio de fauna acompañante en raíces de manglar en la Ciénaga Grande de Santa Marta y las bahías de Neguanje y Chengue. Otros estudios como los de Ortiz (1987) y Rozemeijer y Dulfer (1987) fueron realizados con un enfoque ecológico, de modo que los ejemplares fueron identificados a nivel de género o morfoespecie. De otra parte, cabe destacar el trabajo realizado por Pérez (1991) en el área de Santa Marta y La Guajira, el cual, a pesar de aún no estar publicado, fue referencia para la identificación de algunos especimenes listados en esta investigación. (León Pérez. Universidad del Magdalena, Santa Marta-Colombia, 2003. Com. Pers.).
La información presentada en este estudio complementa de manera significativa el conocimiento que se tiene de los briozoos en el Caribe Sur y particularmente en el Caribe colombiano. De esta manera, se contribuye con el listado de 62 especies del orden Cheilostomata, el cual, además de ser el más diverso, estuvo presente en 48 de los 83 arrastres efectuados durante la expedición INVEMAR-MACROFAUNA II. Se destaca que 36 especies fueron primeros registros para el Caribe colombiano, cuatro para el Caribe, una para el Atlántico Occidental Tropical, así como la ampliación de la distribución batimétrica y geográfica para 13 especies. Adicionalmente, se hace un análisis preliminar acerca de la distribución de los cheilostomados en el Caribe colombiano y las diferentes asociaciones con otros grupos de organismos como cnidarios, algas y esponjas.
ÁREA DE ESTUDIO
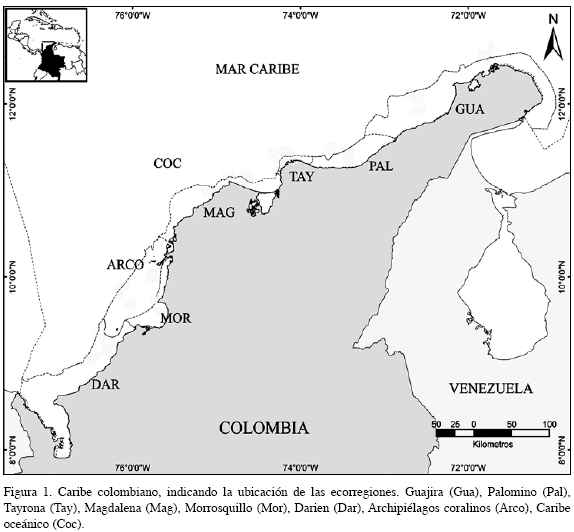
En este estudio se identificaron los briozoos presentes en ocho de las nueve ecorregiones establecidas en el Caribe colombiano: Guajira, Palomino, Tayrona, Magdalena, Darién, Morrosquillo, Archipiélagos Coralinos y Caribe Oceánico (Figura 1). Estas ecorregiones se extienden desde la línea de costa hasta la isóbata de 200 m, a excepción de Morrosquillo que va hasta 40 m, y de Caribe Oceánico que se extiende mar afuera, frente a todas las ecorregiones hasta el límite jurisdiccional (INVEMAR, 2000).
Dichas regiones fueron definidas según la geomorfología, ecología y paisaje de la costa. En el extremo norte se localizan Guajira y Palomino, caracterizadas por tener una plataforma continental amplia, masas de agua con alta energía y un fenómeno estacional de surgencia, que determina una elevada productividad biológica (Andrade y Barton, 2005); en seguida se encuentra Tayrona, formada por estribaciones de la Sierra Nevada de Santa Marta, la cual se caracteriza por la existencia de numerosas bahías y una plataforma continental estrecha con un descenso pronunciado del talud; posteriormente Magdalena, Morrosquillo y Darién se ven fuertemente influenciadas por las descargas continentales de ciénagas y ríos; ubicada frente a Morrosquillo se encuentra Archipiélagos Coralinos, determinada por abundantes formaciones arrecifales (Díaz et al., 2000); y Caribe Oceánico caracterizada por la transparencia de sus aguas, libres de descargas continentales.
La expedición recorrió cada una de las ecorregiones y en Caribe oceánico se desplazó hasta la isóbata de 500 m. Abarcando en general el área comprendida entre las coordenadas con límite norte 12o34’36,999” N, sur 9o0’78,760” N, oriente 72o18’19,000” W y occidente 77o53’26,999” W.
MATERIALES Y MÉTODOS
La campaña Macrofauna II fue realizada a bordo del buque de investigaciones B/I ANCÓN. Las muestras obtenidas fueron recolectadas mediante arrastres de fondos blandos a 20, 70 y 150 m en todas las ecorregiones costeras (excepto Morrosquillo), y a 300, 400 y 500 m de profundidad en Caribe Oceánico. Para la recolecta de muestras se empleó una red demersal de tipo semi-balón (9 m de ancho x 1 m de alto x 16 m de largo), arrastrando a una velocidad de crucero de tres nudos durante 10 minutos. En total se realizaron 83 arrastres, los cuales se distribuyeron en: 12 en cada una de las ecorregiones Guajira, Palomino y Tayrona, 16 en Magdalena, 11 en Arrecifes Coralinos y Darién, cuatro en Morrosquillo y cinco en Caribe Oceánico.
En la cubierta del buque el material fue lavado con abundante agua, seleccionado y preservado en etanol al 70%. En el laboratorio fue separado por morfotipos y limpiado cuidadosamente, en algunos casos fue necesario el empleo de hipoclorito de sodio al 5% y agua para eliminar los residuos de tejido y sedimento. En el proceso de identificación se tomaron medidas de los principales caracteres morfológicos y se emplearon las descripciones realizadas por Osburn (1927, 1940, 1947), Banta y Carson (1977), Winston (1982, 1986), Fransen (1986) y Cheetham et al. (1998), entre otros. El trabajo de ilustración se realizó con una cámara fotográfica digital Nikon D1 adaptada a un estereoscopio y los esquemas con base en la observación directa de los individuos. El material fue almacenado en el Museo de Historia Natural Marino de Colombia (MHNMC) del Instituto de Investigaciones Marinas y Costeras (INVEMAR), de igual manera la información referente a la especie y al material examinado, como sinonimias, diagnosis, descripción, distribución, notas del estado y captura, hace parte del Sistema de Información sobre Biodiversidad Marina (SIBM).
RESULTADOS Y DISCUSIÓN
Nuevos registros
Uno de los resultados más representativos es el hallazgo de 41 primeros registros en el Caribe colombiano, incrementando el conocimiento del orden Cheilostomatida en un 68% para el área. Entre los primeros registros sobresalen las especies Copidozoum tenuirostre, Eutaleia evelinae, Rogicka biserialis, y Microporella protea, las cuales se registran por primera vez en el Gran Caribe, así como Lagenicella cf. spinulosa para el Atlántico Occidental Tropical. A continuación se presenta un listado de las especies y familias de los cheilostomados encontrados en este estudio, siguiendo la clasificación sistemática de Winston (2005) y Bock (2007) se indican los primeros registros, las especies que ampliaron sus distribuciones batimétricas y geográficas, la ecorregión, profundidad y el sustrato donde fueron observados (Tabla 1).
Composición
Las 62 especies identificadas se encuentran agrupadas en 39 familias y 51 géneros, evidenciando la alta diversidad en estos niveles. Las familias mejor representadas fueron Phidoloporidae con cuatro especies y Membraniporidae, Smittinidae y Stomachetocellidae con tres cada una. El orden Cheilostomatida es el más diverso en la actualidad (Best y Winston, 1984) en comparación con Cyclostomatida, el cual tuvo un punto cumbre durante el Cretácico (Ryland, 1970). Diversos autores (Cheetham, 1971; Schopf, 1977; Best y Winston, 1984; Hughes y Jackson, 1990) han intentado dar explicación a la diversificación de los cheilostomados, sugiriendo que las diferentes estrategias han sido desarrolladas en pro de brindar mayor protección y soporte a las partes blandas del organismo, este cambio evolutivo implicó el desarrollo de una pared frontal calcificada, con diferentes tipos de perforación, que le permiten mantener el mecanismo hidrostático, responsable de la eversión del lofóforo para la función alimentaria (Cheetham, 1971). De igual modo se ha observado una tendencia evolutiva en el desarrollo de estructuras extrazoeciales, como la formación de espinas, umbos y tubérculos, favoreciendo el aumento de la calcificación y reduciendo el área membranosa expuesta (Hayward y Ryland, 1999). Dichos factores son respuesta a eventos ambientales como corrientes y sedimento, aunque de igual forma pueden estar cumpliendo un rol de defensa ante depredadores como picnogónidos, nudibranquios y erizos, entre otros (Harvell, 1992). Hechos que han favorecido la exitosa colonización de estos organismos en distintos ambientes.
Distribución
Los cheilostomados predominaron en las ecorregiones Guajira (37 especies), Palomino y Magdalena (25 especies, cada una) y Tayrona (19 especies), localizando a la mayoría del grupo en las regiones media y norte del Caribe colombiano, y mostrando una disminución del número de familias y especies en sentido norte-sur. Las ecorregiones mencionadas se caracterizan por presentar fondos heterogéneos constituidos por lodos, arenas, rocas y sedimentos calcáreos, los cuales dan lugar a una amplia variedad de sustratos de tipo orgánico e inorgánico, fundamentales para el asentamiento y crecimiento de las colonias de organismos sésiles. El hecho de que la ecorregión Guajira haya concentrado un mayor número de especies se relaciona estrechamente con la disponibilidad de sustratos duros, susceptibles de ser extraídos durante el muestreo. Las estaciones ubicadas a 70 m en Guajira se caracterizaron por la presencia de un bajo coralino hallado a esa profundidad, en el cual los corales azooxantelados Madracis myriaster y Cladocora debilis fueron los principales componentes (Reyes et al., 2005), acompañados por esponjas y antipatarios, los cuales proveen cavidades y superficies aprovechables para el asentamiento larval.
Cabe mencionar que especies de vida libre como Discoporella depressa y Cupuladria surinamensis fueron frecuentes y abundantes a lo largo de las diferentes estaciones. Se hallaron un total de 567 colonias de D. depressa y 657 de C. surinamensis, cuantificación realizada gracias a la morfología de las colonias. Estas especies se han adaptado a condiciones de alta sedimentación imperantes en fondos blandos sometidos a fuertes corrientes, las cuales pueden ser hostiles para otros briozoos.
Sustratos
Los sustratos más frecuentes fueron los corales, seguidos por algas y plástico. Dentro de la primera categoría el más común fue el coral azooxantelado Cladocora debilis (19 especies), seguido por los scleractinios (siete especies) y octocorales (seis especies); dichos organismos, básicamente por sus características físicas, proveen espacios susceptibles para el asentamiento y desarrollo de las larvas de briozoos. En el caso de las algas (11 especies), las phaeophytas fueron un sustrato común, hecho típico en los ambientes costeros, ya que estas gracias a la morfología, química y textura superficial, toleran la colonización de dichos organismos (Winston y Eiseman, 1980). Por otro lado, algunas especies de briozoos se caracterizan porque sus larvas presentan gran afinidad a sustratos como el plástico (siete especies), siendo las superficies de tipo artificial una buena opción para especies con elevados niveles de tolerancia a la temperatura, la salinidad, la turbidez y la polución (Brock, 1985; Gordon y Mawatari, 1992). Considerando que en Colombia el plástico constituye el 60% de los residuos flotantes no biodegradables más comunes (Garay, 1992), resulta ser un medio de dispersión habitual, e incluso podría llegar a ser un medio de transporte para especies introducidas.
Tipos de crecimiento
Un factor más que refleja la alta adaptación que han tenido los cheilostomados para colonizar diversos hábitat son los tipos de crecimiento que han incorporado. Para efectos de este estudio se clasificaron cinco tipos: colonias laminares, de vida libre, erectas rígidas, erectas articuladas y con estolón. Se observó que el tipo de crecimiento predominante fue el laminar, común en las especies colonizadoras de corales (sustrato elegido por la mayoría de especies de cheilostomados en este estudio), siguiendo el patrón encontrado en diversos estudios del Caribe, en donde las especies asociadas a arrecifes coralinos, son generalmente laminares bidimensionales, fuertemente cementadas al sustrato (Winston, 1986). En la categoría de colonias de vida libre se observaron tres especies: C. surinamensis, D. depressa y Mamillopora cupula, típicas de áreas con alta sedimentación y corrientes fuertes. Por otro lado, casos como el de Biflustra savartii, que tiene crecimiento laminar y erecto, así como los de Celleporaria sherryae, Celleporaria tubulosa y Poricella mucronata que tuvieron crecimiento bilaminar y erecto, podrían ser modificaciones que se expresan como respuesta fenotípica colonial al ambiente. Algunos autores opinan que ciertas especies pueden cambiar su tipo de crecimiento de incrustante a erecto, tubular o bilaminar, tolerando factores adversos inherentes a los ambientes y sustratos que habitan (Cook, 1968; Ryland, 1970; McKinney y Jackson, 1989). No obstante, se deben desarrollar rigurosos estudios morfométricos entre los distintos morfotipos para descartar la existencia de nuevas morfoespecies. Las colonias erectas articuladas como Nellia tenella y Canda simplex se encontraron ampliamente distribuidas en el Caribe colombiano, resistiendo en ambientes litorales y profundos donde la acción del oleaje y las corrientes es fuerte, todo gracias a la flexibilidad de sus colonias. Finalmente, especies con estolón como Aetea anguina y Aetea ligulata fueron características de colonizar sobre algas phaeophytas y plástico, sustratos que se encuentran sometidos a movimientos constantes.
Fichas taxonómicas
A continuación se presentan las fichas taxonómicas de las especies Copidozoum tenuirostre, Eutaleia evelinae, Microporella protea y Rogicka biserialis, nuevos registros para el Gran Caribe y Lagenicella cf. spinulosa, primer registro para el Atlántico Occidental Tropical.
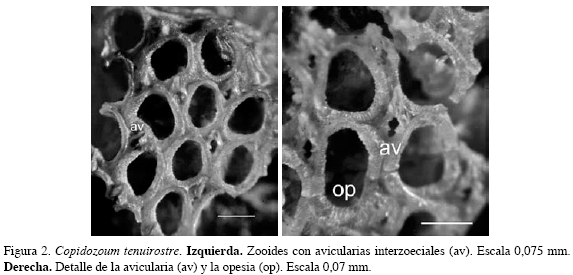
Copidozoum tenuirostre (Hincks, 1880)
(Figura 2)
Membranipora tenuirostris Hincks, 1880: 70.
Membranipora tenuirostris: Waters, 1918: 9.
Callopora tenuirostris: Canu y Bassler, 1920: 114; 1928: 31.
Copidozoum tenuirostre: Marcus, 1937: 48.
Material examinado: INVBRY69, 1 colonia, estación 41; INVBRY130 1 colonia, estación 41.
Descripción: Colonia incrustante, unilaminar, multiseriada. Zooides ovales separados entre sí por surcos profundos. Opesia amplia, que constituye la mayor parte de la superficie frontal. Criptocisto reducido y granular, rodeado por un anillo marginal grueso y prominente. Avicularias interzoeciales de forma triangular, rectos, delgados y con un rostro largo, ubicados a la altura media de la cámara adyacente y con la mandíbula dirigida distalmente. Carece de espinas y ovicelas. Los caracteres morfológicos descritos fueron complementados con sus medidas (Tabla 2).
Distribución: Atlántico occidental tropical: Florida y Golfo de México, entre los 40 y 93 m de profundidad (Canu y Bassler, 1928). En Colombia se encontró en la ecorregión Guajira a 73 m.
Comentarios: Primer registro para el Gran Caribe. Se observaron dos colonias en buenas condiciones, estas se encuentran compartiendo sustrato con los briozoos M. protea, Escharina pesanseris, Gemelliporidra typica, Crisia denticulata, Watersipora subtorquata, A. ligulata y Schedocleidochasma contractum sobre una esponja.
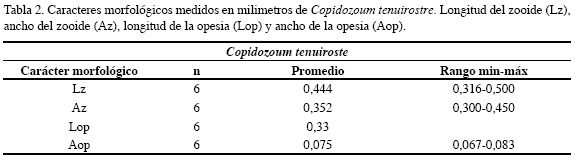
Eutaleia evelinae Marcus, 1938
(Figura 3)
Eutaleia evelinae Marcus, 1938: 33.
Eutaleia evelinae: Cook, 1968: 178;
Lagaaij 1973: 145.
Material examinado: INVBRY22, 3 fragmentos, estación 64; INVBRY25, 3 colonias; estación 64; INVBRY37, 5 colonias, estación 64; INVBRY127, varios fragmentos, estación 64; INVBRY342, 3 colonias, estación 64; INVBRY347, varias colonias, estación 64; INVBRY356, varias colonias, estación 64; INVBRY513, varias colonias, estación 64; INVBRY521, 1 colonia, estación 64; INVBRY530, 4 colonias, estación 64; INVBRY555, 4 colonias, estación 64; INVBRY572, 3 colonias, estación 64.
Descripción: Colonia incrustante, unilaminar, uniseriada, ramificada, altamente calcificada y de color blanco a amarillo claro. Zooides con forma de gota, convexos, mucho más abultados en la porción distal. Pared frontal lisa, finamente perforada. Abertura en forma de campana, con dos pequeños umbos ubicados a cada lado y otro en la porción proximal. No presenta avicularias ni ovicelas. Los caracteres morfológicos descritos fueron complementados con sus medidas (Tabla 3).
Distribución: Atlántico occidental: Brasil (Marcus, 1938) y África occidental (Cook, 1968). En Colombia en la ecorregión Magdalena a 20 m de profundidad.
Comentarios: Colonias en buen estado, colonizando siempre sobre algas.
Schizoporella biserialis Hincks, 1885: 250.
?Dakaria biserialis: Osburn 1952: 329.
Arthropoma biseriale: Powell 1967: 259.
Rogicka biserialis: Uttley y Bullivant, 1972: 38
Material examinado: INVBRY322, 1 fragmento, estación 45; INVBRY367, 1 colonia, estación 49; INVBRY390, 1 colonia, estación 45; INVBRY391, 1 colonia, estación 45; INVBRY393, 1 fragmento, estación 46; INVBRY394, 1 colonia, estación 48; INVBRY519, 1 colonia, estación 55.
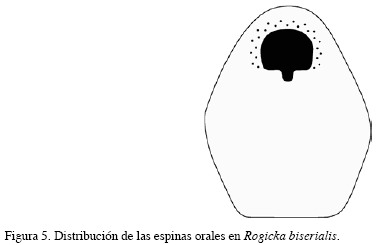
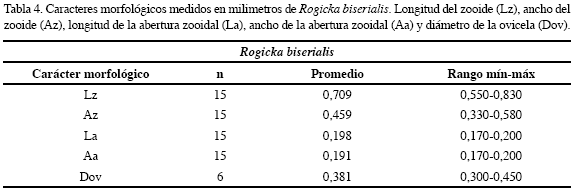
Descripción: Colonia incrustante, unilaminar, multiseriada, bien calcificada, de color amarillo claro a crema. Zooides pentagonales, claramente delimitados, dispuestos en series alternas. Pared frontal convexa, granular y homogéneamente perforada. Abertura semicircular con el margen proximal recto y sinus amplio en forma de “U”. Dos hileras de espinas rectas altamente calcificadas y alternas; hilera interna con 13 espinas, hilera externa con 11 espinas, a veces 12. Esporádicamente se presentan avicularias adventicias ubicadas cerca del ángulo que limita con las otras cámaras. Los caracteres morfológicos descritos fueron complementados con sus medidas (Tabla 4).
Distribución: Pacífico y Atlántico sur (Hincks, 1885). En el Caribe colombiano se encontró en las ecorregiones Guajira, Palomino y Tayrona entre 20 y 70 m de profundidad.
Comentarios: La especie es un nuevo registro para el Gran Caribe. El material se encuentra compuesto por varias colonias, en regular estado debido a la pérdida de espinas y fragmentación de las cámaras; algunas se encontraban colonizando sobre el coral C. debilis.
Lagenicella cf. spinulosa (Hincks, 1884)
(Figura 6)
Lagenipora spinulosa Hincks, 1884: 57.
Lagenipora spinulosa: Osburn, 1952: 487; Hastings, 1930: 730, Soule et al. 1995: 264.
?Lagenipora spinulosa: Robertson, 1908: 283; Canu y Bassler, 1923: 171; Soule, 1961: 50.
Material examinado: INVBRY29, 1 colonia, estación 64; INVBRY35, varias colonias, estación 64; INVBRY40, varios fragmentos, estación 64; INVBRY44, 2 colonias, estación 64; INVBRY49, varios fragmentos, estación 64; INVBRY58, varias colonias, estación 64; INVBRY62, 2 colonias, estación 64; INVBRY120, varios fragmentos, estación 64; INVBRY281, 1 colonia, estación 64; INVBRY303, 1 colonia, estación 64; INVBRY334, 1 colonia, estación 64; INVBRY336, varios fragmentos, estación 64; INVBRY344, varias colonias, estación 64; INVBRY350, 1 colonia, estación 64; INVBRY357, varios fragmentos, estación 64; INVBRY360, 2 colonias, estación 64; INVBRY439, 1 colonia, estación 64; INVBRY522, varios fragmentos, estación 64; INVBRY537, 2 fragmentos, estación 41; INVBRY543, 1 colonia, estación 64; INVBRY554, varios fragmentos, estación 64; INVBRY573, varios fragmentos, estación 64; INVBRY581, varios fragmentos, estación 64; INVBRY589, varios fragmentos, estación 64.
Descripción: Colonias incrustantes, multiseriadas, bien calcificadas, frágiles y translúcidas, que forman parches pequeños sobre los sustratos. Zooides con forma de botella ligeramente inclinados, globosos proximalmente, cuello largo, grueso y con numerosas proyecciones espinosas, parte distal amplia y aserrada. Abertura más o menos circular, rodeada por un peristomio delgado, sobre cuyos bordes laterales hay un par de avicularias pequeñas y ligeramente ovales. Ovicelas globosas ubicadas en la parte dorso distal del peristomio, con un área frontal perforada en forma de media luna. Los caracteres morfológicos descritos fueron complementados sus medidas (Tabla 5).
Distribución: Registrada para el Pacífico Oriental: Alaska y California (Soule et al., 1995). En el Caribe colombiano se encontró en las ecorregiones Magdalena y Guajira alrededor de los 70 m de profundidad.
Comentarios: Lagenicella cf. spinulosa es un nuevo registro para el Atlántico Occidental Tropical. A pesar de que el material colombiano porta espinas en su peristosmio, carácter determinante de la especie, es necesario cotejar el material con los especímenes del Pacifico y obtener imágenes de microscopía electrónica que ratifiquen su identidad, ya que al no confirmarla como L. spinulosa, podría tratarse de una nueva especie. Durante el proceso de identificación se descartó que se tratara de Lagenipora verrucosa (Canu y Bassler, 1928), especie previamente registrada por Osburn (1947) para el Cabo de la Vela; ya que a pesar de compartir rasgos como la forma de botella, sus zooides son más robustos y su disposición es uniserial. Es importante aclarar que la descripción de la especie L. spinulosa fue basada en especimenes del Pacifico norte (Columbia Británica y California), áreas típicamente de baja temperatura, por lo que resulta extraño que dicha especie se encuentre en el Caribe colombiano, sin embargo, el sector donde fueron recolectadas las muestras (Caribe norte), se caracteriza por presentar un afloramiento estacional, el cual enriquece la columna de agua y disminuye considerablemente la temperatura, incluso algunos autores han sugerido que es una zona atípica del Caribe y asemeja una localidad subtropical (Bula-Meyer, 1990). El material examinado está compuesto por varias colonias pequeñas, la mayoría en buen estado pero muy vulnerables a la manipulación. Se observó colonizando sobre algas y desechos plásticos, así como compartiendo el sustrato con los briozoos A. anguina, C. denticulata, Electra bellula y Pasythea tulipifera.
Microporella protea Winston, 2005
(Figura 7)
Microporella protea: Winston, 2005: 78.
Porellina ciliata Smitt, 1873: 26 en parte.
No Eschara ciliata Pallas, 1766: 38.
?Microporella ciliata personata Osburn, 1947: 36.
No Microporella personata Busk, 1854: 74.
Microporella ciliata Long y Rucker, 1970: 20.
Material examinado: INVBRY66, 1 colonia, estación 41; INVBRY132, 1 colonia, estación 41; INVBRY179, 1 fragmento, estación 45; INVBRY248, 1 colonia, estación 45; INVBRY284, 1 colonia, estación 48; INVBRY318, 1 colonia, estación 45; INVBRY366, 1 colonia, estación 49; INVBRY407, 2 colonias, estación 41; INVBRY408, 1 colonia, estación 45; INVBRY410, 1 colonia, estación 45; INVBRY411, 1 colonia, estación 46; INVBRY412, 1 colonia, estación 46; INVBRY414, 1 colonia, estación 46; INVBRY417, 1 colonia, estación 48; INVBRY418, varias colonias, estación 49; INVBRY443, 1 colonia, estación 41; INVBRY452, 1 colonia, varios fragmentos, estación 43; INVBRY496, 1 colonia, estación 41; INVBRY564, 1 colonia, estación 41; INVBRY598, 1 colonia, estación 41; INVBRY601, 1 colonia, estación 45.
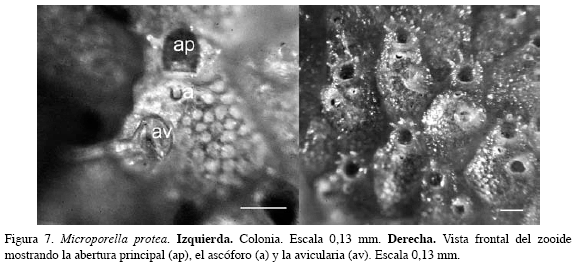
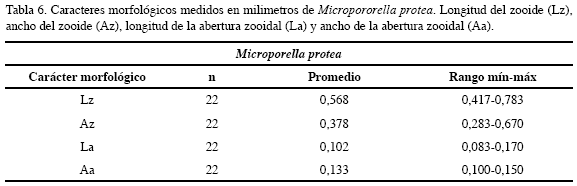
Descripción: Colonias incrustantes, unilaminares, altamente calcificadas de aspecto vítreo. Zooides convexos de forma ovalada o hexagonal, delimitados por surcos. Pared frontal más o menos rugosa, con perforaciones. Abertura principal semicircular, con la porción proximal recta y dentada, sin cóndilos, portando cuatro espinas delgadas sobre el margen distal. Ascóforo con forma de media luna justo debajo de la abertura principal. Avicularia frontal dirigida distolatermalmente, ubicada cerca del margen del zooide, mandíbula quitinosa, larga y triangular, orientada lateralmente. Ovicelas ausentes en las colonias observadas. Los caracteres morfológicos descritos fueron complementados con sus medidas (Tabla 6).
Distribución: Atlántico occidental: Cabo Hatteras a Florida (Winston, 2005). Colombia, en las ecorregiones Guajira y Palomino entre 20 y 70 m de profundidad.
Comentarios: La especie es un nuevo registro para el Gran Caribe. Los especimenes colectados no son Microporella ciliata personata (Busk, 1854), variedad previamente registrada para Colombia por Osburn (1947) en el Cabo de la Vela a 20 m de profundidad. Dicha variedad presenta un peristomio elevado hacia la región proximal entre la abertura y el ascóforo, hecho que no fue observado en el material analizado. Microporella protea había sido denominada erróneamente para el Caribe por diversos autores como M. ciliata; Winston (2005) esclarece las diferencias entre M. ciliata y M. protea, basada en el número de espinas, forma del orificio, morfología del ascóforo y la presencia de cóndilos en M. ciliata, la cual es originalmente británica. Sin embargo, aunque los caracteres coinciden con lo descrito por Winston (2005), podrían encontrarse diferencias al obtener imágenes de mayor resolución. El material examinado se compone de varias colonias en buen estado colonizando al coral Cladocora debilis, así como a un escleractinio, un octocoral y a madera, observando que ocasionalmente compartía el sustrato con el briozoo S. contractum.
AGRADECIMIENTOS
Los autores agradecen al Instituto de Investigaciones Marinas y Costeras INVEMAR por el respaldo financiero y logístico; al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS) por la cofinanciación del proyecto Caracterización de la Macrofauna del Caribe colombiano Fases II y III, códigos 210509-10401 y 210509-11248. A la Universidad Jorge Tadeo Lozano sede Santa Marta, por el apoyo logístico; al grupo GTSEM por su disposición y especialmente a la Dra. Judith E. Winston por la colaboración en la confirmación de las especies y corrección del documento, al Doctor Dennis P. Gordon por sus comentarios.
BIBLIOGRAFÍA
1 Andrade, C.A. y E.D. Barton. 2005. The Guajira upwelling system. Cont. Shelf Res., 25(9):1003-102. [ Links ]
2 Banta, W.C. y R.J.M. Carson. 1977. Bryozoa from Costa Rica. Pac. Sci., 31. 424 p. [ Links ]
3 Best, B. y J.E. Winston. 1984. Skeletal strength of encrusting cheilostome bryozoans. Biol. Bull., 167:390- 409. [ Links ]
4 Bock, P. 2007. Systematic list of families of Bryozoa. Mayo de 2007. http://www.bryozoa.net/famsys.html#Cheilostomata. [ Links ]
5 Brock, F.J. 1985. South Australian fouling bryozoans. 45-49. En: Nielsen, C. y G.P. Larwood (Eds). Bryozoa: ordovician to recent. Olsen & Olsen, Dinamarca. [ Links ]
6 Bula-Meyer, G. 1990. Altas temperaturas estacionales del agua como condición disturbadora de las macroalgas del Parque Nacional Tairona, Caribe colombiano: una hipótesis. An. Inst. Invest. Mar.-Punta de Betín, 19-20:9-21. [ Links ]
7 Busk, G. 1854. Catalogue of marine Polyzoa in the collection of the British Museum. II Cheilostomata. Trustees of the British Museum (Natural History). Londres. 8:55-124. [ Links ]
8 Canu, F. y R.S. Bassler. 1920. North American early tertiary Bryozoa. Proc. U. S. Natl. Mus., (106):1-879. [ Links ]
9 Canu, F. y R.S. Bassler. 1923. North American later tertiary and quaternary Bryozoa. Proc. U. S. Natl. Mus., (125):1-302. [ Links ]
10 Canu, F. y R.S. Bassler. 1928. Fossil and recent Bryozoa of the Gulf of Mexico region. Proc. U. S. Natl. Mus., 2710(14):1-199. [ Links ]
11 Cheetham, A. 1971. Functional morphology and biofacies distribution of Cheilostome Bryozoa in the Danian Stage (Palocene) of southern Scandanavia. Smithson. Contrib. Paleobiol., 6:1-87. [ Links ]
12 Cheetham, A.H., J. Sanner, J. Jackson, Y. Ventocilla y A. Herrera. 1998. Bryozoans. Neogene marine biota of Tropical America. Marzo de 2006. http://nmita.geology.uiowa.edu. [ Links ]
13 Cook, P. 1968. Bryozoa (Polyzoa) from the coasts of tropical West Africa. Atlantide Rep., 10:115-262. [ Links ]
14 Cuffey, R.J. y S.S. Fonda. 1977. Cryptic bryozoan species assemblages in modern coral reefs off Andros and Eleuthera, Bahamas. Proc. 3th Int. Coral Reef Symp., 1:81-86. [ Links ]
15 Díaz, J. M., L.M. Barrios, M. Cendales, J. Garzón-Ferreira, J. Geister, M. López, G. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Ser. Publ. Espec., INVEMAR, Santa Marta, 5:175 p. [ Links ]
16 Fransen, C.H. 1986. Caribbean Bryozoa: Anasca and Ascophora imperfecta of the inner bays of Curaçao and Bonaire. Stud. Fauna Curaçao and Other Carib. Isl., 68:119 p. [ Links ]
17 Garay, J.A. 1992. Monitoreo de residuos sólidos flotantes (basuras) en el Caribe colombiano 1990-1992. Memorias del 7º Seminario Nacional de las Ciencias y las Tecnologías del Mar: 1084-1093. [ Links ]
18 Gordon, D. y S.F. Mawatari. 1992. Atlas of marine-fouling Bryozoa of New Zealand ports and harbours. Misc. Ser. N. Z. Oceanogr. Inst., 107:52 p. [ Links ]
19 Harmer, S.F. 1915. The Polyzoa of the Siboga expedition. Part. 1. Entoprocta, Ctenostomata and Cyclostomata."Siboga" Expedition, 28: 180 p. [ Links ]
20 Harvell, D.C. 1992. Inducible defenses and allocation shifts in a marine bryozoan. Ecology, 73(5):1567-1576. [ Links ]
21 Hastings, A.B. 1930. Cheilostomatous Polyzoa from the vicinity of the Panama Canal collected by Dr. C. Crossland on the cruise of the S.Y. 'St. George'. Proc. Zool. Soc. Lond., 47:697-740. [ Links ]
22 Hayward, P.J. y J.S. Ryland. 1999. Cheilostomatous Bryozoans. Part 2. Hippothooidea - Celleporoidea. London: The Linnean Society of London & the Estuarine and Coastal Sciences Association. Synop. Br. Fauna new ser., 14: 416 p. [ Links ]
23 Hincks, T.H. 1880. Contributions towards a general history of the marine Polyzoa. Ann. and Mag. Nat. His., 6:69-92. [ Links ]
24 Hincks, T.H. 1884. Report on the Polyzoa of the Queen Charlotte Islands. Ann. and Mag. Nat. His., 13: 49-58, 203-215. [ Links ]
25 Hincks, T.H. 1885. Contributions towards a general history of the marine Polyzoa. XIV. Polyzoa from New Zealand and Australia. XV. Cheilostomata, Miscellaneous. Ann. and Mag. Nat. His., 15: 244-257. [ Links ]
26 Hughes, D.J. y J.B. Jackson. 1990. Do constant environments promote complexity of form?: The distribution of bryozoan polymorphism as a test of hypotheses. Evolution, 4:889-905. [ Links ]
27 INVEMAR. 2000. Programa Nacional de Investigación en Biodiversidad Marina y Costera (PNIBM). Plan de acción, 2001-2010. Díaz J.M. y Gómez D.I.. (eds), INVEMAR-FONADE-MMA. 83 p. [ Links ]
28 Jackson, J.B. y A. Herrera-Cubilla, 2000. Adaptation and constraint as determinants of zooid and ovicell size among encrusting Ascophoran Cheilostome bryozoa from opposite sides of the isthmus of Panama. 249-258. En: Herrera-Cubilla, A. y J.B. Jackson (Eds.). Proc. 11th Intern. Bryozoology Ass. Conf. Smithsonian Tropical Research Institute. Panamá. [ Links ]
29 Lagaaij, R. 1973. Shallow-water Bryozoa from deep-sea sands of the Principe Channel, Gulf of Guinea. 139- 151. En: Larwood, G.P. (Ed). Living and fossil Bryozoa. Londres. [ Links ]
30 Long E.R. y J.B. Rucker. 1970. Offshore marine cheilostome Bryozoa from Fort Lauderdale, Florida. Mar. Biol., 6:18-25. [ Links ]
31 Marcus, E. 1937. Bryozoarios marinhos brasileiros I. Zool., 1:1-224. [ Links ]
32 Marcus, E. 1938. Bryozoarios marinhos brasileiros II. Zool., 2:1-137. [ Links ]
33 Mckinney, F.K. y J.B. Jackson. 1989. Bryozoan Evolution. Unwin y Hyman, Boston. 250 p. [ Links ]
34 Ortiz, R. 1987. Estudio del desarrollo de comunidades de briozoos en sustrato artificial a diferentes profundidades en la bahía de Santa Marta. Trabajo de grado (Biólogo). Pontificia Universidad Javeriana, Facultad de Ciencias, Bogotá, 113 p. [ Links ]
35 Osburn, R.C. 1927. Bryozoa of Curaçao. Bijdr. Dierkd., 25:123-132. [ Links ]
36 Osburn, R.C. 1940. Bryozoa of Porto Rico with a resume of the West Indian Bryozoan fauna. Scientific Survey of Porto Rico and the Virgin Islands, 16(3):321-486. [ Links ]
37 Osburn, R. C. 1947. Bryozoa of the Allan Hancock Atlantic expedition 1939. The University of Southern California. United States Report. 5. 66 p. [ Links ]
38 Osburn, R. C. 1952. Bryozoa of the Pacific coast of America, part, 2, Cheilostomata-Ascophora. Allan Hancock Pac. Exped., 14:271-610. [ Links ]
39 Pallas, P.S. 1766. Elenchus zoophytorum sistens generum adumbrationes generaliores et specierum cognitarum succinctas descriptiones. Petrum van Cleef, Hagae-Comitum. 451 p. [ Links ]
40 Powell, N. A. 1967. Polyzoa (Bryozoa) Ascophora from north New Zealand. Disc. Rep., 34: 199-393. [ Links ]
41 Powell, N. A. 1971. The marine Bryozoa near the Panama Canal. Bull. Mar. Sci., 21:766-778. [ Links ]
42 Reyes, J., N. Santodomingo, A. Gracia, G. Borrero-Pérez, G. Navas, L. Mejía-Landino, A. Bermúdez y M. Benavides. 2005. Southern Caribbean azooxanthellate coral communities off Colombia. 309-330. En: Freiwald, A., & J. Roberts (Eds.). Cold-Water corals and ecosystems. Springer, Alemania. [ Links ]
43 Reyes, R. y N. Campos. 1992. Macro invertebrados colonizadores de raíces de Rhizophora mangle en la bahía de Chengue, Caribe colombiano. An. Inst. Invest. Mar.-Punta de Betín, 20:101-116. [ Links ]
44 Robertson, A. 1908. The incrusting Cheilostomatous Bryozoa of the West Coast of North America. University of California. 4:253-344. [ Links ]
45 Rozemeijer, M. y W. Dulfer. 1987. A quantitative analysis of the cryptofauna of the Santa Marta area (Colombia). University of Amsterdam. 48 p. [ Links ]
46 Ryland, J.S. 1970. Bryozoans. Hutchinson University Library. Londres. 175 p. [ Links ]
47 Schopf, T.J. 1973. Ergonomics of polymorphism: its relation to the colony as a unit of natural selection in species of the phylum Ectoprocta. 247-295. En: Boardman, R.S.; Cheetham, A.H. y W. A. Oliver, (Eds). Animal colonies: development and function through time. Stroudsburg, EE. UU. [ Links ]
48 Schopf, T.J. 1977. Patterns and themes of evolution among the Bryozoa. 159-207. En: Patterns of evolution. Amsterdam. [ Links ]
49 Smitt, F.A. 1873. Floridan Bryozoa, collected by Count L.F. de Pourtales, Part II. Kong. Svenska. Veten. Akad. Handl., 11(4):3-83. [ Links ]
50 Soule, J.D. 1961. Ascophoran Cheilostomata (Bryozoa) of the Gulf of California. Results of the Puritan- American Museum's Expedition to Western Mexico. Am. Mus. Novit., 6:1-54. [ Links ]
51 Soule, D.; Soule, J. y H. Chaney. 1995. Taxonomic atlas of the benthic fauna of the Santa Maria basin and western Santa Barbara Channel. The Bryozoa. California: Santa Barbara Museum of Natural History for the Hancock Institute of Marine Studies. 13. 344 p. [ Links ]
52 Uttley G.H. y J.S. Bullivant. 1972. Biological results of the Chatham Islands 1954 Expedition Part 7 Bryozoa Cheilostomata. NZOI Mem., 57:1-61. [ Links ]
53 Waters, A.W. 1918. Some collections of the littoral marine fauna of the Cape Verde Islands mad by Cyril Crossland, M.A., B.Sc. F.Z.S., in the summer of 1904. Bryozoa. Biol. J. Linn. Soc., 34:1-45. [ Links ]
54 Winston, J.E. 1982. Marine bryozoans (Ectoprocta) of the Indian River Area (Florida). Bull. Am. Mus. Nat. Hist., 172(2):99-176. [ Links ]
55 Winston, J.E. 1984. Shallow-water Bryozoans of Carrie Bow Cay, Belize. Am. Mus. Novit., 2799:1-38. [ Links ]
56 Winston, J.E. 1986. An annotated checklist of coral-associated bryozoans. Am. Mus. Novit., 2859:1-39. [ Links ]
57 Winston, J.E. 2004. Bryozoans from Belize. Atoll Res. Bull., 523:1-14. [ Links ]
58 Winston, J.E. 2005. Redescription and revision of Smitts' "Floridan Bryozoa" in the collection of the Museum of Comparative Zoology, Harvard University. VMNH. Memoir 7. 152 p. [ Links ]
59 Winston, J.E. y N. Eiseman. 1980. Bryozoan-algal associations in coastal and continental shelf waters of Eastern Florida. Fla Sci., 2:65-74. [ Links ]
FECHA DE RECEPCIÓN: 24/10/06 FECHA DE ACEPTACIÓN: 19/09/07