Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.39 no.2 Santa Marta July/Dec. 2010
LA COMUNIDAD FITOPLANCTÓNICA DURANTE EVENTOS DE SURGENCIA Y NO SURGENCIA, EN LA ZONA COSTERA DEL DEPARTAMENTO DEL MAGDALENA, CARIBE COLOMBIANO
PHYTOPLANKTON COMMUNITIES DURING UPWELLING AND NON-UPWELLING EVENTS, IN THE MAGDALENA COASTAL ZONE, COLOMBIAN CARIBBEAN
Jeimmy Samanta Ramírez-Barón, Andrés Franco-Herrera, Lorena Marcela García-Hoyos y Diego Alejandro López
Universidad de Bogotá Jorge Tadeo Lozano, Facultad de Ciencias Naturales e Ingeniería, Programa de Biología Marina. Carrera 2, No. 11-68, Edificio Mundo Marino, El Rodadero, Santa Marta, Colombia. samantha8462@yahoo.com (J.S.R.B.), andres.franco@utadeo.edu.co (A.F.H.)
RESUMEN
Se evaluaron algunos atributos estructurales de la comunidad fitoplanctónica en las ensenadas de Granate y Gaira y bahía de Taganga, con el fin de establecer su respuesta a cambios en la dinámica oceanográfica, modulada por pulsos de surgencia y no surgencia en la zona costera del departamento del Magdalena, Caribe colombiano, en el período comprendido entre febrero-junio de 2008, correspondiente a época seca mayor y lluviosa menor La velocidad del viento indicó la división de dos períodos febrero-abril (en presencia de surgencia: S) y junio-julio (no surgencia: NS) de 2008. Para cada período (S-NS), se identificaron en total 51-47 géneros distribuidos en 29-28 familias, correspondiendo el 78.23-86.19 % a diatomeas céntricas, el 16.68-9.47 % a diatomeas pennadas, el 4.57-3.78 % a cianobacterias y cerca del 0.5-0.55 % a dinoflagelados, flagelados y clorófitas. Los géneros con mayor abundancia fueron Chaetoceros(colonial) y Skeletonema(colonial) alcanzando una abundancia relativa de 47-19.57 % y 8.13-60.93 %, respectivamente, con densidades superiores a 2000 cel/L. Las concentraciones de clorofila a ostentaron valores bajos a lo largo de las sesiones en estudio, pasando de 0.72 ± 0.47 mg/m3 durante S, a 0.15 ± 0.15 mg/m3 en NS. El Índice de Actividad Fotosintética (IAF1) de 6.34 ± 5.34, indica una alta calidad de los pigmentos o el poco pastoreo por parte del zooplancton, representando entonces un estado fisiológico óptimo en condiciones de S. En contraste, el bajo valor promedio del IAF1 de 0.52 ± 0.84 propio del período de NS, indica un amplio declive en el estado fisiológico de la comunidad fitoplanctónica. Se evidenció un patrón de segregación temporal definido por la densidad celular de 22142.23 ± 15236.72 cel/L y 13588.58 ± 12608.455 cel/L para períodos de S y NS, respectivamente. La temperatura superficial del mar, salinidad y concentración de nitratos (0-60 m de profundidad), fueron las variables que mejor representaron la variabilidad de los períodos climáticos e influenciaron significativamente la estructura de la comunidad fitoplanctónica.
PALABRAS CLAVE: Fitoplancton, Surgencia, Caribe colombiano, Clorofila a, Diversidad.
ABSTRACT
The phytoplankton community structural attributes were evaluated in Granate and Gaira inlets and Taganga Bay in order to establish the community's response to changes in oceanographic dynamics modulated by upwelling and non-upwelling processes throughout the coastal waters of the Magdalena region, Colombian Caribbean, between February and June of 2008, during the main dry and short rainy seasons. Average wind speed divided in the research period in two seasons: February-April (upwelling: S) and June-July (non upwelling: NS) of 2008. In each period (upwelling and non-upwelling), 51-47 genera were identified distributed in 29-28 families, corresponding 78.23-86.19 % to centric diatoms, 16.68-9.47 % to pennate diatoms, 4.57-3.78 %) to cyanobacteria and about 0.50-0.55 %) to dinoflagellates, flagellates, and chlorophyta. The most abundant genera were Chaetoceros(colonial) and Skeletonema(colonial) with a relative abundance of 47-19.57 % and 8.13-60.93 %, respectively, and densities greater than 2000 cel/L. Chlorophyll a concentrations showed low values in this study from 0.72 ± 0.47 mg/m3 during S until 0.15 ± 0.15 mg/m3 during NS. The photosynthetic activity index (IAF1) of 6.34 ± 5.34 indicates either high pigment quality or low zooplankton grazing, representing an optimal phytoplankton physiological state during periods of S. In contrast, the IAF1 low average value of 0.52 ± 0.84 at NS indicates a wide decline in the phytoplankton community's physiological state. A temporal segregation pattern was defined by cell densities from 22142.23 ± 15236.72 cel/L to 13588.58 ± 12608.45 cel/L, for S and NS periods, respectively. Temperature, salinity, and nitrate concentration (0-60 m depth), were the variables that represented the most seasonal changes, and affected the phytoplankton community structure.
KEY WORDS: Phytoplankton, Upwelling, Colombian Caribbean, Chlorophyll a, Diversity.
INTRODUCCIÓN
La dinámica temporal y espacial de los organismos marinos está enmarcada en una serie de interacciones entre las variables ambientales y las características fisiológicas de los individuos (Álvarez, 1981; Wetzel, 1981), es decir, relaciones abióticas-bióticas. El fitoplancton depende principalmente de la oferta de luz, nutrientes inorgánicos y de la temperatura (Lynch y Poole, 1979), y es el responsable de recibir y transformar la energía solar en energía química y así ser la fuente primaria de materia orgánica para el sostenimiento de las redes tróficas. Cuando se aplican estos conceptos al Caribe centro-sur de Colombia, se encuentra que la información en la mayoría de los casos tiende a ser descriptiva, sin profundizar en la explicación de las variaciones de los autótrofos en respuesta a los cambios ambientales. Es así como los estudios acerca de la ecología y ensamblaje fitoplanctónico en diferentes puntos del Caribe colombiano coinciden en señalar al grupo de las diatomeas como el más dominante en la comunidad microfitoplanctónica, seguido por los dinoflagelados Igualmente, establecen cambios en la densidad de dichos grupos, en respuesta probablemente a cambios en la estratificación del agua (Caicedo, 1975; Corredor, 1979a; Duarte, 1996; Tigreros, 2001; Franco-Herrera y Torres-Sierra, 2006; Franco- Herrera et al., 2006; Suárez-Villalba et al., 2007 ). Además, son coincidentes en determinar valores de biomasa (i.e. clorofila a) y densidad celular fitoplanctónica fluctuantes en las diferentes épocas climáticas, alcanzando mayores valores durante la época lluviosa (Franco-Herrera, 2001, 2005, 2006; Tigreros, 2001; Franco-Herrera y Torres-Sierra, 2006; Arévalo-Martínez y Franco-Herrera, 2008), sugiriendo, mas no confirmando la importancia potencial del aporte de nutrientes por parte de los ríos y los eventos de surgencia (Webber y Roff, 1996).
Estos conceptos toman mayor relevancia en la zona costera del departamento del Magdalena, donde la presencia de la corriente del Caribe (generada por los vientos provenientes del noreste), la contracorriente de Panamá (generada por vientos provenientes del suroeste) (Franco-Herrera, 2005), los procesos de surgencia causados por la fuerte divergencia en los campos de los vientos (Bula-Meyer, 1990; Cabrera y Donoso, 1993; Andrade et al., 2003), los aportes de aguas continentales por el río Magdalena y la Ciénaga Grande de Santa Marta y los cambios en el acoplamiento océano-atmósfera por eventos de escala regional (e. g. Niño/Niña) (Franco-Herrera, 2001), hacen que la dinámica fitoplanctónica sea dependiente de un complejo sistema abiótico. Debido a lo anterior, el objetivo de esta investigación fue evaluar algunos atributos estructurales como composición, abundancia y biomasa de la comunidad fitoplanctónica, teniendo en cuenta la mayoría de variables (velocidad del viento, profundidad de Ekman, temperatura superficial del mar, salinidad, oxígeno disuelto, pH y concentración de nutrientes orgánicos) que reflejan la dinámica oceanográfica causada y que permiten definir períodos de surgencia (S) y de no surgencia (NS), con el fin de dar pautas claras del funcionamiento de esta comunidad autotrófica en un área costera que soporta una de las principales pesquerías artesanales del Caribe colombiano, con especial énfasis en pequeños pelágicos de hábitos herbívoros y omnívoros (Paramo y Roa, 2003; Paramo y Viaña, 2003; Paramo et al., 2003).
ÁREA DE ESTUDIO
La zona costera del departamento del Magdalena comprende la región de Santa Marta y el Parque Nacional Natural Tayrona (PNNT), ubicados entre las coordenadas 11°15' - 11°22' N y 73°57' - 74°12' W (Díaz et al, 2000). El régimen climático del sector se encuentra principalmente bajo la influencia de los desplazamientos norte-sur de la Zona de Convergencia Intertropical (ZCIT; INVEMAR, 2004). Se caracteriza en general como tropical semiárido, con dos períodos climáticos principales, la época seca (verano, diciembre-abril) y la época lluviosa (invierno, septiembre-noviembre), con una época de transición compuesta por un periodo lluvioso menor (i.e. mayo-junio) y seco menor (i.e. julio-agosto), este último conocido también como "veranillo de San Juan" (Hernández-Camacho, 1998; INVEMAR, 2004; Franco-Herrera, 2005). La época seca comprendida entre los meses de diciembre a abril, se caracteriza por vientos fuertes del norte y el noreste (alisios del NE), con velocidades promedio de 6.94 m/s. Las lluvias son débiles y escasas, no sobrepasan los 50 mm/mes, siendo enero y febrero los meses de más bajos índices de precipitación y caudales hídricos mínimos del orden de 100 m3/s (INVEMAR, 2004). Para esta época del año, tras la ocurrencia de una fuerte divergencia en el campo de los vientos, se ha observado el desarrollo del proceso de surgencia, caracterizado por la presencia de aguas con temperaturas relativamente bajas (21-24 °C ) y altas salinidades (36.5-37.2) (Müller, 1979; Ramírez, 1983, 1987; Bula-Meyer, 1990) permitiendo evidenciar la influencia de la Masa de Agua Subtropical Sumergida (MASS) que se localiza entre 100 y 200 m de profundidad en el mar Caribe (Bula-Meyer, 1985, 1990; Hernández-Camacho, 1998, Andrade et al., 2003). Ésta es seguida por el período lluvioso menor y seco menor, respectivamente. Para esta época los vientos no superan los 5.14 m/s Mientras que las direcciones presentan un predominio de las componentes norte y este La época de invierno, comprendida entre los meses agosto a noviembre, se caracteriza por lluvias abundantes, con máximos en octubre (270 mm/mes). En esta época, se presentan los caudales máximos de agua dulce; el intercambio de calor en la interfase del mar y el aire se disminuye ya que la velocidad del viento se reduce también (INVEMAR, 2004). La temperatura del agua sube hasta los 29-30 °C y la salinidad puede disminuir de 1 a 3 unidades del valor que alcanza durante los períodos de surgencia (Bula-Meyer, 1990; Donoso, 1990). En síntesis, las condiciones generales para el período anual de temperatura ambiente, temperatura del agua y salinidad, se encuentran comprendidas entre los siguientes rangos: 20-37 °C, 21-29 °C y 24.8-37, respectivamente (Acosta, 1989; Martínez y Acosta, 2005).
MATERIALES Y MÉTODOS
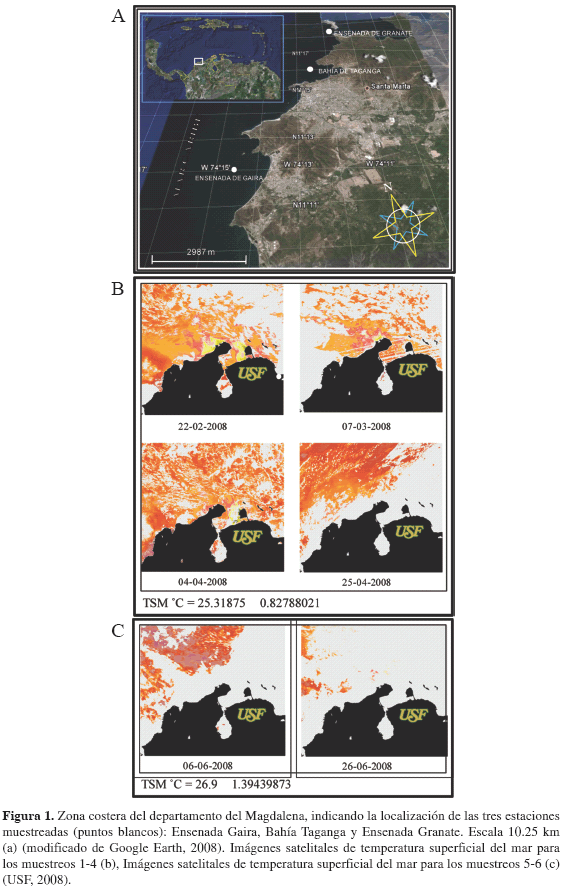
Se escogieron tres estaciones de muestreo, ubicadas en la bahía de Taganga (11° 15' 54'' N - 74° 12' 40'' W) y ensenadas de Gaira (11° 12' 44'' N - 74° 14' 44'' W) y Granate (11° 16' 57'' N - 74° 12' 40'' W; Figura 1a). Dichas estaciones fueron muestreadas en seis ocasiones comprendidas entre febrero y junio de 2008, cuatro muestreos (1, 2, 3 y 4) durante la época seca (i.e. febrero-abril) y dos (5 y 6) durante el período lluvioso menor (i.e. junio-julio), cuando se presentan las mayores (i.e. 3.5 m/s) y menores (i.e. 2.6 m/s) velocidades del viento, respectivamente, en el primer semestre del año (IDEAM, 2008). Para determinar la presencia y tipo de surgencia costera, se obtuvo información meteorológica de velocidad y dirección de viento diaria de una estación meteorológica Davis-Wizard III, ubicada en la Universidad Jorge Tadeo Lozano de Bogotá, sede Santa Marta, a 10 msnm, en la zona costera de la ensenada de Gaira. Con ésta, se calculó la profundidad de afloramiento o profundidad de Ekman (5E) (Pond y Pickard, 1983). Los datos fueron obtenidos de García-Hoyos (2008).
Para el análisis del componente biótico (fitoplancton, pigmentos fotosintéticos y accesorios: chl-a, chl-b, chl-c, carotenoides y feopigmento a) y abiótico (temperatura, salinidad, pH, oxígeno disuelto y nutrientes inorgánicos: nitratos, nitritos, amonio y ortofosfatos), se tomaron muestras a 0, 5, 30 y 60 m de profundidad haciendo uso de una botella de Van Dorn de 6 L de capacidad nominal. Análogamente, se obtuvieron muestras mediante arrastres verticales desde 60 m de profundidad hasta la superficie, haciendo uso de una red cónica simple de 30 cm de diámetro de boca y poro de malla de 63 µm. Las muestras de pigmentos fotosintéticos y nutrientes inorgánicos fueron depositadas en frascos oscuros de 2 L y se refrigeraron en neveras de fibra de vidrio con hielo. Las muestras para composición y abundancia fueron fijadas con solución de lugol-formalina al 4 %, neutralizada con bórax y glicerina. La temperatura, salinidad, pH y oxígeno disuelto del agua se determinaron in situ mediante el uso de sondas multiparámetros WTW- 330 para cada profundidad.
La concentración de los pigmentos fotosintéticos, fue obtenida filtrando 2 L de agua de mar de cada profundidad mediante un filtro sintético Whatman GF/C. Los pigmentos fueron extraídos mediante solución de acetona al 90 % y su concentración se determinó a través del método espectrofotométrico de acuerdo con lo descrito en INVEMAR (2003). Se estimaron los Índices de Actividad Fotosintética (IAF), relacionando la concentración de clorofila a: feopigmentos a (IAF1) y clorofila a: carotenoideos (IAF2), como medida del estado fisiológico de la comunidad autotrófica (Margalef, 1991). La concentración de nutrientes inorgánicos (nitratos, nitritos, amonio y ortofosfatos), fue medida usando las marchas analíticas propuestas por INVEMAR (2003).
Para el recuento de células, las muestras obtenidas por botella de Van Dorn fueron filtradas a través de un filtro de 25 µm de poro. La identificación se llevó a cabo hasta el nivel taxa-género, mediante el uso de un microscopio óptico de luz Nikon E200 con objetivos de 10x y 40x, usando la técnica de portaobjetos-cubreobjetos. El número mínimo de alícuotas a observar se estimó mediante curvas de diversidad acumulada (Ramírez, 2005) Las muestras obtenidas en red fueron analizadas con placas SR Cell Counter S 50. Para la identificación de los organismos se utilizaron las guías de Cupp (1943), Vidal y Carbonell (1977), Parra et al. (1982), Balech (1988), Vidal (1995), Tigreros (2001) y Botes (2003).
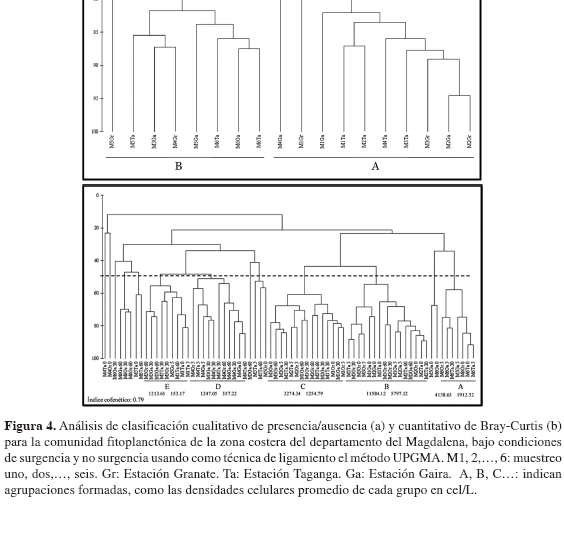
La información de composición fue recopilada en una matriz primaria de acuerdo con la clasificación taxonómica descrita por Chretiennot-Dinet et al (1993), que permitió valorar la composición por géneros y grupos mayores (e.g. diatomeas, dinoflagelados, cianobacterias), en las diferentes profundidades en cada estación. Consecutivamente, se estimó la densidad celular por géneros y total por profundidad y la densidad integrada en la columna de agua (0-60 m) Para evaluar la similitud entre muestras se realizó inicialmente un análisis de clasificación cualitativo entre muestras a partir de una matriz presencia-ausencia. Posteriormente, se adelantó un análisis de similitud cuantitativo de Bray-Curtis a través del programa PRIMER 5v 2.2® (Clarke y Ainsworth, 1993) Los valores de similitud obtenidos fueron sometidos a un análisis de ordenación multidimensional no-métrica (NMDS) y a un análisis de clasificación jerárquica en modo Q (entre estaciones) y su dendrograma fue construido utilizando el método UPGMA (Ochoa y Tarazona, 2003). Conjuntamente, se realizó un análisis de similaridad (ANOSIM) para definir si existen diferencias significativas en términos de abundancia de géneros, entre los muestreos considerados de surgencia y no surgencia y los distintos estratos de profundidad considerados en el diseño muestreal (Clarke y Warwick, 1994).
Para establecer la estructura de la comunidad fitoplanctónica, se calcularon los índices ecológicos, riqueza de Margalef, uniformidad de Pielou, diversidad de Shannon-Weaver, predominio de Simpson y números de Hill N0, N1 y N2 de la comunidad, a través del programa PRIMER 5v 2.2® (Clarke y Ainsworth, 1993). Para determinar si existían diferencias en los índices calculados entre épocas de surgencia y no surgencia, estaciones y/o profundidades, se empleó inicialmente el test de Wilcoxon, seguido por el test de Friedman, sin embargo, debido a su baja potencia, se hizo un análisis exploratorio mediante el uso de la prueba t pareada que corrobora la veracidad de las pruebas en mención, a través del programa STATISTICA Versión 8.0® (Zar, 1996).
Para evidenciar el efecto de los eventos de turbulencia o eventos Lasker sobre cambios temporales a pequeña escala en la comunidad fitoplanctónica, se analizó su variabilidad durante el día de muestreo. Se determinó la turbulencia mediante el índice de Pingree (Lalli y Parsons, 1993), la concentración de clorofila a integrada en la columna de agua (0-60 m), y se establecieron correlaciones de Spearman (Clarke y Ainsworth, 1993; Clarke y Warwick, 2001) entre las variables turbulencia - pigmentos fotosintéticos (chl-a) para los momentos de muestreo. Finalmente, para establecer las relaciones existentes entre las variables océano-atmosféricas y la comunidad fitoplanctónica, todas las variables fueron estandarizadas para su respectivo rango de máximos y mínimos, siguiendo la metodología descrita en Guisande (2006) y se llevaron a cabo correlaciones Pearson a través del programa STATGRAPHICS versión 5.1® (Zar, 1996).
RESULTADOS
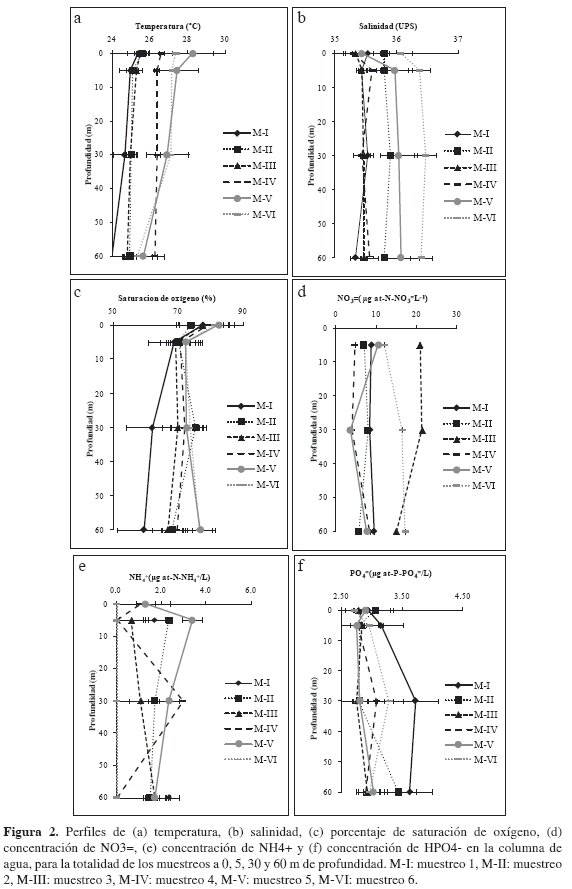
Durante los muestreos realizados, tanto la velocidad promedio (> 4.0 m/s) y la dirección del viento (paralela y perpendicular a la costa) indicaron condiciones favorables para la ocurrencia de eventos de surgencia por transporte de Ekman y acción de vientos continentales para los muestreos 1-4 (época seca), a diferencia de los muestreos 5 y 6 (época lluviosa menor), que estuvieron regidos por velocidades promedio más bajas (Tabla 1). En respuesta a la intensidad del viento, se generaron profundidades de Ekman, que superaron la termoclina permanente (45 m) evidenciando el ascenso de aguas de afloramiento, en los muestreos 1-4. Durante el período febrero-abril de 2008, las aguas superficiales de las ensenadas de Gaira y Granate y de la bahía de Taganga, presentaron bajas temperaturas, altas salinidades y valores de subsaturación de oxígeno, condiciones físico-químicas típicas de aguas de afloramiento (Figuras 1b, 2a, b, c; García-Hoyos, 2008). Las concentraciones de amonio y nitritos fluctuaron entre 0.04 y 5.46 µg-at-N-NH4+/L y 3.24 y 3.62 µg-at- N-NO2-/L, respectivamente. Los nitratos y ortofosfatos se mantuvieron en ámbitos considerablemente altos (i.e. entre 1.92 y 31.54 µg-at-N-NO3=/L, 2.59 y 4.68 µg-at- P-HPO4-/L). Es importante destacar que la variabilidad fisicoquímica de la columna de agua no presentó diferencias significativas entre períodos de surgencia y no surgencia (Wilcoxon, p > 0.05). No obstante, se hizo evidente una segregación de los muestreos en respuesta a las variables evaluadas separándose aquellos influenciados por eventos de surgencia, caracterizados por mayor densidad celular, biomasa y diversidad fitoplanctónica (muestreo 1 a 4) de muestreos sin acción de aguas de afloramiento (muestreos 5 y 6; Figuras 1c, 2).
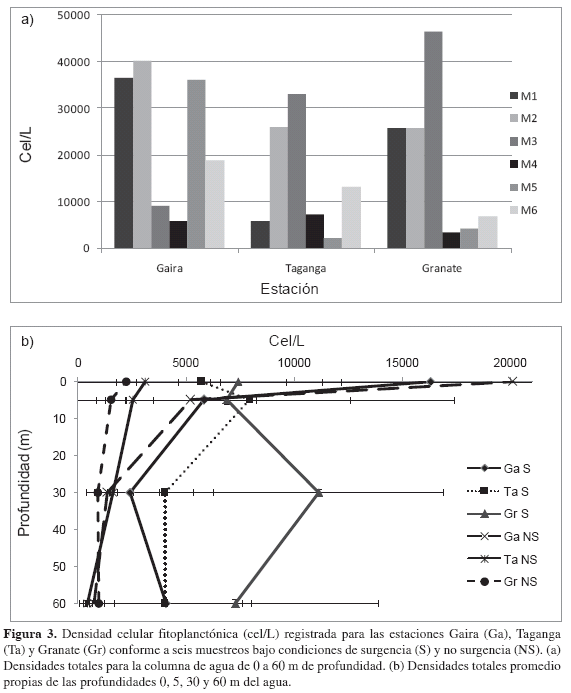
La densidad celular fluctuó en presencia de eventos S entre 5926.11 cel/L y 46553.60 cel/L y entre 2266.13 y 36137.20 cel/L en NS (Figura 3a). La misma tendencia se encontró en la densidad integrada para la columna de agua promedio que registra un valor máximo de 53.7x107 ± 18.6x107 cel/m, durante los muestreos de afloramiento (S), mientras que en ausencia de ellos (NS), la densidad alcanzó solamente hasta las 49.8x106 ± 15.6x106 cel/m2 (Tabla 2). En relación con la distribución vertical, los mayores valores de densidad celular se encontraron en promedio en las capas superiores de la columna de agua, con valores entre 9277.23 ± 8411.08 cel/L a 0 m y 5366.99 ± 4988.06 cel/L a 5 m de profundidad, y descendiendo en las capas inferiores a 4034.31 ± 4518.95 cel/L a 30 m y 3354.58 ± 4107.92 cel/L a 60 m de profundidad (Figura 3b).
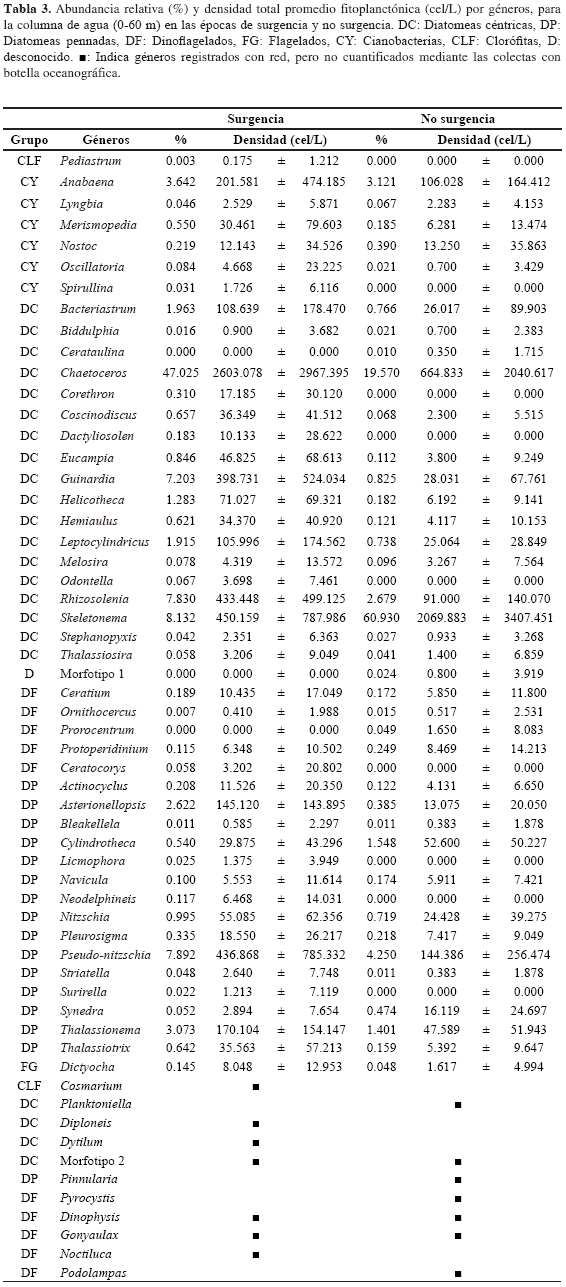
En términos de composición, la comunidad microfitoplanctónica en las épocas de S (NS) se caracterizó por el dominio de las diatomeas que presentaron 35 (32) géneros, seguidas por las cianobacterias 6 (5), dinoflagelados 6 (8), flagelados 2 (2) y clorófitas 2 (0) (Tabla 3). De las diatomeas, los géneros de mayor importancia fueron Chaetocerosy Skeletonema, alcanzando una abundancia relativa de 47.02 % (19.57 %) y 8.13 % (60.93%) respectivamente, y densidades promedio superiores a 2000 cel/L. Los géneros Rhizosolenia, Leptocylindrus, Thalassionema, Pseudo-nitszchia y Anabaena mostraron densidades considerablemente bajas con respecto a Chaetocerosy Skeletonema, pero fueron característicos y frecuentes en la totalidad del período de muestreo, con densidades promedio superiores a 55 cel/L, representando porcentajes superiores al 1 % sobre el total (Tabla 3). Los géneros Asterionellopsis, Guinardia, Bacteriastrum y Helicotheca igualmente alcanzaron porcentajes superiores al 1 % exclusivamente durante el período febrero-abril, no obstante, fueron frecuentes en el período junio-julio, aunque con baja importancia relativa (< 1%; Tabla 3).
Los valores de diversidad para las dos condiciones oceanográficas (S: 2.25 ± 0.16 y NS: 1.88 ± 0.19) fueron similares (Wilcoxon, p > 0.05) y bajos, sin superar los 2.5 bits en términos de diversidad, generando así niveles de equiparabilidad entre 34 y 76 % y valores de predomino menores a 0.55. Esto llevó a que la estructura de la comunidad estuviera principalmente sujeta a la riqueza de géneros y se viera influenciada por el gradiente de profundidad, lo que llevó a que se encontraran diferencias significativas en términos de diversidad con respecto a la profundidad (Friedman, p < 0.05).
Consecuentemente a lo anterior, el análisis de clasificación cualitativo de presencia/ausencia reveló dos grupos correspondientes de manera general a los dos escenarios (S y NS), incluyendo las tres estaciones en cada uno de ellos (Figura 4a). El análisis de clasificación cuantitativo Bray-Curtis (Figura 4b) sigue un patrón similar y muestra la formación de cinco grupos que responden principalmente a la variación temporal modulada por eventos de surgencia (S) y no surgencia (NS). El grupo A junto con el E reunieron en su mayoría las muestras propias de los muestreos 5 y 6 en NS, con densidades celulares promedio bajas y medias en las capas inferiores y superiores, respectivamente. En contraste, los grupos B y C se conforman en su totalidad por las muestras correspondientes a los muestreos 1, 2 y 3 en S, que se segregan en respuesta a densidades altas y medias/bajas, sin una discriminación clara de profundidades y/o estaciones. Finalmente el grupo D asocia las muestras correspondientes al muestreo 4 en S con densidades preponderantemente bajas que se infieren como consecuencia de las condiciones atípicas que se presentaron en dicho muestreo, causado por el derrame del aceite vegetal de la empresa Terlica S. A. a la bahía de Taganga y zonas adyacentes. El análisis de similaridad ANOSIM (R = 0.43 p < 0.001) confirma el patrón de distribución y el factor determinante (época).
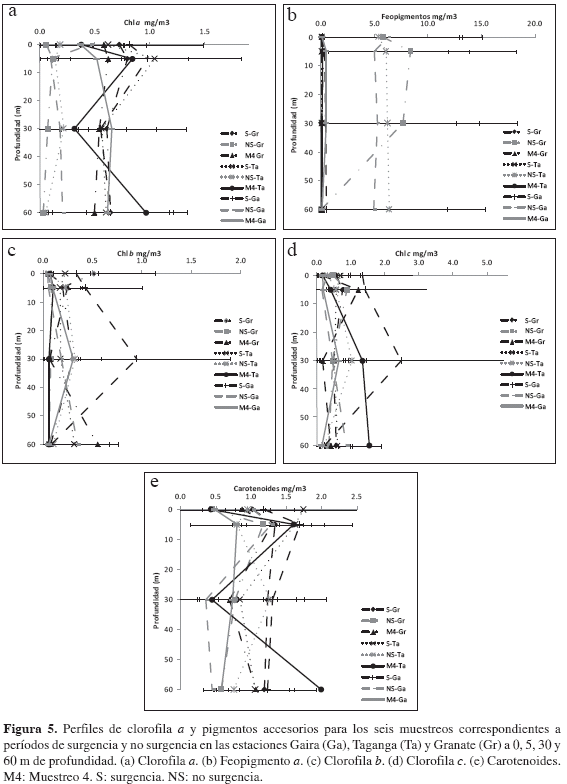
Las concentraciones de clorofila a (chl-a) alcanzaron mayores valores durante el período febrero-abril de 2008 en presencia de surgencia fluctuando entre 0.007 y 1.610 mg/m3, con una media de 0.72 ± 0.47 mg/m3 y disminuyeron durante el intervalo junio-julio de 2008 en ausencia de surgencia, oscilando entre 0.001 y 0.679 mg/m3, con un promedio de 0.150 ± 0.150 mg/m3. Consecuentemente, los pigmentos accesorios mantuvieron el mismo comportamiento, así la chl-b, chl-c y carotenoides alcanzaron promedios de 0.31 ± 0.41 mg/m3, 0.86 ± 1.12 mg/m3 y 1.29 ± 0.54 mg/m3 en S y un claro declive en NS con 0.13 ± 0.17 mg/m3, 0.51 ± 0.41 mg/m3 y 0.82 ± 0.45 mg/ m3, respectivamente. Las concentraciones de feopigmento a presentaron una relación inversa con la concentración de chl-a, con promedios bajos en S (0.21 ± 0.27 mg/m3) y altos en NS (5.62 ± 6.08 mg/m3). Respecto a la distribución vertical de la concentración de pigmentos fotosintéticos (chl-a, chl-b, chl-c, carotenoides y feopigmento a), aun cuando se observó una ligera agrupación de los valores altos en las capas superficiales del agua, no se evidenció un patrón de segregación vertical marcado, pese a que se encontró que existen diferencias significativas en el patrón de distribución de los pigmentos con respecto a la profundidad (Friedman, p < 0.05; Figuras 5a, 6).
El Índice de Actividad Fotosintética (IAF1, feopigmentos a) con un promedio de 6.34 ± 5.34 en S, indicó una alta calidad de los pigmentos y/o poco pastoreo por parte del zooplancton, representando entonces un estado fisiológico óptimo. En contraste, durante el período en ausencia de surgencia (NS) se encontró un valor promedio (0.52 ± 0.84) considerablemente menor, lo que indica un amplio declive en el estado fisiológico de la comunidad fitoplanctónica propio de esta época. Por otra parte, el IAF2 (pigmentos carotenoideos, ámbito 0.03-1.61) presentó valores promedios más altos durante el período inicial (S) con 0.55 ± 0.30 y más bajos (0.21 ± 0.23) para el final (NS).
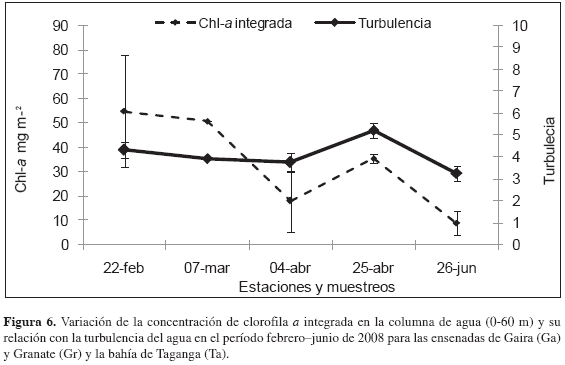
Los valores de turbulencia en las ensenadas de Gaira y Granate y bahía de Taganga fluctuaron entre 3.026 y 5.600 indicando aguas turbulentas para las tres estaciones (Lalli y Parsons, 1993). La correlación Spearman indicó una asociación positiva entre las variables turbulencia y concentración de chl-a (Spearman, r = 0.6099, p < 0.005), reflejándose mayor biomasa fitoplanctónica a medida que se homogeniza la capa de mezcla (Figura 6).
Las correlaciones de Pearson indicaron que la densidad celular fitoplanctónica se relacionó positivamente con la concentración de NO3= y negativamente con la salinidad y densidad del agua. De la misma manera, se observó una relación negativa entre la riqueza de géneros y la diversidad de Shannon Weaver con la temperatura del agua, salinidad, pH, oxígeno disuelto y saturación de oxígeno. La equiparabilidad mostró una relación positiva con la concentración de NH4+ y negativa con la saturación de oxígeno. La concentración de chl-a se relacionó negativamente con la temperatura del agua, salinidad y NO3=. Inversamente, la concentración de feopigmentos a mostró una relación positiva con dichas variables. Finalmente, los resultados de las correlaciones señalan que, al parecer las concentraciones de chl-b y carotenoides no se vieron afectadas de manera importante por las variables evaluadas en este estudio; en adición, permiten descartar que las concentraciones NO2- y HPO4- tengan un efecto importante sobre las variables biológicas en estudio (Tabla 4).
DISCUSIÓN
En el período comprendido entre febrero y junio de 2008, cuando se presentaron las épocas seca mayor y lluviosa menor en la zona costera del departamento del Magdalena, la estación lluviosa menor mostró una baja intensidad producto de la oscilación en el desplazamiento hacia el norte de la ZCIT (CIOH, 2008), desencadenando importantes efectos sobre la dinámica oceanográfica. Dichos efectos, representados principalmente por la salinidad, que incluso evidenció un aumento, fluctuando entre 35.1 y 36.6. Por otra parte, la intensidad de los vientos alisios del NE generó eventos de surgencia para los cuatro muestreos iniciales. A diferencia de los dos muestreos finales (5 y 6) donde no se desarrollaron eventos de surgencia, a causa de un notorio debilitamiento de los alisios del NE. Hechos evidenciados por la temperatura superficial del mar (TSM), que mostró valores bajos en el inicio del período (muestreo 1, Figura 2a) con 23.4 °C, y paulatinamente fue en aumento llegando hasta 30 °C (muestreo 5, Figura 2a). No obstante, las diferencias en las condiciones oceanográficas entre períodos y/o estaciones no fueron significativas (Wilcoxon p > 0.05). Los valores de TSM registrados en el presente estudio están entre los ámbitos encontrados en trabajos anteriores para la zona costera del departamento del Magdalena (Ramírez, 1983, 1990; Andrade, 1993; Bernal, 1994; Blanco et al., 1994; Franco-Herrera et al, 2006; Arévalo-Martínez y Franco Herrera, 2008). Se resalta el registro de valores de salinidad por encima de 36.0, los cuales resultan atípicos en el período de lluvias de acuerdo con lo registrado en los trabajos anteriormente mencionados.
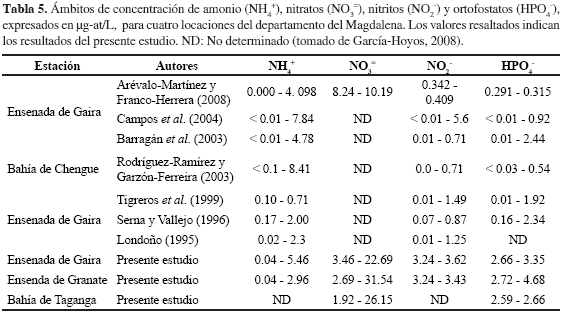
Las concentraciones de nutrientes inorgánicos no presentaron una alta variabilidad con relación a las épocas climáticas (i.e. seca mayor y lluviosa menor). Las concentraciones de amonio (NH4+) y nitritos (NO2-) se encuentran entre los ámbitos registrados por diversos autores para el área (Tabla 5). Sin embargo, las concentraciones de nitratos mayores a 30 µg-at N-NO3=/L, propias de este estudio, superan por mucho las registradas para la zona costera del departamento del Magdalena y hacen comparable este escenario de surgencia con sistemas como los de Perú (Ramírez, 1990), Chile (Iriarte et al., 2007) y África noroccidental (Ramírez, 1990), tal como lo describe García-Hoyos (2008). Asimismo, la concentración de ortofosfatos (HPO4-) superan los valores registrados para la zona (Tabla 5).
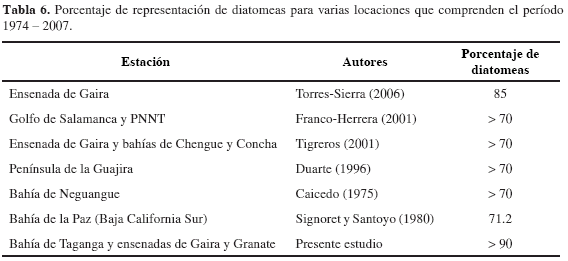
La mayor proporción de diatomeas durante la totalidad de la investigación es típica de ambientes de surgencia costera (Bruland et al., 2001; Santander et al., 2003, Tabla 6) El grupo de las diatomeas es cosmopolita, muy diverso, con un muy elevado número de formas marinas (McConnaughey, 1974; Round et al., 1990), y presenta adaptaciones a aguas turbulentas como las del Caribe, que aseguran su permanencia en el medio (Balech, 1977; Corredor, 1979b) Asimismo, se ha demostrado una mayor actividad enzimática de las nitrato/nitrito reductasas en especies de diatomeas en comparación a especies de flagelados (Iriarte et al., 2007), lo que les atribuye la capacidad de aprovechar ofertas de NO3= y NO2-, con mayor efectividad. Esto último, es consecuente con las altas concentraciones de nitratos registradas en este estudio, que habrían favorecido el crecimiento de las diatomeas por encima de otros grupos taxonómicos. Dentro del grupo de las diatomeas, es notable la dominancia de 11 géneros: Chaetoceros(colonial, c), Skeletonema(c), Rhizosolenia (c), Guinardia (c), Bacteriastrum (c), Leptocylindricus (nc), Helicotheca (nc), Thalassionema (c), Asterionellopsis (c), Pseudo-nitzschia (nc) y Nitzschia (nc). Las formas coloniales son las más abundantes, pues al parecer presentan ventajas al aumentar la fricción que disminuye la velocidad de sedimentación (Balech, 1977; Santander et al., 2003). Además, mantienen alta eficiencia en términos de captación de luz, incorporación de nutrientes y crecimiento, dado que cada célula conserva su individualidad, viéndose favorecida por una mayor relación superficie/volumen, lo que se traduce en un mayor aprovechamiento de las condiciones propias de un evento de surgencia costera (Balech, 1977; Santander et al., 2003).
A partir de la composición por géneros-taxa, no se evidenciaron discrepancias significativas de la comunidad fitoplanctónica entre condiciones de surgencia y no surgencia (Figura 4a). Esto puede deberse a un gran porcentaje (71 %) de los géneros comunes a las dos condiciones oceanográficas, lo que puede ser atribuido a las características fisicoquímicas que no se diferencian significativamente; resultado equiparable con lo registrado por Franco-Herrera y Torres-Sierra (2006). Sin embargo, se denota una segregación temporal, en respuesta a grupos específicos que estarían caracterizando cada período (S-NS).
Por otra parte, las densidades celulares mostraron marcadas diferencias entre los dos períodos El índice de Bray-Curtis (Figura 4b) permitió observar la formación de varias agrupaciones, producto de una segregación temporal con mayores densidades en surgencia, y en las capas superiores del agua. Al parecer, los pulsos de surgencia modularon condiciones físicas y químicas adecuadas para la proliferación (aumento en la densidad) de la comunidad fitoplanctónica, representadas especialmente por el género Chaetoceros. Igualmente, cabe resaltar que el retraso en la aparición de la temporada de lluvias en 2008 y la disminución en la intensidad de los vientos alisios del NE, generaron una disminución en el aporte de nutrientes proveniente de descargas continentales y en la surgencia, generando un descenso de la abundancia fitoplanctónica. Esto lleva a señalar a este último (junio-julio) como un período transicional, caracterizado por la presencia de géneros de crecimiento rápido y de alta adaptabilidad, principalmente a Skeletonema(Rojas y Estrada, 1976; Sakshaug et al., 1989), con densidades más altas en condiciones de no surgencia.
La dominancia del género Chaetoceros en períodos de surgencia (febrero-abril de 2008), junto con su alta densidad en ausencia de afloramientos de agua (junio-julio de 2008), pudo deberse a que la mayoría de sus especies son euritérmicas, eurihalinas y producen hipnosporas (Calderón, 1986), lo que les atribuye amplios ámbitos de supervivencia, incluso en condiciones desfavorables (Pitcher, 1990) Así mismo, el estar ornamentados con largas setas, les permite la formación de colonias lo cual representa una gran ventaja ya que pueden permanecer en diferentes estratos del agua (Hafner et al., 1980; Waite, 1996). Ha sido documentado el dominio de estos géneros en el área en diferentes períodos climáticos (tanto en época seca como de lluvias) (Franco-Herrera y Torres-Sierra, 2006), lo que muestra por parte de éstos una gran capacidad de adaptación y aprovechamiento de diferentes condiciones características de dichas épocas.
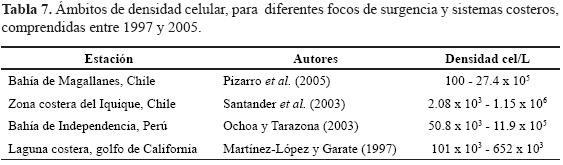
Mayores densidades fitoplanctónicas durante el período de surgencia en comparación con no surgencia, son contrarias a lo registrado en trabajos anteriores para el área (Caicedo, 1975; Franco-Herrera, 2001; Tigreros, 2001; Franco-Herrera y Torres-Sierra, 2006) Sin embargo, pese a haber encontrado mayores densidades en surgencia, los valores registrados son inferiores a los hallados en otros focos de afloramiento en el mundo (Tabla 7). Un factor a tener en cuenta es la salinidad que presentó una asociación negativa con la densidad celular (Tabla 4). Ello permitiría inferir que los ámbitos de salinidad habrían superado los intervalos de tolerancia de algunas de las especies que componen la comunidad fitoplanctónica en este estudio, convirtiéndose en un factor limitante para su crecimiento Moronta et al (2006) encontraron que en condiciones axénicas autotróficas, valores altos de salinidad (35) inhiben el crecimiento microalgal hasta en un 90 %.
Los resultados de densidad celular actuales ostentan un ámbito más amplio (246.40-26392.80 cel/L) con respecto a lo registrado por Franco-Herrera y Torres-Sierra (2006; 344.11 - 7044.47 cel/L) para la ensenada de Gaira. Puesto que las concentraciones de NO3= se relacionaron positivamente con la densidad celular (Tabla 4), se hace evidente que mayores concentraciones de NO3= favorecen el aumento de la densidad. Lo que podría explicar las abundancias celulares superiores propias de este estudio, dado que las concentraciones de este macronutriente (31.54 µg-at-N-NO3=/L) superan por mucho las registradas por Arévalo (2007) (10.20 µg-at-N-NO3=/L), a lo que se suman concentraciones de ortofosfatos (0.31 µg-at-P-HPO4-/L) igualmente superiores (4.68 µg-at-P-HPO4-/L) (García-Hoyos, 2008), que habrían favorecido el crecimiento de las poblaciones fitoplanctónicas.
Toda esta dinámica en la composición y abundancia fitoplanctónica llevó a que la diversidad mostrara una variabilidad acorde a los períodos climáticos en presencia y ausencia de afloramientos, a causa principalmente de la densidad celular. Manifestando valores altos con respecto a bajas densidades celulares y viceversa. Las variables temperatura del agua y pH presentaron una asociación negativa con los atributos estructurales de la comunidad fitoplanctónica como lo son riqueza, diversidad y números de Hill N0, lo que podría explicar, en términos de diversidad, la disminución registrada para el período de no surgencia (S: 2.25 ± 0.16 - NS: 1.88 ± 0.19), donde se registraron los picos de las variables físicas y químicas en mención. La mayor parte de los valores de diversidad de Shannon - Weaver y uniformidad de Pielou (equiparabilidad) del presente estudio se mantienen dentro de los ámbitos registrados tanto para la costa Caribe colombiana como para diferentes regiones del mundo con afloramientos de aguas subsuperficiales (Tabla 8).
Durante la época seca, la biomasa fitoplanctónica (chl-a), fue baja (0.007 - 1.610 mg/m3) ante la magnitud de los eventos de surgencia, no obstante fue mayor que en los períodos de no surgencia Pese a la disponibilidad de nutrientes es significativa (0.04 - 5.46 µg-at-N-NH4+/L, 3.24 - 3.62 µg-at-N-NO2-/L, 1.92 - 31.54 µg-at-N-NO3=/L, 2.59 - 4.68 µg-at-P-HPO4-/L), probablemente existió un desfase en el tiempo de respuesta por parte de la comunidad fitoplanctónica. Al respecto, Ahumada (1989) señala que la existencia de un período de retardo está asociada al tiempo que necesitan para que se produzca el consumo de los nutrientes transportados por las aguas recientemente afloradas. De ahí que la concentración de NO3= apareció como otro factor que se relacionó negativamente con las concentraciones de chl-a, indicando que al parecer el consumo de nitrato favorece el crecimiento de la comunidad fitoplanctónica. Junto a este conjunto de variables, se encuentra la turbulencia del agua (i.e. eventos Lasker) cuya asociación significativamente positiva con la chl-a (Figura 6) indica que, en general, las mayores biomasas fitoplanctónicas se manifestaron conjuntamente con la ocurrencia de los denominados eventos Lasker, evidenciando, que durante estos picos, la columna de agua no presentó una estratificación ni turbulencia muy altas, permitiendo que los nutrientes recientemente aflorados por turbulencia fueran utilizados por el fitoplancton, condición favorable para el florecimiento fitoplanctónico (Lalli y Parsons, 1993).
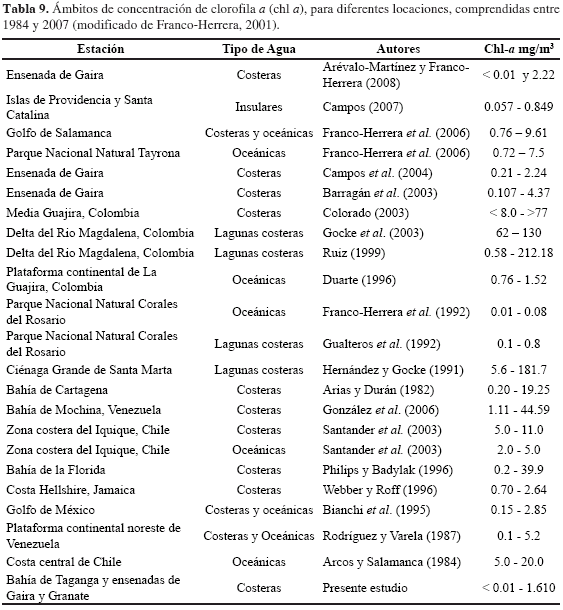
Las concentraciones de chl-a, en general, se ajustan a lo registrado para la costa Caribe colombiana específicamente para los sistemas oceánicos y costeros. Sin embargo, son bajas con respecto a las registradas para diferentes sistemas de surgencia entre estos, las costas de Chile y Venezuela (Tabla 9).
Los valores IAF1 (> 2.0) permitieron inferir la presencia de comunidades fotosintéticamente activas durante los eventos de surgencia, lo cual es consecuente con lo registrado por Estrada y Blasco (1985), Margalef (1985) y Corredor (1992), quienes afirman que la fertilización de aguas resultante de afloramientos estimula la respuesta de la comunidad autótrofa. De manera contraria, en ausencia de pulsos de surgencia se evidenciaron procesos de degradación de los pigmentos fotosintéticos por senescencia y/o presión de pastoreo. Los valores de IAF2 se mostraron bajos durante el período de muestreo (< 2.0), indicando que las concentraciones de chl-a y carotenoides fueron similares, no obstante, durante no surgencia se evidenció un aumento en la concentración de carotenoides Al respecto, Moronta et al. (2006) encontraron que el incremento en la salinidad favorece el aumento en la concentración de carotenoides. En síntesis, los resultados encontrados evidencian que las aguas costeras de la bahía de Taganga y las ensenadas de Gaira y Granate tienen bajas concentraciones de chl-a junto con bajas densidades fitoplanctónicas, con una estructura comunitaria típica de aguas de afloramientos ocasionales, con predominancia de diatomeas grandes o coloniales, baja diversidad y cambios drásticos en términos de densidad celular y biomasa fitoplanctónica asociados a cambios en las condiciones moduladas por eventos de surgencia y ausencia de estos entre épocas climáticas.
AGRADECIMIENTOS
Los autores agradecen especialmente a la Facultad de Ciencias Naturales e Ingeniería, al Programa de Biología Marina, a la Dirección de Investigación, Creatividad e Innovación de la Universidad de Bogotá Jorge Tadeo Lozano y a su personal, por la financiación total del proyecto y el apoyo logístico, así como equipo científico y administrativo de la sede Santa Marta. Igualmente, a los evaluadores anónimos y editores encargados por sus comentarios y correcciones para el fortalecimiento del manuscrito. Esta investigación se realizó dentro del marco del proyecto "Variabilidad oceanográfica de la zona costera del departamento del Magdalena, Caribe colombiano", código 96/03/07, dentro del Grupo de Investigación Dinámica y Manejo de Ecosistemas Marino-Costeros, de la Universidad de Bogotá Jorge Tadeo Lozano.
BIBLIOGRAFÍA
1 Acosta, A. 1989. Composición y estructura de la comunidad de corales hermatípicos en tres zonas representativas de la región de Santa Marta (mar Caribe colombiano). Trabajo de grado Biol., Univ. Nacional de Colombia, Bogotá. 242 p. [ Links ]
2 Ahumada, R. 1989. Producción y destino de la biomasa fitoplanctónica en un sistema de bahías en Chile central: una hipótesis. Biol. Pesq., 18: 53-63. [ Links ]
3 Álvarez, F. 1981. Introducción a la ecología del mar. Fascículos de ecología II. Editorial Mejoras, Bogotá. 90 p. [ Links ]
4 Andrade, C. A. 1993. Análisis de la velocidad del viento en el mar Caribe. Bol. Cient. Cent. Invest. Oceanogr. Hidrogr., 13: 33-43. [ Links ]
5 Andrade, C. A., E. D. Barton y Ch. N. K. Mooers. 2003. Evidence for an eastward flow along the Central and South American Caribbean Coast. J. Geophys. Res., 108: 1-11. [ Links ]
6 Arcos, D. y M. Salamanca. 1984. Distribución de clorofila y condiciones oceanográficas frente a Chile central (latitudes 32°S-38°S). Biol. Pesq., 13: 5-14. [ Links ]
7 Arévalo, D. L. 2007. Acoplamiento océano-atmósfera en el desarrollo de la surgencia frente a las costas de la ensenada de Gaira, Caribe Colombiano, época seca menor. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 107 p. [ Links ]
8 Arévalo-Martínez, D. y A. Franco-Herrera. 2008. Características oceanográficas de la surgencia frente a la ensenada de Gaira, departamento del Magdalena. Bol. Invest. Mar. Cost., 37 (2): 131-162. [ Links ]
9 Arias, F. y J. Durán. 1982. Variación anual del fitoplancton en la bahía de Cartagena para 1980. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Cartagena. 69 p. [ Links ]
10 Balech, E. 1977. Introducción al fitoplancton marino. Universitaria, Buenos Aires. 194 p. [ Links ]
11 Balech, E. 1988. Los dinoflagelados del Atlántico sudoccidental. Publicaciones Especiales Instituto Español de Oceanografía. Ministerio de Agricultura, Pesca y Alimentación, Madrid. 310 p. [ Links ]
12 Barragán, R. G., F. Maldonado, S. Nieto y A. Franco-Herrera. 2003. Relación de la biomasa fitoplanctónica con la dinámica fisicoquímica y meteorológica de la capa de mezcla en la bahía de Gaira, Caribe colombiano, durante el período agosto-noviembre de 2003. Informe final, Seminario de investigación, Facultad de Biología Marina. Univ. de Bogotá Jorge Tadeo Lozano, Santa Marta. 57 p. [ Links ]
13 Bernal, A. R. 1994. Aspectos ecológicos de la comunidad de zooplancton nerítico en el departamento del Magdalena. Tesis de Maestría Biol., Univ. Nacional de Colombia, Santa Marta. 72 p. [ Links ]
14 Bianchi, T., C. Lambert y D. Biggs. 1995. Distribution of chlrophyll a and phaeopigments in the northwestern Gulf of México. A comparison between fluorometric and high performance liquid chromatography measurements. Bull. Mar. Sci., 56 (1): 25-32. [ Links ]
15 Blanco, J., J. Díaz, G. Ramírez y M. Cortés. 1994. El banco de las Ánimas: una amplia formación arrecifal desarrollada sobre un antiguo delta del río Magdalena. Bol. Ecotrópica., 27: 10-18. [ Links ]
16 Botes, L. 2003. Phytoplankton identification catalogue. Saldanha Bay, South Africa, April 2001. GloBallast Monograph. Series No. 7. IMO, Londres. 77 p. [ Links ]
17 Bruland, K., E. Rue y G. Smith. 2001. Iron and macronutrients in California coastal upwelling regimes: Implications for diatom blooms. Limnol. Oceanogr., 46 (7): 1661-1674. [ Links ]
18 Bula-Meyer, G. 1985. Un núcleo nuevo de surgencia en el Caribe colombiano detectado en correlación con las distribuciones de las algas. Bol. Ecotrópica, 12: 3-25. [ Links ]
19 Bula-Meyer, G. 1990. Oceanografía. 100-113. En: Jimeno, M. C. (Ed.). Caribe Colombia. Primera edición, Fondo FEN-Colombia, Folio Ltda., Bogotá. 271 p. [ Links ]
20 Cabrera, E. y M. Donoso. 1993. Estudio de las características oceanográficas del Caribe colombiano, Región III, Zona 1, PDCTM. Bol. Cient. Cent. Invest. Oceanogr. Hidrogr., 13: 19-32. [ Links ]
21 Caicedo, I. E. 1975. Productividad primaria y fitoplancton en la bahía de Neguange (Parque Nacional Natural Tayrona). An. Inst. Invest. Mar. Punta de Betín, 9: 7-14. [ Links ]
22 Calderón, E. 1986. Las diatomeas en el plancton de los esteros de la rada de Tumaco (Pacífico colombiano), con observaciones ecológicas y biogeográficas. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 206 p. [ Links ]
23 Campos, E. M. 2007. Fitoplancton de las islas de Providencia y Santa Catalina, Caribe colombiano. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 77 p. [ Links ]
24 Campos, E. M., J. Orejarena, M. Palomino y A. Franco-Herrera. 2004. Dinámica de la biomasa fitoplanctónica en la capa de mezcla y su relación con la oceanometeorología de la bahía de Gaira, Caribe colombiano. Fase II: Febrero-mayo de 2004. Informe final, Seminario de investigación, Facultad de Biología Marina, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 53 p. [ Links ]
25 Chretiennot-Dinet, S., A. Sournia, M. Ricard y C. Billard C. 1993. A classification of the marine phytoplankton of the world from class to genus. Phycologia, 32 (3): 159-179. [ Links ]
26 CIOH. 2008. Programa SARPAR: Sistema Automatizado de Recepción y Pronóstico del CIOH. http://www.sarpar.cioh.org.co/SARPAR/goes.php. 06/30/08. [ Links ]
27 Clarke, K. y M. Ainsworth. 1993. A method of linking multivariate community structure to environmental variables. Mar. Ecol. Prog. Ser., 92: 205-219. [ Links ]
28 Clarke, K. y R. Warwick. 1994. Changes in marine communities: An approach to statistical analysis and interpretation. Natural Environment Research Council, Londres. 144 p. [ Links ]
29 Clarke, K. y R. Warwick. 2001. Change in marine communities: An approach to statistical analysis and interpretation. Segunda edición. PRIMER-E Ltd., Plymouth, Reino Unido. 82 p. [ Links ]
30 Colorado, M. 2003. Valoración de las variables fisicoquímicas, biomasa fitoplanctónica y biomasa mesozooplanctónica en las aguas costeras del proyecto "Ciudadela Camaronera" en la media Guajira, Caribe colombiano en los meses de enero a mayo de 2002. Trabajo de grado Biol Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 149 p. [ Links ]
31 Corredor, J. E. 1979a. Phytoplankton response to low level nutrient enrichment through upwelling in the Colombian Caribbean basin, Deep Sea Res., Part A, 26: 731-741. [ Links ]
32 Corredor, J. 1979b. Aspects of phytoplankton dynamics in the Caribbean sea and adjacent regions. FAO Fisheries Report. Simposio sobre los adelantos en las investigaciones en el Caribe y regiones adyacentes, (200): 101-114. [ Links ]
33 Corredor, J. 1992. Dinámica espacio-temporal de la surgencia de La Guajira. 206-221. En: CCO (Ed.). Memorias VIII Seminario Nacional de Ciencias y Tecnologías del Mar. Comisión Colombiana de Oceanografía, Santa Marta. 1144 p. [ Links ]
34 Cupp, E. 1943. Marine plankton diatoms of the West coast of North America. Bull. Scripps Inst. of Oceanogr. Univ. California, La Joya, EE. UU. 238 p. [ Links ]
35 Díaz, J. M., L. M. Barrios, M. H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Serie de Publicaciones Especiales No. 5, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 176 p. [ Links ]
36 Donoso, M. 1990. Circulación de las aguas en el mar Caribe. 345-354. En: CCO (Ed). Memorias VII Seminario Nacional de Ciencias y Tecnologías del Mar. Comisión Colombiana de Oceanografía, Cali. 792 p. [ Links ]
37 Duarte, G. 1996. Estructura del fitoplancton al noroeste de La Guajira, durante el crucero Caribe 1-93. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 98 p. [ Links ]
38 Estrada, M. y D. Blasco. 1985. Phytoplankton assemblages in coastal upwelling areas. Simposio internacional sobre áreas de afloramiento en el oeste africano. Inst. Inv. Pesq., 1: 379-402. [ Links ]
39 Franco-Herrera, A. 2001. Estrategias de ingestión y flujo de carbono entre fitoplancton y Eucalanus spp. (Copepoda: Calanoidea) en dos ambientes oceanográficos del Caribe central colombiano. Informe final, Centro de Investigaciones Científicas, Facultad de Biología Marina, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 67 p. [ Links ]
40 Franco-Herrera, A. 2005. Una aproximación a la oceanografía de la ensenada de Gaira: El Rodadero, más allá que un centro turístico. Univ. Jorge Tadeo Lozano, Santa Marta. 58 p. [ Links ]
41 Franco-Herrera, A. 2006. Variación estacional del fitoplancton y mesozooplancton e impacto de herbivoría de Eucalanus subtenuis, Giesbrecht, 1888 (Copepoda: Eucalanidae) en el Caribe colombiano. Tesis de Doctorado Oceanogr., Univ. Concepción, Concepción, Chile. 209 p. [ Links ]
42 Franco-Herrera, A. y E. A. Torres-Sierra. 2006. La comunidad fitoplanctónica en el evento de surgencia frente al mar Caribe centro de Colombia. Actual. Divulg. Cient., 10 (1): 159-172. [ Links ]
43 Franco-Herrera, A., D. Avendaño, W. Bernal y M. Uribe. 1992. Contribución al conocimiento del plancton de Isla Tesoro, Parque Nacional Natural Corales del Rosario, Caribe colombiano. 754-762. En: CCO (Ed.). Memorias VIII Seminario Nacional de Ciencias y Tecnologías del Mar y I Congreso Centroamericano y del Caribe de Ciencias del Mar. Comisión Colombiana de Oceanografía, Santa Marta. 1144 p. [ Links ]
44 Franco-Herrera, A., L. Castro y P. C. Tigreros. 2006. Plankton dynamics in the South-Central Caribbean sea: Strong seasonal changes in a coastal tropical system. Caribb. J. Sci., 42 (1): 24-38. [ Links ]
45 García-Hoyos, L. M. 2008. Dinámica en el acoplamiento océano-atmósfera y su influencia en la biomasa fitoplanctónica durante un evento de surgencia y no surgencia en la zona costera del departamento del Magdalena. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 130 p. [ Links ]
46 Gocke, K., J. E. Mancera-Pineda, L. A. Vidal y D. Fonseca. 2003. Phytoplankton primary production and community respiration in several coastal lagoons of the outer Delta of the Río Magdalena, Colombia. Bol. Invest. Mar. Cost., 32: 125-144. [ Links ]
47 González, F., E. Zoppi de Roa y E. Montiel. 2006. Productividad primaria del fitoplancton en la bahía de Mochima, Venezuela. Invest. Mar., 34 (2): 37-45. [ Links ]
48 Google Earth. 2008. Beta 4.1. http://www.google.com. 05/05/08. [ Links ]
49 Gualteros, W., C. Hernández, A. Castillo y A. Fresneda. 1992. Clorofila y seston total en la laguna costera de Cocoliso, Isla Grande, Parque Nacional Natural Corales del Rosario. 512-521. En: CCO (Ed.). Memorias VIII Seminario Nacional de Ciencias y Tecnologías del Mar y Congreso Centroamericano y del Caribe de Ciencias del Mar, Santa Marta. 1144 p. [ Links ]
50 Guisande, C. 2006. Tratamiento de datos. Ediciones Díaz de Santos, Vigo. 336 p. [ Links ]
51 Hafner, G., G. Harris y M. Jarai. 1980. Physical variability and phytoplankton communities. III: Vertical structure in phytoplankton populations. Arch. Hydrobiol., 89 (3): 363-381. [ Links ]
52 Hernández-Camacho, J. 1998. Colombia: patria de tres mares. Expolisboa 98. Diego Samper Ediciones, Bogotá. 240 p. [ Links ]
53 Hernández, C. y K. Gocke. 1991. Productividad primaria de la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Inv. Mar. Punta de Betín, 19: 101-119. [ Links ]
54 IDEAM. 2008. Pronóstico de pleamares y bajamares costa Caribe colombiana. Informe técnico, Instituto de Hidrología, Meteorología y Estudios Ambientales-IDEAM. Bogotá. 123 p. [ Links ]
55 INVEMAR. 2003. Manual de técnicas analíticas para la determinación de parámetros fisicoquímicos y contaminantes marinos: aguas, sedimentos y organismos. Serie de Documentos Generales No. 13, Santa Marta. 177 p. [ Links ]
56 INVEMAR. 2004. Informe del estado de los ambientes marinos y costeros en Colombia. Serie de Publicaciones Periódicas No. 8, Santa Marta. 327 p. [ Links ]
57 Iriarte, J., R. Quiñones, R. González y C. Valenzuela. 2007. Relación entre actividad enzimática y biomasa de ensambles fitoplanctónicos en el sistema pelágico. Invest. Mar., 35 (1): 71-84. [ Links ]
58 Lalli, C. M. y T. R. Parsons. 1993. Biological oceanography: An introduction. Pergamon Press, Oxford. 301 p. [ Links ]
59 Lynch, J. M. y N. J. Poole. 1979. Microbial ecology: a conceptual approach. Blackwell Scientific Publications, Londres. 238 p. [ Links ]
60 Margalef, R. 1978. Phytoplankton communities in upwelling areas. The Example of NW Africa. Oecol. Aquat., 3: 97-132. [ Links ]
61 Margalef, R. 1985. Primary production in upwelling areas: energy, global ecology and resources. Simposio Internacional sobre Áreas de Afloramiento en el Oeste Africano. Ins. Inv. Pesq., 1: 225-232. [ Links ]
62 Margalef, R. 1991. Ecología. Editorial Planeta, Barcelona. 951 p. [ Links ]
63 Martínez, S. y A. Acosta. 2005. Cambio temporal en la estructura de la comunidad coralina del área de Santa Marta-Parque Nacional Natural Tayrona (Caribe colombiano). Bol. Invest. Mar. Cost., 34: 161-191. [ Links ]
64 Martínez-López, A. e I. Gárate. 1997. Variación diurna de la materia orgánica particulada en una laguna costera del golfo de California. Rev. Biol. Trop., (45): 1421-1428. [ Links ]
65 McConnaughey, B. 1974. Introducción a la biología marina. Editorial Acribia, Zaragoza. 445 p. [ Links ]
66 Mora, M. A. 1993. Contribución al conocimiento de los dinoflagelados de las zonas de sumergencia. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Cartagena. 41 p. [ Links ]
67 Moronta, R., R. Mora y E. Morales. 2006. Respuesta de la microalga Chlorella sorokiniana al pH, salinidad y temperatura en condiciones axénicas y no axénicas. Rev. Fac. Agron., 23: 27-41. [ Links ]
68 Müller, K. 1979. Interrelaciones entre salinidad y temperatura en la bahía de Santa Marta. Bol. Invest. Mar. Cost., 13: 219-226. [ Links ]
69 Ochoa, N. y J. Tarazona. 2003. Variabilidad temporal de pequeña escala en el fitoplancton de Bahía Independencia, Pisco, Perú. Rev. Per. Biol., 10 (1): 59-66. [ Links ]
70 Paramo, J. y R. Roa. 2003. Acoustic-geostatistical assessment and habitat-abundance relations of small pelagic fish from the Colombian Caribbean. Fish. Res., 60: 309-319. [ Links ]
71 Paramo, J. y J. Viaña. 2003. Evaluación hidroacústica del machuelo (Opisthonema oglinum) y la sardina (Sardinella aurita), en la zona norte del Caribe colombiano, durante julio-agosto y diciembre de 1997. Bol. Invest. Mar. Cost., 31: 32-52. [ Links ]
72 Paramo, J., R. A. Quiñones., A. Ramírez y R. Wiff. 2003. Relationship between biomass density of small pelagic and environmental factors in the Colombian Caribbean Sea: an analysis based on hydroacustic information. Aq. Liv. Res., 16 (3): 239-245. [ Links ]
73 Parra, O., M. González, V. Dellarossa, P. Rivera y M. Orellana. 1982. Manual taxonómico del fitoplancton de aguas continentales, con especial referencia al fitoplancton de Chile. Tomo I. al V. Univ. Concepción, Concepción, Chile. Vol. 1, Cyanophyceae, 1982; Vol. 2, Chrysophyceae- Xanthophyceae, 1982; Vol. 3, Cryptophyceae, Dinophyceae y Euglenophyceae, 1982 ; Vol. 4, Bacillariophyceae, 1982; Vol. 5 (partes 1 y 2), Chlorophyceae, 1983. [ Links ]
74 Philips, E. y S. Badylak. 1996. Spatial variability in phytoplankton standing crop and composition in shallow inner-shelf lagoon, Florida Bay. Bull. Mar. Sci., 58 (1): 203-216. [ Links ]
75 Pitcher, G. 1990. Phytoplankton see populations of the Cape Peninsula upwelling plume, with particular reference to resting spores of Chaetoceros (Bacillariophyceae) and their role in seeding upwelling waters. Est. Coast. Shelf. Sci., (31): 283-301. [ Links ]
76 Pizarro, G., V. Montecino, L. Guzmán, V. Muñoz, V. Chacón, H. Pacheco, M. Frangópulos, L. Retamal y C. Alarcón. 2005. Patrones locales recurrentes del fitoplancton en fiordos y canales Australes (43° - 56° S) en primavera y verano. Cienc. Tecnol. Mar., 28 (2): 63-83. [ Links ]
77 Pond, S. y G. Pickard. 1983. Introductory dynamical oceanography. Butterwotrh Heinemann, Oxford. 329 p. [ Links ]
78 Ramírez, G. 1983. Características fisicoquímicas de la bahía de Santa Marta. An. Inst. Inv. Mar. Punta de Betín., 3: 111-121. [ Links ]
79 Ramírez, G. 1987. Características hidrodinámicas y composición química de los sedimentos de la bahía de Neguanje, Caribe colombiano. An. Inst. Inv. Mar. Punta de Betín., 17: 15-26. [ Links ]
80 Ramírez, G. 1990. Distribución de los nutrientes inorgánicos en las aguas costeras de la región de Santa Marta, Caribe colombiano. 244-254. CCO (Ed.). Memorias VII Seminario Nacional de Ciencias y Tecnologías del Mar. Comisión Colombiana de Oceanografía (CCO). Cali 792 p. [ Links ]
81 Ramírez, A. 2005. Ecología aplicada. Diseño y análisis estadístico. Univ. Jorge Tadeo Lozano, Bogotá. 326 p. [ Links ]
82 Rodríguez, C. y R. Varela. 1987. Pigmentos clorofílicos e hidrografía en la región noroccidental de Venezuela con énfasis en el golfo de Venezuela. An. Inst. Inv. Mar. Punta de Betín, 17: 3-14. [ Links ]
83 Rodríguez-Ramírez, A. y J. Garzón-Ferreira. 2003. Monitoreo de arrecifes coralinos, pastos marinos y manglares en la bahía de Chengue (Caribe colombiano) 1993-1999. Serie de Publicaciones Especiales No. 8, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 170 p. [ Links ]
84 Rojas, B. y B. Estrada. 1976. El fitoplancton en el área de Pimentel. Verano de 1972. Inv. Pesq., 40 (2): 463-490. [ Links ]
85 Round, F., R. Crawford y D. Mann. 1990. The diatoms: Biology and morphology of the genera. Cambridge University Press, Londres. 747 p. [ Links ]
86 Ruiz, D. 1999. Variación cualitativa y cuantitativa del fitoplancton en ciénagas del delta exterior oriental del río Magdalena y su relación con la reapertura del Canal El Clarín. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 183 p. [ Links ]
87 Sakshaug, S., K. Andresen y A. Kiefer. 1989. A steady state description of growth and light absorption in the marine planktonic diatom Skeletonema costatum. Limnol. Oceanogr., 34 (1): 198-205. [ Links ]
88 Santander, E., L. Herrera y C. Merino. 2003. Fluctuación diaria del fitoplancton en la capa superficial del océano durante la primavera de 1997 en el norte de Chile (20°18'S): II. Composición específica y abundancia celular. Rev. Biol. Mar. Oceanogr., 38 (1): 13-25. [ Links ]
89 Serna, A. y F. Vallejo. 1996. Descripción de algunos parámetros fisicoquímicos de la bahía de El Rodadero, durante el período agosto a noviembre de 1996 (Santa Marta, Caribe colombiano). Informe final, Seminario de investigación, Facultad de Biología Marina, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 60 p. [ Links ]
90 Signoret, M. y H. Santoyo. 1980. Aspectos ecológicos del plancton de la bahía de La Paz, Baja California sur. Anal. Inst. Cien. Mar Limnol., 7: 217-247. [ Links ]
91 Suárez-Villalba, V., A. Franco-Herrera y M. L. Cañón. 2007. El microfitoplancton en los principales muelles de la bahía de Cartagena, Caribe colombiano, vectores posibles de floraciones microalgales. Bol. Cient. Cent. Invest. Oceanogr. Hidrogr., 25: 135-149. [ Links ]
92 Tigreros, P. 2001. Biodiversidad y valoración bioquímica del fitoplancton marino en ambientes costeros mesotróficos y oligotróficos tropicales, Caribe colombiano. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 173 p. [ Links ]
93 Tigreros, P. C., T. Vanegas, D. Vargas, S. Betancourt y J. Walteros. 1999. Evaluación de la composición especial de las larvas de las clases Stelleroidea y Echinoidea (Echinodermata), considerando algunas condiciones fisicoquímicas de la columna de agua en la bahía de Gaira, Caribe colombiano. Informe final, Seminario de investigación, Facultad de Biología Marina, Univ. Bogotá Jorge Tadeo Lozano. Santa Marta. 71 p. [ Links ]
94 Torres, A., F. Martínez, O. Duarte y R. Orozco. 1993. Caracterización del fitoplancton para el período comprendido entre los meses de agosto-septiembre de 1993 en bahía de Gayraca, Parque Nacional Natural Tayrona, Caribe colombiano. Informe final, Seminario de investigación, Facultad de Biología Marina, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 16 p. [ Links ]
95 USF. 2008. Institute for Marine Remote Sensing (IMARS). Sea surface temperature data. University of South Florida. http://www.imars.usf.edu.20/06/08. [ Links ]
96 Vásquez, D. 2006. Dinámica estructural de la comunidad fitoplanctónica en la bahía de Cispatá, asociada a la industria camaronera local. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 99 p. [ Links ]
97 Vidal, L. A. 1995. Estudio del fitoplancton en el sistema lagunar estuarino tropical Ciénaga Grande de Santa Marta, Colombia, durante el año 1987. Tesis de Maestría Biol. Univ. Nacional de Colombia, Santa Marta. 207 p. [ Links ]
98 Vidal, L. A. y M. C. Carbonell. 1977. Diatomeas y dinoflagelados de la bahía de Cartagena. Trabajo de grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 150 p. [ Links ]
99 Waite, A. 1996. Phytoplankton biodiversity: boxes, spheres, spirals, and sunbursts. Oceanus reports on research from de Woods Hole Oceanographic Institution, 39: 2-5. [ Links ]
100 Webber, D. F. y J. C. Roff. 1996. Influence of Kingston Harbor on the phytoplankton community of the nearshore coast, southeast Jamaica. Bull. Mar. Sci., 59 (2): 245-258. [ Links ]
101 Wetzel, R. 1981. Limnología. Editorial Omega, Barcelona. 679 p. [ Links ]
102 Zar, J. 1996. Biostatistical analysis. Tercera edición. Prentice Hall. Inc. Upper Saddle River, New Jersey. 718 p. [ Links ]
FECHA DE RECEPCIÓN: 30/04/2009 FECHA DE ACEPTACIÓN: 19/07/2010