Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.32 no.92 Medellín Jan./June 2010
ARTÍCULOS DE INVESTIGACIÓN
PROPAGACIÓN IN VITRO DE PAEONIA SP.
IN VITRO PROPAGATION OF PAEONIA SP.
Yarianne Lezcano1; Maritza Escalona2; Marcos Daquinta3
1 Laboratorio de Células y Cultivo Tejidos, Centro de Bioplantas, Universidad de Ciego de Ávila. CP: 69450, Cuba. Fax: 53-33 266340. ylezcano@bioplantas.cu.
2 Laboratorio de Células y Cultivo Tejidos, Centro de Bioplantas, Universidad de Ciego de Ávila. CP: 69450, Cuba. Fax: 53-33 266340. mescalona@bioplantas.cu.
3 Laboratorio de Células y Cultivo Tejidos, Centro de Bioplantas, Universidad de Ciego de Ávila. CP: 69450, Cuba. Fax: 53-33 266340. mdaquinta@bioplantas.cu.
Resumen
Las especies de Paeonia son consideradas como ornamentales perennes que se cultivan más en los países templados y fríos del hemisferio boreal. Con el objetivo de aumentar los coeficientes de multiplicación in vitro de esta especie de planta ornamental, se evaluaron en las variedades CoLo, Bartzella, GoBa y JuRo diferentes tipos de citoquininas (BA, Met y MetoxiMet) y concentraciones de citoquininas (0, 2,22, 4,44 y 6,66 μmol l-1), así como la influencia de la formulación salina (Lepoivre y MS modificado) y la exposición de los brotes a altas concentraciones de citoquininas (50 mg l-1 de BA + 50 mg l-1 de kinetina) en la proliferación de brotes de dichas variedades. En las variedades CoLo, Bartzella, GoBa y JuRo, el mejor comportamiento en la proliferación in vitro se logró con 6,66 μmol l-1 de BA. Por otra parte, se encontró influencia del genotipo (variedad) en la formación de raíces, en las respuestas a la composición del medio basal y altas concentraciones previas a la proliferación.
Palabras clave: citoquininas aromáticas, medio de cultivo, micropropagación, Paeonia
Abstract
The species of Paeonia are considered ornamental perennials that are cultivated more in temperate countries of the boreal hemisphere. With the aim of increasing the multiplication rate in vitro of this ornamental plant, different types of cytokinins (BA, Met y MetoxiMet) and concentrations of cytokinins (0, 2.22, 4.44, and 6.66 μmol l-1) were evaluated in the varieties CoLo, Bartzella, GoBa, and JuRo. The salt formulation (Lepoivre and MS modificate) and cytokinin pre-treatment (50 mg l-1 of BA + 50 mgl l-1 of Kinetin) were evaluated on shoot proliferation in each variety. In the CoLo, Bartzella, GoBa, and JuRo varieties, the best in vitro proliferation behavior was achieved with 6.66 μmol l-1 BA. On the other hand, an influence of genotype was found on root development, on responses to the composition of the culture medium and on the pulse response with higher concentrations of cytokinins.
Key words: aromatic cytokinins, culture medium, micropropagation, Paeonia
INTRODUCCIÓN
En las Ranunculaceae (Orden Ranunculales: Angiospermas) se encuentran numerosas especies ornamentales cultivadas en jardinería, y a menudo profundamente modificadas para su cultivo, encontrándose en esta familia los géneros: Anemone, Aquilegia, Clematisc, Delphinium, Nigella, Paeonia y Ranunculos. Otras especies son utilizadas con diversos propósitos, en medicina como revulsivas (Ranunculos sceleratus), insecticidas (Delphinum staphisagria), o por su importancia farmacológica de los principios activos que contienen, como ocurre con el aconito (Aconitum napellus) de los Alpes, Pirineos y otras montañas europeas, el adonis (Adonis vernalis) (Gola y Cappelletti, 1969).
Especies de Paeonia son consideradas como especies perennes de mayor importancia ornamental. Se propagan de manera vegetativa a través de la división del rizoma o de la corona de la planta. Por esta vía solo es posible obtener de tres a cinco clones por año (Hosoki et al. 1989) y la tasa de multiplicación es muy lenta para satisfacer las demandas de producción de cultivos populares así como la introducción de nuevas especies e híbridos.
Estas especies tienen dificultades para producir raíces adventicias. El injerto es uno de los métodos que mayormente se aplica a escala comercial para su propagación asexual. Las estacas pueden formar su propio sistema radical solo después de uno o dos años de haber sido injertadas sobre el rizoma de especies de Paeonia herbáceas (Bouza et al. 1994a).
Las técnicas de cultivo de tejidos como la formación de callos a partir de yemas florales y de embriones de semilla han sido implementadas sin éxito en la regeneración de plantas de Paeonia. Sin embargo, con el empleo de filamentos y pétalos como explantes se logró la propagación adventicia, a partir de la regeneración de callos después de ocho semanas en medios con thidiazuron (TDZ) (Beruto et al. 2004a). Es posible mediante el manejo de los reguladores del crecimiento (citoquininas) incrementar el coeficiente de multiplicación de especies de Paeonia en el cultivo in vitro.
El objetivo del presente trabajo fue evaluar diferentes condiciones químicas (reguladores del crecimiento y medios de cultivo) en la propagación in vitro de cuatro variedades de Paeonia.
MATERIALES Y MÉTODOS
Establecimiento del medio de cultivo para la multiplicación y enraizamiento de brotes. Se utilizaron las siguientes variedades de Paeonia: CoLo JuRo, GoBa y Bartzella. Los brotes se encontraban en la fase de multiplicación en el medio MS suplementado con 30 g l-1 sacarosa, vitaminas MS, 440 mg l-1 de CaCl2 (Beruto et al. 2004b) y los reguladores de crecimiento BA 2,22 μmol l-1 y GA3 1,44 μmol l-1. Los brotes provenían del tercer subcultivo.
Se evaluaron tres citoquininas: benciladenina (BA): N6-bencil adenina, la metatopolina (MET): N6-(3-hidroxybenzyl) adenina y la metametoximetatopolina (MetoxiMet): N6-(2-hidroxybenzyl) adenina a las siguientes concentraciones: 0,0, 2,22, 4,44 y 6,66 μmol l-1. El experimento contó con doce tratamientos cada uno con tres frascos y seis brotes en cada frasco de cultivo para un total de dieciocho repeticiones.
La capacidad del frasco de cultivo y el volumen de medio fue de 250 y 50 ml, respectivamente. Como agente gelificante se utilizó Gelrite a la concentración de 2,5 g l-1. Se inocularon seis brotes por frasco. Después de cinco semanas, se determinó el coeficiente de multiplicación. Las condiciones de cultivo fueron de 30 μmol.m-2.s-1 de flujo de fotones fotosintéticos, y un fotoperiodo de 16 h luz y 8 h de oscuridad.
El potencial de formación de raíces se evaluó utilizando de cada tratamiento nueve brotes mayores a 5 cm de longitud y un diámetro mayor a 0,5 cm. Se inocularon tres brotes por frasco y se emplearon tres frascos por tratamiento.
El procedimiento que se siguió para el enraizamiento consistió en sumergir los brotes por 30 minutos en una solución estéril de ácido indol butírico (AIB) a una concentración de 492,02 μmol l-1 (esta solución se prepara previamente con KOH y el pH se ajustó a 5,8). Luego se transfirieron a un medio semisólido (Gelrite 2,5 g l-1) con la siguiente composición basal del medio de cultivo: sales MS suplementado con 440 mg l-1 CaCl2 y 60 g l-1 de sacarosa (Beruto et al. 2004b). Posteriormente se cultivaron en la oscuridad durante dos semanas. Después de ese tiempo se transfirieron al cuarto de cultivo durante 45 días a 30 μmol.m-2.s-1 de flujo de fotones fotosintéticos, y un fotoperiodo de 16 h luz y 8 h de oscuridad.
Efecto del medio de cultivo en el coeficiente de multiplicación de los brotes de Paeonia. Con el propósito de evaluar la efectividad de las concentraciones de calcio del medio basal, así como el efecto de un pretratamiento de citoquinina a altas concentraciones (Madhulatha et al. 2004) en la capacidad de proliferación y calidad de los brotes de Paeonia se desarrolló este experimento. Se utilizaron las variedades CoLo, JuRo, GoBa y Bartzella.
La capacidad del frasco de cultivo y el volumen de medio fue el descrito en el experimento anterior. Se utilizó el Gelrite a una concentración de 2,5 g l-1. Se inocularon seis brotes provenientes del cuarto subcultivo por frasco. A las cinco semanas se determinó el coeficiente de multiplicación y variables morfológicas de calidad (número de hojas, longitud y diámetro).
Se estudió la composición de dos medios de cultivo: Lepoivre et al. (1977) donde la composición de los nitratos es la siguiente: 400 mg l-1 NH4NO3, 1.800 mg l-1 KNO3, 1.200 m l-1 Ca(NO3)2 y el medio de cultivo MS enriquecido con 440 mg l-1 CaCL2, es decir el doble del contenido de esta sal en el medio original (Beruto et al. 2004b). En las dos variantes de medios de cultivo se utilizó como fuente de carbono sacarosa a 30 g l-1 y las vitaminas MS. El segundo factor por evaluar fue el tratamiento previo de los brotes con pretratamiento de citoquinina. Este consistió en sumergir a los brotes en una solución o sin él compuesta por 50 mg l-1 BA y 50 mg l-1 Kin por 60 min (Madhulatha et al. 2004).
Para cada una de las variedades, se realizaron tres repeticiones, con seis brotes cada una. Las condiciones experimentales fueron las mismas que se describieron en el experimento anterior. Se empleó como medio de proliferación la mejor combinación hormonal que se determinó en el experimento anterior que para todas las variedades resultó ser la BA a 6,66 μmol l-1, más 1,44 μmol l-1 de GA3.
Análisis estadístico. Para el procesamiento estadístico de los datos se empleo el utilitario estadístico SPSS (versión 8.0 para Windows). Se hicieron análisis no paramétricos y en el experimento del enraizamiento in vitro se utilizó un análisis paramétrico. En este último, a cada variable se le realizó la prueba de homogeneidad de varianza y la prueba de normalidad (Kolmogornov-Smirnov). Se utilizó el análisis de varianza (ANOVA) y prueba de rangos múltiples de Tukey para valores de p ≤ 0,05. En los análisis no paramétricos se realizó el Kruskall-Wallis y la clasificación de medias por el método de Student-Newman-Keuls.
RESULTADOS Y DISCUSIÓN
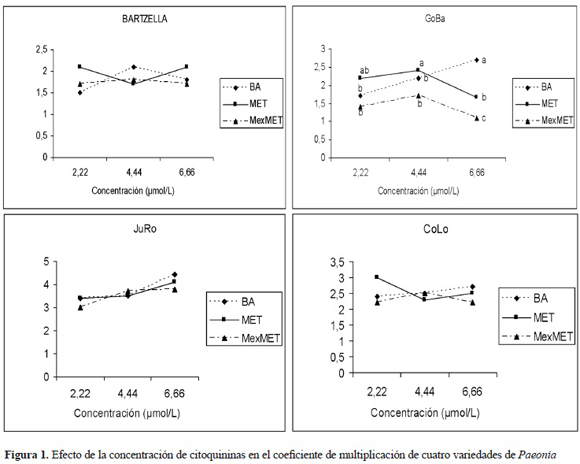
Efecto de las citoquininas en el coeficiente de multiplicación de cuatro variedades de Paeonia. Cuando se analizó el efecto de las citoquininas en la proliferación de las Paeonia se encontró que cada variedad respondió de manera diferente. La variedad JuRo presentó el coeficiente de multiplicación mayor (4,8) y sin diferencias estadísticas en la interacción de ambos factores. En esta variedad no se encontraron diferencias entre las citoquininas utilizadas. Sin embargo, el mayor coeficiente se logró a la concentración de 6,66 μmol l-1. Para la variedad CoLo, la mayor tasa de multiplicación (3,0) se logró con el tratamiento del MET a 2,22 μmol l-1. La variedad GoBa presentó mayor coeficiente de multiplicación al tratamiento con BA a la concentración de 6,66 μmol l-1. En esta variedad, la metoxi-metatopolina redujo significativamente esta variable a las concentraciones utilizadas. De todas las variedades, la Bartzella presentó la menor respuesta a la acción de las diferentes citoquininas (figura 1).
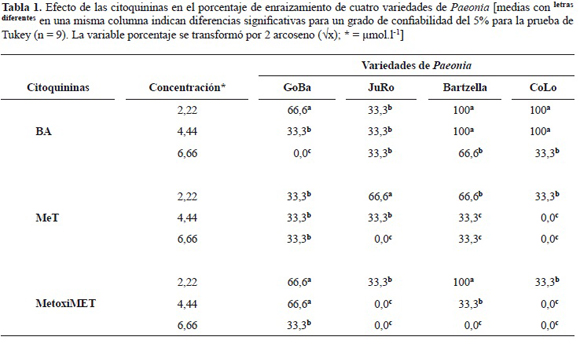
Al evaluar el efecto residual de las citoquininas sobre el enraizamiento de los brotes, la BA fue la que logró mayor porcentaje de enraizamiento en todas las variedades, a excepción de la JuRo que consiguió bajos porcentajes de enraizamiento (33,3%). Por lo general, los brotes que estuvieron expuestos a altas concentraciones de citoquininas presentaron bajos o nulos porcentajes de enraizamiento. De las cuatro variedades utilizadas, la CoLo y la Bartzella lograron el 100% de enraizamiento de los brotes cuando estos estuvieron expuestos a concentraciones de 2,22 y 4,44 μmol l-1 de BA. Los brotes expuestos a mT y Metoximet presentaron bajos porcentajes de enraizamiento (tabla 1).
Por lo general, la capacidad para la proliferación axilar en las Paeonia varía de acuerdo con el genotipo. Generalmente, la tasa de multiplicación ha sido reportada o hasta el momento solo se había alcanzado en un rango de dos y cinco brotes dependiendo del cultivar. Una correlación de tipo lineal se encontró entre el estado de desarrollo de la yema y su habilidad para iniciar el cultivo (Beruto et al. 2004b).
La ontogenia de los brotes de Paeonia durante el cultivo in vitro sugiere la formación de tres tipos de brotes: a) el brote principal, b) brotes axilares que se desarrollan a partir de la base y c) brotes adventicios que se estimulan también de la base del agregado. En general, la formación de agregados de yemas (axilares y adventicias) sobre un medio conteniendo citoquinina ha sido previamente descrito para este tipo de plantas. La eliminación del brote mayor reduce la dominancia apical y estimula el ulterior crecimiento y desarrollo de los brotes axilares y adventicios que emergen de la base. Un aumento en la presencia de brotes adventicios se ha logrado a partir de un tercer subcultivo en medio semisólido (Harris y Mantell 1991).
La presencia de brotes hiperhídricos, fenoles en los tejidos y el desarrollo de callo en la base del agregado que evita el ulterior desarrollo de la yema, es característico de cada variedad. En variedades como GoBa el aumento en la concentración de BA fue favorable en la proliferación axilar de brotes sin provocar aumento en la hiperhidricidad de estos. Bartzella presentó alto grado de fenolización en la base del agregado, mientras que la JuRo y la CoLo tuvieron mayor nivel de respuesta a la acción de las citoquininas.
De las citoquininas que se evaluaron, BA fue la que logró inducir mayor tasa de multiplicación de los brotes. Estos resultados están en correspondencia con los informados en la literatura donde se emplea la BA a 4,44 μmol l-1 como la concentración más adecuada para la proliferación de las Paeonia en el medio de cultivo semisólido.
La tasa de multiplicación que se obtuvo para las diferentes variedades está en correspondencia con la ya informada para otras especies de Paeonia la cual oscila entre 2,5 y 3,5. Harris y Mantell (1991) sugieren que esta tasa de multiplicación es adecuada para la propagación comercial de esta especie. Beruto et al. (2004b) informaron que la tasa de multiplicación, la frecuencia de necrosis y la hiperhidricidad de los brotes son dependientes del cultivar y la tasa de multiplicación decrece en función del número de subcultivos, lo cual es un importante factor para tener en cuenta para programar una producción comercial. Sin embargo, la evaluación de la efectividad de la técnica de inmersión temporal en estas variedades podría incrementar la tasa de multiplicación y hacer más eficiente el proceso de micropropagación. Este aspecto será abordado en futuras investigaciones.
El porcentaje de brotes enraizados fue dependiente del tratamiento con citoquininas durante la fase previa de proliferación. Aquellos que estuvieron expuestos a altas concentraciones de citoquininas presentaron menores porcentajes de emisión de raíces. Bouza et al. (1994a) señalaron que el ciclo de subcultivos en presencia de citoquininas puede afectar el enrizamiento de los brotes y que a medida que aumenta el número de subcultivos se incrementa la presencia de brotes adventicios.
Es bien conocido que la capacidad y el proceso de formación de raíces de los explantes cultivados in vitro depende de los contenidos endógenos de auxinas y citoquininas (Georges 1993). En un estudio combinado de HPLC-ELISA para evaluar la capacidad de enraizamiento de brotes de Paeonia propagadas in vitro, se comprobó que la capacidad de enraizamiento de los brotes fue favorecida por una acumulación de AIA endógeno, la cual ocurre sólo cuando el contenido de BA del medio de proliferación era menor. Los brotes principales a partir de cinco semanas de proliferación lograban este balance hormonal y fueron los de mejor enraizamiento con un 87%, mientras que los brotes provenientes de ciclos más cortos siempre contenían altos niveles de citoquininas y la capacidad de enraizamiento estuvo entre 25 y 55% (Bouza et al. 1994 a).
En el proceso de enraizamiento de las cuatro variedades de Paeonia se encontraron dos tipos diferentes de raíces, una prominente y potente que emerge de la base del brote con buenas características para la reserva de nutrientes y otras de tipo más débiles que no parecen emerger de la base del brote, sino que el proceso se asemeja a una rizogénesis a partir del callo que se forma en la base del brote. Las raíces del primer tipo se presentaron con mayor frecuencia en los brotes expuestos a bajas concentraciones de BA.
El enraizamiento in vitro y la aclimatización ex vitro de las Paeonia han sido también correlacionados con una detención del desarrollo del brote. Un tratamiento a bajas temperaturas previo a la aclimatización es necesario para lograr la actividad funcional de las raíces. Durante el proceso de inducción del enraizamiento, la actividad de las células meristemáticas se incrementan debido a la supresión de la BA y a la adición de auxina en el medio de cultivo (Beruto et al. 2004b). Para explicar este hecho dos hipótesis han sido propuestas.
La primera hipótesis sugiere que el contenido endógeno de citoquininas no es el suficiente para el desarrollo autónomo y podría considerarse una inhibición del crecimiento. Esta se corresponde con el hecho de que las vitroplantas se desarrollan otra vez normalmente cuando se cultivan in vitro sobre un medio de multiplicación el cual contiene citoquininas. La segunda hipótesis apunta que un estado dormante se induce por la acumulación de ABA (Bouza et al. 1994b).
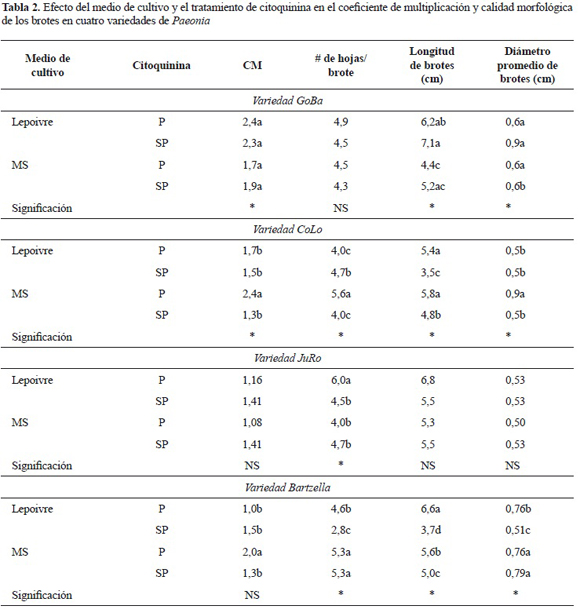
Efecto del medio de cultivo en el coeficiente de multiplicación y calidad morfológica de los brotes de cuatro variedades de Paeonia. En la tabla 2 se muestra el efecto de la interacción del medio de cultivo y el pretratamiento con citoquinina en el coeficiente de multiplicación y calidad de los brotes de cuatro variedades de Paeonia después de cinco semanas de proliferación. En la variedad GoBa, el medio de cultivo de Lepoivre (1977) aumentó el coeficiente de multiplicación de forma independiente al pretratamiento con citoquininas. No se encontraron diferencias significativas en el número de hojas por brote, mientras que los brotes de mayor longitud se presentaron en el medio de Lepoivre sin la influencia del pretratamiento de citoquininas. Los brotes de mayor diámetro igualmente se lograron en este medio basal sin pretratamiento de citoquininas.
En las variedades Colo y Bartzella, el empleo del medio MS (1962) con el pretratamiento de citoquininas incrementó significativamente el coeficiente de multiplicación así como el número de hojas/brote, longitud y el diámetro de los brotes. En JuRo, no se encontraron diferencias estadísticas entre los coeficiente de multiplicación, ni para los indicadores de calidad evaluados. Solo en los brotes con un pretratamiento de citoquininas y establecidos en el medio de Lepoivre presentaron un aumento significativo del número de hojas.
La principal diferencia de la composición entre el medio de Lepoivre (1977) y el medio MS (1962) modificado se basa en la concentración de los nitratos y amonio así como el calcio. Al comparar la concentración de estos iones, se observa que la concentración de nitrato de amonio se reduce a la cuarta parte, en el medio de Lepoivre y la concentración del nitrato de potasio es menor en el medio de Lepoivre y el calcio se incrementa 1,5 veces. En este medio de cultivo, el calcio se suministra como nitrato de calcio, mientras que en el medio MS el calcio se adiciona como cloruro de calcio.
La adición del calcio se recomienda en el cultivo in vitro de las Paeonia. Orlikowska et al. (1998) utilizaron el medio MS suplementado con doble cantidad de cloruro de calcio y sulfato de magnesio para la regeneración de brotes a partir de la base de los pecíolos y pétalos de Paeonia mlokosewitschii y P. tenuifolia.
En la estimulación de yemas axilares de dieciséis variedades de Paeonia se utilizó el medio WPM (Lloyd y McCown 1980) con doble concentración de iones calcio (6 mM). La propagación se realizó por la división de los brotes axilares cada ocho semanas, la tasa de multiplicación y la calidad de los brotes se evaluó por un año en el mismo medio de cultivo (Beruto et al. 2004b).
En el estudio de diferentes tratamientos hormonales durante la multiplicación in vitro de la variedad de Paeonia ''Mme de Vatry'' se utilizó el medio MS con doble concentración de calcio y 4,44 μmol l-1 de BA (Bouza et al. 1994a).
Como uno de los principales cationes, el calcio ayuda al balance de aniones dentro de la planta. A consecuencia de su capacidad para unirse a moléculas biológicas, este elemento está involucrado en la estructura y propiedades biológicas de las membranas y de la capa media lamelal de la pared celular. La enzima β- (1-3) glucan sintetasa depende para su actividad de los iones calcio y la síntesis de celulosa por la célula no ocurre al menos que existan cantidades micromolares de este ión en el medio de cultivo. Algunas otras enzimas son calcio dependientes y este actúa como cofactor en las enzimas responsable para la hidrólisis del ATP (Salisbury y Ross 1992).
Aunque las concentraciones de calcio puedan estar presentes en el rango de milimolares dentro de la célula de las plantas, los iones calcio son bombeados fuera del citoplasma celular para mantener la concentración alrededor de 0,1 μM. Este removimiento activo de los iones calcio a partir del protoplasma es necesario para prevenir la precipitación de iones fosfato e interferir con la función del magnesio (George 1993).
Los iones calcio están involucrados en la morfogénesis in vitro y es requerido para algunas de las respuestas inducidas por los reguladores de crecimiento de las plantas, particularmente las auxinas y las citoquininas. La formación de protocormos a partir de callos de Dendrobium fibriatum fue pobre cuando el calcio se suprimió del medio de cultivo. También en segmentos de tallos de Torenia la formación de yemas adventicias inducida por las citoquininas parece estar mediada, por un incremento en los niveles de calcio dentro de la célula (George 1993).
A partir de estos resultados se demuestra la función del calcio en la expresión de la morfogénesis in vitro. Para el caso específico de las Paeonia un incremento en la concentración de este ión puede ser necesario para aumentar la capacidad morfogenética de los brotes a través de la acción de citoquininas. Está bien establecido que los explantes de las Paeonia durante el cultivo in vitro decrecen su capacidad para regular el metabolismo auxina-citoquinina. La falta de estas hormonas durante un periodo cuando los brotes están en completo desarrollo causan estrés, el cual podría resultar en un aumento en la acumulación de ABA y la subsiguiente inducción de la dormancia (Bouza et al. 1994a). En los mecanismos de acción hormonal en las plantas está bien establecido el papel del calcio como mensajero secundario cuando se une con la proteína calmodulin (George 1993).
De allí que el aumento en la concentración de este ión en el medio de cultivo para la proliferación de las Paeonia podría potenciar la acción de las citoquininas en la formación de brotes. Esta respuesta fue genotipo dependiente y solo en la variedad GoBa se logró el incremento en el coeficiente de multiplicación en el medio de cultivo Lepoivre, rico en calcio, independientemente del pretratamiento o no de citoquininas. En las variedades Bartzella y CoLo una mejor respuesta en la proliferación de los brotes se logró en el medio MS con doble concentración de calcio, lo cual evidencia que para estas plantas además de altas concentraciones de nitrógeno como iones amonio parece ser favorable.
El análisis de ápices necróticos ha demostrado estar asociado con deficiencia de iones calcio en los mismos (Debergh 1988). Debido a que el calcio no es removilizado dentro del tejido de las plantas, los brotes en crecimiento activo necesitan un constante suministro fresco de iones en la corriente de la transpiración. Un inadecuado suministro de calcio puede ser el resultado de una limitada asimilación del ión por la planta o un transporte inadecuado a través de los tejidos de la misma. Este último causado por la ausencia de transpiración debido a la alta humedad relativa en el vaso del cultivo. Esto puede ser remediado por una reducción de la temperatura o utilizando vasos de cultivo los cuales promuevan un mejor intercambio gaseoso o el aumento en las concentraciones de calcio en el medio de cultivo.
La toxicidad por cloro puede presentarse cuando se adiciona cloruro de calcio al medio de cultivo. Para evitar esta dificultad la adición de 6 mM de gluconato de calcio al medio WPM es recomendable (George 1993). Por esta razón para aumentar la concentración de calcio a 1.200 mg/l para la proliferación de las Paeonia se empleó el nitrato de calcio.
En las variedades de Paeonia que se ensayaron, el efecto del pretratamiento con citoquininas fue también genotipo dependiente y presentó efecto favorable en el coeficiente de multiplicación en las variedades CoLo y Bartzella con el uso del medio de cultivo MS modificado.
Se reconoce que uno de las principales factores que incide en la baja capacidad de proliferación de las Paeonia son los altos contenidos endógenos de ABA que provocan el estado dormante de los brotes. Un tratamiento de los brotes al frío al final del subcultivo incrementa la multiplicación (Albers y Kunneman 1992). Durante el cultivo in vitro de las plantas de Paeonia la capacidad de los brotes para regular el balance auxina-citoquininas decrece (Bouza et al. 1994b). Por ello el empleo de pretratamientos con citoquininas podría constituir una práctica para mantener el coeficiente de multiplicación y evitar la exposición continuada de los brotes a altas concentraciones de BA.
REFERENCIAS
1. Beruto M, Debergh P. 2004a. Micropopagation of Ranunculus asiaticus: a review and perspectives. Plant Cell, Tissue and Organ Culture, 77: 221-230. [ Links ]
2. Beruto M, Portogallo C. 2004b. Micropropagation of tree peony (Paeonia suffruticosa). Plant Cell, Tissue and Organ Culture, 79: 249-255. [ Links ]
3. Bouza L, Jacques M, Sotta B, Miginiac E. 1994a. Relations between auxin and cytokinin contents and in vitro rooting of tree Peony (Paeonia suffruticosa Andr.) Plant Growth Regulation, 15: 69-73. [ Links ]
4. Bouza L, Jacques M, Miginiac E. 1994b. In vitro propagation of Paeonia suffruticosa (Andr. cv Mme de Vatry) developmental effects of exogenous hormones during the multiplication phase. Science Horticulturae, 58: 223-233. [ Links ]
5. Debergh P, Harbaooui Y, Lemeur R. 1988. Mass propagation of globe artichoke (Cynara scolymus) evaluation of different hypotheses to overcome vitrification with special reference to water potential. Physiologia Plantarum, 53: 181-187. [ Links ]
6. George EF. 1993. Plan propagation by tissue culture. Part 1. The Technology. 2nd edition. London: Exegetics Limited. p. 555. [ Links ]
7. Gola G, Cappelletti C. 1969. Tratado de Botánica. La Habana (Cuba): Ed. Revolucionaria. p. 933. [ Links ]
8. Harris RA, Mantell SH. 1991. Effects of stage II duration on the multiplication rate and rooting capacity of micropropagated shoots of tree peony (Paeonia suffruticosa Andr.). Journal Horticultural Science, 66: 95-102. [ Links ]
9. Hosoki T, Ando M, Kubara T, Hamada M, Itami M. 1989. In vitro propagation of herbaceous peony (Paeonia lactiflora Pall.) by a longitudinal shoot-split method. Plant Cell Reports, 8: 243-246. [ Links ]
10. Lepoivre M, Quoirin M, Boxus PH. 1977. Un premier bilan de 10 années de recherches sur les cultures de meristémes et la multiplication in vitro de frutiers ligneux. Compte rendu de recherches 1976-1977. Station de cultures fruitiéres et maraicheres. Belgium: Gembloux. p. 117. [ Links ]
11. Lloyd G, McCown B. 1980. Commercially-feasible micropropagation of mountain laurel, Kalima latifolia, by use of shoot tip culture. Proceeding International Plant Propagation Society, 30: 421-427. [ Links ]
12. Madhulatha P, Anbalagan M, Jayachandran S, Sakthivel N. 2004. Influence of liquid pulse treatment with growth regulators on in vitro propagation of banana (Musa ssp. AAA). Plant Cell, Tissue and Organ Culture, 76: 189-191. [ Links ]
13. Orlikowska T, Marasek A, Kucharska D. 1998. Regeneration of Paeonia mlokosewitschii Lom. and P. tenuifolia L. in vitro from different explants. Acta Societatis Botanicorum Poloniae, 67 (3-4): 223-227. [ Links ]
14. Salisbury FB, Ross CW. 1992. Fisiología vegetal. México: Grupo Editorial Iberoamérica. p. 759. [ Links ]
Recibido: noviembre 2009;
aceptado: abril 2010.




![EFFECT OF ELECTRIC FIELDS ON BIOMASS PRODUCTION OF THE MEDICINAL FUNGUS GANODERMA LUCIDUM [(W. CURT.: FR.) P. KARST. (GANODERMATACEAE)]](/img/en/prev.gif)