Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Caldasia
Print version ISSN 0366-5232On-line version ISSN 2357-3759
Caldasia vol.31 no.1 Bogotá Jan./June 2009
Poblational and ecological aspects of demersal fishes in north zone of Colombian Caribbean in relationship with habitat: a tool for identify marine protected areas (mpas) to fisheries management
JORGE PARAMO
LIA GUILLOT-ILLIDGE
SEIDY BENAVIDES
ALFREDO RODRÍGUEZ
CLAUDIA SÁNCHEZ-RAMÍREZ
Grupo de Investigación Ciencia y Tecnología Pesquera Tropical (CITEPT), Universidad del Magdalena; Cra. 32 No. 22-08, Avenida del Ferrocarril, Santa Marta, Colombia, jparamog@yahoo.com, citept@unimagdalena.edu.co
Zentrum für Marine Tropenökologie (ZMT), Universität Bremen, Fahrenheit Strasse 6, Bremen, Alemania. jorge.paramo@zmt-bremen.de
Grupo de Investigación Ciencia y Tecnología Pesquera Tropical (CITEPT), Universidad del Magdalena; Cra. 32 No. 22-08, Avenida del Ferrocarril, Santa Marta, Colombia. lguillotillidge@gmail.com; cheyo29@yahoo.com.mx
Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta Betin, Apartado 1016, Santa Marta.
Grupo de Investigación Ciencia y Tecnología Pesquera Tropical (CITEPT), Universidad del Magdalena; Cra. 32 No. 22-08, Avenida del Ferrocarril, Santa Marta, Colombia, alfreingeniero@yahoo.com.mx; csanchez661@hotmail.com
RESUMEN
Las pesquerías marino-costeras están bajo amenaza de colapso debido al incremento del esfuerzo pesquero y los impactos antropogénicos que directa e indirectamente degradan el hábitat y los sistemas ecológicos de los cuales depende la actividad pesquera. La pesca acompañante (bycatch) y los descartes globales equivalen a un tercio (1/3) de la biomasa total desembarcada. Particularmente, el bycatch de la pesca de arrastre de camarón en aguas tropicales representa el 27 % de todos los descartes globales, lo cual para el manejo de las pesquerías es un serio problema ecológico. Por lo tanto, hay una necesidad de medidas de manejo adicionales a las usadas tradicionalmente, que contribuyan a proteger los recursos pesqueros y mejorar la producción pesquera. Las Áreas Marinas Protegidas (AMPs) han emergido como una herramienta para la conservación marina y el manejo de pesquerías. El propósito del trabajo es identificar potenciales AMPs para el manejo de los recursos pesqueros demersales mediante un análisis de la relación entre la distribución espacial de aspectos poblacionales y ecológicos de estos recursos en la zona norte del Caribe colombiano con las características del hábitat (temperatura, salinidad, profundidad, tipo de sedimento). Se estableció la relación de la estructura poblacional de los peces demersales con las condiciones del hábitat, que resultó importante cuando se quiere identificar AMPs como una herramienta de manejo pesquero sostenible bajo un enfoque ecosistémico. Mediante modelación espacial se calculó el área de distribución espacial de los peces demersales (5805.8 km2) y de ésta, los juveniles se encontraron entre Dibulla y el Río Buritaca en un área de 393.1 km2 y en La Guajira se encontró el área de mayor diversidad 297.0 km2, las cuales representan un 11.9 % del área de distribución espacial de los peces demersales. Se plantea la implementación de Áreas Marinas Protegidas de Múltiples Usos (AMP-MU) en estos sectores, es decir, hacer uso limitado de los recursos pesqueros con un sistema de manejo sostenible con la participación activa de los pescadores.
Palabras clave. Áreas Marinas Protegidas, manejo pesquero, peces demersales, ecología, Caribe colombiano.
ABSTRACT
The coastal marine fisheries are threatened with collapse due to the increase of the fishing effort and the anthropogenic impacts that directly and indirectly degrade the habitat and the ecological systems of which the fishing activity depends. The bycatch and discard are equal to one third (1/3) of the total landings of biomass. Particularly, the bycatch of the shrimp trawl fishery in tropical waters represents 27% of global discard, which is a serious ecological problem for fisheries management. Therefore, there is a necessity of additional fisheries management measures to those used traditionally that contribute to protect the fishing resources and to improve fishing production. The Marine Protected Areas (MPAs) have emerged as a tool for marine conservation and fisheries management. The purpose of this work is to identify potentials MPAs for the fisheries management of the demersal resources by means of an analysis of the relationship among the spatial distribution of population and ecological aspects of these resources in the northern area of the Colombian Caribbean Sea with the habitat characteristics (temperature, salinity, depth, sediment type). The relationship of population structure of demersals fishes with the habitat conditions was established, which are important when we want to identify MPAs as a tool of sustainable fisheries management under an ecosystem approach. By means of spatial modelization, the area of spatial distribution of demersal fishes was calculated (5805.8 km2) and of this, the juveniles were located between Dibulla and the Buritaca river in an area of 393.1 km2 and the area of most diversity (297.0 km2) was located in La Guajira region, which each represent 11.9% of the spatial distribution of the demersal fishes. We advise for the implementation of Multiple Use -Marine Protected Areas (MU-MPA) in these sectors, that is to say, to make limited use of the fishing resources with a system of sustainable management with the active participation of the fishersmen.
Key words. Marine Protected Areas, fisheries management, demersal fishes, ecology, Colombian Caribbean Sea..
INTRODUCCIÓN
La gran cantidad de poblaciones de peces e invertebrados sobreexplotadas, así como los efectos indirectos de las pesquerías sobre los ecosistemas marinos, indican que el manejo de las pesquerías en buena parte del mundo ha fracasado en alcanzar su objetivo principal, la sustentabilidad. Este fracaso se debe principalmente al continuo incremento en las tasas de captura como respuesta a la incesante presión socio-política para obtener grandes capturas en el corto plazo y a la intrínseca incertidumbre científica y de manejo de los sistemas pesqueros (Ludwig et al. 1993, Caddy & Mahon 1996, Botsford et al. 1997, Weeks & Parker 2002, Pauly et al. 2003). Las pesquerías marinas costeras mundiales están bajo amenaza de colapso, debido al incremento del esfuerzo pesquero, aún cuando las tasas de captura de peces permanecen estables o disminuyen y a otros impactos antropogénicos y ambientales que degradan directa e indirectamente el hábitat y los sistemas ecológicos de los cuales dependen las pesquerías (Pauly et al. 2002, Sale et al. 2005, Worm et al. 2006). Adicionalmente, la pesca acompañante (bycatch) y los descartes globales equivalen a un tercio (1/3) de la biomasa total desembarcada (Alverson et al. 1994) y al 27% de la pesca de arrastre de camarón en aguas tropicales (Eayrs 2005), lo cual tiene serias implicaciones ecológicas (Murray et al. 1999).
La pérdida de la biodiversidad marina está disminuyendo la capacidad de los océanos para proveer alimento, mantener la calidad del agua y recuperarse de perturbaciones (Worm et al. 2006, Stokstad 2006). Debido a que se estima que con las actuales medidas de manejo todas las pesquerías del mundo habrán colapsado en 50 años (Worm et al. 2006), se ha sugerido incluir la ecología de los océanos y el ciclo de vida de las especies, bajo un enfoque ecosistémico para el manejo de las pesquerías (EEMP) (Cury & Christensen 2005, Cury et al. 2005a, Cury et al. 2005b, García & Cochrane 2005). Las Áreas Marinas Protegidas (AMPs) son una de estas aproximaciones de manejo que han mostrado su utilidad al propiciar un incremento en la diversidad de especies, que están asociadas con el aumento en la productividad de las pesquerías (Johnson et al. 1999, Bohnsack 2000). Como ejemplo, se ha visto que en áreas de pesca alrededor de las AMPs, hay un incremento de cuatro veces la captura por unidad de esfuerzo (Worm et al. 2006).
La mayoría de las pesquerías costeras en el Caribe colombiano, se encuentran en sus niveles máximos de explotación o sobre-explotadas. Además, como ocurre en muchos mares tropicales del mundo (García 1989), las pesquerías demersales en Colombia son multiespecíficas, lo que significa que ejercen alta intensidad de explotación sobre un rango amplio de especies y tallas, ocasionando que los recursos presenten signos de sobreexplotación. La actividad pesquera artesanal se realiza principalmente sobre peces demersales, generando una gran cantidad de empleos directos e indirectos. Sin embargo, los peces demersales (e.g. pargos) que son las principales especies capturadas por los pescadores artesanales, también se capturan como pesca acompañante por los barcos arrastreros, cuya pesca objetivo son los camarones. Medidas de manejo tales como límites de talla mínima de captura son insuficientes, particularmente en pesquerías tropicales multiespecíficas, ya que los peces bajo la talla mínima se siguen capturando como pesca acompañante en la pesquería de arrastre. Esto hace un conflicto de uso entre las dos pesquerías, ya que la actividad pesquera de arrastre de la pesca industrial probablemente está influyendo en la disminución de las capturas en la pesca artesanal y en la utilización de las zonas de pesca que les corresponde a los pescadores artesanales e industriales.
El propósito del trabajo es identificar potenciales AMPs para el manejo de los recursos pesqueros demersales mediante un análisis de la relación entre la distribución espacial de aspectos poblacionales (estructura de tallas, abundancia, distribución espacial) y ecológicos (diversidad, ensamblaje) de estos recursos en la zona norte del Caribe colombiano con las características del hábitat (temperatura, salinidad, profundidad, tipo de sedimento).
MATERIALES Y METODOS
Área de estudio
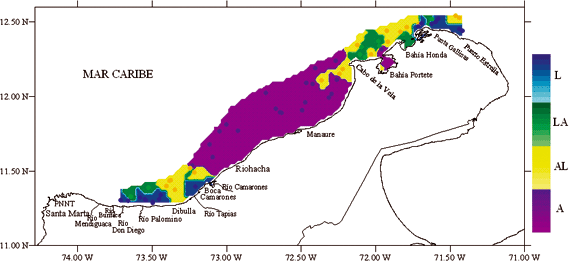
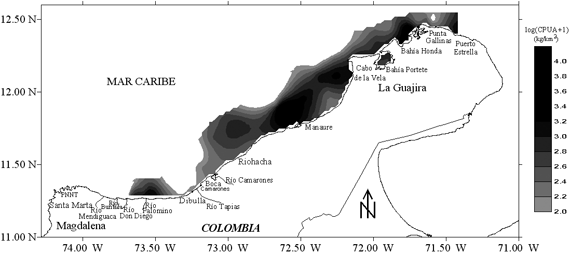
El área de estudio comprendió la zona norte del Caribe colombiano, desde Santa Marta (11º19'54''; 74º17'00'') hasta Puerto Estrella (12º23'00''; 71º22'30''), hasta el veril de los 100 m de profundidad (Figura 1). Al norte de la Península de La Guajira la plataforma continental es muy estrecha, con profundidades de 200 metros (m) a unas 10 millas náuticas (mn) de la costa y frente a Punta Gallinas a solo unas 3 mn. Hacia el oeste, desde el Cabo de la Vela la plataforma se ensancha y alcanza un máximo de unas 25 mn frente a Riohacha, luego en inmediaciones del Río Palomino vuelve a reducirse y prácticamente desaparece en el sector del Parque Nacional Natural Tayrona (PNNT) y Santa Marta (Anon 1989, Quintero 1992, Álvarez-León et al. 1995). La zona norte del Caribe colombiano está dividida en tres ecoregiones: Tayrona (acantilados, bahías y ensenadas, surgencia estacional, mosaicos coralinos); Palomino (playas de arenas, ríos, manglares y pastos marinos) y Guajira (área influenciada por la surgencia, elevada productividad primaria, fanerógamas y algas) (Díaz-Pulido 1997, INVEMAR 2000).
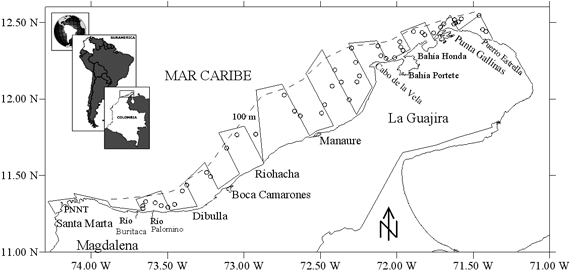
La región del Caribe colombiano está influenciada por la circulación atmosférica de los vientos alisios, tributarios de los centros anticiclónicos del Atlántico nororiental (Pujos et al. 1986, Andrade et al. 2003). El régimen climático esta bajo la influencia de los desplazamientos norte-sur de la Zona de Convergencia Intertropical (ZCIT). Cuando la ZCIT se encuentra más hacia el sur (estación seca), las altas presiones hacen que los alisios soplen del noreste de manera constante y fuerte (Pujos et al. 1986). La zona norte del Caribe colombiano (desde La Guajira hasta Santa Marta) está modulada directamente por la corriente Caribe y por la surgencia estacional de aguas profundas que están presentes durante las estaciones secas, cuando los vientos alisios están en plena actividad (verano mayor: mediados de diciembre-abril; verano menor: julio mediados de agosto). En las estaciones húmedas (invierno menor: mayo-junio; invierno mayor: septiembre-noviembre) se percibe la contracorriente que llega incluso hasta el Cabo de la Vela en La Guajira (Bula-Meyer 1990, Andrade et al. 2003).
Diseño del muestreo
El crucero se realizó durante la época seca, desde el 6 hasta el 16 de febrero de 2006, a bordo del B/I ANCON empleando una ecosonda científica SIMRAD EY 500 para identificar las zonas de arrastre, una red de arrastre demersal para muestras biológicas, un CTD SEABIRD SBE19 para la obtención de datos oceanográficos (temperatura y salinidad) y una draga Van Veen para la recolección de muestras de sedimentos. Para estas últimas muestras se obtuvieron los valores de PHI (-2 a -1: gránulos; -1 a 0: arenas muy gruesas; 0 a 1: arenas gruesas; 1 a 2: arenas medianas; 2 a 3: arenas finas; 3 a 4: arenas muy finas; >4: lodos) (Buchanan 1984, para mayor explicación en análisis de sedimentos ver: Benavides 2007).
Los muestreos se realizaron sobre fondos arrastrables y dos estratos de profundidades: <50 m y 50-100 m. El diseño del crucero correspondió a un muestreo sistemático, con transectos paralelos y perpendiculares a la costa, espaciados regularmente cada 10 mn (Figura 1). Sin embargo, los sitios de muestreo se realizaron considerando sólo las áreas arrastrables, lo cual involucró algo de aleatoriedad en la toma de las muestras. La duración de cada arrastre fue de 15 minutos (Folmer & Pennington 2000), con una velocidad promedio de 3 nudos.
Análisis espacial
Los peces tienden a estar organizados en estructuras en forma de agregaciones, de ahí que su distribución en el espacio o el tiempo no es al azar (Maravelias et al., 1996), sino que están bien organizados de acuerdo a factores físicos, químicos y biológicos que controlan su actividad, tal como la alimentación, evitar la predación, migración, reproducción y selección del hábitat (Simard et al., 1993). La geoestadística da a la ecología una novedosa herramienta para la interpretación de los patrones espaciales de los organismos, de los numerosos componentes ambientales con los cuales estos interactúan, y la conexión de dependencia espacial entre organismos y su ambiente (Rossi et al 1992, Rivoirard et al. 2000). Por lo tanto, se realizó un análisis geostadístico (Cressie 1993, Petitgas 1996, Rivoirard et al. 2000) para obtener el área de distribución espacial de las especies de peces demersales capturadas en los arrastres. Para analizar la autocorrelación espacial se calculó un variograma experimental , donde h representa la distancia entre estaciones de muestreo.
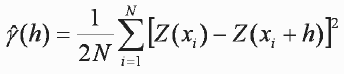
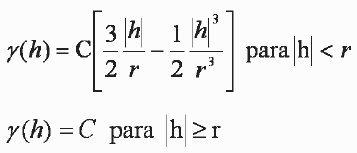
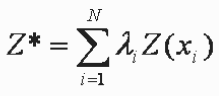
Relación hábitat - abundancia y tallas
Los Modelos Aditivos Generalizados (GAM, por sus siglas en ingles, Generalized Additive Modeling) (Hastie & Tibshirani 1990) es una técnica moderna de estadística no paramétrica que libera al investigador del concepto limitante de una estricta forma paramétrica y permite el ajuste de modelos estadísticos que están de acuerdo con la teoría ecológica (Katsanevakis & Maravelias 2009). Los GAM se están usando cada vez más para estudiar la distribución espacial de las especies marinas y su relación con el hábitat (Maravelias & Papaconstantinov 2003, Katsanevakis 2007, Maravelias et al. 2007 a,b) y en la interpretación de estudios sobre ecología marina (Katsanevakis & Maravelias 2009). En este estudio se hizo un análisis de las preferencias ambientales de la abundancia y las tallas de los peces demersales mediante GAM (Hastie & Tibshirani 1990). Un modelo aditivo es una extensión de los modelos lineales, pero permite que las funciones lineales de los predictores (temperatura, salinidad, tipo de sedimento y profundidad) sean reemplazados por funciones de suavizamiento y no requiere supuestos de las formas funcionales (Agenbag et al. 2003):
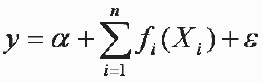

Aspectos ecológicos
Con la información de composición y abundancia obtenida en cada arrastre de pesca, se determinó la diversidad de peces demersales por medio del índice de Shannon-Wiener, se realizó un análisis espacial de su distribución geográfica (Maynou et al. 1996) y se relacionó con las condiciones ambientales mediante modelos GAM.
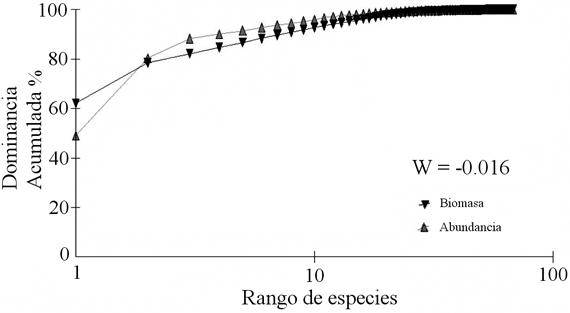
Para conocer los efectos de la pesca sobre los ensamblajes de peces demersales se utilizó el método Comparación Abundancia Biomasa (ABC), que compara la dominancia en términos de abundancia con la dominancia en términos de biomasa (Warwick 1986, Warwick et al. 1987, Yemane et al. 2005). Se supone que en estado normal la comunidad está dominada por especies seleccionada K (crecimiento lento, tamaños grandes, maduración tardía, en equilibrio) y la curva de biomasa esta por encima de la curva de abundancia. Cuando se incrementa la pesca el sistema se vuelve dominado por especies seleccionada r (crecimiento rápido, tamaños pequeños, maduración temprana, oportunistas) y la curva de la biomasa cae debajo de la curva de abundancia. El W estadístico representa el área de diferencia entre las dos curvas. Un signo negativo indica que la curva de la biomasa esta por debajo de la curva de abundancia y sugiere una comunidad alterada (Warwick & Clarke 1994, Yemane et al. 2005).
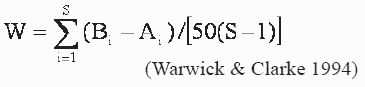
Donde, S describe el cambio en el número total de especies, A es la abundancia total en cada muestra i y B es la biomasa total en cada muestra i.
RESULTADOS
Sedimentos
La mayor parte del área de estudio estuvo conformada por sedimentos de tipo arena (A), principalmente entre Riohacha y Manaure (Figura 2). En el Cabo de la Vela y Bahía Honda los sedimentos fueron del tipo areno lodoso (AL), lodo arenoso (LA) y en Punta Gallinas se encontraron sedimentos de tipo lodo (L). En Boca Camarones y los ríos Buritaca y Palomino los sedimentos fueron de tipo Lodo (L), relacionados con la presencia de aportes fluviales y mas hacia fuera de la costa lodo arenoso (LA), frente a Dibulla areno lodoso (AL).
Oceanografía
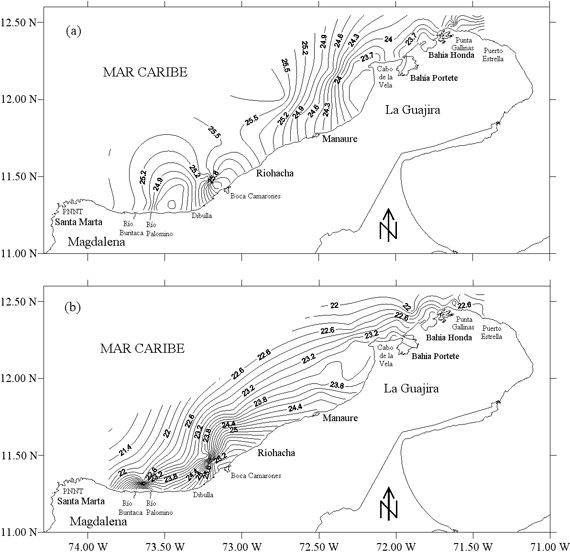
La temperatura superficial del mar (TSM) (Figura 3a) fue menor en el norte del área de estudio, entre Puerto Estrella y Manaure (22.80 - 24.00 ºC), con dos núcleos de surgencia uno en el Cabo de la Vela y otro en Punta Gallinas. En el sur la TSM aumentó hacia la costa, con un pequeño núcleo de aguas más frías entre Dibulla y el Río Palomino. La temperatura cerca al fondo (Figura 3b) fue baja y más homogénea en toda el área de estudio (21.4 - 23.0 ºC). Sin embargo, tanto en la superficie como cerca al fondo, en Boca Camarones se encontraron mayores temperaturas, debido a la presencia de una termoeléctrica que descarga las aguas de refrigeración (calientes) directamente al mar.
Distribución espacial de los peces demersales
La estructura espacial de la densidad de los peces demersales que se capturaron (log CPUA+1) se estudió a través de un variograma isotrópico experimental (Figura 4), el cual presentó mejor ajuste por mínimos cuadrados ponderados mediante un modelo de variograma esférico. A cortas distancias el variograma mostró una estructura no resuelta por el diseño de muestreo que consideró un 22.0% de la varianza total, es decir, la fracción de la varianza no explicada (nugget).
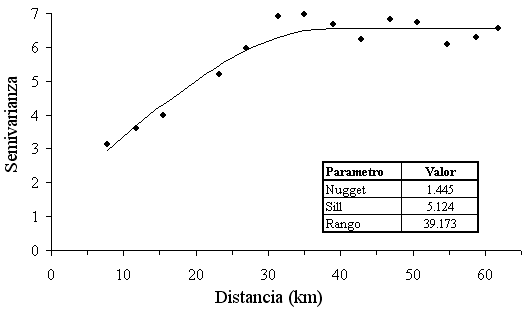
El rango de autocorrelación fue de 39 km, lo que indica que no hay correlación espacial más allá de esta distancia y muestra el tamaño de agregación de los peces demersales. Los peces demersales mostraron una distribución en agregaciones (Figura 5), con focos de abundancia alta (= 3.0 log CPUA+1) frente a Punta Gallinas, el Cabo de la Vela y Manuare, que corresponde a los alrededores del área de influencia de la surgencia estacional. Mediante modelación espacial se calculó el área de distribución espacial de los peces demersales (5805.8 km2).
Al sur del área de estudio, entre Dibulla y el río Buritaca, se mostró otra agregación de peces demersales de abundancia media (< 3.0 log CPUA+1), con tallas menores (Figura 6) (juveniles) en comparación a los valores de abundancia (Figura 5) y tallas de peces (Figura 6) de toda el área de estudio, en un área de 393.1 km2.
Relación hábitat - abundancia y tallas
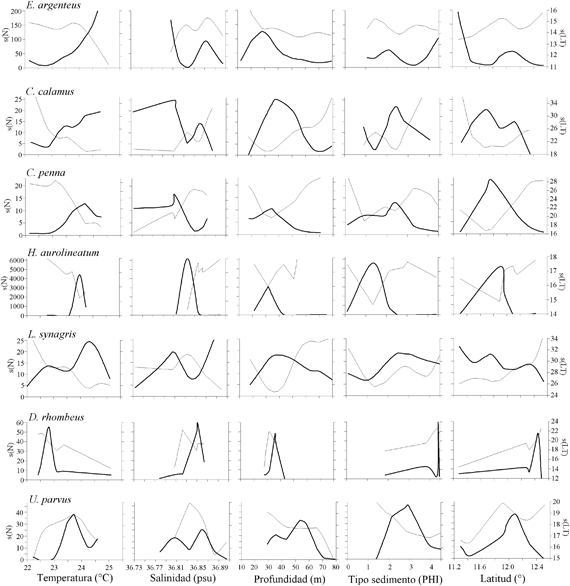
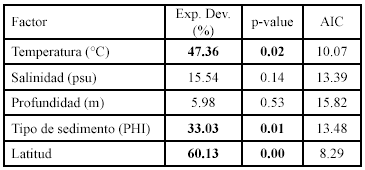
Los resultados de la modelación entre la abundancia (número) de los peces demersales con las variables ambientales, muestran asociaciones significativas principalmente con la temperatura, la salinidad y el tipo de sedimento (Figura 6; Tabla 1).
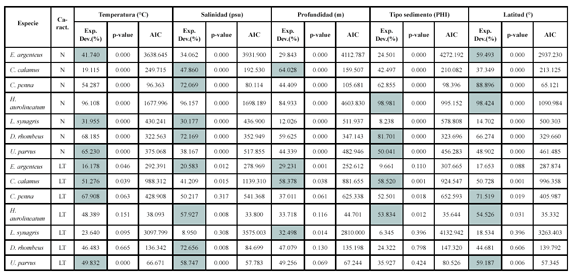
Las abundancias mayores de Eucinostomus argenteus y Calamus calamus estuvieron asociadas a temperaturas mayores de 23.0ºC. La especie C. penna se presentó en un máximo de abundancia entre 24.0 y 24.5ºC. Las abundancias mayores de Haemulon aurolineatum se presentaron en 24.0ºC. Lutjanus synagris presentó dos picos de abundancia, uno con abundancias menores y tallas mayores con aguas frías (22.5 - 23ºC) y las mayores abundancias y tallas menores con aguas mas cálidas (24.0 - 24.5ºC). Diapterus rhombeus prefirió temperaturas menores (22.5 - 23.0ºC) y U. parvus con 23.0ºC. Las especies E. argenteus, C. calamus y C. penna estuvieron asociadas a salinidades menores de 36.81 (psu). Haemulon aurolineatum y D. rhombeus estuvieron restringidas a salinidades de 36.82 - 36.85. Calamus calamus fue la especie que explicó mayor la varianza con la profundidad, las mayores abundancias estuvieron entre 30 y 50 m. Las mayores abundancias de E. argenteus, C. penna y H. aurolineatum se presentaron en profundidades menores de 40 m. La especie L. synagris se presentó en un amplio intervalo de profundidad (18 - 80 m), con las mayores abundancias entre 30 y 50 m. Diapterus rhombeus estuvo entre 30 y 40 m y U. parvus fue la especie que se presentó a mayores profundidades (50 - 60 m). Haemulón aurolineatum y U. parvus estuvieron asociados con arenas medianas y finas, respectivamente. La especie D. rhombeus se presentó en sedimentos tipo lodo.
La distribución espacial de las tallas de los peces demersales mostró que los peces adultos se encontraron principalmente en la zona norte del área de estudio, desde Manaure hasta Punta Gallinas, mientras que los juveniles se distribuyeron al sur de Manaure, con predominancia entre Dibulla y el río Buritaca. Los ajustes del GAM con la temperatura (Figura 6; Tabla 1) muestran que las tallas menores (juveniles de E. argenteus, C. calamus, C. penna) se asociaron con temperaturas altas, mientras que las tallas mayores (adultos) con temperaturas bajas; aunque H. aerolineatum, L. synagris y D. rhombeus no mostraron asociación significativa, muestran la misma tendencia. Cuando se utilizó la latitud como variable predictora, se observa que las tallas menores se encuentran a latitudes más bajas y las tallas mayores a latitudes más altas del área de estudio (Figura 6; Tabla 1). De lo anterior se puede resaltar que los juveniles de los peces demersales prefieren aguas más cálidas y que se localizan al sur del área de estudio y los adultos prefieren las aguas mas frías de la zona de La Guajira, donde hay influencia de la surgencia estacional. La profundidad fue la variable que predijo mejor la distribución espacial de las tallas de E. argenteus, C. calamus, L. synagris. En la primera, las tallas mayores estaban en profundidades menores de 30 m y en las otras dos las tallas mayores estuvieron entre 40 y 60 m. En las especies que se asociaron con el tipo de sedimento (C. calamus y H. aerolineatum), se observa que las tallas menores estuvieron asociadas con arenas y las tallas mayores con lodos (Figura 6; Tabla 1). En las especies E. argenteus, C. calamus, H. aerolineatum y D. rhombeus las tallas menores se asociaron con salinidades bajas y las tallas mayores con salinidad alta; sucedió lo contrario con U. parvus (Figura 6; Tabla 1).
Aspectos ecológicos
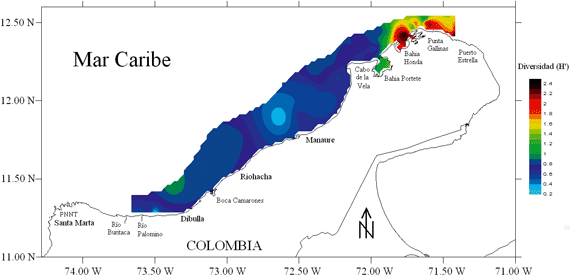
Se capturaron un total de 68 especies de peces demersales, pertenecientes a 34 familias, siendo Haemulidae, Lutjanidae, Scianidae y Sparidae las que presentaron el mayor numero de especies, con 8, 6, 6 y 4, respectivamente. La zona de mayor diversidad de peces demersales se localizó entre Bahía Honda hacia Puerto Estrella (297.0 km2), en la zona de mayor influencia de la surgencia estacional de aguas frías y productivas (Figura 7).
La modelación GAM de la diversidad con las variables ambientales mostró asociación con la temperatura de fondo, el tipo de sedimento y latitud (Figura 8; Tabla 2), pero el factor ambiental que predijo mejor la diversidad fue la temperatura de fondo (mayor devianza explicada y menor AIC; Tabla 2). La diversidad aumentó a temperaturas menores y latitudes altas en la zona de influencia de la surgencia estacional.
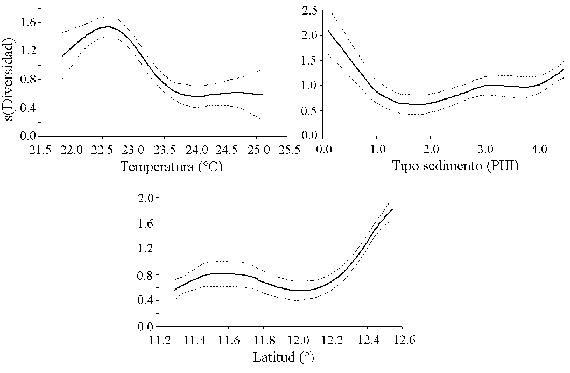
El método ABC para el ensamblaje de peces demersales muestra que la curva de la biomasa cae por debajo de la curva de abundancia (Figura 9), pero la diferencia entre las curvas es baja, indicando un ensamblaje moderadamente alterado (W = -0.016).
La distribución espacial del W estadístico (Figura 10) muestra que las zonas alteradas (W negativo) están sometidas a la actividad pesquera de los barcos de arrastre camaronero. Además, hay zonas en las cuales los ensamblajes no muestran alteraciones (W positivo), frente a Bahía Honda y frente a Riohacha, donde existen dos plataformas de extracción de gas (Chuchupa) en la cual esta prohibido pescar. Finalmente se destaca que frente al río Palomino el W estadístico fue negativo, lo cual no debe interpretarse como un área alterada, ya que corresponde a un área de crianza, en la cual la presencia de juveniles hace que la curva ABC tiende a tener menor biomasa y mayor abundancia.
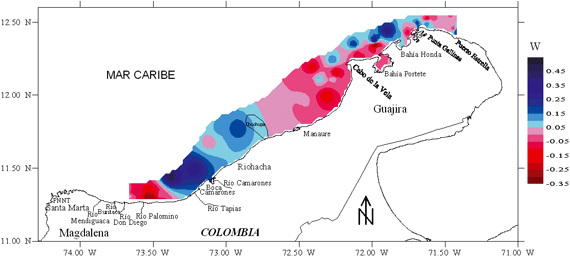
DISCUSIÓN
En el diseño de AMPs para el manejo de pesquerías se debe tener en cuenta cuatro aspectos ecológicos cruciales bajo un enfoque ecosistémico: i) dispersión larval; ii) patrones de movimiento de los juveniles y adultos; iii) impacto de la pesca sobre los ecosistemas y iv) conocimiento adecuado de las masas de agua (corrientes) (Sale et al. 2005). Arteaga et al. (2004a) estimaron la composición, abundancia y distribución de larvas de Lutjanidos en la zona norte del Caribe colombiano y determinaron que éstas se encontraban principalmente entre Dibulla y Manaure. En tanto que las mayores abundancias de biomasa zooplanctónica y huevos de peces demersales se han encontrado en la zona de La Guajira parecen estar asociados a la surgencia. En el presente estudio, las tallas mayores se encontraron en la zona de influencia de la surgencia en La Guajira, indicando la preferencia de los adultos por las menores temperaturas. Mientras los juveniles se encontraron más hacia el sur del área de estudio (entre Dibulla y el rio Buritaca) con preferencias de las temperaturas más altas. Las pesquerías más importantes en la zona norte del Caribe colombiano se encuentran en el área de La Guajira, donde la oceanografía local es modulada por la surgencia estacional. Por lo tanto, las condiciones ambientales se consideran importantes en la distribución y abundancia de los peces del Caribe colombiano, ya que hay un incremento de la productividad y la cantidad de alimento disponible para los peces adultos (Paramo et al. 2003, Paramo & Roa 2003). Además, áreas con temperaturas más altas en el Caribe colombiano, pueden estimular el crecimiento de los juveniles, ya que bajo estas condiciones el metabolismo de los peces es más rápido y pueden crecer lo suficiente para disminuir la mortalidad natural (Paramo et al. 2003). Una parte de la corriente Caribe se desplaza hacia el sur del área de estudio, transportando aguas ricas en nutrientes desde la zona de surgencia de La Guajira. La mayoría de los peces mostraron las menores tallas en la zona entre Dibulla y el río Buritaca, donde se encontraron de aguas cálidas cerca de la costa. Lo anterior hace suponer que la corriente Caribe transporta las larvas de los peces demersales hacia la zona entre Dibulla y el río Buritaca que muestra las condiciones necesarias para ser un área de crianza (Paramo et al. 2003), ya que presenta los procesos de retención, concentración y enriquecimiento, necesarios para un éxito en el reclutamiento (Bakun 1996).
En las zonas templadas los patrones de desove se caracterizan por la estacionalidad de la productividad primaria, pero en las zonas tropicales las estrategias reproductivas de los peces tienden a presentar un desove continuo (Johannes 1978, Mackenzie 2000). Esto coincide con los resultados de este estudio, ya que los peces demersales tuvieron gran porcentaje de individuos maduros. Sin embargo, también se pueden presentar picos de desove en el Caribe colombiano que pudieran estar asociados al inicio de eventos de surgencia. Paramo et al. (2006) encontraron que el camarón de aguas someras (Farfantepenaeus notialis) presenta un desove continuo, pero que tiene dos picos de desove relacionados con el final de la estación lluviosa y el inicio de la estación seca, cuando los vientos alisios del noreste empiezan su actividad. Arteaga et al. (2004a) identificaron dos picos de desove para L. synagris: 1) abril-agosto, periodo de transición entre las épocas seca y húmeda, con un pico en mayo y 2) octubre, y fueron identificadas dos áreas de desove: una frente a Dibulla y otra entre Riohacha y Manaure. En Lutjanus analis se han identificado dos picos de desove: 1) marzo-mayo y 2) septiembre-noviembre. Se estableció que el área de desove ocurre principalmente entre Riohacha y Manaure (Arteaga et al. 2004b). Es importante destacar que los periodos de desove de los peces demersales en el Caribe colombiano se presentan al final de la época húmeda, lo cual sugiere que la condición reproductiva está enlazada con el inicio de la época de mayor productividad, donde se espera que las larvas encuentren suficiente alimento para sobrevivir (Cushing 1996) y una "ventana óptima ambiental" (Cury & Roy 1989), donde se minimizan los factores limitantes (poco alimento, fuerte turbulencia y transporte fuera de la costa).
Los resultados mostraron que es recomendable proteger un 11.9 % del área de distribución de los peces demersales en la zona norte del Caribe colombiano, que corresponde en el sur entre Dibulla y el río Buritaca (donde están los juveniles) y en el norte entre Bahía Honda y Puerto Estrella (mayor diversidad). Lo anterior coincide con autores que recomiendan proteger un mínimo de 10-20% del área total de todos los hábitats representativos, basado en tradiciones culturales, aceptación social y el principio precautorio (Ballantine 1991). Mientras que muy poca área no puede dar mucha protección, áreas muy grandes pueden innecesariamente limitar la producción pesquera. Se sugiere que del 10 al 20% de la plataforma continental se debe proteger para obtener un óptimo beneficio (Bohnsack 1994). Ballantine (1997) sostiene que el área requerida para proteger seria de un 20-30% del área total. La modelación basada en especies con diferente historia de vida sugiere que una proporción grande del hábitat total (hasta el 50%) se debe incluir en el AMP para proteger eficientemente el hábitat y los organismos vivos de los impactos negativos de la explotación de los recursos (Guénette et al. 1998). Las etapas vulnerables del ciclo de vida de las especies, tales como los sitios de desove y las regiones de crianza tienen una alta prioridad en la localización de las AMPs (Armstrong et al. 1993, Roberts & Hawkins 2000). Actualmente, hay mucha preocupación por los impactos de la actividad pesquera sobre la diversidad biológica (Fraser et al. 2009), lo cual ha estimulado el desarrollo de un enfoque ecosistémico para el manejo de las pesquerías (EEMP) (Gislason et al. 2000, Sainsbury & Sumaila 2001, Hall & Mainprize 2004, Cury & Christensen 2005, García & Cochrane 2005). La diversidad de especies frecuentemente se incrementa después de la implementación de AMPs (Halpern 2003, Lubchenco et al. 2003, Friedlander et al. 2007, McClanahan et al. 2007) y los beneficios son mas notables en peces demersales (Barrett et al. 2007), ya que se reestablecen las interacciones predatorias y el consecuente efecto de cascada en la trama trófica (Guidetti 2006). Por el contrario, la apertura de AMPs a la actividad pesquera puede disminuir la diversidad de especies (Russ & Alcala 1989). Además, debido a la preocupación sobre la biodiversidad marina, las AMPs pueden ser bien utilizadas para conservar la biodiversidad de peces como objetivo central de un EEMP (Kaiser 2005, Fraser et al. 2009). El EEMP esta intencionado para ser holístico (Pikitch et al. 2004), por lo tanto, al utilizar AMPs para conservar o restaurar la biodiversidad da un enfoque alternativo de naturaleza multiespecies y espacial para el manejo de los recursos marinos (Fraser et al. 2009).
La implementación de AMPs puede tener objetivos biológicos y sociales. Los objetivos biológicos incluyen rehabilitar hábitats destruidos, sostener la biodiversidad, proteger la vida marina, y proveer un laboratorio para investigación básica natural. Los objetivos sociales incluyen restaurar las pesquerías, crear experiencias de ecoturismo, generar oportunidades económicas en las comunidades costeras. En este sentido, las AMPs pueden tener un "éxito" biológico resultando en un incremento de abundancia de peces y la biodiversidad y un hábitat mejorado, pero también pueden ser un "fracaso social" careciendo de amplia participación en el manejo, compartir beneficios económicos y mecanismos de resolución de conflictos (Christie et al. 2003). La experiencia ha mostrado que la imposición de AMPs sin un amplio consenso con las comunidades locales de pescadores conlleva al fracaso (Christie & White 2007). Además, se ha demostrado empíricamente que la fuerte participación puede ser un factor de éxito en las AMPs (Pollnac et al. 2001), por lo cual es muy importante el proceso participativo en todas las etapas de AMPs: consulta, diseño, implementación y monitoreo (Charles & Wilson 2009). Esto conlleva al intercambio de información, anima la inclusión de expertos y autoridades, da confianza en los procesos de decisión y permite la discusión colaborativa entre grupos de usuarios, lo cual conlleva a soluciones aceptables por todos (Jones 2002, IUCN 2007). En todas las AMPs hay una necesidad crucial para complementar la información biofísica y ecológica con información de la gente: a cerca de los valores humanos, usos históricos y actuales del área, y a cerca de consideraciones sociales, económicas e institucionales dentro del área (Charles & Wilson 2009). Los objetivos humanos (e.g. mitigación de la pobreza y desarrollo económico, justicia social y ambiental) también se debe incluir dentro de la planeación y manejo de un AMP (IUCN 2007). Además, las AMPs no deben ser aisladas cuando se elabora un programa de manejo de recursos costeros, porque esto puede conllevar a "protección de islas" rodeadas por áreas incontrolables de amenaza, donde son prevalentes la contaminación, destrucción del hábitat y sobrepesca (Salm et al. 2000).
Se estableció que la relación de la estructura poblacional y ecológica de los peces demersales con las condiciones del hábitat resultó importante cuando se quiere identificar AMPs como una herramienta de manejo pesquero sostenible bajo un enfoque ecosistémico. De acuerdo a lo anterior, la zona entre Bahía Honda y Puerto Estrella (297.0 km2) debe considerarse como un AMP (Figura 11), ya que presentó la mayor diversidad (Figura 7), otras investigaciones han mostrado también esta zona como de mayor diversidad en otras épocas climáticas (Manjares 1998, Manjares 2004), está moderadamente alterada por la actividad pesquera (W negativo) (Figura 10) y tiene un ecosistema frágil de manglar en Bahía Honda (Díaz-Pulido 1997, INVEMAR, 2000).
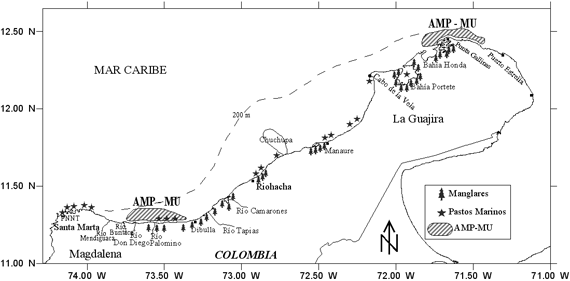
Además, se identificó que el área entre Dibulla y el río Buritaca (Figura 5) puede ser crítica para el ciclo de vida de la mayoría de los peces demersales (crianza), inclusive de pelágicos pequeños (Paramo & Roa 2003, Paramo et al. 2003) y posee un ecosistema de manglar y pastos marinos (Díaz-Pulido 1997, INVEMAR 2000), apropiado para las etapas iniciales del ciclo de vida de los peces (Figura 11), en el cual deben restringirse actividades extractivas que deterioren el hábitat y así solucionar conflictos entre pescadores artesanales e industriales. Por lo tanto, algo importante que se plantea en este trabajo es la implementación de Áreas Marinas Protegidas de Múltiples Usos (AMP-MU) (De Andrade 2007, Rovira 2007). El AMP-MU consiste en hacer uso limitado con un sistema de manejo sostenible con participación activa de los pescadores, fomentar actividades de turismo ecológico, recreación, y/o cultivo de especies nativas en las AMP-MU (Paramo 2007).
AGRADECIMIENTOS
Los autores agradecen al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología "Francisco José de Caldas" (COLCIENCIAS), a la Universidad del Magdalena, al Instituto Colombiano de Desarrollo Rural (INCODER), al Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (INVEMAR), al Institut de Recherche pour le Developpment, France (IRD), por el apoyo financiero, técnico y logístico para el desarrollo del proyecto "Las Áreas Marinas Protegidas (AMPs): Una Herramienta de Manejo para las Pesquerías Demersales en la Zona Norte del Caribe Colombiano" código 020309-16652. Durante la elaboración del artículo Jorge Paramo fue financiado por una beca del Programa ALECOL DAAD en la Universidad de Bremen (Alemania).
LITERATURA CITADA
1. AGENBAG, J.J., A.J. RICHARDSON., H. DEMARCQ., P. FRÉON., S. WEEKS & F.A. SHILLINGTON. 2003. Estimating environmental preferences of South African pelagic fish species using catch size and remote sensing data. Progress in Oceanography 59: 275-300. [ Links ]
2. ÁLVAREZ-LEÓN, R., J. AGUILERA-QUIÑONEZ, C. A. ANDRADE-AMAYA & P. NOWAK. 1995. Caracterización general de la zona de surgencia en La Guajira colombiana. Revista Academia Colombiana Ciencias 19(75): 679-694. [ Links ]
3. ALVERSON, D. L., M. H. FREEBERG, S. A. MURAWSKI & J. G. POPE. 1994. A Global Assessment of Fisheries Bycatch and Discards. FAO Fisheries Technical Paper 339. Food and Agriculture Organization of the United Nations, Roma. [ Links ]
4. ANDRADE, C.A., E.D. BARTON & CH.N.K. MOOERS. 2003. Evidence for an eastward flow along the Central and South American Caribbean Coast. Journal of Geophysical Research 108: 1-11. [ Links ]
5. ANON. 1989. Prospecciones de los recursos pesqueros de la áreas de plataforma entre Surinam y Colombia. Institute of Marine Research. NORAD/UNDP/FAO Programe. Bergen. [ Links ]
6. ARMSTRONG, D. A., T. C. WAINWRIGHT, G. C. JENSEN, P. A. DINNEL & H. B. ANDERSEN. 1993. Taking refuge from bycatch issues: red king crab (Paralithodes camtschaticus) and trawl fisheries in the eastern Bering Sea. Canadian Journal of Fisheries and Aquatic Science 50: 1993-2000. [ Links ]
7. ARTEAGA, E., M. CRIALES, D. RODRÍGUEZ, P. GÓMEZ & L. MANJARRÉS. 2004a. Dinámica reproductiva de los stocks de pargo rayado Lutjanus synagris (Linnaeus, 1758) en el área norte del Caribe colombiano. Págs. 203-215 en: L. Manjares (ed.), Pesquerías demersales del área norte del Mar Caribe de Colombia y parámetros biológico-pesqueros y poblaciones del recurso pargo. Universidad del Magdalena, Santa Marta. [ Links ]
8. ARTEAGA, E., M. CRIALES, D. RODRÍGUEZ, P. GÓMEZ & L. MANJARRÉS. 2004b. Dinámica reproductiva de los stocks de pargo palmero Lutjanus analis (Cuvier, 1828) en el área norte del Caribe colombiano. Págs. 217-228 en: L. Manjares (ed.), Pesquerías demersales del área norte del Mar Caribe de Colombia y parámetros biológico-pesqueros y poblaciones del recurso pargo. Universidad del Magdalena, Santa Marta. [ Links ]
9. BAKUN, A. 1996. Patterns in the ocean: ocean processes and marine population dynamics. University of California Sea Grant, UCSD, San Diego, CA y Centro de Investigaciones Biológicas de Noroeste, La Paz, Baja California. [ Links ]
10. BALLANTINE, W. J. 1991. Marine reserves for New Zealand. Leigh Laboratory Bulletin 25: 1-196. [ Links ]
11. BALLANTINE, B. 1997. Design principles for systems of "no-take" marine reserves. The design and monitoring of marine reserves, Workshop. University of British Columbia, Vancouver. [ Links ]
12. BENAVIDES, S. 2007. Ensamblaje de peces demersales en la costa norte del Caribe colombiano durante la época seca: un enfoque espacial para el manejo de los recursos pesqueros. Tesis de grado Ingeniero Pesquero. Universidad del Magdalena, Santa Marta [ Links ]
13. BOHNSACK, J. A. 1994. Marine Reserves: They enhance fisheries, reduce conflicts, and protect resources. Naga, ICLARM 17(3): 4-7. [ Links ]
14. BOHNSACK, J. A. 2000. A comparison of the short-term impacts of no-take marine reserves and minimun size limits. Bulletin of Marine Science 66(3): 635-650. [ Links ]
15. BOTSFORD, L. W., J. C. CASTILLA & C. H. PETERSON. 1997. The management of fisheries and marine ecosystems. Science 277: 509-515. [ Links ]
16. BUCHANAN, J. B. 1984. Sediment Analysis. Págs. 41-45 en: N. A. Holme & A. D. Mclntyre (eds.), Methods for the study of Marine Benthos. Blackwell. [ Links ]
17. BULA MEYER, G. 1990. Oceanografía. Págs. 51-66 en: Caribe Colombia. Fondo José Celestino Mutis -FEN- Bogotá. [ Links ]
18. BURNHAM, K. P. & D. R. ANDERSON. 2002. Model selection and multimodel inference: a practical information-theoretic approach. Springer-Verlag, Nueva York. [ Links ]
19. CADDY, J. F. & R. MAHON. 1996. Puntos de referencia para la ordenación pesquera. FAO Doc. Téc. Pesca. No. 347. Roma. [ Links ]
20. CHARLES, A & L. WILSON. 2009. Human dimensions of Marine Protected Areas. ICES Journal of Marine Science 66: 6-15. [ Links ]
21. CHRISTIE, P., B. J. MCCAY, M. L. MILLAR, C. LOWE, A. T. WHITE, R. STOFFLE, D. L. FLUHARTY, L. T. MCMANUS, R. CHUENPAGDEE, C. POMEROY, D. O. SUMAN, B. G. BLOUNT, D. HUPPERT, R. VILLAHERMOSA, E. ORACION, K. LOWRY & R. B. POLLNAC. 2003. Toward developing a complete understanding: A social science research agenda for marine protected areas. Fisheries 28 (12): 22-26. [ Links ]
22. CHRISTIE, P & A. WHITE. 2007. Best practices in governance and enforcement of marine protected areas: an overview. En: FAO Expert Workshop on Marine Protected Areas and Fisheries Management: Review of Issues and Considerations. FAO, Roma. [ Links ]
23. CONAN, G. Y. 1985. Assessment of shellfish stocks by geostatistical techniques. ICES CM 1985/K:30. [ Links ]
24. CRESSIE, N. A. C. 1993. Statistics for spatial data. John. Wiley & Sons, Nueva York. [ Links ]
25. CURY, P & C. ROY. 1989. Optimal environmental window and pelagic fish recruitment success in upwelling areas. Canadian Journal of Fisheries and Aquatic Science 46: 670-680. [ Links ]
26. CURY, P. & V. CHRISTENSEN. 2005. Quantitative Ecosystem Indicators for Fisheries Management. ICES Journal of Marine Science 62: 307-310. [ Links ]
27. CURY, P., L. J. SHANNON, J-P. ROUX, G. M. DASKALOV, A. JARRE, C. L. MOLONEY & D. PAULY. 2005a. Trophodynamic indicators for an ecosystem approach to ?sheries. ICES Journal of Marine Science 62: 430-442. [ Links ]
28. CURY, P., C MULLON, S. M. GARCIA & L. J. SHANNON. 2005b. Viability theory for an ecosystem approach to ?sheries. ICES Journal of Marine Science 62: 577-584. [ Links ]
29. CUSHING, D. H. 1996. Towards a science of recruitment in fish populations. Págs. 175 en: O. Kinne (ed.), Excellence in Ecology. Ecology Institute, D21386, Oldendorf/Luhe. [ Links ]
30. DE ANDRADE, R (ed.). 2007. Áreas Marinas y Costeras Protegidas de Múltiples Usos alcances y desafíos del modelo de gestión para la conservación de la biodiversidad marina en Chile. Ocho Libros editores. GEF Marino - PNUD. 214 pp. [ Links ]
31. DÍAZ-PULIDO, G. 1997. Ecosistemas Marinos y Costeros. Págs. 228-314 en: Chavez, M.E. & N. Arango (eds.), Informe nacional sobre el estado de la Biodiversidad Colombia. Tomo I, Diversidad Biológica. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. Bogotá. [ Links ]
32. EAYRS, S. 2005. A Guide to Bycatch Reduction in Tropical Shrimp-Trawl Fisheries, Food and Agricultural Organization (FAO) of the United Nations, Roma. [ Links ]
33. FOLMER, O. & M. PENNINGTOn. 2000. A statistical evaluation of the design and precision of the shrimp trawl survey off West Greeland. Fisheries Research 49: 165-178. [ Links ]
34. FRASER, H.M., S.P.R. GREENSTREET & G.J. PIET. 2009. Selecting MPAs to conserve groundfish biodiversity: the consequences of failing to account for catchability in survey trawls. ICES Journal of Marine Science 66: 82-89. [ Links ]
35. FRIEDLANDER, A. M., E. K. BROWN & M.E. MONACO. 2007. Coupling ecology and GIS to evaluate efficacy of marine protected areas in Hawaii. Ecological Applications 17: 715-730. [ Links ]
36. GARCÍA, S. 1989. The management of coastal penaeid shrimp fisheries. Págs. 281-306 en: J.F. Caddy (ed.), Marine invertebrate fisheries: Their assessment and management. Wiley and Sons, Nueva York. [ Links ]
37. GARCIA, S. M. & K. L. COCHRANE. 2005. Ecosystem approach to ?sheries: a review of implementation guidelines. ICES Journal of Marine Science 62: 311-318. [ Links ]
38. GISLASON, H., M. SINCLAIR, K. SAINSBURY & R. O'BOYLE. 2000. Symposium overview: incorporating ecosystem objectives within fisheries management. ICES Journal of Marine Science 57: 468-475. [ Links ]
39. GUENETTE, S., T. LAUCK & C. CLARK. 1998. Marine reserves: from Beverton and Holt to the present. Review Fish Biology and Fisheries 8: 251-272. [ Links ]
40. GUIDETTI, P. 2006. Marine reserves re-establish lost predatory interactions and cause community changes in rocky reefs. Ecological Applications 16: 963-976. [ Links ]
41. HALL, S. J & B. MAINPRIZE. 2004. Towards ecosystem-based fisheries management. Fish and Fisheries 5: 1-20. [ Links ]
42. HALPERN, B. 2003. The impact of marine reserves: do reserves work and does size matter? Ecological Applications 13: S117-S137. [ Links ]
43. HASTIE, T. J. & R. J. TIBSHIRANI. 1990. Generalized Additive Models. Chapman & Hall, Londres. [ Links ]
44. IUCN. 2007. Establishing Marine Protected Area Networks: Making It Happen. A Guide for Developing National and Regional Capacity for Building MPA Networks. World Conservation Union. [ Links ]
45. INVEMAR. 2000. Programa nacional de investigación en biodiversidad marina. Ecoregiones naturales marinas y costeras. Invemar, Santa Marta. [ Links ]
46. JOHANNES, R. E. 1978. Reproductive strategies of coastal marine fishes in the tropics. Environmental Biology Fishes 3(1): 65-84. [ Links ]
47. JOHNSON, D. R., N. A. FUNICELLI & J. A. BOHNSACK. 1999. Effectiveness of an Existing Estuarine No-take Fish Sanctuary within the Kenedy Space Center, Florida. North American Journal of Fisheries Management 19(2): 439-453. [ Links ]
48. JONES, P. J. S. 2002. Marine protected area strategies: issues, divergences and the search for middle ground. Reviews in Fish Biology and Fisheries 11: 197-216. [ Links ]
49. JOURNEL, A. G. & C. J. HUIJBREGTS. 1978. Mining geostatistics. Academic Press, Nueva York. [ Links ]
50. KAISER, M. J. 2005. Are marine protected areas a red herring or a fisheries panacea? Canadian Journal of Fisheries and Aquatic Sciences 62: 1194-1199. [ Links ]
51. KATSANEVAKIS, S. 2007. Density surface modeling with line transect sampling as a tool for abundance estimation of marine benthic species: the Pinna nobilis example in a marine lake. Marine Biology 152:77-85. [ Links ]
52. KATSANEVAKIS, S & CH.D. MARAVELIAS. 2009. Bathymetric distribution of demersal fish in the Aegean and Ionian Seas based on generalized additive modeling. Fisheries Science 75: 13-23. [ Links ]
53. LUBCHENCO, J., S.R. PALUMBI, S.D. GAINES & S. ANDELMAN. 2003. Plugging a hole in the ocean: the emerging science of marine reserves. Ecological Applications 13: S3-S7. [ Links ]
54. LUDWIG, D., R. HILBORN & C. WALTERS. 1993. Uncertainty, resource explotation, and conservation: lessons from history. Science 260: 17-18. [ Links ]
55. MCCLANAHAN, T. R., N.A.J. GRAHAM, J.M. CALNAN & M.A. MACNEIL. 2007. Towards pristine biomass: reef fish recovery in coral reef marine protected areas in Kenya. Ecological Applications 17: 1055-1067. [ Links ]
56. MACKENZIE, B. R. 2000. Turbulence, larval fish ecology and fisheries recruitment: a review of field studies. Oceanológica Acta 23(4): 357-375. [ Links ]
57. MANJARRÉS, L. 2004. Pesquerías demersales del área norte del Mar Caribe de Colombia y parámetros biológico-pesqueros y poblaciones del recurso pargo. Universidad del Magdalena, Santa Marta: 77-90. [ Links ]
58. MANJARRES, L. 1998. Caracterización ambiental, ecológica y biológico-pesquera de las asociaciones de peces demersales del caribe colombiano norte, con énfasis en pargos (Lutjanidae). Tesis de Maestría. Universidad Nacional de Colombia. Santa Marta. [ Links ]
59. MARAVELIAS, C., D.G. REID, E.J. SIMMONDS & J. HARALABOUS. 1996. Spatial analysis and mapping of acoustic survey data in the presence of high local variability: geostatistical application to North Sea herring (Clupea harengus). Canadian Journal Fisheries and Aquatic Science 53: 1497-1505. [ Links ]
60. MARAVELIAS, C.D & C. PAPACONSTANTINOU. 2003. Size-related habitat use, aggregation patterns and abundance of anglerfish (Lophius budegassa) in the Mediterranean Sea determined by generalized additive modelling. Journal of Marine Biology Assoc UK 83:1171-1178. [ Links ]
61. MARAVELIAS, C.D., E.V. TSITSIKA & C. PAPACONSTANTINOU. 2007(a). Evidence of Morocco dentex (Dentex maroccanus) distribution in the NE Mediterranean and relationships with environmental factors determined by generalized additive modelling. Fisheries Oceanography 16:294-302. [ Links ]
62. MARAVELIAS, C.D., E.V. TSITSIKA & C. PAPACONSTANTINOU. 2007(b) Seasonal dynamics, environmental preferences and habitat selection of John Dory (Zeus faber). Estuarine Coastal Shelf Science 72:703-710 [ Links ]
63. MATHERON, G. 1963. Principles of geostatistics. Economic Geology 58: 1246-1266. [ Links ]
64. MAYNOU, F., G. Y. CONAN, J. E. CARTES, J. B. COMPANY & F. SARDA. 1996. Spatial structure and seasonality of decapod crustacean populations on the northwestern Mediterranean slope. Limnology and Oceanography 41(1): 113-125. [ Links ]
65. MURRAY, S. T., R. F. AMBROSE, J. A. BOHNSACK, L. W. BOTSFORD, M. H. CARR, G. E. DAVIS, P. K. DAYTON, D. GOTSHALL, D. R. GUNDERSON, M. A. HIXON, J. LUBCHENCO, M. MANGEL, A. MACCALL, D. A. MCARDLE, J. C. OGDEN, J. ROUGHGARDEN, R. M. STARR, M. J. TEGNER & M. M. YOKLAVICH. 1999. No-take Reserve Networks: Sustaining Fishery Populations and Marine Ecosystems. Fisheries 24(11): 11-25. [ Links ]
66. PARAMO, J. & R. ROA. 2003. Acoustic-geostatistical assessment and habitat-abundance relations of small pelagic fish from the Colombian Caribbean. Fisheries Research 60: 309-319. [ Links ]
67. PARAMO, J., R. A. QUIÑONES, A. RAMIREZ & R. WIFF. 2003. Relationship between abundance of small pelagic fishes and environmental factors in the Colombian Caribbean Sea: an analysis based on hydroacustic information. Aquatic Living Resources 16 (3): 239-245. [ Links ]
68. PARAMO, J., J. BUELVAS, N. P. CORREA & E. D. EGURROLA. 2006. Dinámica de la pesquería del camarón de aguas someras (Farfantepenaeus notialis) (Pérez Farfante, 1967), en el Caribe colombiano. Informe proyecto: Monitoreo Biológico Pesquero del camarón de aguas someras del Caribe colombiano. INCODER. [ Links ]
69. PARAMO, J. 2007. AMCP: herramienta de manejo para las pesquerías en el norte del Caribe colombiano, 197 - 199. En: Áreas Marinas y Costeras Protegidas de Múltiples Usos. Ocho Libros editores. GEF Marino - PNUD. [ Links ]
70. PAULY, D., V. CHRISTENSEN, S. GUENETTE, T. J. PITCHER, U. R. SUMAILA, C. J. WALTERS, R. WATSON Y D. ZELLER. 2002. Towards sustainability in world fisheries. Nature 418: 689-695. [ Links ]
71. PAULY, D., J. ALDER, E. BENNETT, V. CHRISTENSEN, P. TYEDMERS & R. WATSON. 2003. The future for fisheries. Science 21: 1359-1361. [ Links ]
72. PIKITCH, E. K., C. SANTORA, E.A. BABCOCK, A. BAKUN, R. BONFIL, D.O. CONOVER, P. DAYTON, P. DOUKAKIS, D. FLUHARTY, B. HENEMAN, E. D. HOUDE, J. LINK, P. A. LIVINGSTON, M. MANGEL, M. K. MCALLISTER, J. POPE & K. J. SAINSBURY. 2004. Ecosystem-based fishery management. Science 305: 346-347. [ Links ]
73. PETITGAS, P. 1996. Geostatistics and their applications to fisheries survey data. Págs. 113-142 en: Megrey, B.A. & E. Moskness (eds.), Computers in fisheries research. Chapman & Hall, Londres. [ Links ]
74. POLLNAC, R. B., B.R. CRAWFORD & M.L. GOROSPE. G. 2001. Discovering factors influencing the success of community-based marine protected areas in the Visayas, Philippines. Ocean and Coastal Management 44: 683-710. [ Links ]
75. PUJOS, M., J. PAGLIARDINI, R. STEER, G. VERNETTE & O. WEBER. 1986. Influencia de la contra-corriente norte colombiana para la circulación de las aguas en la plataforma continental: su acción sobre la dispersión de los efluentes en suspensión del río Magdalena. Boletín Científico CIOH 6: 3-15. [ Links ]
76. QUINTERO, R. 1992. Crucero evaluación recursos demersales por el método de área barrida - Fase Caribe colombiano. Págs. 818-829 en: Mem. VIII Sem. Nal. Cien. Técn. Mar. Tomo II. Santa Marta. [ Links ]
77. RIVOIRARD, J., J. SIMMONDS, K.G. FOOTE, P. FERNANDES & N. BEZ. 2000. Geostatistics for Estimating Fish Abundance. Blackwell Science, Londres. [ Links ]
78. ROBERTS, C. & J. P. HAWKINS. 2000. Fully-protected marine reserves: a guide. WWF Endangered Seas Campaign, 1250 24th Street, NW, Washington, DC 20037, USA and Environment Department, University of York, York, YO10 5DD. [ Links ]
79. ROSSI, R.E., D.J. MULLA, A.G. JOURNEL, & E.H. FRANZ. 1992. Geostatistical tools for modeling and interpreting ecological spatial dependence. Ecological Monographs 62(2): 277-314. [ Links ]
80. ROVIRA, J. 2007. Múltiples usos en AMCP: un aporte a su comprensión. 17 - 24. En: Áreas Marinas y Costeras Protegidas de Múltiples Usos. Ocho Libros editores. GEF Marino - PNUD. [ Links ]
81. RUSS, G. R & A.C. ALCALA. 1989. Effects of intense fishing pressure on an assemblage of coral reef fisheries. Marine Ecology Progress Series 56: 13-27. [ Links ]
82. SALE, P. F., R. K. COWEN, B. S. DANILOWICZ, G. P. JONES, J. P. KRITZER, K. C. LINDEMAN, S. PLANES, N. V. C. POLUNIN, G. R. RUSS, Y. J. SADOVY & R. S. STENECK. 2005. Critical science gaps impede use of no-take fishery reserves. TRENDS Ecology and Evolution 20 (2): 74-80. [ Links ]
83. SAINSBURY, K & U.R. SUMAILA. 2001. Incorporating ecosystem objectives into management of sustainable marine fisheries including "best practice" reference points and use of marine protected areas. En: Responsible Fisheries in the Marine Ecosystem, pp. 343-361. Ed. M. Sinclair. CABI Publishing. [ Links ]
84. SALM, R. V., J. CLARK & E. SIIRILA. 2000. Marine and Coastal Protected Areas: a Guide for Planners and Managers. IUCN, Washington, DC. [ Links ]
85. SIMARD, Y., D. MARCOTTE, & G. BOURGAULT. 1993. Exploration of geostatistical methods for mapping and estimating acoustic biomass of pelagic fish in the Gulf of St. Lawrence: size of echo-integration unit and auxiliary environmental variables. Aquatic Living Resources 6: 185-199. [ Links ]
86. STOKSTAD, E. 2006. Global loss of biodiversity harming ocean bounty. Science 314(3): 745. [ Links ]
87. WARWICK, R. M. 1986. A new method for detecting pollution effects on marine macrobenthic communities. Marine Biology 92: 557- 562. [ Links ]
88. WARWICK, R. M., T.H. PEARSON & H. RUSWAHYUNI. 1987. Detection of pollution effects on marine macrobenthos: further evaluation of the species abundance/biomass method. Marine Biology 95: 193-200. [ Links ]
89. WARWICK, R. M. & K.R. CLARKE. 1994. Relearning the ABC: taxonomic changes and abundance/biomass relationships in disturbed benthic communities. Marine Biology 118: 739-744. [ Links ]
90. WEEKS, H. & S. PARKER. 2002. Scientific and Management Uncertainty Create Competing Precautionary Needs for Fishery Managers. Fisheries 27(3): 25- 27. [ Links ]
91. WORM, B., E. B. BARBIER, N. BEAUMONT, J. E. DUFFY, C. FOLKE, B. S. HALPERN, J. B. C. JACKSON, H. K. LOTZE, F. MICHELI, S. R. PALUMBI, E. SALA, K. A. SELKOE, J. J. STACHOWICZ & R. WATSON. 2006. Impacts of biodiversity loss on ocean ecosystem services. Science 314(3): 787 - 790. [ Links ]
92. YEMANE, D., J. G. FIELD & R. W. LESLIE. 2005. Exploring the effects of ?shing on ?sh assemblages using Abundance Biomass Comparison (ABC) curves. ICES Journal of Marine Science 62: 374-379. [ Links ]
Recibido: 10/08/2008
Aceptado: 29/01/2009














