Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Lasallista de Investigación
Print version ISSN 1794-4449
Rev. Lasallista Investig. vol.7 no.2 Caldas July/Dec. 2010
Artículo original / Original article / Artigo original
Producción de lacasa utilizando Pleurotus ostreatus sobre cáscaras de plátano y bagazo de caña
Production of locase using Pleurotus ostreatus on plantain peel and sugar cane bagasse
Produção de lacasa utilizando Pleurotus ostreatus sobre cascas de plátano e bagazo de cana
* Ingeniería de Alimentos. Candidata a Maestría en Ciencia y Tecnología de Alimentos Universidad Nacional de Colombia. Medellín. Antioquia.
** Ingeniera de Alimentos. Master en Administración de Negocios (MBA). Universidad de los Andes. Bogotá.
*** Ingeniero Químico. Ph D. en Ingeniería de Alimentos. Docente Asociado. Departamento de Ingeniería Agrícola y Alimentos. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. Antioquia.
Correspondencia: Eduardo Rodríguez Sandoval. e-mail: edrodriguezs@unal.edu.co.
Artículo recibido: 16/12/2009; artículo aprobado: 3/12/2010
Resumen
Introducción. La cáscara de plátano de uso industrial representa del 35% al 40%, del peso total del fruto, siendo una cantidad considerable de residuos que se podrían aprovechar para la producción de complejos enzimáticos. Objetivo. Investigar el potencial que tiene la cáscara de plátano (verde y madura) variedad Dominico-Hartón como sustrato para la producción de la enzima extracelular lacasa utilizando el hongo Pleurotus ostreatus. Materiales y métodos. El hongo Pleurotus ostreatus se cultivó en diferentes mezclas así: Cáscaras de plátano verde (PV), cáscaras de plátano maduro (PM), cáscaras de plátano verde-bagazo de caña (50/50) (PVB), cáscaras de plátano maduro-bagazo de caña (50/50) (PMB). Las unidades de fermentación se mantuvieron a un pH de 4.8, una temperatura de 28°C y un contenido de humedad de 63%. La determinación de la enzima lacasa se llevó a cabo por la oxidación ABTS. Resultados. En los sustratos utilizados se obtuvieron un máximo de actividad lacasa el día 24; con excepción del tratamiento con PM que lo alcanza en el día 34. El sustrato PMB tuvo la mayor producción de lacasa con una concentración de 19.4 U/ml. Conclusión. La cáscara de plátano puede ser un buen sustrato cuando se suplementa con otros residuos lignocelulósicos como por ejemplo el bagazo de caña. La lacasa puede ser un indicador morfogenético al mostrar el máximo crecimiento del micelio.
Palabras clave: cáscara de plátano, bagazo de caña, Pleurotus ostreatus, lacasa.
Abstract
Introduction. Plantain peel for industrial purposes represents from 35% to 40% of the total fruit weight, becoming a considerable quantity of waste which could be used to produce enzymatic complexes. Objective. To investigate the potential green and mature plantain peel of "Dominico-Hartón" as a supportsubstrate to produce laccase extracellular enzyme by the use of Pleurotus ostreatus fungus. Materials and Methods. Pleurotus ostreatus fungus was cultivated in different mixtures, as follows: Green plantain peel (GPP), mature plantain peel (MPP) green plantain peel-cane bagasse (50/50) (GPPCB), mature plantain peel-cane bagasse (50/50) MPPCB). Fermentation units were kept at pH 4.8, 28°C and a 63% humidity. The determination of the laccase enzyme was carried out by ABTS oxidation. Results. In the substrates used, a maximum laccase activity was achieved in the 24th day, except in the mature plantain treatment, which achieved it in the 34th day. MPPCB substrate had the highest production of laccase with 19.4 U/mL concentration. Conclusion. Plantain peel can be a good substrate when is supplemented with other lignocellulosic wastes, such as sugar cane bagasse. Laccase can be used as a morphogenetic indicator because it shows the maximum growth of the mycelium.
Key words: plantain cane, cane bagasse, Pleurotus ostreatus, laccase.
Resumo
Introdução. A casca de plátano de uso industrial representa do 35% ao 40%, do peso total do fruto, sendo uma quantidade considerável de resíduos que se poderiam aproveitar para a produção de complexos enzimáticos. Objetivo. Pesquisar o potencial que tem a casca de plátano (verde e madura) variedade Dominico-Hartón como substrato para a produção da enzima extracelular lacasa utilizando o fungo Pleurotus ostreatus. Materiais e métodos. O fungo Pleurotus ostreatus se cultivou em diferentes misturas assim: Cascas de plátano verde (PV), cascas de plátano maduro (PM), cascas de plátano verde-baguaçu de cana (50/50) (PVB), cascas de plátano maduro-baguaçu de cana (50/50) (PMB). As unidades de fermentação se mantiveram a um PH de 4.8, uma temperatura de 28°C e um conteúdo de umidade de 63%. A determinação da enzima lacasa se levou a cabo pela oxidação ABTS. Resultados. Nos substratos utilizados se obtiveram um máximo de atividade lacasa o dia 24; com exceção do tratamento com PM que o atinge no dia 34. O substrato PMB teve a maior produção de lacasa com uma concentração de 19.4 Ou/ml. Conclusão. A casca de plátano pode ser um bom substrato quando se suplementa com outros resíduos lignocelulósicos como, por exemplo, o baguaçu de cana. A lacasa pode ser um indicador morfogenético ao mostrar o máximo crescimento do micélio.
Palavras importantes: casca de plátano (Banana da Terra), Baguaçu de cana, Pleurotus ostreatus, lacasa.
Introducción
El cultivo de plátano en Colombia tiene gran importancia socioeconómica como generador de empleo y de seguridad alimentaria, entendida esta última como la disponibilidad estable y suficiente de alimentos. El plátano (de consumo interno y exportación) alcanzó un área total de cultivo de 346.524 ha y un nivel de producción de 2.699.099 ton en el 20081. Actualmente, cerca de un 4% de la producción nacional de plátano se destina al mercado de exportación, el restante se dirige hacia el consumo interno en fresco y una muy pequeña proporción, menos del 1%, se destina como materia prima para la agroindustria nacional. Se estima que el mercado industrial del plátano absorbe aprox. 12 mil ton/año y se destinan a productos procesados para consumo humano y concentrados para consumo animal2, donde se generan grandes residuos ricos en lignina y celulosa.
La lignocelulosa es uno de los recursos bioenergéticos renovables más abundantes en la naturaleza, el cual se compone de celulosa, hemicelulosa y lignina. Sin embargo, su utilización como fuente de energía se ve limitada en el presente porque la lignina es difícil de degradar y transformar a glucosa3. El porcentaje en peso de cáscara de las variedades de uso industrial puede estar entre un 35% a 40%, el cual es una cantidad considerable de residuos durante el procesamiento del plátano4. La cáscara contiene celulosa (10.5%) y hemicelulosa (14%) y lignina (17%)5. Por esta razón, se podría utilizar para la producción de complejos enzimáticos. Se han realizado diversas investigaciones sobre la obtención de enzimas ligninolíticas y celulolíticas con diferentes clases de hongos empleando como sustrato residuos de plátano (hojas, tallos, cáscaras). Reddy et al. (2003),6 investigaron la obtención de lacasa, lignina peroxidasa, xilanasa, CMCasa y Fpasa sobre residuos de banano utilizando Pleurotus ostreatus y Pleurotus sajorcaju. Osma et al. (2007),7 investigaron la producción de lacasa a partir de cáscara de banano con el hongo Trametes pubescens. Otros estudios se han enfocado en la evaluación de lacasa, manganeso peroxidasa y ligninoperoxidasa utilizando Pleurotus djamor y Lentinus crinitus en residuos de plátano y aserrín8-9.
Los hongos del género Pleurotus son basidiomicetos de pudrición blanca, con un alto valor nutricional, propiedades terapéuticas y variadas aplicaciones biotecnológicas. El hongo Pleurotus ostreatus (P. ostreatus) posee la capacidad de degradar grandes polímeros (lignina y celulosa) que constituyen el substrato vegetal, así como contaminantes ambientales mediante la secreción de un complejo enzimático. La efectividad de esta degradación depende en gran medida de las oxidoreductasas extracelulares y los metabolitos secundarios de bajo peso molecular3. Según estudios previos, el hongo P. ostreatus es capaz de crecer sobre sustratos muy económicos como los residuos agrícolas10.
La importancia biotecnológica de la enzima lacasa radica en su habilidad para oxidar los compuestos fenólicos y los relacionados con la lignina, como también degrada ciertos contaminantes ambientales7. La lacasa se ha utilizado como agente blanqueador en la pulpa de madera y la industria de papel, en la desinfección con cloro y en la eliminación de compuestos fenólicos de las aguas residuales. En lo referente al sector alimenticio esta enzima hace parte indispensable de los análisis de fenoles en los jugos naturales; además tiene aplicaciones como biosensor para la determinación de los catecoles de los polifenoles en el té. La lacasa inmovilizada se ha utilizado para eliminar fenoles del zumo de manzana y del vino11. Teniendo en cuenta lo anterior, esta propuesta plantea la evaluación de la actividad enzimática de lacasa producida mediante el cultivo Pleurotus ostreatus sobre cáscaras de plátano verdes y maduras, y bagazo de caña como fuente de carbono en fermentación sólida.
Materiales y métodos
Materia prima
Los plátanos verde y maduro variedad Dominico-Harton, fueron adquiridos en un supermercado local de la ciudad de Bogotá D.C y almacenados a temperatura ambiente hasta su posterior uso. Las cáscaras fueron retiradas de los plátanos y desinfectadas con hipoclorito de sodio al 1% en agua y cortadas en láminas de aproximadamente 2 cm x 2cm. El bagazo de caña adquirido por la Universidad Jorge Tadeo Lozano fue cortado en trozos de 2 cm x 2cm y mezclado con la cáscara verde y madura en diferentes proporciones. Los sustratos utilizados en la experimentación fueron los siguientes: cáscaras de plátano verde (PV) (100%), cáscaras de plátano maduro (PM) (100%), cáscaras de plátano verde-bagazo de caña (PVB) (50/50), cáscaras de plátano maduro-bagazo de caña (PMB) (50/50).
Cultivo de Pleurotus ostreatus
Los inóculos de Pleurotus ostreatus se obtuvieron de semillas de trigo cultivada con esta cepa utilizando una relación de 4% (p/p en base húmeda) para cada unidad de fermentación. Las unidades de fermentación fueron bolsas de polipropileno biorientado (esterilizables), con tapón de algodón y capacidad de 500g, pero solo empleando 200 g en cada una de ellas. La fermentación se llevó a cabo a 28°C, en oscuridad, y ajustando la humedad a 63%, condiciones apropiadas para el crecimiento del organismo y la producción de enzimas3.
Medición de la actividad enzimática lacasa (Lcc)
Los extractos enzimáticos de cada cultivo se obtuvieron con buffer de acetato 0.05 M, pH 4.8, en una relación 0.25 g de sustrato/mL de buffer. Se agitaron vigorosamente y se centrifugaron a 4000 rpm durante una hora. El sobrenadante se filtró sobre gasa y se centrifugó de nuevo a 4000 rpm durante 30 min y se almacenó a 4°C para una posterior medición de su actividad enzimática.
La determinación de la enzima lacasa se llevó a cabo por la oxidación ABTS [2,2'- Azinobis(3-ethylbenzothiazoline-6-sulfonic acid)] al catión ABTS+ con un volumen de reacción de 2 ml que comprende a 200 μl de ABTS 1 mM, 600 μl de buffer acetato de sodio 0.1M, pH 5 y 1200 μl de extracto enzimático12. La absorbancia se tomó a una longitud de onda de 420 nm en un espectofotometró (Unicam Helios B NC 9432 UVB 1000E, Termo Spectronic, Rochester NY), realizando medidas al inicio de la reacción y tres minutos después, para obtener un delta de absorbancia útil en los cálculos, donde se utilizó un coeficiente de extinción de 36000 M-1 cm-1 12-13. Una unidad enzima se define como 1 μmol de producto formado por minuto (U = μmol / min), bajo las condiciones del ensayo. Las unidades enzimáticas (U/L) de lacasa se calculan utilizando la Ecuación 1.
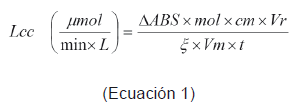
Donde, ΔABS es la lectura de absorbancia final - lectura de absorbancia inicial, Vr es el volumen total de la reacción, ξ es el coeficiente de extinción que tiene un valor de 36000 mol-1 cm-1, Vm es el volumen de la muestra.14
Diseño experimental y análisis estadístico
Para este estudio se aplicó un diseño experimental aleatorio de medidas repetidas, con los siguientes factores: tiempo de fermentación (5 niveles) y tipo de sustrato (4 niveles). El tiempo de medición de la fermentación fue en los días 12, 24, 34, 41 y 45. Los sustratos utilizados fueron cáscaras de plátano verde (PV), cáscaras de plátano maduro (PM), cáscaras de plátano verde-bagazo de caña (PVB), cáscaras de plátano maduro-bagazo de caña (PMB). Los tratamientos se realizaron por triplicado, en total fueron 60 tratamientos. La variable de respuesta fue la actividad lacasa. Los datos experimentales se analizaron mediante un ANOVA y las diferencias significativas se establecieron utilizando la prueba de Duncan. El análisis se realizó mediante Statgraphics plus® de Microsoft.
Resultados y discusión
En los ensayos preliminares se observaron diferentes intensidades de color amarillo en los extractos de cada uno de los tratamientos, los cuales se utilizaron para la cuantificación de la actividad lacasa (Figura 1). Durante el tiempo de experimentación la coloración de los extractos enzimáticos aumentaba lo que se atribuye al estado de maduración del sustrato en el momento de hacer las mediciones. Amaga et al (2008)18 establecieron que se incrementa el porcentaje de lignina (14.3–15.4%) a medida que las cáscaras de plátano maduran, y si se tiene en cuenta que la lignina es utilizada por los hongos filamentosos para producir enzimas ligninasas como la lacasa, se podría afirmar que las cáscaras de plátano maduro pueden tener una mayor producción de lacasa.

En la figura 2 se presenta el comportamiento de la actividad lacasa para los diferentes tratamientos durante el tiempo de experimentación. A partir del día 12 de cultivo se observa un pequeño valor en la producción de lacasa. En los sustratos utilizados se obtiene un máximo de actividad lacasa el día 24; sin embargo, el tratamiento PM alcanza su máximo en el día 34. Luego comienza a descender, aunque en el día 45 hay un leve aumento de esta actividad para el tratamiento con sustrato PMB. Este comportamiento es similar al reportado por Murrieta et al. (2002)15, quienes evaluaron la producción de lacasa utilizando Pleurotus pulmonarius y Trichoderma viride sobre pulpa de café.
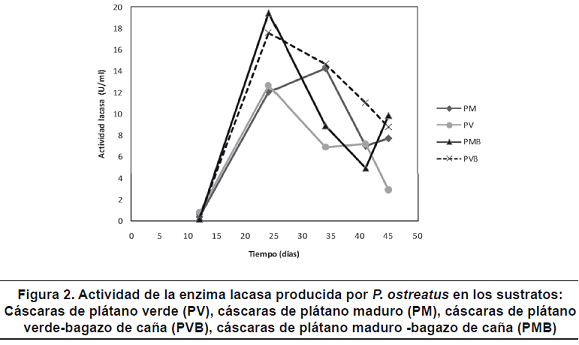
La mayor actividad de lacasa en el estudio de Murrieta et al. (2002)15 se obtuvo en el día 12 con un valor de 34.69 U/g sustrato y descendió en el día 16, debido a que el sustrato estaba cubierto completamente con el micelio (masa de hifas que constituye el cuerpo vegetativo de un hongo), lo que indica el inicio de la fructificación. En esta etapa la producción de lacasa disminuye y comienza la producción de celulasas que se relaciona con el desarrollo de los primordios (cuerpos fructíferos en las primeras etapas de desarrollo)16. En el presente estudio se encontró un comportamiento parecido, donde la máxima actividad enzimática coincide con el máximo crecimiento del micelio durante la fase vegetativa y decrece hasta aparecer los cuerpos fructíferos del hongo. Esta enzima puede utilizarse como un indicador morfogenético al mostrar el máximo crecimiento del micelio, y de esta manera obtener el tiempo que debe comenzar a fructificar el P. ostreatus.
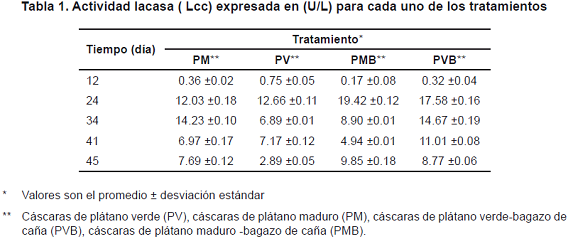
Los valores de la actividad lacasa obtenidos por ml de extracto (U/ml) para cada uno de los tratamientos de cultivo durante 45 días se muestran en la Tabla 1. Los resultados de la actividad lacasa tuvieron diferencias significativas entre tratamientos. El sustrato PMB resultó ser el más adecuado para la producción de lacasa, teniendo una mayor concentración de esta en un tiempo de 24 días (19.4 U/ml), seguido del sustrato PVB que al mismo tiempo reportó un valor de 17.6 U/ml. Los PV y PM obtuvieron las actividades más bajas con valores entre 12-12.6 U/ml para ese mismo tiempo de cultivo (24 días). Si se comparan estos dos últimos sustratos se puede apreciar que se produce más lacasa cuando se utiliza sustrato de cáscaras de plátano maduro (PM), lo cual pudo contribuir a la mayor actividad de esta enzima empleando bagazo de caña (PMB).
La lignina es un componente estructural de la pared celular de los vegetales, junto con la celulosa, la hemicelulosa y las pectinas. Además, la lignina es una cadena de compuestos fenólicos conformado por aldehído siríngico, alcoholes coniferílicos, sinapílicos y cumarílicos17. El principal componente de la cáscara de plátano es la lignina con un contenido entre 12%-16.8%, de acuerdo al estado de madurez y al genotipo de la variedad18-19. Durante la maduración del plátano, el contenido de lignina aumenta contrario a lo que sucede con la cáscara de banano. Adicionalmente, se ha reportado que el incremento de la glucosa en la cáscara de plátano se debe a la hidrólisis del almidón y a la degradación de la hemicelulosa presente en este material vegetal18. Los cambios dinámicos en la matriz de la superficie del sustrato pueden afectar los resultados de la actividad enzimática3. Esto podría explicar el comportamiento de la actividad lacasa cuando se emplea cáscara de plátano maduro. El incremento del contenido de lignina y la deficiencia de hemicelulosa en la cáscara a medida que se madura el plátano podría contribuir al aumento en la producción de enzimas ligninolíticas como la lacasa.
Las condiciones de crecimiento constituyen un factor importante que influye en la eficiencia de los hongos para producir lacasa. Por ejemplo, cuando se suplementan las cáscaras de cacahuete con diferentes sustratos ricos en nitrógeno a una razón de 9:1, la productividad de lacasa aumenta de 2.2 a 49.2 U/g de sustrato seco20. Los niveles de la actividad lacasa se pueden mejorar después de optimizar las condiciones de cultivo y de adicionar inductores (fuentes de nitrógeno y xilidina). Reddy et al. (2003)6 encontraron valores de lacasa entre 0.11 y 1.66 U/mg de proteína de sustrato después del día 10 de cultivo con P. ostreatus y P. sajor-caju sobre residuos agrícolas de banano. Ramirez et al. (2003)21 reportaron valores de 20 U/ml de actividad lacasa utilizando P. ostreaus en un sustrato de vinaza y salvado de trigo (1:1). Sin embargo, estos resultados son particulares para cada sistema y dependen del sustrato y las condiciones de cultivo.
Membrillo et al. (2008)22 sugirieron que el tamaño de partícula y la geometría del bagazo de caña de azúcar afectan los niveles de lacasa producidos con P. ostreatus. Teniendo en cuenta lo expuesto anteriormente, es posible sugerir que el sustrato conformado por plátano maduro y bagazo de caña de azúcar (PMB) genera un complemento que aumenta la actividad lacasa del P. ostreatus con las condiciones propuestas en este estudio. La cáscara de plátano puede ser un buen sustrato cuando se suplementa con otro tipo de residuo lignocelulósico, como por ejemplo el bagazo de caña.
Conclusiones
El Pleurotus ostreatus es un hongo comestibles que tiene la capacidad de producir complejos enzimáticos con actividad lignolítica, como la lacasa. El estudio de la producción de este tipo de enzimas, de gran interés para la industria alimentaria, ambiental y química, a partir de cáscaras de plátano de diferentes estados de maduración y bagazo de caña es una buena alternativa para el aprovechamiento de residuos orgánicos por medio de procesos biotecnológicos. Durante el desarrollo de este trabajo, se encontró que el Pleurotus ostreatus produce mayor cantidad de lacasa (19.4 U/ml) en el día 24 de cultivo utilizando como sustrato cáscara de plátano maduro y suplementado con bagazo de caña (50/50). Además, cuando se desarrolla completamente el micelio se presenta la mayor actividad de la lacasa, y posteriormente desciende debido al desarrollo de los cuerpos fructíferos del hongo. Se recomienda estudiar el efecto de otros suplementos lignocelulósicos y otras condiciones de proceso (pH, temperatura) para encontrar mayores producciones de la enzima lacasa.
Agradecimientos
Se reconoce la ayuda ofrecida por el laboratorio de biotecnología de la Universidad Jorge Tadeo Lozano. Además se agradece los aportes realizados por la Ingeniera Yineth Piñeros para desarrollar este estudio.
Referencias
1. AGRONET. Área y producción agrícola y pecuaria. Análisis y Estadísticas. [en línea]. Bogotá: Ministerio de Agricultura y Desarrollo Rural, 2008. [Citado 15 de diciembre 2009]. URL disponible en: <http://www.agronet.gov.co> [ Links ]
2. COLOMBIA. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. La cadena del plátano en Colombia. Documento de trabajo N° 102. Bogotá: El Ministerio, 2006. 40 p. [ Links ]
3. LIU, Lihua; et al. Fermentation optimization and characterization of the laccase from Pleurotus ostreatus strain 10969. En: Enzyme and Microbial Technology. 2009. Vol. 44, no. 6-7, p. 426–433. [ Links ]
4. DUFOUR, Dominique; et al. Diversidad del plátano de cocción consumido en Colombia. En: Congreso Iberoamericano de Ingeniería de Alimentos. (7: 6-9, septiembre: Bogotá). Memorias. Bogotá: Universidad de la Sabana, 2009. [ Links ]
5. LY, J. Bananas y plátanos para alimentar cerdos: aspectos de la composición química de las frutas y de su palatabilidad. En: Revista Computadorizada de Producción Porcina. 2004. Vol. 11, no. 3, p. 5-24. [ Links ]
6. REDDY, G.V.; et al. Utilization of banana waste for the production of lignolytic and cellulolytic enzymes by solid substrate fermentation using two Pleurotus species (P. ostreatus and P. sajor-caju). En: Process Biochemistry. 2003. Vol. 38, no. 10, p. 1457-1462. [ Links ]
7. OSMA, J Johann F.; TOCA HERRERA, José L. y RODRÍGUEZ-COUTO, Susana. Banana skin: A novel waste for laccase production by Trametes pubescens under solid-state conditions. Application to synthetic dye decolouration. En: Dyes and Pigments. 2007. Vol. 75, no. 1 p. 32-37. [ Links ]
8. GRANDA, Diana M.; MEJÍA, Amanda y JIMÉNEZ, Gloria. Utilización de residuos de plátano para la producción de metabolitos secundarios por fermentación en estado sólido con el hongo Lentinus crinitus. En: Vitae, Revista de la Facultad de Química Farmacéutica. 2005. Vol. 12, no. 2, p. 13-20. [ Links ]
9. MOTATO, Karina; MEJÍA, Amanda y LEÓN, Angela. Evaluación de los residuos agroindustriales de plátano (Musa paradisíaca) y aserrín de abarco (Cariniana piriformes) como sustratos para el cultivo del hongo Pleurotus djamor. En: Vitae, Revista de la Facultad de Química Farmacéutica. 2006. Vol. 13, no. 1, p. 24-29. [ Links ]
10. RODRÍGUEZ, Suyén; et al. Tratamiento de efluentes industriales coloreados con Pleurotus spp. En: Revista Iberoamericana de Micología. 2003. Vol. 20, p. 164-168. [ Links ]
11. WHITAKER R. Handbook of Food Enzymology. New York, NY, USA: Marcel Dekker Inc., p 526. 2002. [ Links ]
12. BUSWELL, J.A.; CAI, Yijin y CHANG, Shu-Ting. Effect of nutrient nitrogen and manganeso on manganeso peroxidase and lacase production by Lentinula (Lentinus) edodes. En: FEMS Microbiolology Letter. 1995. Vol. 128, no. 1, p. 81-88. [ Links ]
13. CAVALLAZI, J. R.; DE ALMEIDA, M. G. y MEGUMI, K. M. Laccase production by Lepista sordida. En: Brazilian Journal of Microbiology. 2004. Vol. 34, p. 261-263. [ Links ]
14. LÓPEZ, C.; et al. Producción de la enzima lacasa por el hongo clasdosporiumc clasdoporioides en presencia de fenantreno. En: VI Congreso de la Sociedad Cubana de Bioingeniería. Habana, Cuba: Sociedad Cubana de Bioingeniería, 2005. p. 2-6. [ Links ]
15. MURRIETA-HERNADEZ, Dulce María; MATA, Gerardo y IGLESIAS-ANDREU, Lourdes. Cambios en la producción de lacasa por el hongo Pleurotus pulmonarius (FR) quél. cultivado en pulpa de café en confrontación con Trichoderma viride pers., un hongo contaminante. En: Foresta Veracruzana. 2002. Vol. 4, no. 1, p. 47-52. [ Links ]
16. OHGA, Shoji; et al. Transcriptional regulation of laccase and cellulase in relation to fruit body formation in the mycelium of Lentinula edodes on a sawdust-based substrate. En: Mycoscience. 2000. Vol. 41, no. 2, p. 149-153. [ Links ]
17. BADUI DEGRAL, Salvador. Química de los alimentos. 4ª Ed. México: Pearson Educación, 2006. 716 p. [ Links ]
18. EMAGA, Thomas Happi; et al. Dietary fibre components and pectin chemical features of peels during ripening in banana and plantain varieties. En: Bioresource Technology. 2008. Vol. 99, no. 10, p. 4346–4354. [ Links ]
19. CHOI, Sun Tay y HUBER, Donald. Differential sorption of 1-methylcyclopropene to fruit and vegetable tissues,storage and cell wall polysaccharides, oils, and lignins. En: Postharvest Biology and Technology. 2009. Vol. 52, no. 1, p. 62–70. [ Links ]
20. MISHRA, Abha y KUMAR, Sunil. Cyanobacterial biomass as N-supplement to agro-waste for hyper-production of laccase from Pleurotus ostreatus in solid state fermentation. En: Process Biochemistry. 2007. Vol. 42, no. 4, p. 681–685. [ Links ]
21. RAMIREZ, Nubia Esperanza; et al. Caracterización de la lacasa obtenida por dos métodos de producción con Pleurotus ostreatus. En: Revista Colombiana de Biotecnología. 2003. Vol. 5, no. 2, p. 64–72. [ Links ]
22. MEMBRILLO, Isabel; et al. Effect of substrate particle size and additional nitrogen source on production of lignocellulolytic enzymes by Pleurotus ostreatus strains. En: Bioresource Technology. 2008. Vol. 99, no. 16, p. 7842–7847. [ Links ]














