Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.7 no.2 Medellín July/Dec. 2012
Implementación de un método basado en PCR, para el diagnóstico de Ehrlichia spp., en caninos de Medellín (Colombia)*
Implementation of a PCR-based method for the diagnosis of Ehrlichia spp, in canine in Medellin (Colombia)
Implementação de um método baseado em PCR, para o diagnóstico de Ehrlichia spp., em caninos de Medellín (Colômbia)
Lina María Carrillo Bonilla1,2*, MV, Msc; Sara Betancur Cardona1 MV; Daniel Roldán Cardona1 MV; Juan Esteban Pérez Jaramillo2, Biol, MSc; Daniel Galeano Rivera1 MV; Érica Tatiana Loaiza Echeverría1 MV, Msc; Carlos Andrés Giraldo Echeverría1 MV, Msc.
*Autor para correspondencia: linacarrillo@gmail.com, Facultad de Ciencias Agrarias, Ciudadela de Robledo, Carrera 75 N° 65*87, Medellín - Colombia.
Para citar este artículo: Carrillo LM, Betancur S, Roldán D, Pérez TE, Galeano D, Loaiza ET, Giraldo CA. Implementación de un método basado en PCR, para el diagnóstico de Ehrlichia spp., en caninos de Medellín (Colombia). Rev CES Med Vet Zootec 2012; Vol 7 (2): 38-46.
1 Grupo de Investigación VERICEL, Facultad de Ciencias Agrarias, Universidad de Antioquia, AA 1226, Medellín, Colombia.
2 Programa de Estudio y Control de Enfermedades Tropicales -PECET-, Universidad de Antioquia, AA 1226, Medellín, Colombia.
(Recibido: 08 de octubre de 2012; aceptado: 11 de diciembre de 2012)
Resumen
La Ehrlichiosis es una enfermedad de distribución mundial, es endémica en los países tropicales y subtropicales en donde la seroprevalencia puede llegar a ser hasta del 33%, como en México e Israel. La baja sensibilidad de las pruebas utilizadas para el diagnóstico, 67% en las pruebas con IFI, han llevado a la necesidad de buscar nuevas alternativas que permitan diagnosticar la enfermedad de manera rápida y eficaz. La PCR es una de estas técnicas que podría ofrecer una alta sensibilidad y especificidad. El objetivo de este trabajo fue implementar la prueba de PCR, para el diagnóstico de Ehrlichia spp., en muestras de sangre de caninos sospechosos provenientes de consultorios veterinarios de la ciudad de Medellín. Se tomaron 90 muestras, 33 de animales sospechosos de ehrlichiosis por sintomatología, y 57 de animales sanos como probables negativos. Se utilizó como control positivo el ADN de la cepa Madrid. La PCR fue realizada utilizando como ejemplo el protocolo sugerido por Aguirre et al. (2004). Se utilizaron los primers EEC y ECB reportados por Dawson et al. (1994). En este estudio se logró amplificar la banda de 500 pb correspondientes al gen 16s ARNr de Ehrlichia spp., en 11 muestras de los animales sospechosos, obteniendo una frecuencia de presentación del 33,3%, confirmando la presencia de la bacteria en los animales de nuestro medio, y logrando la implementación de PCR para Ehrlichia spp. como herramienta diagnóstica en nuestra ciudad.
Palabras clave: Ehrlichiosis Monocítica Canina, PCR, trombocitopenia.
Abstract
Ehrlichiosis is a worldwide illness, endemic in tropical and subtropical countries where seroprevalence can reach up to 33% as it is the case in México and Israel. However, the low sensitivity of the serological tests used for diagnosis, 67% in tests with IFI, has led to a required searching for new alternatives to diagnose the disease quickly and effectively. PCR is one of these techniques that could provide high sensitivity and specificity. The target of this study was to implement the PCR test for the diagnosis of Ehrlichia spp., on blood samples from animals with suspected illness from veterinary clinics in the city of Medellin. 90 samples were taken, 33 samples from animals suspected of having symptoms and 57 from healthy animals as probable negatives. DNA from the Madrid strain was used as a positive control. The PCR was performed using as an example the protocol suggested by Aguirre et al (2004). EEC and ECB primers reported by Dawson et al (2004) were used (aquí el propio texto en español no está claro). In this study the 500pb band was amplified, corresponding to the 16s rRNA of Ehrlichia spp., in 11 samples of the animals with suspected illness, obtaining a presentation rate of 33.3%, confirming the presence of bacteria in the animals of the environment, and achieving the implementation of PCR for Ehrlichia spp. as a diagnostic tool in the city.
Key words: Canine Monocytic Ehrlichiosis, PCR, thrombocytopenia.
Resumo
A ehrlichiose é uma doença em todo o mundo, é endêmica em países tropicais e subtropicais, onde a soroprevalência pode atingir até 33%, como no México e Israel. A baixa sensibilidade dos testes utilizados para o diagnóstico, 67% nos testes de IFI, levaram à necessidade de buscar novas formas de diagnosticar a doença de forma rápida e eficaz. PCR é uma técnica de tal forma que poderia fornecer alta sensibilidade e especificidade. O objetivo deste trabalho foi implementar o teste de PCR para o diagnóstico de Ehrlichia spp., Em amostras de sangue de cães suspeitos de clínicas veterinárias da cidade de Medellín. Demorou 90 amostras, 33 amostras de suspeitos que apresentavam sintomas de erliquiose e 57 animais saudáveis como negativo provável. Foi utilizado como controle positivo de ADN a partir da estirpe de Madrid. A PCR foi padronizada utilizando o exemplo do protocolo proposto por Aguiar et al. (2004). Utilizouse primers BCE CES e relatado por Dawson et al. (1994). Neste estudo foram amplificados de banda de 500 pb para o gene 16S rRNA do gênero Ehrlichia em 11 amostras de animais suspeitos, a obtenção de uma taxa de apresentação de 33,3%, o que confirma a presença de bactérias em animais nosso meio ambiente e obter a implementação de PCR por Ehrlichia spp. como uma ferramenta de diagnóstico em nossa cidade.
Palavras chave: Erliquiose Monocítica Canina, PCR, trombocitopenia.
Introducción
Ehrlichia spp. corresponde a un grupo de bacterias intracelulares gram negativas, de la familia Rickettsiae, con distribución mundial, potencialmente zoonóticas, las cuales, necesitan de un mamífero como reservorio, y de un artrópodo como vector para ser transmitidas. Los artrópodos pertenecientes a los géneros Ixodes spp. y Rhipicephalus spp., son sus principales vectores15,22,27. Entre las diferentes especies de Ehrlichia spp. que afectan a los mamíferos, se encuentran: E. canis, que produce ehrlichiosis monocítica en perros; E. chaffeensis, que causa ehrlichiosis monocítica humana y que también ha sido identificada en perros, coyotes, cabras y venados; E. ewingii, que causa ehrlichiosis granulocítica en perros y en humanos y E. risticii, causante de la ehrlichiosis monocítica equina23,31. Finalmente se ha reportado E. phagocytophilum (Anaplasma phagocytophilum), causante de la ehrlichiosis granulocítica humana12.
La Ehrlichiosis Canina es una enfermedad grave, cuyos signos clínicos son inespecíficos, e incluyen: depresión, letargia, anorexia, fiebre, linfoadenomegalia, esplenomegalia y pérdida moderada de peso30. Pueden presentarse petequias y equimosis en la piel y membranas mucosas y, ocasionalmente, epistaxis. Aunque las alteraciones hematológicas son complejas y multifactoriales, tanto en pacientes agudos como crónicos, la trombocitopenia se presenta frecuentemente en la infección por Ehrlichia spp., acompañada de anemia y de cambios en el recuento de leucocitos17. E. canis, el agente más común de Ehrlichiosis Canina, es generalmente considerada como no zoonótica20, sin embargo, en un estudio realizado en el Estado de Lara en Venezuela29, encontraron que de 20 pacientes humanos que ingresaron con signos clínicos compatibles con Ehrlichiosis Monocítica Humana, seis resultaron positivos a E. canis por PCR.
La Ehrlichiosis es una patología frecuente en las zonas tropicales y subtropicales donde está presente el vector. Se han reportado seroprevalencias en perros del 33,1% en México28, en Israel del 30%5, en Perú del 16,5%1 y en Brasil del 21,7%9. Los datos anteriores la convierten en una de las enfermedades emergentes de mayor importancia en la clínica veterinaria.
El estado de esta enfermedad es poco conocido en Colombia. Pocos estudios se han desarrollado en el país: en Montería (Córdoba), se comprobó la enfermedad en 20 de 74 perros sospechosos utilizando la técnica de capa sanguínea blanca teñida con Wright21. En Cali (Valle del Cauca), se encontró una seropositividad del 49,5% en 101 perros sospechosos a E. canis, usando la prueba ELISA34. Recientemente, se encontró una seropositividad contra E. chaffensis de 31,8% en caninos de Villeta (Cundinamarca)18.
Las técnicas utilizadas actualmente para su diagnóstico son: la inmunofluorescencia indirecta (IFI), ELISA, frotis directo, cromatografía en capa sólida y la reacción en cadena de la polimerasa (PCR), siendo el ELISA y el frotis directo, las más utilizadas para el diagnóstico en nuestro medio. La IFI ha sido considerada la "prueba de oro" (Gold estándar) para el diagnóstico de Ehrlichia spp.32, sin embargo, es la visualización de la bacteria en extendidos de sangre, la correcta prueba de oro en Ehrlichiosis Canina33.
La dificultad en la observación de la bacteria debido a su muy bajo porcentaje de infección celular (menos 1%) hace que esta prueba tenga muy baja sensibilidad y que su lectura sea dispendiosa, por lo que se ha conciliado que un paciente es positivo "definitivo" a la enfermedad, siempre y cuando tenga la sintomatología clínica y los parámetros hematológicos característicos de Ehrlichia spp., sumado a títulos de IgG ≥ 1:25333,35.
Con pruebas como la ELISA y la IFI se puede detectar los anticuerpos anti-ehrlichia en pacientes infectados experimentalmente, a partir de los siete días posinfección, aunque algunos no desarrollan los anticuerpos sino hasta 28 días después de la infección27.
El diagnóstico serológico puede ser poco confiable debido a la demora en la respuesta de anticuerpos durante la fase aguda de la enfermedad, a la reacción cruzada con otros organismos íntimamente relacionados (como Anaplasma spp. y Neorickettsia spp.) y a la persistencia de los anticuerpos después de la resolución de la infección, lo que dificulta diferenciar entre el estado subclínico de la enfermedad y una infección anterior3, 7, 16, 27.
Se propone la PCR, como un método altamente sensible y especifico, que ofrece hasta un 100% de seguridad en el diagnóstico de muchas enfermedades, ya que detecta y amplifica el ADN de Ehrlichia spp4, 13, 24, 37. Esta prueba puede detectar Ehrlichia spp. tempranamente, de cuatro a diez días posinoculación, en pacientes infectados experimentalmente2, 27, 37. Un estudio realizado por Lidell et al. (2003)23, para determinar la presencia de Ehrlichia spp. demostró una sensibilidad de la IFI de sólo el 67%, comparada con la PCR; mientras que la sensibilidad y especificidad del ELISA es del 96,2 y 97,7%, respectivamente, comparada con la IFI10.
El propósito de este trabajo fue implementar la PCR para el diagnóstico de la Ehrlichiosis canina en la ciudad de Medellín (Colombia), para tener una herramienta que permita conocer el estado de la enfermedad en los caninos, el riesgo que puede representar la presencia de esta enfermedad en la población humana, y las especies de Ehrlichia spp. que circulan en la ciudad.
Materiales y métodos
Población de estudio
La muestra poblacional se determinó a conveniencia, sin discriminar por raza, sexo o edad. Este estudio se realizó con 33 caninos que ingresaron a consulta al Hospital Veterinario de la Universidad de Antioquia, al Centro Veterinario Juan Carlos Builes, a la Clínica Veterinaria la 80 y, a la Clínica Veterinaria Caninos y Felinos, ubicadas en la ciudad de Medellín. Se tipificaron como pacientes probablemente positivos a Ehrlichiosis, los caninos que presentaban al menos dos de los siguientes signos y/o síntomas como criterios de inclusión: presencia de garrapatas, fiebre, anorexia, linfadenitis, hematoquecia, petequias, epistaxis, hepatomegalia, esplenomegalia, uveítis u opacidad corneal, depresión, y pérdida de peso.
Como control negativo, se tomaron muestras de 57 cachorros sanos menores de seis meses, de criaderos sin historia de Ehrlichiosis, de raza Bulldog, utilizando los signos o síntomas antes descritos como criterios de exclusión.
Para los análisis de especificidad, se realizó en el laboratorio Syngamia de la Universidad de Antioquia, una prueba rápida de aglutinación en placa con 2β-mercaptoetanol (cepa M-) 14, y hemocultivo a todas las muestras, para la detección de Brucella canis, bacteria que puede generar reacción cruzada.
Toma de muestras
Se obtuvo 1 mL de sangre de la vena safena, vena cefálica o vena yugular, en tubos con vacío con anticoagulante EDTA (Vacutainer®, Becton Dickinson, USA). Las muestras fueron conservadas en refrigeración a 4 °C, hasta su procesamiento. Los propietarios de los caninos firmaron un consentimiento informado acerca del uso y objetivo de la toma de la muestra, así como de sus riesgos.
Hemograma
Se realizó un hemograma completo a las muestras de sangre para la determinación de anemia (hematocrito <35%), trombocitopenia (<300000 plaquetas/µL), leucocitosis (>14000 leucocitos/µL) y leucopenia (<2000 leucocitos/µL).
Serología para Ehrlichia spp
Las muestras de suero fueron procesadas con el kit SNAP® 4Dx Plus (IDEXX Laboratories, Inc, Europe), siguiendo las recomendaciones del fabricante. PCR para Ehrlichia spp.
El ADN se purificó con el DNaesy Blood and tissue kit (QIAGEN®) siguiendo las especificaciones del fabricante. El kit se basa en la capacidad de retener el material genético en columnas de sílice para separarla del resto de componentes celulares. El ADN extraído se cuantificó en el espectrofotómetro Nanodrop 1000 (THERMO SCIENTIFIC®) a una absorbancia de 260nm. Para la PCR, se usaron los oligonucleótidos con los primers ECC Fw (5'- AGAACGAACGCTGGCGGCAAGCC-3') y ECB (5'CGTATTACCGCGGCTGCTGGC-3'), reportados por Dawson et al. (1994)10 que amplifican un fragmento de 500 pb dentro de la región del ADNr 16S del género Ehrlichia. Las condiciones usadas en la PCR convencional se hicieron siguiendo el protocolo desarrollado por Aguirre et al. (2004)3.. 0,25 µM de cada uno de los oligonucleótidos, 200 µM de cada deoxi-nucleótido, 2 mM de MgCl2, y 1,2 unidades de TaqPolimerasa (Fermentas®). Se utilizó 1µL de ADN extraído para completar un volumen final de reacción de 50µL. Posterior a una desnaturalización durante cuatro minutos a 94 °C, el programa de amplificación fue de 35 ciclos de: 94°C durante un minuto, 60 °C durante un minuto y 72 °C durante un minuto, con una extensión final de cinco minutos a 72 °C. Los productos obtenidos fueron corridos en geles de agarosa al 2% a 70V durante una hora. Se utilizó un marcador de peso molecular de 50pb (Fermentas®) y se revelaron en transiluminador ultravioleta para verificar la presencia de ADN de Ehrlichia spp.
Como control positivo de la prueba, se utilizó el ADN extraído de cultivo celular de la línea DH82 infectado por E. canis (strain Madrid) donado por el laboratorio Departamento de Medicina y Cirugía Animal, Facultad de Veterinaria de la Universidad Complutense de Madrid.
Análisis estadístico
Los datos obtenidos por canino como edad, sexo, raza, procedencia y sintomatología, fueron consignados en una base de datos en el programa Excel® 2007. Se utilizaron tablas de 2 x 2 para determinar la existencia de asociación entre cada uno de los signos clínicos encontrados en los pacientes y el resultado de la PCR, para determinar dicha asociación, se utilizó el estadístico exacto de Fisher y se consideró estadísticamente significativo un p<0,05.
Se utilizó el programa estadístico Statcalc® utilizando tablas de 2 x 2 para obtener los valores de Sensibilidad (Se), Especificidad (Sp), Valor Predictivo Positivo (VPP) y Valor Predictivo Negativo (VPN) de la prueba.
Resultados
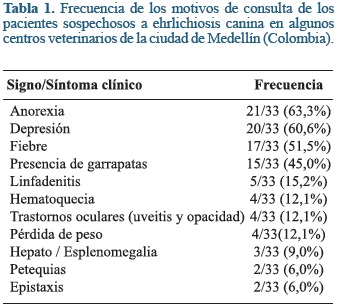
Se tomaron muestras de 12 hembras y 21 machos que cumplían los criterios de inclusión, con edades entre 1 a 15 años; de razas inespecífica (30,3%), Poodle (24,2%), Labrador (15,2%), Pastor alemán (6,1%), Schnauzer (6,1%), Weimaraner (6,1%), Rottweiler (4%), Chowchow (4%) y Bulldog (4%). Los principales motivos de consulta de los pacientes muestreados fueron anorexia, depresión, fiebre y presencia de garrapatas (Tabla 1). La principal alteración hematológica fue trombocitopenia (Tabla 2).

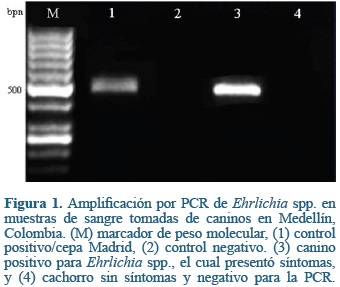
La serología para E. canis únicamente se realizó a diez pacientes, debido a restricciones presupuestales, de los cuales, cinco resultaron seropositivos, dos pacientes presentaron historia de ELISA positivo 40 días antes de la PCR, y tres resultaron seronegativos. No se encontraron resultados positivos para B. burgdorferi, A. phagocytophilum/A. platys, y D. immitis. Se logró amplificar el fragmento del gen 16s ARNr de 500pb de Ehrlichia spp. en 11 (33,3%) de los caninos sintomáticos (Figura 1). No se amplificó esté fragmento en los controles negativos asintomáticos (n=57), incluyendo diez de estos que fueron seropositivos para Brucella canis. No hubo ninguna asociación estadísticamente significativa entre los síntomas y signos clínicos con los resultados de la PCR.
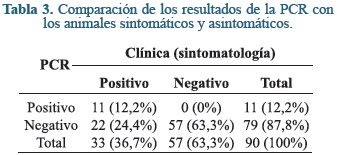
Se comparó los resultados de la PCR con los resultados clínicos (Tabla 3) y con los resultados del ELISA (Tabla 4) para hacer los cálculos de sensibilidad (Se), especificidad (Sp), valor predictivo positivo (VPP) y negativo (VPN). En comparación con los resultados clínicos la PCR tuvo una Se del 33,3% y una Sp del 100%. Igualmente, se calculó el VPP, que es la capacidad de detectar como positivo a un paciente que realmente tiene la enfermedad, o sea, que está enfermo, en un 100%. El VPN que es la capacidad de detectar como negativo a un paciente que realmente no tiene la enfermedad, o sea, que está sano, se calculó en un 72.1%.
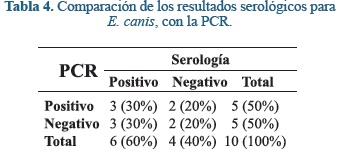
Mientras que cuando se compara los resultados del ELISA con la PCR, se encuentra que tanto Se cómo Sp son del 50% con un VPP del 60% y un VPN fue del 40%.
Discusión
El diagnóstico de Ehrlichiosis Canina en nuestro medio se basa en pruebas directas como la técnica de capa sanguínea blanca teñida con Wright que tiene baja sensibilidad y especificidad, y en ensayos serológicos como el ELISA cuyos resultados en la literatura de sensibilidad y especificidad han sido contradictorios, Belanger et al, (2002)6 y De Morais et al. (2004)11, demostraron que este ensayo inmunodiagnostico tiene una sensibilidad y especificidad cercana a la de la IFI que oscila entre 67% y el 90%, sin embargo, Waner et al. (1996b)36 y Moreira et al. (2009)25, reportaron para esta misma prueba una baja confiabilidad. Por esta razón Neer et al. (2002)26, recomienda para el diagnóstico de esta enfermedad el uso de la PCR como prueba confirmatoria.
En este trabajo se logró estandarizar la PCR para Ehrlichia spp. utilizando los primers EEC y ECB reportados por Dawson et al. (1994)10. La prueba demostró ser altamente especifica, con un 100% de especificidad incluso en muestras con presencia de otras bacterias intracelulares como Brucella canis. Sin embargo, la PCR estandarizada en este trabajo tiene una limitada sensibilidad, probablemente debido a que los animales que se tomaron como positivos no necesariamente eran verdaderos positivos, pues son animales sospechosos a la infección por sintomatología y análisis clínico, y la Ehrlichiosis Canina es una patología con sintomatología inespecífica.
Esta puede ser también la explicación de encontrar una mayor sensibilidad en la PCR cuando se comparan los resultados con las muestras que tenían pruebas más específicas como el ELISA. Para la determinación exacta de Se y Sp de esta PCR debe utilizarse la prueba de oro, cual es el extendido la cual se espera realizar en próximos estudios.
Tener una prueba con una alta especificidad pero no tan buena sensibilidad, demuestra que esta PCR es una excelente prueba confirmatoria y que puede ser utilizada en el diagnóstico confirmatorio de la enfermedad en nuestro medio cuando hay sospechas de Ehrliquiosis, pero no debe ser utilizada como una prueba tamiz en, por ejemplo, estudios de prevalencia, reafirmando la sugerencia hecha por Neer et al., (2002)26 de utilizar tanto muestras serológicas como moleculares para el diagnóstico definitivo de Ehrlichiosis.
Por otro lado, cuando se analizan los tres casos en donde el ELISA fue positivo pero PCR negativo, que es el resultado que más influye en la disminución de la especificidad de la prueba, podemos observar que dos de estos pacientes tuvieron terapia antibiótica antes de la toma de muestra para la PCR y después de los resultados serológicos, lo que induce un sesgo en el resultado, pues estudios previos concluyeron que 14 días de tratamiento con doxiciclina elimina la infección aguda por E. canis 8; sin embargo, los títulos de anticuerpos se mantienen en concentraciones altas, es por esto que para pruebas serológicas, el parámetro para determinar el éxito terapéutico es después de la 7-8 semanas postratamiento19.
Para poder validar mejor esta comparación entre los resultados serológicos y moleculares se sugiere realizar estudios que incluyan un mayor número de muestras y utilizar como prueba serológica la IFI. El no poder hacer una comparación más exacta con muestras que sean realmente positivas demuestra la gran deficiencia en el diagnóstico de la Ehrlichiosis que se tiene en nuestro medio, pues no hay disponibilidad de hacer cultivo, o IFI y el alto costo de las pruebas serológicas como el ELISA limita su utilización.
La PCR puede ser usada no sólo para el diagnóstico de la enfermedad, sino también para evaluar la eliminación del patógeno después de realizada la terapia antibiótica, con lo cual se puede reducirse el riesgo de reinfección del paciente o determinarse el estado del paciente como portador en la etapa subclínica de la enfermedad3,16,25 a pesar de que Neer et al. (2002)26 reporta que la sensibilidad de la PCR puede decaer en la fase crónica de la Ehrlichiosis.
Los resultados de la estandarización de la PCR con los primers ECC y ECB demostraron la presencia de Ehrlichia sp en nuestro medio, con una frecuencia del 11,2% en pacientes sintomáticos este resultado es similar a lo encontrado en Perú en donde Adrianzén et. al. (2003)1 reportaron una prevalencia del 16,5% para E canis utilizando la técnica de ELISA. Mientras fue menor a lo encontrado en Brasil en donde la seroprevalencia fue de 21,7% en 129 perros sospechosos 9.
Esta seropositividad es la menor de las reportadas en Montería, Cali y Villeta18,21,34. Este es el primer dato de frecuencia de la enfermedad en animales sintomáticos en la ciudad de Medellín, si bien no puede extrapolarse e a toda la prevalencia en la ciudad, pues no hay muestras representativas de todos los consultorios si da una idea clara de la alta circulación de la bacteria entre nuestras mascotas.
La implementación de la PCR para el diagnóstico de la Ehrlichiosis Canina fue realizada con éxito en el presente estudio y se propone esta PCR como prueba confirmatoria para el diagnóstico de Ehrlichiosis Canina en la ciudad de Medellín.
Finalmente, con este primer estudio se aísla por primera vez en nuestro medio el ADN de esta bacteria lo que abre toda una línea de investigación sobre esta enfermedad tan desconocida en nuestro medio. De forma inmediata se espera secuenciar este ADN para poder hacer la determinación de la especie circulante y hacer el primer reporte de especie para Colombia. Además con la determinación de la especie se podrá determinar el riesgo para la población humana, así como toda la caracterización epidemiológica del ciclo para el establecimiento de medidas de prevención y control.
Agradecimientos
A todo el personal del Hospital Veterinario de la Universidad de Antioquia, del Centro Veterinario Juan Carlos Builes, de la Clínica Veterinaria la 80 y de la Clínica Veterinaria Caninos y Felinos. Al laboratorio Syngamia por los controles negativos y el procesamiento de las muestras para brucelosis canina. Al laboratorio Departamento de Medicina y Cirugía Animal, Facultad de Veterinaria de la Universidad Complutense de Madrid, en especial al Doctor Ángel Sainz por el control positivo. Al CODI por la financiación de este proyecto.
Referencias
1.Adrianzén J, et al. Seroprevalencia de la dirofilariosis y ehrlichiosis canina en tres distritos de Lima. Revista de Investigaciones Veterinarias del Perú 2003; 4:43-48. [ Links ]
2. Aguirre E, Tesouro MA, Amusategui I, Rodríguez-Franco F, Sainz A. Comparison between different polymerase chain reaction methods for the diagnosis of Ehrlichia canis infection. Ann N Y Acad Sci 2008 Dec; 1149:118-20. [ Links ]
3. Aguirre E, Sainz A, Dunner S, Amusategui I, López L, et al. First isolation and molecular characterization of Ehrlichia canis in Spain. Vet Parasitol 2004 Nov 10; 125(3-4):365-72. [ Links ]
4. Baneth G. Canine ehrlichiosis - a silent killer. En: World Congress WSAVA/FECAVA/CSAVA; 2006. URL: http://www.ivis.org. [ Links ]
5. Baneth G, Waner T, Koplah A, Weinstein S y Keysary A. Survey of Ehrlichia canis antibodies among dogs in Israel. Vet Rec 1996 Mar 16; 138(11):257-9. [ Links ]
6. Bélanger M, Sorenson HL, France MK, Bowie MV, Barbet AF, et al. Comparison of serological detection methods for diagnosis of Ehrlichia canis infections in dogs. J Clin Microbiol 2002 Sep; 40(9):3506-8. [ Links ]
7. Bell CA y Patel R. A real-time combined polymerase chain reaction assay for the rapid detection and differentiation of Anaplasma phagocytophilum, Ehrlichia chaffensis, and Ehrlichia ewingii. Diagn Microbiol Infect Dis 2005 Dec; 53(4):301-6. [ Links ]
8. Breitschwerdt EB, Hegarty BC y Hancock SI. Doxycycline hyclate treatment of experimental canine ehrlichiosis followed by challenge inoculation with two Ehrlichia canis strains. Antimicrob Agents Chemother 1998 Feb; 42(2):362-8. [ Links ]
9. Dagnone AS, de Moráis HS, Vidotto MC, Jojima FS, Vidotto O. Ehrlichiosis in anemic, thrombocytopenic, or tick-infested dogs from a hospital population in South Brazil. Vet Parasitol 2003 Nov 28; 117(4):285-90. [ Links ]
10. Dawson JE, Stallknecht DE, Howerth EW, Warner C, Biggie K, et al. Susceptibility of white-tailed deer (Odocoileus virginianus) to infection with Ehrlichia chaffeensis, the etiologic agent of human ehrlichiosis. J Clin Microbiol 1994 Nov; 32(ll):2725-8. [ Links ]
11.De Moráis HA, et al. Diretrizes gerais para diagnóstico e manejo de cães infectados por Ehrlichia spp. Clínica Veterinária 2004; 48:28-30. [ Links ]
12. Dumbler JS, Choi KS, García JC, Barat N, Scorpio DG, et al. Human granulocytic anaplasmosis and anaplasma phagocytophilum. Emerg Infect Dis 2005; 11:828-833. [ Links ]
13. Engvall EO, Pettersson B, Persson M, Artursson K, Johansson KE. A 16S rRNA-based PCR assay for detection and identificatión of granulocytic Ehrlichia species in dogs, horses, and cattle. J Clin Microbiol. 1996 Sep;34(9):2170-4. [ Links ]
14. Giraldo CA, Ruiz-Cortés ZT y Olivera M. Brucella canis en Medellín (Colombia), un problema actual. Revista U.D.C.A. Actualidad & Divulgación Científica 2009; 12(l):51-57. [ Links ]
15. Groves MG, Dennis GL, Amyx HL, Huxsoll DL. Transmission of Ehrlichia canis to dogs by ticks (Rhipicephalus sanguineus). Am J Vet Res 1975 Jul; 36(7):937-40. [ Links ]
16. Harrus S, Waner T, Aizenberg I, Foley JE, Poland AM, et al. Amplification of ehrlichial DNA from dogs 34 months after infection with Ehrlichia canis. J Clin Microbiol 1998 Jan; 36(l):73-6. [ Links ]
17. Harrus S, Aroch I, Lavy E y Bark H. Clinical manifestations of infectious canine cyclic thrombocytopenia. Vet Rec. 1997; 141(10):247-250. [ Links ]
18. Hidalgo M, Vesga JF, Lizarazo D, Valbuena G. Short report: A survey of antibodies against Rickettsia rickettsii and Ehrlichia chaffeensis in domestic animals from a rural area of Colombia. Am J Trop Med Hyg 2009 Jun; 80(6):1029-30. [ Links ]
19. Iqbal Z, Chaichanasiriwithaya W y Rikihisa Y. Comparison of PCR with other tests for early diagnosis of ehrlichiosis. J Clin Microbiol 1994 Jul; 32(7):1658-62. [ Links ]
20. Irwin PJ. Pups, PCRs and platelets: ehrlichia and anaplasma infections of dogs in Australia and overseas. Proceedings of the WSAVA Congress, Sydney, Australia. 2007. [ Links ]
21. Jaramillo GP Reporte de un caso clínico de Ehrlichiosis Canina en la Ciudad de Montería, departamento de Córdoba, Colombia. En: Memorias Primer Congreso Nacional y IV Panamericano de Clínica y Cirugía de pequeñas especies. VEPA. San Andrés, Colombia. 1996. [ Links ]
22. Lewis GE Jr, Ristic M, Smith RD, Lincoln T y Stephenson EH. The brown dog tick Rhipicephalus sanguineus and the dog as experimental hosts of Ehrlichia canis. Am J Vet Res. 1977 Dec; 38(12):1953-5. [ Links ]
23. Liddell AM, Stockham SL, Scott MA, Sumner JW, Paddock CD, et al. Predominance of Ehrlichia ewingii in Missouri Dogs. J Clin Microbiol 2003 Oct; 41(10):4617-22. [ Links ]
24. McBride JW, Corstvet RE, Gaunt SD, Chinsangaram J, Akita GY, Osburn BI, et al. PCR detection of acute Ehrlichia canis infection in dogs. J Vet Diagn Invest 1996 Oct; 8(4):441-7. [ Links ]
25. Moreira MBE, et al. Comparative evaluation of two serological methods for detection of Ehrlichia canis antibodies in dogs. Proceedings of the 34th World Small Animal Veterinary Congress WSAVA 2009, Sao Paulo, Brazil. URL: http://www.ivis.org. [ Links ]
26. Neer TM, Breitschwerdt EB, Greene RT, Lappin MR. Consensus statement on ehrlichial disease of small animals from the infectious disease study group of the ACVIM. J Vet Intern Med 2002 May-Jun; 16(3):309-15. [ Links ]
27. Neer TM. Canine monocytic and granulocytic ehrlichiosis. En: Greene C, editor. Infectious Diseases of the Dog and Cat. 2nd ed. Philadelphia: WB Saunders. 1998. p.139-147. [ Links ]
28. Nuñez L. Estudio de la seroprevalencia de Ehrlichia canis en México. Revista AMMVEPE 2003, 14:83-85. [ Links ]
29. Pérez M, Bodor M, Zhang C, Xiong Q, Rikihisa Y Human infection with Ehrlichia canis accompanied by clinical signs in Venezuela. Ann N Y Acad Sci 2006 Oct; 1078:110-7. [ Links ]
30. Procajło A, Skupieñ EM, Bladowski M, Lew S. Monocytic ehrlichiosis in dogs. Pol J Vet Sci. 2011; 14(3):515-20. [ Links ]
31. Pusterla N, Madigan JE. Equine granulocytic ehrlichiosis. En: Robinson NE, editor. Current Therapy in equine medicine. 5nd ed. 2003. p.78-80. [ Links ]
32. Ristic M, Huxsoll DL, Weisiger RM, Hildebrandt PK, Nyindo MB. Serological diagnosis of tropical canine pancytopenia by indirect immunofluorescence. Infect Immun. 1972 Sep; 6(3):226-31. [ Links ]
33. Rotondano TE, de Almeida AM, Lustosa EM, Cordeiro AA, Camboim EK, et. al. An assessment of whole blood and fractions by nested PCR as a DNA source for diagnosing canine ehrlichiosis and anaplasmosis. Scientific World Journal. 2012;2012:605-743. [ Links ]
34. Silva-Molano RF, Sánchez-Ucrós N y Loaiza-Echeverri AM. Reporte de presentación de Ehrlichia canis en muestras sanguíneas de caninos en la ciudad de Cali, Colombia. Revista Veterinaria y zootecnia 2008; 2:39-43. [ Links ]
35. Waner T, Harrus S, Jongejan F, Bark H, Keysary A, et al. Significance of serological testing for ehrlichial diseases in dogs with special emphasis on the diagnosis of canine monocytic ehrlichiosis caused by Ehrlichia canis. Vet Parasitol. 2001 Feb; 95(1):1-15. [ Links ]
36. Waner T, Rosner M, Harrus S, Naveh A, Zass R, et al. A. Detection of ehrlichia antigen in plasma of beagle dogs with experimental acute Ehrlichia canis infection. Vet Parasitol. 1996 Jun; 63(3-4):331-5. [ Links ]
37. Wen B, Rikihisa Y, Mott JM, Greene R, Kim HY, et al. Comparison of nested PCR with immunofluorescent-antibody assay for detection of Ehrlichia canis infection in dogs treated with doxycycline. J Clin Microbiol. 1997 Jul; 35(7):1852-5. [ Links ]













