Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.8 no.2 Medellín July/Dec. 2013
Inactivación del cromosoma X en el desarrollo embrionario mamífero
X chromosome inactivation in mammalian embryonic development*
Inativação do cromossomo X no desenvolvimento embrionário dos mamíferos
Mariano Eliécer Acosta Lobo1*, Biol, MSc; Neil Aldrin Vásquez Araque2, Biol, MSc; Luis Fernando Londoño Franco3, MV, MSc, PhD
* Autor de correspondencia. Mariano Eliécer Acosta Lobo. Circular 73 #35-04 Oficina 106. mariano.acosta@uam.edu.co.
1 Facultad de Medicina Veterinaria y Zootecnia. Fundación Universitaria Autónoma de las Américas. Medellín-Colombia.
2 Facultad de Ciencias. Escuela de Biociencias. Universidad Nacional de Colombia sede Medellín. Medellín- Colombia.
3 Facultad de Ciencias Agropecuarias. Politécnico Colombiano Jaime Isaza Cadavid. Medellín Colombia.
(Recibido: 1 de noviembre, 2013; aceptado: 29 de noviembre, 2013)
*Para citar este artículo: Acosta Lobo ME, Vásquez Araque NA, Londoño Franco LF. Inactivación del cromosoma X en el desarrollo embrionario mamífero. Rev CES Med Zootec. Vol 8(2): 108-119.
Resumen
La regulación de la expresión génica durante el desarrollo embrionario temprano requiere de múltiples y ordenados procesos epigenéticos que garanticen una correcta diferenciación y proliferación celular. La inactivación del cromosoma X es un proceso multiepigenético estrechamente ligado al desarrollo embrionario, que involucra el silenciamiento transcripcional de uno de los dos cromosomas X en las células de hembras mamíferas. El modelo embrionario mejor estudiado es el de ratón, donde se observan ciclos de inactivación y reactivación durante la formación del trofoectodermo y el epiblasto. En el trofoectodermo y el endodermo primitivo se observa una inactivación preferencial por el X paterno, mientras en la masa celular interna se observa una inactivación aleatoria, pudiendo inactivarse tanto el cromosoma X materno como el paterno. La inactivación del cromosoma X se observa también en la meiosis masculina, donde se observa un silenciamiento del cromosoma X, que perdura hasta la fertilización. En este artículo revisamos los eventos moleculares en la progresión de la inactivación, desde la gametogénesis hasta el blastocisto, y las características que regulan los procesos de inactivación y reactivación del cromosoma X en embriones de hembras mamíferas.
Palabras clave: cromosoma X, desarrollo embrionario, epigenética, inactivación.
Abstract
The gene expression regulation during embryonic development early requires multiple and ordered epigenetic processes that ensure a correct differentiation and cellular proliferation. The inactivation of the X chromosome is a multiepigenetic process closely linked to embryonic development, involving the transcriptional silencing of one of the two X chromosomes in mammalian females cells. The best studied embryonic model is the mouse, where inactivation and reactivation cycles are observed during the formation of the trophoectoderm and the epiblast. The trophoectoderm and primitive endoderm shows a preferential inactivation by the paternal X, while the mass cell internal observed one random inactivation, and can inactivate both the paternal and the maternal X chromosome. X chromosome inactivation is also observed in male meiosis, showing silencing of the X chromosome, which lasts until fertilization. Here we review the molecular events in the progression of inactivation, from gametogenesis to the blastocyst, and the characteristics that regulate the processes of inactivation and reactivation of the X chromosome in female mammalian embryos.
Key words: embryonic development, epigenetics, inactivation, X chromosome.
Resumo
A regulação da expressão génica durante o desenvolvimento embrionário nos primeiros estádios requer de muitos e organizados processos epigenéticos que garantissem uma correta diferenciação e proliferação celular. A inativação do cromossomo X é um processo complexo que esta fortemente ligado ao desenvolvimento embrionário, este processo involucra o silenciamento transcripcional de um dos cromossomos X nas células das fêmeas mamíferas. O modelo embrionário do rato é o melhor estudado, onde se observam ciclos de inativação e reativação durante a formação do trofoectodermo e o epiblasto. No trofoectodermo e o endodermo primitivo se observa uma inativação preferencial pelo X paterno, enquanto na massa celular interna se observa uma inativação aleatória, conseguindo inativar-se tanto no cromossomo X materno quanto no paterno. A inativação do cromossomo X se observa também na meiose masculina onde se observa um silenciamento do cromossomo X, que permanece até a fertilização. Neste artigo revisamos os eventos moleculares na progressão da inativação, desde a gametogênese até o blastocisto, e as características que regulam os processos de inativação e reativação do cromossomo X em embriões de fêmeas mamíferas.
Palavras chave: cromossomo X, desenvolvimento embrionário, epigenética, inativação.
Introducción
Los mecanismos epigenéticos de expresión génica aseguran pasos críticos durante el desarrollo embrionario temprano, como el tiempo de la primera división celular, compactación, formación del blastocisto, expansión y eclosión. Estos procesos epigenéticos incluyen la metilación del ADN, modificaciones de histonas, introducción de variantes de histonas, regulación por ARN antisentido y remodelación de la cromatina. La cromatina es una estructura dinámica y variable, compuesta por ADN, histonas y proteínas andamio. Precisamente, las histonas son fundamentales en el control de la expresión génica, ya que no solo funcionan como proteínas estructurales sino que ejercen una función reguladora a través de modificaciones que se establecen sobre ellas, como acetilación, metilación, fosforilación entre otras. De igual manera, la metilación del ADN es esencial para el desarrollo normal en los mamíferos, teniendo un papel importante en procesos como la inactivación del cromosoma X, el establecimiento del imprinting genómico y la modificación de la cromatina(28).
En los mamíferos el sexo es determinado por la combinación de los cromosomas X y Y, desarrollándose hembras con la combinación XX y machos con la combinación XY. Esta diferencia representa un problema para el desarrollo normal, ya que las hembras teóricamente duplicarían la expresión génica del X frente a los machos. Para solucionar esta potencial desigualdad, evolutivamente se desarrolló un sistema de compensación de dosis, en el cual las hembras inactivan transcripcionalmente la mayoría de los genes en uno de los dos cromosomas X en todas sus células. Este sistema de compensación iguala la expresión de genes del cromosoma X en machos y hembras asegurando que solo un cromosoma X funcione en ambos sexos.
En caso de células con más de dos cromosomas X, todos los cromosomas en exceso, excepto uno, son silenciados. Debido a que las hembras con dos cromosomas X activos no sobreviven, la inactivación del cromosoma X es un proceso esencial de la diferenciación sexual femenina. Este sistema de compensación de dosis es conocido como inactivación del cromosoma X y fue propuesto en 1961 para explicar la expresión de genes en el cromosoma X que controlaban el color del pelaje en ratones(30).
En los mamíferos existen diferencias entre los mamíferos placentarios y no placentarios, pero todos los placentarios utilizan los mismos mecanismos moleculares básicos para llevar a cabo la inactivación del X. Los cambios en la expresión de genes del cromosoma X son dinámicos durante el desarrollo premplantatorio e incluyen el total de los mecanismo epigenéticos conocidos(3, 55). Aunque los mecanismos epigenéticos de la inactivación del cromosoma X son tradicionalmente estudiados en embriones de hembras mamíferas, también se observa inactivación en los machos durante la espermatogénesis. El único cromosoma X en las células germinales masculinas es sometido a un proceso de silenciamiento transcripcional el cual conduce a la formación del cuerpo XY al finalizar la meiosis. Este mecanismo se lleva a cabo por mecanismos epigenéticos diferentes a los que se observan durante el la inactivación del cromosoma X en la embriogénesis mamífera(51). En la tabla 1 se resumen los últimos avances en los estudios sobre inactivación del cromosoma X.
La aplicación de tecnologías de reproducción asistida, tales como el cultivo de embriones in vitro y la transferencia nuclear de células somáticas se asocia de manera frecuente con patrones errados de expresión génica, alteraciones epigenéticas y alto riesgo de fenotipos trastornados, ya que afectan los patrones de metilación del ADN, la remodelación de la cromatina y la expresión génica(39). En el cromosoma X se encuentran genes que expresan enzimas clave en el metabolismo de carbohidratos y nucleótidos entre otros, y que impactan la viabilidad embrionaria y la proporción de sexos. En embriones bovinos, y humanos se han encontrado diferencias en el metabolismo de glucosa, entre blastocistos hembras y machos. Este metabolismo diferencial se puede atribuir a un desbalance en la expresión de genes del cromosoma X entre los sexos durante ciertos estados del desarrollo preimplantatorio, donde ha fallado el proceso de inactivación del X, y ambos cromosomas se encuentran(54). Precisamente, la comprensión de los fenómenos epigenéticos que regulan las etapas iniciales del desarrollo embrionario, son fundamentales para el mejoramiento de las tecnologías reproductivas de cultivo embrionario, manipulación de células madre y clonación. Siendo un proceso que involucra todos los mecanismos epigenéticos conocidos, en este artículo, nosotros revisamos los eventos que contribuyen a la inactivación del cromosoma X en gametos y embriones.
El XIC y Los ARNs de la inactivación
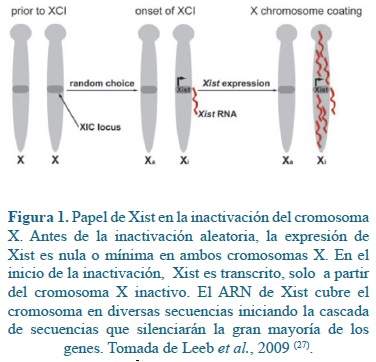
El proceso de inactivación del cromosoma X requiere de cinco pasos, el conteo, el cual verifica el número de cromosomas X por conjunto de autosomas en cada célula de una hembra; la escogencia, donde se decide si se inactiva el cromosoma X materno (Xm) o el X paterno (Xp); la iniciación, proceso controlado por un locus denominado el centro de inactivación del X (XIC), el cual produce ARNs no codificantes, y al cual le siguen una serie de modificaciones epigenéticas que garantizan la migración hacia todo el cromosoma; y el mantenimiento, proceso que conservará a través de las divisiones celulares las marcas epigenéticas del proceso de inactivación(3, 46). El silenciamiento transcripcional del X requiere la actividad de elementos actuando en cis y factores en trans localizados en el XIC. Este locus transcribe varios ARNs no codificantes necesarios para la regulación de la inactivación, entre los cuales se encuentran el disparador de la inactivación conocido como Transcripto específico del X inactivo XIST (Xist en el ratón) y TSIX, un ARN antisentido que regula la expresión de XIST(5,6). El silenciamiento transcripcional del cromosoma X se inicia en la embriogénesis temprana con la sobreexpresión en el futuro X inactivo de Xist, el cual cubre el cromosoma, un evento necesario para iniciar la inactivación(5,6) (Figura 1).
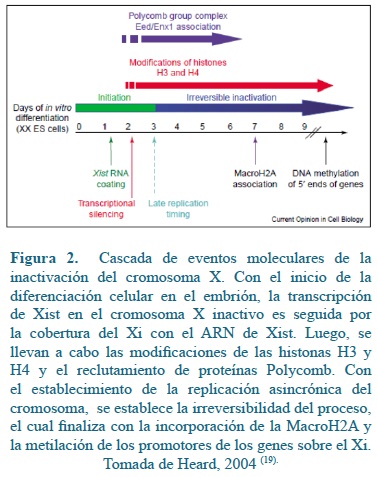
La asociación del ARN de XIST en diversas secuencias a lo largo del futuro X inactivo, dispara una cascada de modificaciones epigenéticas que resultan en la formación de heterocromatina facultativa(19). Estas modificaciones incluyen modificaciones de histonas, incorporación de variantes de histonas, metilación del ADN y la compartamentalización en la periferia nuclear del cromosoma X inactivo(29), el cual se visualiza en células interfásicas en una estructura conocida como corpúsculo de Barr (Figura 2).
Actualmente se ha caracterizado a XIST como el disparador del proceso de inactivación del cromosoma X, ya que este es necesario para la etapa del conteo. De hecho, se ha demostrado que los XIC de los dos cromosomas X se aparean transitoriamente antes y durante la iniciación de la inactivación(2, 57).
El mecanismo por el cual XIST inicia el procedimiento de inactivación aun no es claro, pero están involucrados algunos procesos como la exclusión de la ARN polimerasa II del territorio cromosómico que ocupa el Xi en el núcleo(40). Recientemente se ha descubierto una proteína, llamada YY1, la cual amarra a XIST al DNA en las secuencias donde cubrirá el cromosoma Xi, un amarre que está determinado por regulación epigenética(22). Además de XIST, hay otro ARN no codificante incluido en la regulación del inicio de la inactivación del X. Este ARN es llamado TSIX y funciona como un represor antisentido de XIST. En el Xa TSIX es expresado, regulando negativamente la expresión de XIST, con lo cual el proceso de inactivación se bloquea. En contraste, en el Xi, TSIX es silenciado con lo cual se aumenta la expresión de XIST, conduciendo a los eventos iniciales de la inactivación del cromosoma X(26). Algunos autores sugieren que además de la modificación por antisentido, TSIX puede ejercer su efecto inactivador de la expresión de XIST mediante modificación de la estructura de la cromatina(42).
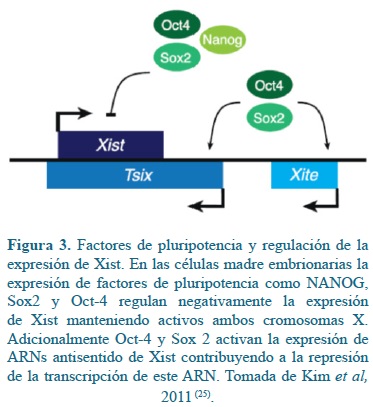
El XIC es un nicho de ARNs no codificantes, entre los cuales no solo se encuentran XIST y TSIX, sino ARNs con función activadora de XIST como Jpx y RepA, los cuales son regulados por factores de pluripotencia(27, 32). Cuando las células madre embrionarias aún no han iniciado su proceso de diferenciación, Los factores de pluripotencia como NANOG, SOX2 y OCT-4 regulan negativamente la expresión de XIST uniéndose a regiones promotoras del gen, y al mismo tiempo haciendo regulación positiva sobre los promotores de Xite y TSIX, manteniendo la doble dosis génica de ambos cromosomas X(37, 38). TSIX, además de ser un regulador negativo de XIST, también reduce la expresión de genes como Jpy y RepA. Al desaparecer estos factores de pluripotencia, se reduce la expresión de Tsix, se activa la expresión de Jpy Y RepA, los cuales regulan positivamente la expresión de XIST, conduciendo a la iniciación del proceso de inactivación aleatoria del cromosoma X en las células madre embrionarias(25, 50) (Figura 3).
Mecanismos epigenéticos de la inactivación
Luego de la cobertura con el ARN de XIST, el X inactivo prosigue con una serie de modificaciones de la cromatina tales como desmetilación de la histona H3 en la lisina 4 (H3-K4), metilación de la histona H3 en la lisina 9 (H3-K9) y metilación de la histona H3 en la lisina 27 (H3-K27)(8). Estas modificaciones en la histona H3 no son suficientes por lo cual también se manifiesta la replicación asíncrónica del ADN, se hipoacetilan las histonas H4, se reclutan proteínas Polycomb, HP1 y la variante de la histona H2, Macro H2A(43). Las modificaciones a las histonas inician el proceso irreversible de inactivación del cromosoma X en las células embrionarias(56). Se han encontrado diferencias entre especies en las modificaciones de histonas que contribuyen al silenciamiento transcripcional, por ejemplo la trimetilación de la lisina 9 en la histona H3 (H3 K9 me3) se observa en el cromosoma Xi en humanos pero no en ratón, al igual que la trimetilación sobre la lisina 20 en la histona H4 (H4 K20 me3)(10, 58). Por último, se metilan regiones promotoras de un gran número de genes en el cromosoma(11).
En el Xi la metilación es uno de los eventos tardíos pero no menos importante, ya que está relacionado con el mantenimiento de la inactivación. Los promotores de los genes sobre el Xi están hipermetilados comparados con los del Xa, al igual que los de aquellos genes que escapan de la inactivación. En el Xa el promotor de XIST se encuentra metilado a diferencia del Xi donde la hipometilación garantiza su expresión. La metilación del ADN se ha asociado más al mantenimiento del proceso de inactivación en las divisiones celulares somáticas que al proceso de inicio del silenciamiento génico. Experimentos demuestran que en ausencia de las enzimas ADN metiltransferasas, se expresa adecuadamente XIST y el proceso de inactivación se lleva a cabo(45), pero pueden ocurrir reactivación de genes en el Xi en etapas posteriores(9). La metilación como regulador negativo de la expresión génica se divisa más a nivel génico individual, ya que se encuentran promotores de genes metilados sobre el Xa y no metilados en el Xi. Adicionalmente al comparar de manera global, el Xi es hipometilado comparado con el Xa(20).
Inactivación del cromosoma X en espermatogénesis
El mecanismo de MSCI es diferente al que ocurre en células embrionarias. Un Estudio de McCarrey en 2002 demostró que este proceso es independiente de Xist(31). De hecho se ha demostrado que el mecanismo de silenciamiento transcripcional se lleva cabo por la acumulación de proteínas pertenecientes a las vías de respuesta de daño al ADN, como ATR kinasa y H2AX(4).
En las células somáticas de machos, el único cromosoma X permanece activo, a diferencia de lo que ocurre durante la espermatogénesis donde hay un silenciamiento transcripcional del cromosoma X durante el proceso meiótico. En las espermatogonias de ratón los cromosomas X y Y son hiperactivos, transcribiendo un gran número de genes. Al entrar en meiosis, hay una represión global de la transcripción. Sin embargo, durante el paquiteno de la primera profase hay un incremento de la transcripción desde los autosomas, a diferencia de los cromosomas X y Y, los cuales son sometidos a modificaciones epigenéticas que conllevan al silenciamiento transcripcional, proceso conocido como Inactivación de cromosomas sexuales meióticos (MSCI)(51). Esta inactivación transcripcional finaliza en la formación de una heterocromatina conocida como el cuerpo sexual o cuerpo XY(17). Dicha MSCI contrasta con lo que ocurre en la gametogénesis femenina, donde en las oogonias un cromosoma es inactivado mientras el otro es reactivado antes de entrar a meiosis. Por lo tanto, los machos no tienen cromosoma X activo durante la meiosis mientras las hembras poseen los 2 activos(35).
Se ha sugerido que la MSCI protege a los cromosomas X y Y del punto de control de paquiteno, el cual se dispara si hay regiones cromosómicas no involucradas en sinapsis. Debido a que los cromosomas X y Y solo se aparean en la región pseudoautosómica, la mayoría de su longitud está desapareada a falta de un verdadero homólogo. Este punto de control conduce a detención del ciclo celular y/o apoptosis. Precisamente, con el proceso de MSCI se garantiza el paso por este punto de control evitando una apoptosis masiva durante la espermatogénesis(51, 52). Estudios recientes demuestran que el proceso de MSCI es necesario para el mantenimiento de la fertilidad masculina(44). Aunque históricamente ha prevalecido el punto de vista de que la MSCI se produce solo para pasar el punto de control que revisa las regiones no involucradas en sinapsis durante la meiosis, trabajos recientes muestran que los efectos de la MSCI permanecen hasta la espermiogénesis y que el cromosoma X permanece aún inactivo en espermátidas redondas conformando un cuerpo silenciado llamado cromatina sexual posmeiótica (PMSC)(52) (Figura 4).
Dos formas de silenciamiento del X en el embrión mamífero
Existen dos modos diferentes de inactivar el cromosoma X. El modo con impresión, el cual silencia solo el cromosoma X paterno y el modo aleatorio que silencia o el cromosoma X materno o el paterno. En mamíferos no placentarios, solo se observa la inactivación con impresión mientras en los mamíferos placentarios se observan algunos como el ratón, que utiliza la inactivación con impresión durante etapas iniciales del desarrollo embrionario y aleatoria durante etapas tardías, y otros mamíferos como el humano que solo utilizan la aleatoria(16). En ratones, luego de la fecundación, el cromosoma X paterno (Xp) se encuentra activo en los zigotos. En el estadio de 4 células se inicia el proceso de inactivación del Xp con la transcripción del Xist y la cobertura del futuro X inactivo con este ARN(40). Otros autores sugieren que el Xp empieza a ser inactivado en el estadío de 8 células(33). El Xp es mantenido inactivo hasta el estadío de blastocisto cuando en las células de la masa celular interna (MCI), en el blastocisto expandido, el Xp inactivo es reactivado permitiendo una remodelación de la cromatina y finalmente procediendo con una inactivación aleatoria de los cromosomas X, la cual se mantendrá de manera clonal en los tejidos, excepto en las células del trofoectodermo donde se mantiene inactivo el Xp(49, 40) (Figura 5).
Tada et al.(48), encontraron que el X materno (Xm) es protegido contra la inactivación en embriones tempranos de ratón. Esta protección, la cual es establecida durante la maduración del oocito, se lleva a cabo previniendo la expresión de Xist, con lo que se consigue mantener el cromosoma X activo(48). En bovinos producidos in vitro, estudios iniciales mostraron que la inactivación ocurre cerca al estadío de blastocisto(12), mientras un estudio más reciente que caracterizó por primera vez la inactivación del X en esta especie, mostró que la inactivación del cromosoma X bovino comienza desde el estadio de mórula, donde se inactiva el Xp, siendo luego reactivado en el estadio de blastocisto, para iniciar la inactivación aleatoria en las células de la masa celular interna(15). Tanto en bovinos como en ratón se mantiene el Xp inactivo en los tejidos extraembrionarios, mientras en humanos se ha encontrado que hay inactivación aleatoria(34). La reactivación del cromosoma Xp está relacionada con la expresión de factores de pluripotencia como NANOG, el cual reprime la expresión de Xist(47). Aun se debate sobre si en humanos se da o no una inactivación del cromosoma X con impresión en tejidos extraembrionarios. Algunos trabajos han encontrado que en placenta se observa inactivación con impresión, mientras trabajos más recientes muestran que la inactivación es aleatoria(34).
La reactivación del cromosoma X
Luego de haber inactivado el cromosoma Xp en los estadíos iniciales del desarrollo embrionario, los mamíferos placentarios reactivan este cromosoma en el epiblasto de la masa celular interna del blastocisto(33) y cuyas células pluripotentes reciben el nombre de células madre embrionarias. De aquí en adelante estas células experimentarán la inactivación del X aleatoria, manteniendo el mismo cromosoma X silenciado a través de los sucesivos ciclos celulares. Hasta ahora hay dos modelos para explicar cómo el cromosoma Xp es escogido para ser inactivado temprano en el desarrollo embrionario.
En el primer modelo, el cual se basa en la ausencia de transcripción en el cromosoma X en embriones de dos células, se propone que la inactivación con impresión del Xp se produce desde la espermatogénesis por el mecanismo de MCSI(21). De otro lado se propone un modelo de inactivación del Xp independiente del mecanismo de MSCI. Este modelo se basa en que la acumulación de histonas con modificaciones típicas del silenciamiento transcripcional, las cuales se observan solo después del estadío de cuatro células. Un estudio reciente utilizó FISH y mostró que el segundo modelo es el correcto, al encontrar que en el estadío de dos células los embriones exhiben muchos genes activos en el cromosoma Xp(41). Estos genes se van inactivando gradualmente durante el progreso del desarrollo preimplantatorio(24). Sin embargo, un estudio reciente revela que algunas regiones sobre el cromosoma Xp, más específicamente regiones de ADN no codificantes, son preinactivadas desde la línea germinal, mientras el silenciamiento de genes ocurre de novo en el embrión temprano(36).
Escape de la inactivación
En embriones tempranos, después de la iniciación de la inactivación en el locus XIST, el silenciamiento se expande a lo largo de todo el cromosoma X(43). Esta migración es seguida por la fase de mantenimiento la cual asegura que en las células somáticas las marcas epigenéticas que establecieron la inactivación serán copiadas de manera fiel durante las sucesivas divisiones celulares del embrión(18).
El silenciamiento transcripcional del cromosoma X sin embargo no es total. Algunos genes escapan de la inactivación y por lo tanto se expresan en doble dosis en las células de hembras(14). En humanos se ha establecido que aproximadamente entre el 15 y el 20% de los genes del cromosoma X escapan de la inactivación(7). Muchos genes que escapan de la inactivación en humanos, son inactivados en el ratón, sugiriendo un proceso de silenciamiento más completo en esta especie(13). Así mismo, se presentan en otras especies mamíferas similitudes en grupos de genes que escapan de la inactivación.
Un acercamiento a los posibles mecanismos moleculares del escape a la inactivación sería el hecho de que muchos, aunque no todos los genes expresados a partir del Xi se localizan agrupados en el brazo corto del cromosoma X, lo cual podría implicar una falla regional en el proceso de migración de la inactivación Sin embargo, también podría producirse por una falla en el inicio del silenciamiento o por un fenómeno de reactivación del cromosoma X(53). Estos genes que escapan de la inactivación no son expresados en el mismo nivel que en el X activo y estudios con microarreglos han identificado que solo un número pequeño de genes transcritos a partir del cromosoma X son sobreexpresados en las hembras frente a machos(23).
Adicionalmente se han observado genes que escapan de la inactivación en algunas células y en otras no, e incluso genes que escapan de la inactivación en algunas hembras y en otras no, aumentando aún más la posible complejidad epigenética de la regulación del proceso(1, 7).
Perspectivas y conclusiones
La inactivación del cromosoma X sigue siendo un paradigma epigenético ya que establece un patrón de cromatina durante el desarrollo embrionario temprano de hembras mamíferas y lo mantiene en las células diferenciadas. Como conclusión de esta revisión mostramos que el silenciamiento del cromosoma X se lleva a cabo por dos mecanismos moleculares diferentes, uno para la línea germinal y otro para el embrión. Adicionalmente describimos dos formas de silenciamiento génico en el embrión de acuerdo al tipo de estructura del saco embrionario con diferencias entre humanos y ratones en cuanto a las marcas epigenéticas y el mecanismo molecular escogido para llevarla a cabo. Indudablemente la inactivación del cromosoma X permanece como el máximo evento epigenético del desarrollo embrionario y aún quedan muchas preguntas por resolver. De qué manera las células madre embrionarias consiguen la reactivación del cromosoma X en la masa celular interna, cuales son los factores de la cascada epigenética de la inactivación que se afectan durante el cultivo embrionario in vitro y la clonación. Adicionalmente, es necesario comprender la complejidad de la función de las proteínas reclutadas por Xist en la iniciación del proceso de inactivación.
Referencias
1. Anderson C, Brown CJ. Polymorphic X-chromosome inactivation of the human TIMP1 gene. American Journal of Human Genetics 1999; 65: 699-708. [ Links ]
2. Augui S, Filion GJ, Huart S, Nora E, Guggiari M, Maresca M. Sensing X chromosome pairs before X inactivation via a novel X pairing región of the Xic. Science 2007; 318: 1632-1636. [ Links ]
3. Avner P, Heard E. X-chromosome inactivation: counting, choice and initiation. Nat Rev Genet 2001; 2 (1): 59-67. [ Links ]
4. Bellani MA, Romanienko PJ, Cairatti DA, Camerini-Otero RD. SPO 11 is required for sex-body formation, and Spo 11 heterozygosity rescues the prophase arrest of atm-/- spermatocytes. J Cell Sci 2005; 118: 3233-3245. [ Links ]
5. Brown, CJ et al. A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. Nature 1991; 349: 38-44. [ Links ]
6. Brown CJ et al. Localization of the X inactivation centres on the human X chromosome in Xq13. Nature 1991; 349: 82-84. [ Links ]
7. Carrel L, Willard HF. X- inactivation profile reveals extensive variability in X-linked gene expreion in females. Nature 2005; 434: 400-404. [ Links ]
8. Chadwick BP, Willard HF. Multiple spatially distincts types of facultative heterochromatin on the human inactive X chromosome. PNAS 2004; 101 (50): 17450-17455. [ Links ]
9. Chang SC, Tucker T, Thorogood NP, Brown CJ. Mechanisms of X-Chromosome Inactivation. Front Biosci 2006; 11: 852-866. [ Links ]
10. Chaumeil J, Waters PD, Koina E, Gilbert C, Robinson TJ, Graves JA. Evolution from XIST-independent to XIST-controlled X-chromosome inactivation: epigenetic modifications in distantly related mammals. PLoS ONE 2011; 6 e19040. [ Links ]
11. Csankovszki G, Nagy A, Jaenisch R. Synergism of Xist RNA, DNA methylation and histone hypoacetylation in maintaining X chromosome inactivation. Journal of Cell Biology 2001; 153: 773-784. [ Links ]
12. De la fuente R, Hahnel A, Basrur PK, King WA. X-inactive-specific transcript (XIST) expression and X-inactivation in the preattachment bovine embryo. Biology of Reproduction 1999; 60: 769-775. [ Links ]
13. Disteche CM. Escape from X inactivation in human and mouse. Trends Genet 1995; 11: 17-22. [ Links ]
14. Disteche CM. Escapees on the X chromosome. PNAS 1999; 96: 14180-14182. [ Links ]
15. Ferreira AR, Machado GM, Diesel TO, Carvalho JO, Rumpf R, Melo EO, Dode MAN, Franco MM. Allele-Specific Expression of the MAOA Gene and X Chromosome Inactivation in vitro Produced Bovine Embryos. Mol Reprod Dev 2010; 77: 615-621. [ Links ]
16. Goto, T, Monk, M. Regulation of X chromosome inactivation in development in mice and humans. MMBR 1998; 62 (2): 362-378. [ Links ]
17. Handel, MA. The XY body: a specialized meiotic chromatin domain. Exp Cell Res 2004; 296: 57-63. [ Links ]
18. Heard E, Clere P, Avner P. X-chromosome inactivation in mammals. Annu Rev Genet 1997; 31: 571-610. [ Links ]
19. Heard E. Recent advances in the X chromosome inactivation. Curr Opin Cell Biol 2004; 16: 247-255. [ Links ]
20. Hellman A, Chess A. Gene body-specific methylation on the active X chromosome. Science 2007; 315: 1141-1143. [ Links ]
21. Huynh KD, Lee JT. Inheretance of a preinactivated paternal X chromosome in early mouse embryos. Nature 2003; 426: 857-862. [ Links ]
22. Jeon Y, Lee JT. YY1 tethers Xist RNA to the inactive X nucleation center. Cell 2011; 146: 119-133. [ Links ]
23. Johnston CM, Lowell FL, Leongamornlert DA, Stranger BE, Dermitzakis ET, Ross MT. Large-scale population study of human cell lines indicates that dosis compensation is virtually complete. PLoS Genet 2008; 4: e9. [ Links ]
24. Kalantry S, Purushothaman S, Bowen RB, Starmer J, Magnuson T. Evidence of Xist RNA independent initiation of mouse imprinted X-chromosome inactivation. Nature 2009; 460: 647-651. [ Links ]
25. Kim DH, Jeon Y, Anguera MC, Lee JT. X-chromosome epigenetic reprogramming in pluripotent stem cells via noncoding genes. Seminars in Cell & Developmental Biology 2011; 22: 336- 342. [ Links ]
26. Lee JT, Davidow LS, Warshawsky D. Tsix, a gene antisense to Xist at the X-inactivation center. Nat Genet 1999; 21: 400-404. [ Links ]
27. Leeb M, Steffen PA, Wutz A. X chromosome inactivation sparked by non-coding RNAs. RNA Biology 2009; 6 (2): 94-99. [ Links ]
28. Li E. Chomatin modification and epigenetic reprogramming in mammalian development. Nat Rev Genet 2002; 3(9): 662-673. [ Links ]
29. Lucchesi JC, Kelly WG, Panning B. Chromatin remodeling in dosage compensation. Annu Rev Genet 2005; 39: 615-651. [ Links ]
30. Lyon M.F. Gene Action in the X-chromosome of the mouse (Mus musculus L.). Nature 1961; 190: 372-373. [ Links ]
31. McCarrey JR, Watson C, Atencio J, Ostermeier GC Marahens Y, Jaenisch R, Krawetz SA. X-Chromosome inactivation during spermatogenesis is regulated by an Xist/Tsix independent mechanism in the mouse. Genesis 2002; 34 (4): 257-266. [ Links ]
32. Makhlouf, M and Rougeulle, C. Linking X chromosome inactivation to pluripotency: Necessity or fate? Trends Mol Med 2011; 17(6): 329-36. [ Links ]
33. Mak W, Nesterova TB, De Napoles M, Appanah R, Yamanaka S, Otte AP, Brockdorff N. Reactivation of the paternal X chromosome in early mouse embryos. Science 2004; 303: 666-669. [ Links ]
34. Moreira de Mello JC, Araújo ESS, Stabellini R, Fraga AM, Souza JES, Sumita DR, Camargo AA, Pereira LV. Random X inactivation and extensive mosaicism in human placenta revealed by analysis of allele-specific gene expression along the X chromosome. PloS One 2010; 5: 1-8. [ Links ]
35. Monk M, Mclaren A. X-chromosome activity in foetal germ cells of the mouse. J Embryol Exp Morphol 1981; 63: 75-84. [ Links ]
36. Namekawa SH, Payer B, Huynh KD, Jaenich R, Lee JT. Two-step imprinted X inactivation: repeat versus genic silencing in the mouse. Mol Cell Biol 2010; 30: 3187-3205. [ Links ]
37. Navarro P. et al. Molecular coupling of Xist regulation and pluripotency. Science 2008; 321: 1693-1695. [ Links ]
38. Navarro P. et al. Molecular coupling of Tsix regulation and pluripotency. Nature 2010; 468: 457-460. [ Links ]
39. Niemman H, Wrenzycki C, Lucas-Hahn A, Kues WA, Carnwath JW. Gene expression patterns in bovine in vitro produced and nuclear transfer-derived embryos and their aplications for early development. Cloning and Stem Cells 2002; 4: 29-38. [ Links ]
40. Okamoto I, Otte AP, Allis CD, Reimberg D, Heard, E. Epigenetic dynamics of imprinted X inactivation during early mouse development. Science 2004; 303: 644-649. [ Links ]
41. Okamoto I, Arnauld D, Le Baccon P, Otte AP, Disteche CM, Avner P, Heard E.. Evidence for de novo imprinted X-chromosome inactivation independent of meiotic inactivation in mice. Nature 2005; 438: 369-373. [ Links ]
42. Ohhata T, Hoki Y, Sasaki H, Sado T. Crucial role of antisense transcription across the Xist promoter in Tsix-mediated Xist chromatin modification. Development 2008; 135: 227-235. [ Links ]
43. Plath K, Mlynarczyk-Evans S, Nusinov DA, Panning B. Xist RNA and the mechanism of X chromosome inactivation. A Rev Genet 2002; 36: 233-278. [ Links ]
44. Royo H, Polikiewicz G, Mahadevaiah SK, Prosser H, Mitchell M, Bradley A et al. Evidence that meiotic sex chromosome inactivation is essential for male fertility. Current Biology 2010; 20 (23): 2117-2123. [ Links ]
45. Sado T, Okano M, Li E, Sasaki H. De novo DNA methylation is dispensable for the initiation and propagation of X chromosome inactivation. Development 2004; 131: 975-982. [ Links ]
46. Sidhu SK, Minks J, Chang SC, Cotton AM, Brown CJ. X chromosome inactivation: heterogeneity of heterochromatin. Biochem Cell Biol 2008; 86: 370-379 [ Links ]
47. Silva J, Nichols J, Theunissen TW, Guo G, van Oosten A L, Barrandon O, Wray J, Yamanaka S, Chambers I and Smith A. Nanog is the gateway to the pluripotent ground state. Cell 2009; 138: 722-737. [ Links ]
48. Tada T, Obata Y, Tada, M, Goto Y, Nakatsuji N, Tan SS et al. Imprint switching for non-random X-chromosome inactivation during mouse oocyte growth. Development 2000; 127: 3101-3105. [ Links ]
49. Tan SS, Williams EA, Tam PPL. X-chromosome inactivation occurs at different times in different tissues of the post-implantation mouse embryo. Nat Genet 1993; 3:170-174. [ Links ]
50. Tian D, Sun S Lee JT. The Long Noncoding RNA, Jpx, Is a Molecular Switch for X Chromosome Inactivation. Cell 2010; 143: 390-403. [ Links ]
51. Turner JMA. Meiotic sex chromosome inactivation. Development 2007; 134: 1823-1831. [ Links ]
52. Turner JM, Mahadevaiah SK, Ellis PJ, Mitchell MJ, Burgoyne PS. Pachytene asynapsis drives meiotic sex chromosome inactivation and leads to substantial postmeiotic repression in spermatids. Dev. Cell 2006; 10: 521-529. [ Links ]
53. Tsuchiya KD, Willard HF. Chromosomal domains and escape from X inactivation: comparative X inactivation analysis in mouse and human. Mammalian Genome 2000; 11: 849-854. [ Links ]
54. Wrenzycki C, Lucas-Hahn A, Herrmann D, Lemme E, Korsawe K, Niemann H. In Vitro Production and Nuclear Transfer Affect Dosage Compensation of the X-Linked Gene Transcripts G6PD, PGK, and Xist in Preimplantation Bovine Embryos. Biology of reproduction 2002; 66: 127-134. [ Links ]
55. Wu J, Shi, L. Epigenetic regulation in mammalian preimplantation embryo development. Reproductive Biology and Endocrinology 2009; 7: 59-70. [ Links ]
56. Wutz A, Jaenisch R. A shift from reversible to irreversible X inactivation is triggered during ES cell differentiation. Mol Cell 2000; 5: 695-705. [ Links ]
57. Xu N, Tsai CL, Lee JT. Transient homologous chromosome pairing marks the onset of X inactivation. Science 2006; 311: 1149-1152. [ Links ]
58. Zakharova IS, Shevchenko AI, Shilov AG, Nesterova TB, VandeBerg JL, Zakian SM. Histone H3 trimethylation at lysine 9 marks the inactive metaphase X chromosome in the marsupial Monodelphis domestica. Chromosoma 2011; 120: 177-183. [ Links ]