Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.26 no.1 Bogotá Jan./Mar. 2011
1 Médico ginecólogo, mastólogo, Unidad de Patología de Mama, Clínica Medellín, EPS Coomeva, Comfenalco, Medellín, Colombia.
2 Médica radióloga, Unidad de Radiología, Clínica Medellín, Medellín, Colombia.
3 Médica ginecóloga, epidemióloga; profesora, Universidad CES, Medellín, Colombia.
4 Estudiantes de Medicina, Universidad CES, Medellín, Colombia.
5 Médico patólogo; profesor titular, Facultad de Medicina, Universidad Pontificia Bolivariana; Laboratorio Lapaci y Clínica El Rosario, Medellín, Colombia.
Correspondencia: Carlos Restrepo Ramírez, MD, Correo electrónico: carera601@yahoo.com Medellín, Colombia
Fecha de recibido: 20 de octubre de 2010. Fecha de aprobación: 19 de noviembre de 2010.
Resumen
Introducción. El cáncer de mama es el segundo cáncer más común y una importante causa de muerte entre las mujeres. Uno de los pilares para su tratamiento es la determinación del estadio de los ganglios axilares mediante el vaciamiento axilar completo. Este procedimiento conlleva gran morbilidad, la cual ha disminuido considerablemente con la implementación de la técnica del ganglio centinela.
Objetivo. Describir los resultados obtenidos con la técnica del ganglio centinela en la cirugía de cáncer de mama en un centro especializado en patología de mama de Medellín.
Metodología. Se llevó a cabo un estudio descriptivo, retrospectivo. Se revisaron las historias clínicas de 164 pacientes con cáncer de mama en estadio temprano. Se creó una base de datos en Microsoft Office Excel®, y se procesó con el programa estadístico SPSS®, versión 13.
Resultados. El 86% de las pacientes tenía ganglio centinela negativo en la impronta y 82,3% en la patología final. El 4,3% fueron falsos negativos, y 3,5% correspondió a micrometástasis. No hubo falsos positivos. El 17% requirió vaciamiento axilar; de éstos, 78% no presentó evidencia patológica de compromiso residual. El informe más común de histología fue carcinoma ductal con infiltración, el cual, también, presentó el mayor porcentaje de ganglio centinela positivo (78,3%). De los ganglios centinela positivos en la patología final, 90% presentaron tumores positivos para receptores de estrógenos y de progesterona.
Conclusión. La técnica del ganglio centinela es una buena alternativa para el manejo de cáncer temprano de mama, ya que evita intervenciones quirúrgicas que conllevan a mayor morbimortalidad de las pacientes. Con el resultado negativo se puede afirmar con bastante certeza que no hay otros ganglios afectados.
Palabras clave: biopsia del ganglio linfático centinela; neoplasias de la mama; carcinoma ductal de mama; escisión del ganglio linfático.
Abstract
Breast cancer is the second most common cancer and an important cause of mortality in the female population. A key component of breast cancer therapy is the staging of regional lymph nodes via complete axillary lymph node dissection, which carries substantial morbidity. Nevertheless morbidity has significantly been reduced by implementing the technique of the sentinel lymph node biopsy.
Objective: Description of results obtained with the technique of sentinel lymph node biopsy in breast cancer surgery in a breast pathology center in Medellín, Colombia.
Methods: Retrospective study in which the medical records of 164 patients with early stage breast cancer were review and placed in a data base on Microsoft Office Excel® and statistically analyzed with the program SPSS 13®.
Results: 86% of patients were sentinel lymph node negative on imprint and 82.3% on final pathology; 4.3% were false negative (3.5% due to micro-metastasis) and no false positive results were found. 17% of patients required complete axillary lymph node dissection of which 78% had no evidence of disease on final pathology. The most frequently found histological type was the Infiltrating ductal carcinoma, which also had the most sentinel lymph node positive pathology results (78.3%). 90% of patients with positive sentinel lymph nodes were also positive for estrogen and progesterone receptors.
Conclusion: sentinel lymph node biopsy is a good alternative for the management of early staged breast cancer given that it prevents patients from invasive surgery that carries substantial morbidity and mortality. A negative sentinel lymph node gives the physician security that there aren’t other lymph nodes involved.
Key words: sentinel lymph node biopsy; breast neoplasms; carcinoma, ductal, breast; lymph node excision.
Introducción
El cáncer de mama es el segundo cáncer más común en la población femenina y es responsable de 1,6% de las muertes en esta población en el mundo (1). En Latinoamérica representa cerca del 10% de la incidencia y de la mortalidad por cáncer de mama. Aunque la incidencia en los países latinoamericanos es menor que la reportada en los países desarrollados, la tasa de mortalidad es mayor. Esto se puede explicar por las diferencias existentes en estrategias de tamización y en acceso a los servicios de salud, lo que retrasa su diagnóstico y manejo (2).
En Colombia, el cáncer de mama es uno de los carcinomas que se informa con mayor frecuencia en las mujeres (3). Según la experiencia local y nacional, el 70% de las pacientes se diagnostica en los estadios avanzados de la enfermedad (3,4).
En el diagnóstico del cáncer de mama, la evaluación de los ganglios axilares es fundamental para determinar el estadio de la enfermedad y para definir su tratamiento y pronóstico; para ello, tradicionalmente, se ha recurrido al vaciamiento linfático axilar completo (5-7).
El ganglio centinela es, por definición, cualquier ganglio linfático que recibe drenaje directo del tumor primario (8-10). La hipótesis del ganglio centinela fue descrita inicialmente por Cabañas en 1987 para el tratamiento del cáncer de pene (11). Posteriormente, en 1992, Morton lo popularizó para la estadificación del melanoma. Su uso en cáncer de mama fue descrito por Krag et al. y Guilliano et al. (12,13) basados en la hipótesis que el drenaje linfático de un tumor maligno llega inicialmente al ganglio centinela. En el caso de la mama, la diseminación de células tumorales ocurre de manera escalonada y organizada, alcanzando inicialmente el ganglio centinela de la axila, aunque también se pueden encontrar en la cadena ganglionar mamaria interna y en la supraclavicular, en donde al identificarse podrían resecarse y, en caso de ser negativos para compromiso metastásico, permitirían evitar el vaciamiento linfático axilar completo (5,8,14-18).
Los métodos utilizados para la tamización del cáncer de mama permiten su diagnóstico en estadios tempranos cuando, por lo general, los ganglios linfáticos están libres de metástasis (5,7,17,19,20). Según las guías de la American Association of Clinical Oncology (ASCO) se estableció como norma la biopsia del ganglio centinela como el procedimiento apropiado para la estadificación rutinaria de las pacientes con cáncer de mama en estadios tempranos de la enfermedad y con ganglios linfáticos axilares negativos por el examen clínico (6,17).
El objetivo de este trabajo fue describir los resultados obtenidos con la técnica de ganglio centinela en la cirugía de cáncer de mama en un centro especializado en dicha patología de Medellín, Colombia.
Materiales y métodos
Se llevó a cabo un estudio descriptivo, retrospectivo, en el centro especializado en patología de mama en la sede centro de la Clínica Medellín, entre enero de 2007 y julio de 2009.
Se evaluaron 450 pacientes con diagnóstico histológico de cáncer de mama realizado por biopsia estereotáxica o guiada por ecografía, todas con aguja gruesa (trucut o biopsia por punción con aguja gruesa). A cada paciente se le practicó, además del examen clínico de la axila, una ecografía hecha por radiólogos especializados en mama para determinar el posible compromiso de los ganglios axilares. Se les hicieron estudios de extensión que incluyeron placa de tórax, ecografía abdominal y gammagrafía ósea, para descartar enfermedad metastásica. Asimismo, a todas las pacientes se les evaluaron los receptores de estrógenos y progestágenos, HER 2-NEU, según el protocolo institucional.
De las pacientes evaluadas se seleccionaron 164 para la técnica diagnóstica del ganglio centinela; se incluyeron aquellas con diagnóstico de cáncer temprano (T1 a T3) y con tres tipos de histología (ductal in situ, ductal con infiltración o lobulillar con infiltración). Se excluyeron aquellas con tumor localmente avanzado (T4B e inflamatorio), compromiso de ganglios axilares determinado por el examen físico, ecografía e histología, o presencia de metástasis, según el protocolo institucional.
Procedimiento
Previo consentimiento informado y explicación del procedimiento, las pacientes fueron llevadas a la Sección de Medicina Nuclear de la Clínica Medellín para el procedimiento de marcación del ganglio centinela, entre 18 y 24 horas antes del procedimiento. Éste consistió en la aplicación periareolar subdérmica de tecnecio 99 (Tc99) en nanocoloide, es decir, albúmina coloidal, que permite la migración del Tc99 por los vasos linfáticos. El volumen aplicado del marcador fue de 1 mCi o 500 µCi. La migración del material de marcación al ganglio centinela se confirmó por linfogammagrafía –técnica que permite la identificación de los canales y de las vías linfáticas al captar las ondas gamma emitidas por el Tc99– por medio de la gammacámara Phillips® de doble cabeza detectora.
La paciente se colocaba en posición decúbito lateral del lado sano, y se obtenían imágenes anteriores y laterales lo que permitía, además, la delineación con marcador de las coordenadas en donde se encontraba el ganglio centinela para su mejor ubicación por parte del médico durante el procedimiento quirúrgico.
Una vez llevada la paciente al quirófano y bajo anestesia general, se ubicaba nuevamente el ganglio centinela mediante una gammasonda Neoprove®, localizando la zona de mayor captación de Tc99. Se procedió a la resección de los ganglios centinelas que se habían marcado; el número de ganglios resecados osciló entre 1 y 5 (media de 2), y se rotularon en orden sucesivo de acuerdo con su extirpación, para ser enviados a patología para la evaluación por impronta. Si la cirugía por practicar era una cuadrantectomía superior externa o una mastectomía, se utilizaba la misma incisión quirúrgica, de lo contrario, se hacía una incisión diferente de 2 cm en la inserción pilosa de la axila, paralela al borde del músculo pectoral mayor para acceder a los ganglios.
La evaluación citológica intraoperatoria por impronta consiste en hacer el extendido citológico de las superficies del corte del ganglio centinela; se realizaban 2 ó 3 cortes según el tamaño del ganglio, luego se hacía coloración rápida con hematoxilina eosina y se procedía a la observación microscópica de las preparaciones. El reporte de patología –el cual tardaba entre 30 y 40 minutos– era informado telefónicamente al quirófano y el informe escrito se enviaba por fax. En caso de que el ganglio centinela fuera negativo se finalizaba la intervención quirúrgica; si, por el contrario, el ganglio centinela era positivo, se procedía en el mismo acto operatorio a completar el vaciamiento linfático axilar completo. Todos los ganglios obtenidos fueron enviados a patología para evaluación diferida según el protocolo de la institución.
Mientras se esperaba el reporte de la impronta del ganglio centinela, a la paciente se le practicaba la cirugía mamaria previamente determinada: cuadrantectomía, mastectomía o mastectomía más reconstrucción.
A todos los ganglios centinela, tanto positivos como negativos en la impronta, se les realizó estudio patológico completo en cortes seriados para comprobar el resultado. Además, a los ganglios centinela negativos en los cortes de hematoxilina eosina, se les hicieron estudios de inmunohistoquímica con citoqueratina, en busca de células epiteliales neoplásicas. El resultado definitivo de la patología de los ganglios centinela obtenidos por vaciamiento axilar y el diagnóstico histológico de la lesión mamaria fue reportado 8 días después del procedimiento quirúrgico. Las pacientes cuyos ganglios centinela se reportaron como negativos en la impronta y resultaron ser positivos en la patología definitiva, fueron llevadas a una segunda intervención quirúrgica en la que se les practicó vaciamiento linfático axilar completo (diferido) y su posterior análisis patológico.
Las historias clínicas de las pacientes seleccionadas para el procedimiento del ganglio centinela, fueron revisadas antes de incluirlas en la base de datos en Microsoft Office Excel®; los datos se procesaron utilizando el programa estadístico SPSS, versión 13®.
Las variables cualitativas se expresan en porcentajes y las cuantitativas con medias y desviación estándar (DE).
Resultados
Entre enero de 2007 y julio de 2009 se evaluaron 450 pacientes con diagnóstico de cáncer de mama en la Clínica Medellín sede Centro, de las cuales, 164 ingresaron al estudio y se les realizó la técnica diagnóstica del ganglio centinela como parte del manejo del cáncer de mama.
La edad media del grupo de estudio fue de 56,8 años (DE=11,94 años) con una edad mínima de 30 y una máxima de 93 años. Las características y hallazgos de la población del estudio se presentan en la tabla 1.
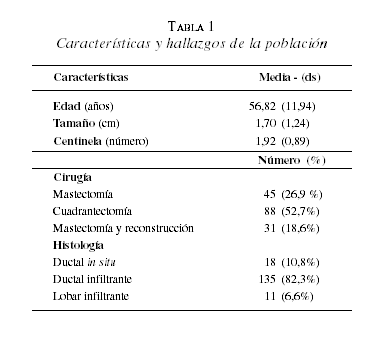
El tamaño tumoral encontrado osciló entre 0,3 y 7 cm (DE=1,24 cm). De las pacientes seleccionadas, 10,3% (17 pacientes) tenía una lesión menor de 1 cm, y de ellas sólo una paciente presentó ganglio centinela positivo. La relación entre el tamaño tumoral y el resultado positivo del ganglio centinela puede observarse en la tabla 2, tanto en la impronta como en la patología final. Es de anotar que la paciente que presentó el tumor de 7 cm tenía 44 años, y el ganglio centinela fue negativo (figura 1).
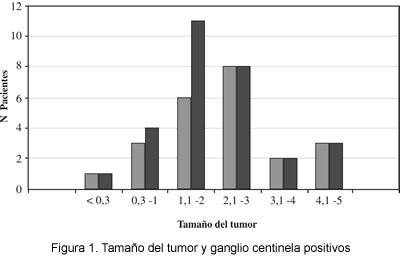
Al comparar el tamaño tumoral con el resultado positivo del ganglio centinela, vemos que hay una tendencia lineal hasta el tamaño de 2 cm, a medida que aumenta el tamaño del tumor aumenta el número de pacientes con ganglio centinela positivo (figura 1). A partir de los 2 cm no se pudo establecer relación del tamaño tumoral con el resultado positivo del ganglio centinela, dado que el número de pacientes no era significativo.
Se encontraron de 1 a 4 ganglios centinela por paciente, con un promedio de 2.
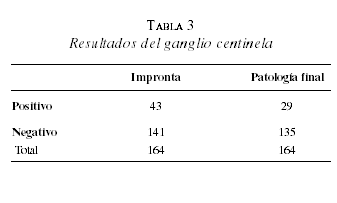
La mayoría de las pacientes evaluadas (86%, 141 pacientes) tuvieron ganglio centinela negativo por impronta; se encontraron datos similares en la patología final de este ganglio, 82,3% (135 pacientes) fueron reportados como negativos tanto en la hematoxilina eosina como en la citoqueratina. El 4,3% (6 pacientes) fueron falsos negativos en la impronta y, por lo tanto, requirieron vaciamiento linfático axilar completo diferido. Cinco de ellos correspondían a micrometástasis que se observaron en el estudio histopatológico convencional, el otro fue detectado con citoqueratina. Ninguna de las pacientes evaluadas en este estudio tuvo un falso positivo en la impronta (tabla 3).
El promedio de edad de las pacientes con ganglio centinela positivo fue de 52,7 años con un rango que osciló entre los 48 y los 59 años.
A 28 pacientes (17%) se les hizo vaciamiento axilar, a 19 (68%) se les practicó en el mismo procedimiento quirúrgico y a 9 (32%) de manera diferida. De éstas, 22 (78%) no tenía evidencia de enfermedad en ninguno de los ganglios obtenidos en el vaciamiento linfático axilar completo en la patología definitiva, y los únicos ganglios comprometidos fueron los centinela.
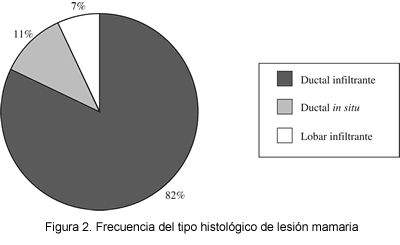
De los tipos histológicos de lesión mamaria incluidos en este estudio, el más común fue el carcinoma ductal con infiltración en 82,3% (135 pacientes) (figura 2). Se encontró ganglio centinela positivo en 18 de las 23 pacientes (78,3%) de esta variante histológica.
En todos los casos de carcinoma ductal in situ el ganglio centinela fue negativo.
De las 164 pacientes, los receptores de estrógeno fueron positivos en 150 pacientes (91%) y los de progesterona en 134 pacientes (81%). De las 29 pacientes que tuvieron ganglio centinela positivo en la patología final, 26 (90%) tenían receptores para estrógenos y para progesterona positivos y la histología correspondió a tumores tipo ductal con infiltración. No hubo relación en cuanto al tamaño tumoral o la presencia de receptores.
Discusión
La metodología usada para la detección y evaluación del ganglio centinela descrita en el presente estudio, hace parte del protocolo institucional y cuenta con validación previa de esta técnica en 44 pacientes con cáncer de mama, a quienes se les practicó estudio de ganglio centinela y vaciamiento linfático axilar completo. Este protocolo, además, está fundamentado en la literatura y en protocolos internacionales (5,10,17,21,22).
La detección de los ganglio centinela se hizo por medicina nuclear con Tc99 y linfogammagrafía, método establecido en el protocolo institucional y fundamentado en literatura nacional e internacional en la que se describe que la cifra ideal de identificación de ganglio centinela debe ser mayor del 90%. Se identificó, al menos, un ganglio centinela en el 100% de las pacientes, datos similares a los obtenidos por Caicedo y Robledo quienes obtuvieron 98% de detección y Marrow et al. con 78% (23,24).
Se utilizó, además, la citología por impronta como método diagnóstico de elección para evaluar el ganglio centinela. El uso de la citología por impronta o de la biopsia por congelación para el análisis intraoperatorio del ganglio centinela ha sido motivo de controversia. Diferentes autores han mencionado las ventajas y las desventajas de un método sobre el otro. Las ventajas que se le han atribuido a la citología por impronta incluyen la rapidez en la evaluación de la muestra, el bajo costo y la conservación de la muestra para estudios posteriores; como desventajas, el subdiagnóstico de micrometástasis y células aisladas. Varios autores han concluido que, por sus ventajas, la citología por impronta debería ser el método de elección en la técnica del ganglio centinela (5,7,22,25-28). Sin embargo, otros autores se basan en la ventaja de la biopsia por congelación para la detección de micrometástasis para afirmar que ésta debería ser el método de elección (29,30).
Se ha descrito en la literatura que a menor tamaño tumoral es menor la frecuencia del compromiso ganglionar axilar (31). Sin embargo, en este estudio se encontró que no hay una relación directa entre el tamaño tumoral y el resultado positivo del ganglio centinela, lo cual concuerda con hallazgos similares descritos por otros autores que afirman que no existen factores clinicopatológicos con suficiente valor pronóstico para determinar la presencia de metástasis axilar (20,29).
Según la ASCO, la cifra ideal de falsos negativos en la técnica del ganglio centinela debe ser menor de 10%, entre 5 y 8% para los tumores en estadio temprano. En el presente estudio se encontró una tasa de falsos negativos de 4,3%, datos similares a los de Moguimi et al. en 2009 en el que la tasa de falsos negativos fue de 8%, el de Kim et al. en 2006 y el de Tanis et al. en 2001, en los que se encontraron tasas de 0 a 29% (promedio de 7,3%) y el de Chung et al., con falsos negativos del 3% (32-37).
En este estudio se logró evitar el vaciamiento linfático axilar completo en 83% de las pacientes, lo que favorece la reducción de la morbimortalidad que se busca con esta técnica diagnóstica; esto, sumado a la alta tasa de identificación que se obtuvo comparado con otras investigaciones, hace de la técnica del ganglio centinela un método seguro para el diagnóstico y el manejo del cáncer de mama en estadio temprano.
En conclusión, podríamos decir que con los hallazgos obtenidos, la obtención de un ganglio centinela negativo se relaciona con una alta probabilidad de no hallar otros ganglios afectados, mientras que el resultado positivo plantea la posibilidad de metástasis axilar. Concluimos, además, que la técnica del ganglio centinela es una alternativa segura para la estadificación del cáncer de mama en estadio temprano y podría evitar intervenciones quirúrgicas que conlleven a mayor morbilidad.
El obtener sólo el 17% de resultados positivos de los ganglios centinela nos permite inferir que hubo una buena selección prequirúrgica de las pacientes para ofrecerles esta técnica quirúrgica.
Además, puede decirse que, con alta probabilidad, cuando se encuentra el ganglio centinela positivo no existe compromiso de otros ganglios; sin embargo, hasta el momento, sigue siendo el vaciamiento axilar posterior el procedimiento establecido en estos casos.
Referencias
1. Álvarez-Vidal A, Salas C, Santamaría I, Galeano LM, Brome MR. Registro poblacional de cáncer en Antioquia. Unidad de Oncología y Hospital Universitario San Vicente de Paúl, Universidad de Antioquia. Boletín Información para la Acción, Medellín. Disponible en: www.dssa.gov.co/index.php/documentos/doc_download/231-06-3. Fecha de consulta: mayo 2009.
2. Cazap E, Buzaid AC, Garbino C, de la Garza J, Orlandi FJ, Schwartsmann G, et al. Breast cancer in Latin America. Cancer 2008;113:2359-65. [ Links ]
3. González-Mariño M. Cáncer de seno en la Clínica San Pedro Claver de Bogotá, 2004. Rev Salud Pública. 2006;8:163-9. [ Links ]
4. Piñeros M, Ferlay J, Murillo R. Cancer incidence estimates at the national and district levels in Colombia. Salud Pública Mex. 2006;48:455-65. [ Links ]
5. James TA, Edge SB. Sentinel lymph node in breast cancer. Curr Opin Obstet Gynecol. 2006;18:53-8. [ Links ]
6. Sato K. Clinical trials for sentinel node biopsy in patients with breast cancer. Breast Cancer. 2007;14:31-6. [ Links ]
7. Chung MHY, Giuliano AE. Role for sentinel lymph node dissection in the management of large (=5 cm) invasive breast cancer. Ann Surg Oncol. 2001;8:688-92. [ Links ]
8. Barroso-Bravo S, Zarco-Espinosa G, Alvarado-Cabrero I, Valenzuela-Flores G, Pichardo-Romero P, Rodríguez-Cueva A. Mapeo linfático y linfadenectomía del ganglio centinela para evitar la disección axilar en mujeres con cáncer temprano de mama. Cir Cir. 2005;73:437-41. [ Links ]
9. Mansel RE, Fallowfield L, Kissin M, Goyal A, Robert G. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: The Almanac trial. J Natl Cancer Inst. 2006;98:599-609. [ Links ]
10. Santosh K, Somasundaram S, Dennis W. Detection of the sentinel lymph node in breast cancer. Br Med Bull. 2007;84:117-31. [ Links ]
11. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer. 1977;39:456-66. [ Links ]
12. Krag DN, Weaver DL, Alex JC, Fairbank JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993;2:335-9. [ Links ]
13. Giuliano AE, Kirgan DM, Guenther JM, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg. 1994;220:391-8. [ Links ]
14. Sato K, Shigenaga R, Ueda S, Shigekawa T, Krag DN. Sentinel lymph node biopsy for breast cancer. J Surg Oncol. 2007;96:322-9. [ Links ]
15. Schulze T, Markwardt J, Schlag P, Bembenek A. Long-term morbidity of patients with early breast cancer after sentinel lymph node biopsy compared to axillary lymph node dissection. J Surg Oncol. 2006;93:109-19. [ Links ]
16. Kim T, Giuliano AE, Lyman GH. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma: a metaanalysis. Cancer. 2006;106:4-16. [ Links ]
17. Sato K. Current technical overviews of sentinel lymph node biopsy for breast cancer. Breast Cancer. 2007;14:354-61. [ Links ]
18. Acosta V, Contreras A, Ravelo R, Marín E, Marín E, Pérez J, Longobardi I., et al. Cáncer de mama ganglio centinela positivo, ¿siempre necesario una disección axilar? Revista Venezolana de Oncología. 2008;20:118-22. [ Links ]
19. Veronesi U, Paganelli G, Viale G, Luini A, Zurrida S, Galimberti V, et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med. 2003;349:546-53. [ Links ]
20. Takei H, Kurosumi M, Yoshida T, Nimomiya J, Hagiwara Y, Kamimura M, et al. Current trends of sentinel lymph node biopsy for breast cancer a surgeon’s perspective. Breast Cancer. 2007;14:362-70. [ Links ]
21. Chen, SL, Iddings DM, Scheri RP, Bilchik AJ. Lymphatic mapping and sentinel node analysis: current concepts and applications. Cancer J Clin. 2006;56:292-309. [ Links ]
22. Piñero A, Giménez J, Merck B, Vázquez C y grupo de expertos. Reunión de consenso sobre la biopsia selectiva del ganglio centinela en el cáncer de mama. Cir Esp. 2007;82:146-9. [ Links ]
23. Caicedo J, Robledo J. Disección ganglio centinela, un nuevo concepto, una nueva técnica quirúrgica. Revista Colombiana de Cirugía. 2005;3:124-34. [ Links ]
24. Morrow M, Rademaker AW, Bethke KP, Talamonti MS, Dawes LG, Clauson J, Hansen N. Learning sentinel node biopsy: results of a prospectiverandomized trial of two techniques. Surgery. 1999;4:714-20. [ Links ]
25. Shiver SA. Intraoperative analysis of sentinel lymph nodes by imprint cytology for cancer of the breast. Am J Surg. 2002;184:424-7. [ Links ]
26. Motomura K, Inahi H, Komoike Y, Kasigai T, Nagumo S, Koyama H. Intraoperative sentinel lymph node examination by imprint cytology and frozen sectioning during breast surgery. Br J Surg. 2000;87:597-601. [ Links ]
27. Acosta V, Contreras A, Ravelo R, Marin E, Ott S, Aguilar Y, et al. Evaluación anatomo-patológica del ganglio centinela: diagnóstico de micrometástasis. Revista Venezolana de Oncología. 2006;18:209-14. [ Links ]
28. Bochner MA, Farshid G, Dodd TJ, Kollias J, Grantley P. Intraoperative imprint cytologic assessment of the sentinel node for early breast cancer. World J Surg. 2003;27:430-2. [ Links ]
29. Clark SE, Bowen RL. Positive and negative aspects of sentinel lymph node biopsy in breast cancer. Future Oncol. 2007;3:65-72. [ Links ]
30. Tanis PJ, Boom RP, Koops HS, Faneyete IF, Peterse J, Nieweg OE, et al. Frozen section investigation of the sentinel node in malignant melanoma and breast cancer. Ann Surg Oncol. 2001;8:222-6. [ Links ]
31. Shethy MR, Reiman HM Jr. Tumor size an axillary metastasis, a correlative occurrence in 244 cases of breast cancer between 1980 y 1995. Eur J Surg Oncol. 1997;23:139-41. [ Links ]
32. Torrenga H, Fabry H, Joost RM, van der Sijp, van Diest P, Pijpers R, Meijer S. Omitting axillary lymph node dissection in sentinel node negative breast cancer patients is safe: a long term follow-up analysis. J Surg Oncol. 2004;88:4-8. [ Links ]
33. Sookhan N, Boughey JC, Zakaria S, Reynolds C A, Hoskin T, Degnim A C. The ‘sentinel chain’ concept for prediction of axillary node status in breast cancer patients. San Francisco: 2007 Breast Cancer Symposium. American Society of Clinical Oncology (ASCO). Fecha de consulta: mayo de 2009. Disponible en: link. [ Links ]
34. Mittendorf EA, Sahin AA, Tucker S, Meric-Bernstam F, Yi M, Ames Fet, al. Role of lymphovascular invasion and lobular histology in predicting the detection of isolated tumor in sentinel lymph nodes from early stages breast cancer patients. San Francisco: 2007 Breast Cancer Symposium. American Society of Clinical Oncology (ASCO). Fecha de consulta: junio de 2009. Disponible en: link. [ Links ]
35. Zavagno G, Carcoforo P, Franchini Z, Renier M, Barutta L, de Salvo G, Maravegias K, et al. Axillary recurrence after negative sentinel lymph node biopsy without axillary dissection: a study on 479 breast cancer patients. J Cancer Surg. 2005;31:715-20. [ Links ]
36. Moghimi M, Ghoddosi I, Rahimabadi AE, Sheikhvatan M. Accuracy of sentinel node biopsy in breast cancer patients with a high prevalence of axillary metastases. Scand J Surg. 2009;98:30-3. [ Links ]
37. van der Ploeg I, Nieweg M, van Rijk R, Valdes O, Kroon B. Axillary recurrence after a tumour-negative sentinel node biopsy in breast cancer patients: A systematic review and meta-analysis of the literature. J Cancer Surg. 2008;1277-84. [ Links ]














